有机化学常见官能团总结ppt课件
- 格式:ppt
- 大小:408.50 KB
- 文档页数:31

甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)苯和氢气C6H6+3H2→C6H12 (条件为催化剂)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸 170摄氏度)两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸 140摄氏度)乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CHO+2Cu→Cu2O(沉淀)+CH3COOH+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)烯烃是指含有C=C键的碳氢化合物。

常见有机化合物官能团1、苯基苯(benzene, C6H6)有机化合物,就是组成结构最简单的芳香烃,在常温下为一种无色、有甜味的透明液体,并具有强烈的芳香气味。
可燃,有毒,为IARC第一类致癌物。
苯具有的环系叫苯环,就是最简单的芳环。
苯分子去掉一个氢以后的结构叫苯基,用Ph表示。
因此苯也可表示为PhH2、羟基羟基,又称氢氧基。
就是由一个氧原子与一个氢原子相连组成的一价原子团,化学式-OH。
在无机物中在无机物中,通常含有羟基的为含氧酸或其的酸式盐。
含羟基的物质溶解于水会电离出氢离子,因此含羟基的物质水溶液多成偏酸性。
在有机物中在有机化学的系统命名中,在简单烃基后跟着羟基的称作醇,而糖类多为多羟基醛或酮。
羟基直接连在苯环上的称作酚。
具体命名见OH原子团的命名。
注:乙醇为非电解质,不显酸性。
羟基的性质1、还原性,可被氧化成醛或酮或羧酸2、弱酸性,醇羟基与钠反应生成醇钠,酚羟基与氢氧化钠反应生成酚钠3、可发生消去反应,如乙醇脱水生成乙烯OH原子团的命名此原子团在有机化合物中称为羟基,就是醇(ROH)、酚(ArOH)等分子中的官能团;在无机化合物水溶液中以带负电荷的离子形式存在(OH-1),称为氢氧根。
当羟基与苯环相连形成苯酚时,可使苯环致活,显弱酸性。
再进基主要进入其邻位、对位。
羟基与氢氧根的区别在很多情况下,由于在示性式中,羟基与氢氧根的写法相同,因此羟基很容易与氢氧根混淆。
虽然氢氧根与羟基均为原子团,但羟基为官能团,而氢氧根为离子。
而且含氢氧根的物质在水溶液中呈碱性,而含羟基的物质的水溶液则多呈偏酸性。
氢氧根与羟基在有机化学上的共性就是亲核性。
有机合成中羟基的保护羟基就是有机化学中最常见的官能团之一,无论就是醇羟基还就是酚羟基均容易被多种氧化剂所氧化。
因此在多官能团化合物的合成过程中,羟基或者部分羟基需要先被保护,阻止它参与反应,在适当的步骤中再被转化。
3、烃基烃分子(碳氢化合物)中少掉一个或几个氢原子而成的基团。

有机化学高中官能团总结有机化学中,官能团是决定有机化合物化学性质的关键部分。
在高中有机化学中,常见的官能团及其性质如下:1. 烃基(Alkyl Groups):烃分子中失去一个或几个氢原子而剩余的部分。
它们没有特殊的化学性质,但可以根据其碳原子数来命名,如甲基(CH₃−)、乙基(CH3CH2−)等。
2. 羟基(Hydroxyl Group, -OH):存在于醇类化合物中,具有弱酸性,能发生取代、酯化等反应。
3. 羧基(Carboxyl Group, -COOH):存在于羧酸中,具有酸性,能发生酯化反应。
4. 醛基(Aldehyde Group, -CHO):存在于醛类中,具有还原性,能发生氧化、加成等反应。
5. 酮基(Ketone Group, -CO-):存在于酮类中,具有还原性,能发生加成、氧化等反应。
6. 酯基(Ester Group, -COO-):存在于酯类中,能发生水解反应生成酸和醇。
7. 氨基(Amino Group, -NH2):存在于胺类中,具有碱性,能发生取代、酰化等反应。
8. 卤素原子(Halogen Atoms, -X, X=F, Cl, Br, I):存在于卤代烃中,能发生取代、消除等反应。
9. 双键(Double Bond, =C=):存在于烯烃中,能发生加成、氧化、还原等反应。
10. 三键(Triple Bond, ≡C≡):存在于炔烃中,能发生加成、氧化、还原等反应。
11. 苯环(Benzene Ring):存在于芳香烃中,具有特殊的稳定性,能发生取代、加成等反应。
了解这些官能团的性质,对于理解和预测有机化合物的化学行为至关重要。
在高中有机化学学习中,应熟练掌握这些官能团的基本性质和反应类型。


有机化学常见官能团的反应总结i 5-7-g f e d c b a e d c b a i h g f ed c ba h g f e d cb a h g f e dc b a 6-4-3-1-2-i h g f ed c b a C=C -C(O)-CH 3CH-CH CH-CX Functional Group InterconversionC=CC C C=CC C RCH 2-SO 2Ph RC CH C C C-NH 2; C-NO 2C-OHC(OR)2; C(SR)2C=C-OR; C=C-SR C C C NC=N-OH, C=N-H C=SC=O C=O C-C(O)Z C=C C=O C-OH C-X C-N C-H C-N C=O C---OH C-OC(O)R C-X C-OCH 2OR C-NH 2 C-OR C-H C-OH C=C C-H C(O)OR C-(OR)2C-OH C-ORC-CHO C-CO 2H C-CN C=C C=O C-S C-X C-OH C-H C=C j C(O)XhC Nj kC-HC-Br 8-C-Xi C-OHC-OH C(O)Z dc b a ed c b a f C-NH 2C-Hj CX-CYC CXC=O h g f iC CH RCH(CO 2H)-CH 3-C(O)-CH 3O OXCRR'=CHXjC O C-NH 2C-CN9-C-CH 3C-Xa e C=O1-adry pyridine: from CaH 2 and distilledtriflatemesylate tosylate S O O O RCH 2CF 3 S OO O RCH 2CH 3CH 3CH 3CH 3OH (2). for 3' alcohol:LiAlH 4(1). for 1', 2' alcohol:1-i h g f e dc b a C-CHO C-CO 2HC-CN C=C C=O C-SC-NH 2C-X C-OH C-H CH 3CH3CH 3H n -Bu 3SnH C S O PhClRCH 2-HCH 3SO O RCH 2CH 3S OOCl RCH 2OHpurification textbook~ $ 30 / Kg toluenesulfonyl chloride (s)methanesulfonyy chloride (l)~ $ 30 / Kg jC(O)XPh 2SiHCl / InCl 3PhPhHPhPhJOC, 2001, 66, 7741.ii. Ph 2SiHCl / InCl 3i. p -TsCl // LiAlH 4i. ClC(S)OPh // n -Bu 3SnH Cl 22via:a unique Lewis acid catalyst, acceleratedeoxgyenationInCl 3indium trichlorideii. Et 3SiH / Lewis acidJ. Org. Chem. 2000, 65, 6179JOC, 2000, 65, 6179.CHCl 2rt, 3 hr1-bBu 3SnH: (l), easy to remove Ph 3SnH: (s), hard to remove Me 3SnH: too volatile, toxic unstable in acid, form H 2 gas; stable in weak baseNaBH 3CN: stable at pH 5-6hygroscopic, dried self, suggest: buy small amount each time(Grignard reagent)H 2OMg / Et O JOC, 1969, 34, 3923.HBrNa / NH 3; Li / NH 3; Na / EtOH Zn; Fe; Sn; Mg(3). metal reduction(2). hydride reduction(1). free radical reductionJACS, 1972, 94, 8905.n -Bu 3SnH HBrNaBH 4 / InCl 3 / CH 3CNradical reagentn -Bu 3SnH / AlBN JA CS, 2002, 124, 906.i iii NaBH 3CNi LiAlH 4i ii ii NaBH 4ii THL, 1969, 3095.JOC, 1976, 41, 3064.iv LiBHEt 3 (super hydride)mechanism uncertain, probably radical burn filter paper if dryRaney Nickel: Ni - Al alloy, suspensionJCS Perkin Trans I, 1973,654.(3). L iAlH 4 / CuCl 2NaBH 4 / NiCl 2NaBHEt 3 / FeCl 2 (or CoCl 2, VCl 3) (2). Li / NH 3(1). Raney NiBuLi1-d1-c RCH 2-HRCH 2NH 2radical mechanism Chemistry:R-SH R-S-R R 2SO R 2SO 2 R-SS-Rremove: Hg +; Ni(1).(2).Ar-H2H PO Ar-NH 2RCH 2NH 2RCH 2NMe 3R=CH 2R-CH 3 (4).X-RCH 2NMe 3OH -p-TsClNaH p-TsCl2(3).Ar-NH 2Ar-Hbasicneutral acidic1-e(2). thioketal:(3). Wolff-Kishner reduction:(5). Tosylhydrazone reduction (Shapiro reaction): (modified Wolff-Kishner reduction):)(6). enol derivatives: SH SH / BF 3, CH 2Cl 2 // RaNiN 2H 4, OH -, heatTsNHNH 2Tf 2O /N// H 2 / PtO 2preparation: HgCl 2 into Znsimilar: Sn / HCl(4). Pd-C / HCO 2NH 4: mild, efficient(7). Et 3SiH / CF 3COOHPhONO 21-fb.p. ~ 230 Chighly toxic, cancer suspected agent?= HMPT: h exa m ethyl p hosphoric t riamide (Me2N)3P=O (3). organic electrochemistryβ(1). particular structure:1-g(1). K / Al2O3K / HMPA(2). Na / NH31-h(2). normal structure: SOCl2JOC, 1980, 45, 3227HMPA: h exa m ethyl p hosphor a mide (Me2N)3P=Oyes for white mouse, uncertain for humanmodified to: N NO1-i(1). RhCl(PPh 3)3 (Wilkinson's cat)(2). Rh(DPPD)2+ Cl -DPPD = Ph 2P-CH 2CH 2-PPh 21-jHSiEt 3 / B(C 6F 5)3activator / hydride sourceRCH 2 OR OORR OROR RCH 2 OCH 2CH 2OH(3). AlCl 3 / LiAlH 4(2). HCl / NaBH 3(CN)(1). h / HSiCl 32-bN NH/ TBDMS-ClTBDPS-ClEt 3N / TMS-Clacid: H 2SO 4H 3PO 4BF 3-Et 2ORC-OCH 2CH=CH2RC-OCPh 3 = RC -OTr RC-O t BuRC-OCH 3RC-OSiR 3RC-OCH 2Ph = RC-OBZl = RC-OBni. Willianson synthesis OK: Si - Cl bond longii. stability of silyl in acid/base: RC-O-TBDPS > RC-O-TBDMS >> RC-O-TBS iii. abbrev.: TBDMS = tert-butyl-dimethylsilyl = TBS = Silyl group:(RO-Tr)Trityl group: (tirphenylmethyl)i. S N 1 reactionii. abbreviation: triphenylmethyl = trityl = -CPh 3 = -Tr iii. advantage: high MW, easy to handle (small amount become large amount)Br Willianson synthesis (base, S N 2) not work: elimination side-product with baset -Butyl group:i. abbreviation: benzyl = PhCH 2 = Bzl = Bn ii. deprotecting: H 2 / Pd-CPhCH 2-ClPhCH 2-Br: reactivity goodPhCH 2-I: reactivity better than PhCH 2Br, generated in situ, PhCH 2Br + NaIPhCH 2-X: Benzyl- group:i. Williamson ether synthesis, S N 2 typeii. not a good protecting group, too stable to convert back to alcohol Me group:CH 3-X: CH 3I; CH 3OSO 2R; (CH 3)3O + BF 4-, (CH 3)2SO 4base: NaH, n -BuLi, Ag 2O(4). t -Bu: acid cat /(3). allyl: base /Br (6). silyl: Et 3N / R 3SiCl(5). trityl: py // Ph 3C-Br(2). PhCH 2-: base / PhCH 2-X application: for protecting groupe d cb a 2-RC=C RC-H RC(O)ORRC-(OR)2RC-OH RC-OR (1). Me: base / CH 3-X2-a (7). acetal / ketal: (see 3e)fRC-CNgenerate H 2, or butane gasJOC, 1988, 53, 2985.trimethyloxonium tetrafluoroborateJCS, 1930, 2166.(8). ArF / CsFROHradical mechanism: SiCl 3RaNi with C=S2-c2-d (1). hv / HSiCl 3(2). HCl / tBu-OO-t Bu(4). BF 3 / NaBH 42-e2-e.vi. H 2O 2, t -BuOH, MnSO 4 // NaHCO 3, pH 8JA CS, 2001, 123, 2933.HO 22COnew, cheap,, simple, green chemistryconvenient, inexpensive, powerful.JOC, 1980, 45, 4758.JOC, 1982, 47, 2670.OOHOOBr via:Br 2 / ROH2-f ROH / HClEtCNEt C OEt OEtJA CS, 1942, 64, 1825.JOC, 2001, 66, 521.C-OH C-H C-OR C-NH 2C-X 3-a b c d3-a(1). [PhI(OAc)-O]2-Mn(TPP)(2). organic electrochemistry (3). X 2 / hv // OH -3-a.13-a.23-a.3(1) Me 3SiCl // MPCBA//H 3O +(2). O 2, LDA, (EtO)3PJA CS, 1975, 97, 6909.i h g f e C=O C---OH C-OC(O)RC-OCH 2OR C=Cj C O(1). Me: application: deprotecting (2). PhCH 2-(5). trityl:(6). silyl: (3). allyl: (4). t-Bu: RC-OCH 2Ph = RC-OBZl = RC-OBnRC-OSiR 3RC-OCH 3RC-OtBuRC-OCPh 3 = RC-OTr RC-OCH 2CH=CH2Ni. TMSIii. BF 3-Et 2O // R-SH (or HS-CH 2CH 2-SH)iii. BBr 3 / CH 2Cl 2, 0-10 C / LiI, heat vi.OCH 3OH+- CH 3Cl i. H 2 / Pd-C ii.CN CN Cl ClO, OH -OH-O COCH 3O O CH 2OCH 3RhCl(PPh 3)3, H 3O +OH - Me 32Oi. TFA (CF 3CO 2H)ii. HBr / HOAc iii. TMS-Ii. HOAc: weak acid: good leaving groupii. H 2need stronger acidi. F - : HF, Py-H + F -; n +--SiMe 3-SiBuMe 2-SiBuPh 2if HOBr: OK for TMDMSJOC, 1987, 52, 4973.OCOCF 3+JOC, 1973, 38, 3224.iv. AlCl 3 / RSH THL, 2001, 42, 9207.MeOCO 2Me HOCO 2MeCH 3(CH 2)11SHodorless3v./ heatCl -N H3-b NH Cl -triphenylmethylorganic base: TMG3-c(1). OH -(2). KO 2 / DMSO 3-d not practically useful: R-OH cheaper than R-X JOC, 1975,40, 1678.(2). Na 2[Fe(CN)5(NO)] / K 2CO 3 / H 2O3-e(1). Symmetry:ketal: use H 3O +acetal: use H 3O +(2). unsymetry:RO-MOM RO-MEM RO-MTM RO-THPi. H 3O +p -TsOH / MeOHi. H 3O +; ii. ZnBr 2 / CH 2Cl 2HgCl 2 / CH 3CN (aq.)actually, acetal exchange (3). Ag 2O / H 2O THL, 1975, 3183.JOC, 1986, 51, 3913.RO 2C (CH 2)3CHRNH 2RO 2C (CH 2)3CHROHNa 2[Fe(CN)5(NO)]2323-f(1). base: KHCO 3 (or K 2CO 3, NH 3) / MeOH; NaOH (1 %, or 0.5 N)(3). RED: (2). acid: H 3O +PPh 3 / DEAD / RCO 2H // OH -3-gMitsunobu inversionSynthesis, 1981, 1.JOC, 1987, 52, 4235.common esters:formate = HCO 2R ------------------------ KHCO 3 (or K 2CO 3, or NH 3) / MeOH trifluoroacetate = CF 3CO 2R ------------ KHCO 3 (or K 2CO 3, or NH 3) / MeOH acetate = CH 3CO 2R = ROAc --------- KHCO 3 (or K 2CO 3, or NH 3) / MeOH benzoate = PhCO 2R = ROBz -------- NaOH (1 %) / MeOH pivalate = t Bu-CO 2R = ROPv ------ NaOH (0.5 N) / EtOH*HOi LiAlH 4ii. NaAlH 2(OCH 2CH 2OCH 3)CH 3O 2CCO 2CH 3HOOHNaAlH 2(OCH 2CH 2OCH 3)266hydride:electron:Na / NH 3AGIEE, 2002, 41, 3028.JACS, 1972, 94, 7159.LAH ------------ almost all: ald, ketone, acie, ester, acyl X, anhydride NaBH 4 --------------- not for acid, ester (but LiBH 4 work for ester)B 2H 6 --------------- not for ester, acyl X, anhydride; from top:LiAlH 4; NaBH 4; Na / NH 3Al (O i Pr)3 / i PrOH ----------- Meerwein-Pondorf-Verley rxn IrCl 4 / i PrOH / P(OMe)3 ------ Henbest rxn LiBH(sec Bu)3 ------------------ H. C. Brown from bottom:(2). stereoselective:(1). regioselective:3-h (3). HCHO reagent:Me CHO MeOHHCHOJACS, 1935, 511, 903.CH 3CHOC(CH 2OH)42Org.Syn, 1925, 4, 53.HCHO / KOHHCHO / Ca(OH)2Synthesis, 1994, 1007.PhNO 2OPhNO 2H OHBH / SMe JOC, 2001, 66, 7514.JOC, 2003, 68, 2030.OBH 3 / THF 99.5 % transsolvent: THF, SMe 23-iR 3B, HOCH 2CH 2OH // H 2O 2 // NaOHJOC, 1986, 51, 4925.CORB RR 3BRRCRR R 3CBOHOCH 2CH 2OH R 3CB OOH O R 3HOB OO R 3C H 2OR 3C OH practice3-k OOHOHOHOHOOHOH OHOHOHJOC, 1967, 32, 3452.H 2O 2: dangerous,skin whiten, metal decomposeHg (OAc)2: toxic, hard to remove (3). B 2H 6, H 2O 2 / OH -, H 2O (2). Hg(OAc)2, H 2O // NaBH 4(1). H 3O +3-j3-j.13-j.2hydration:(1). KMnO 4 / NaOH (2). OsO 4(3). H 2O 2/HCO 2H (4). Na / EtOHcistran cis +trancis3Me2NNN CH3HCl3hνN CH3HHN CH3HH+NCSN CH3ClNHCHC21. LAHR3C NH2R C NR2R C NHRR3C OHR2C OHRC OHR C NH2tertiarysecondaryprimaryCompare nomenclature class: not a very useful reactionC-NC-HC-NC-XC-OHC=OC=C4-abcdefg4-a SO2NH2Ph I OAc OAc SOONHSOON I Ph Fe(TPP)Cl S OONH2 (insertion)TPPNNNNPh2. NaN3N C O1. SO2Cl2CO2CCO OhiC NC(O)XC-C(O)XNH 22RC NORC NH 2iii4-b CF 3CO 3H // Fe / HOAc1. many reducing agents4-b.14-b.21.2.3.4.Fe 3(CO)12 / CH 3OH JOC, 1972, 37, 930.NaBH 4 / Pd-C Na 2S Sn / HCl Vogel's 12.57Vogel's 12.58 Vogel's 12.595.H 2 / Pt (S)-CJACS, 1965, 87, 2767.sulfided platium not affect: aromatic rings, ketones, halides, nitriles, amide, easters。

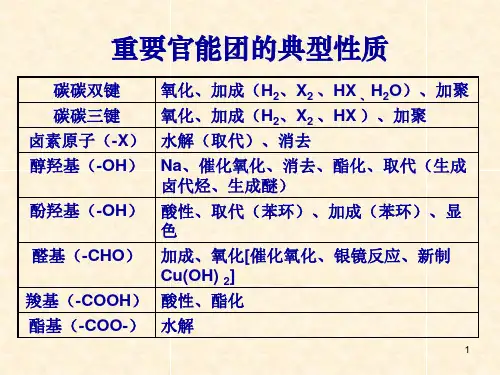
有机化学中的官能团官能团是决定有机化合物性质的原子或原子团,有机化学反应主要发生在官能团上,官能团很大程度上决定了有机物的反应方向。
一.常见的有机化合物官能团有以下几种:6.羧基(-COOH);酸性,与NaOH反应生成水(中和反应),与NaHCO3、Na2CO3反应生成二氧化碳,与醇发生酯化反应二.表格如下:10药学三班温林文- 汉语汉字编辑词条文,wen,从玄从爻。
天地万物的信息产生出来的现象、纹路、轨迹,描绘出了阴阳二气在事物中的运行轨迹和原理。
故文即为符。
上古之时,符文一体。
古者伏羲氏之王天下也,始画八卦,造书契,以代结绳(爻)之政,由是文籍生焉。
--《尚书序》依类象形,故谓之文。
其后形声相益,即谓之字。
--《说文》序》仓颉造书,形立谓之文,声具谓之字。
--《古今通论》(1) 象形。
甲骨文此字象纹理纵横交错形。
"文"是汉字的一个部首。
本义:花纹;纹理。
(2) 同本义[figure;veins]文,英语念为:text、article等,从字面意思上就可以理解为文章、文字,与古今中外的各个文学著作中出现的各种文字字形密不可分。
古有甲骨文、金文、小篆等,今有宋体、楷体等,都在这一方面突出了"文"的重要性。
古今中外,人们对于"文"都有自己不同的认知,从大的方面来讲,它可以用于表示一个民族的文化历史,从小的方面来说它可用于用于表示单独的一个"文"字,可用于表示一段话,也可用于人物的姓氏。
折叠编辑本段基本字义1.事物错综所造成的纹理或形象:灿若~锦。
2.刺画花纹:~身。
3.记录语言的符号:~字。
~盲。
以~害辞。
4.用文字记下来以及与之有关的:~凭。
~艺。
~体。
~典。
~苑。
~献(指有历史价值和参考价值的图书资料)。
~采(a.文辞、文艺方面的才华;b.错杂艳丽的色彩)。
5.人类劳动成果的总结:~化。
~物。
6.自然界的某些现象:天~。
常见官能团的性质二.有机官能团的化学性质与有机基本反应1. 氧化反应(1)燃烧。
凡是含碳氢的有机化合物燃烧都生成二氧化碳和水。
烃的燃烧通式:C K H7+^+^02=X CO34-|H20烃的含氧衍生物的燃烧通式:C x H y03+ 0+ 七一丿6 = 8 + J H a0(2)被酸性高锰酸钾氧化。
能使酸性高锰酸钾褪色的有机物有:①不饱和烃、不饱和烃的衍生物(含碳碳双键、碳碳三键);②苯的同系物(苯基上的烃基易被氧化);③含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐、葡萄糖;④石油产品(裂解气、裂化气)。
(3)羟基的催化氧化。
某些含羟基的有机物在催化剂的作用下,能被氧气氧化成醛或酮。
当与羟基相连的碳原子上有两个氢原子时,羟基能被氧化成醛基。
如:Cu2CH3CH2OH O22CH3CHO 2H2O当与羟基相连的碳原子上有一个氢原子时,羟基能被氧化成羰基(碳氧双键)。
如:CH30I Cu II2CH3-CH-OH+ 02— 2CH3- C-CH3 +2H a0当与羟基相连的碳原子上没有氢原子时,羟基不能被氧化。
(4)醛基的氧化。
有机物中的醛基,不仅可以被氧气氧化成羧基;而且还能被两种弱氧 化剂(银氨离子和铜离子)氧化成羧基。
醛基被氧气氧化。
如:2CH 3CHO O 2 催化剂》2CH 3COOHA银镜反应,醛基被JAg (NH 3 2 ]氧化。
如:CH 3CHO +2 Ag (NH 3)2 ]+ + 2OH-—CH 3COO-+ NH 4 + + 2Ag J +3NH 3 + H 2O醛基被C U (OH )2氧化。
如:CH 3CHO 2C U (OH )2」CH 3COOH C U 2O JS :;2H 2O2. 取代反应。
有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
中 学常见的取代反应有:(1) 烷烃与卤素单质在光照下的取代。
如:CH 4 Cl 2 — 光—CH 3CI HCl(2) 苯与苯的同系物与卤素单质、浓硝酸等的取代。



高中有机化学官能团汇总1. 烃类官能团- 烯烃:含有双键的烃类,如烯烃(C=C)。
常见的官能团有烯烃基(-C=C-)。
- 炔烃:含有三键的烃类,如炔烃(C≡C)。
常见的官能团有炔烃基(-C≡C-)。
2. 羟基官能团- 醇:含有羟基(-OH)的有机化合物。
常见的官能团有羟基(-OH)。
- 酚:含有苯环上的羟基的化合物。
常见的官能团有苯酚基(-C6H5OH)。
3. 羧基官能团- 酸:含有羧基(-COOH)的有机化合物。
常见的官能团有羧基(-COOH)。
4. 醛酮官能团- 醛:含有羰基(-C=O)的有机化合物。
常见的官能团有醛基(-CHO)。
- 酮:含有羰基(-C=O)的有机化合物。
常见的官能团有酮基(-COR)。
5. 氨基官能团- 胺:含有氨基(-NH2)的有机化合物。
常见的官能团有氨基(-NH2)。
6. 卤素官能团- 卤代烃:含有卤素(F、Cl、Br、I)的有机化合物。
常见的官能团有卤素基(-X,X为卤素符号)。
7. 醚化合物和酯类官能团- 醚:含有氧原子的链状结构。
常见的官能团有醚基(-O-)。
- 酯:含有酯基(-COO-)的有机化合物。
常见的官能团有酯基(-R-COO-R')。
8. 脂肪族和芳香族类官能团- 脂肪族:指脂肪酸及其衍生物,如醇、醚、酮、酯等。
- 芳香族:指苯环及其衍生物,如苯胺、硝基苯、羟基苯等。
此文档总结了高中化学中常见的有机化学官能团,希望对学习有机化学的学生有所帮助。
烷烃——无官能团:1.一般C4及以下是气态,C5以上为液态。
2.化学性质稳定,不能使酸性高锰酸钾溶液,溴水等褪色。
3.可以和卤素(氯气和溴)发生取代反应,生成卤代烃和相应的卤化氢,条件光照。
4.烷烃在高温下可以发生裂解,例如甲烷在高温下裂解为碳和氢气。
烯烃——官能团:碳碳双键1.性质活泼,可使酸性高锰酸钾溶液褪色。
2.可使溴水或溴的四氯化碳溶液褪色,发生加成反应,生成邻二溴代烷,例如乙烯和溴加成生成1,2-二溴乙烷。
3.酸催化下和水加成生成醇,如乙烯在浓硫酸催化下和水加成生成乙醇。
4.烯烃加成符合马氏规则,即氢一般加在氢多的那个C上。
5.乙烯在银或铜等催化下可以被空气氧化为环氧乙烷。
6.烯烃可以在镍等催化剂存在下和氢气加成生成烷烃7.烯烃可以发生加聚反应生成高聚物,如聚乙烯,聚丙烯,聚苯乙烯等。
实验室制乙烯通过乙醇在浓硫酸作用下脱水生成,条件170℃。
炔烃——官能团:碳碳三键1.性质与烯烃相似,主要发生加成反应。
也可让高锰酸钾,溴水等褪色。
2.炔烃加水生成的产物为烯醇,烯醇不稳定,会重排成醛或酮。
如乙炔加水生成乙烯醇,乙烯醇不稳定会重拍生成乙醛。
3.乙炔和氯化氢加成的产物为氯乙烯,加聚反应后得到聚氯乙烯。
4.炔烃加成同样符合马氏规则5.实验室制乙炔主要通过电石水解制的(用饱和食盐水)。
芳香烃——含有苯环的烃。
1.苯的性质很稳定,类似烷烃,不与酸性高锰酸钾,溴的四氯化碳反应,与溴水发生萃取(物理变化)。
2.苯可以发生一系列取代反应,主要有:和氯,溴等卤素取代,生成氯苯或溴苯和相应的卤化氢(条件:液溴,铁或三溴化铁催化,不可用溴水。
)和浓硝酸,浓硫酸的混合物发生硝化反应,生成硝基苯和水。
条件加热。
和浓硫酸反应生成苯磺酸,条件加热。
3.苯可以加氢生成环己烷。
4.苯的同系物的性质不同,取代基性质活泼,只要和苯环直接相连的碳上有氢,就可以被酸性高锰酸钾溶液氧化为苯甲酸。
如甲苯可以使酸性高锰酸钾溶液褪色,被氧化为苯甲酸。