物质分离提纯之结晶
- 格式:ppt
- 大小:4.11 MB
- 文档页数:24

苯甲酸的分离提纯方法苯甲酸是一种常用的有机酸,广泛应用于医药、染料、香料等领域。
然而,在实际应用中,苯甲酸的纯度往往不够高,需要进行分离提纯。
下面将介绍两种常用的分离提纯方法:结晶法和萃取法。
1. 结晶法结晶法是一种常用的分离提纯方法,适用于苯甲酸的固体样品。
其基本原理是利用物质在溶液中的溶解度随温度的变化而产生的结晶现象,将杂质与苯甲酸分离。
将苯甲酸样品加入适量的溶剂中,通常选择水或乙醇作为溶剂。
然后加热溶液,使苯甲酸完全溶解。
接着,慢慢降低溶液温度,使其逐渐冷却。
在适当的温度下,苯甲酸会开始结晶,杂质会留在溶液中。
最后,通过过滤或离心,将结晶的苯甲酸分离出来,并用冷溶剂洗涤,以去除残留的杂质。
最终,将苯甲酸在低温下干燥,得到纯净的苯甲酸晶体。
2. 萃取法萃取法是一种常用的液相分离提纯方法,适用于苯甲酸的液体样品。
其基本原理是利用不同溶剂对苯甲酸和杂质的不同溶解度,实现分离提纯。
将苯甲酸样品与适当的溶剂混合,搅拌均匀。
通常选择具有较高溶解度的有机溶剂,如乙酸乙酯或二氯甲烷。
然后,将混合溶液放置一段时间,使苯甲酸和杂质在两种溶剂中分配达到平衡。
接着,将两相分离,并收集有机相。
为了提高分离效果,可以进行多次萃取。
每次萃取后,将有机相收集起来,并与新鲜的溶剂进行下一轮的萃取。
通过多次萃取,可以逐渐提高苯甲酸的纯度。
将收集到的有机相进行蒸发,去除溶剂,得到纯净的苯甲酸。
以上就是苯甲酸的两种常用分离提纯方法:结晶法和萃取法。
根据实际情况,选择合适的方法进行分离提纯,可以得到高纯度的苯甲酸,满足不同领域的需求。




龙文教育个性化辅导授课案教师:师广丽学生:时间:年月日段一、授课目的与考点分析:物质的分离和提纯的物理方法:结晶和重结晶二、授课内容:一、结晶的两种方法:1、蒸发结晶:适用于溶解度受温度影响变化小的物质结晶.如NaCl溶液.2、冷却结晶:适用于溶解度受温度影响变化大的物质结晶.如KNO3溶液.二、结晶的应用:物质的分离和提纯1、冷却结晶例1:从KNO3和NaCl溶液中要提纯KNO3,就要用冷却热饱和溶液(即冷却结晶).例2:从五水硫酸铜溶液中析出CuSO4•5H2O;从十水碳酸钠溶液中析出Na2CO3•10H2O2、蒸发结晶(蒸干型和不蒸干型)例1:从KNO3和NaCl溶液中要提纯NaCl,就要用蒸发溶剂法(即蒸发结晶).例2、从NaCl溶液中提取NaCl晶体。
二、结晶的实验操作过程1、蒸发结晶操作方法:①取样品于烧杯中溶解;②加热蒸发,发现溶液中有大量固体析出时停止加热;③过滤;④需进一步提纯时可重结晶2、冷却结晶操作方法:①取样品于烧杯中溶解;②蒸发浓缩,发现溶液中有较多固体析出时停止加热;③冷却结晶;④过滤;⑤需进一步提纯时可重结晶注意事项:冷却结晶前需将溶液加热浓缩,形成饱和溶液后才能冷却结晶析出晶体。
三、重结晶:按上述步骤再把所得产品重新操作一到三次,进一步提纯。
【练习】1、硝土中含有硝酸镁、硝酸钙、氯化钠等物质,草木灰的主要成分是碳酸钾,民间曾用硝土和草木灰作原料来制取硝酸钾。
其主要生产流程为:(1)写出步骤①中生成MgCO3沉淀的化学方程式:_______________________________,反应类型:____________________。
(2)步骤④中滤液可重复使用的理由是__________________________________________________________________________。
(3)参考右图,解释生产流程中用蒸发结晶得到NaCl晶体,而用冷却结晶得到KNO3晶体的原因:________________________________________________________________________________________________。

物质的检验、分离和提纯知识点一、物质的分离与提纯物质的分离、提纯是中学化学实验中的一项综合性较强的实验内容,复习时应掌握:1.物质提纯的原则:不增、不变、不减、易分。
不增是指不引进新的物质;不变是指被提纯的物质性质不能改变;不减是指不能损耗或减少被提纯的物质;易分是指易使杂质与被提纯的物质分离。
2.提纯的方法可归纳为:“杂吸收、杂转纯、杂变沉、化为气、试剂分。
”(1)杂吸收:常用于气体的净化和干燥,可根据被提纯气体中所含杂质气体的性质,选择适当的固体或液体作为吸收剂。
如:O2中混有的水蒸气则可将气体可通过盛有浓硫酸的洗气瓶;NH3中混有的水蒸气可通过装有碱石灰的干燥管等。
(2)杂转纯:利用化学反应,加入适当的试剂或采用某种条件(如加热),使物质中的杂质转化为提纯物。
如:Na2CO3中混有的NaHCO3可将混合物加热,使NaHCO3全部转化为Na2CO3;FeSO4溶液中混有的CuSO4,可加入适量铁粉将CuSO4氧化成FeSO4。
(3)杂变沉:加入适当试剂使其与杂质反应生成沉淀过滤而除去。
如:除去K2SO4溶液中少量的MgSO4杂质:向混合液中加入过量KOH溶液,过滤出Mg(OH)2沉淀后,向滤液中加入适量硫酸即可得纯净K2SO4溶液。
(4)化为气:加入适当试剂使其与杂质反应生成气体而除去。
如:除去Na2SO4溶液中少量的Na2CO3,加入适量稀硫酸,将CO2-3转变为CO2。
(5)试剂分:对于固体试剂可选择适当的物质将杂质溶解,然后过滤除去。
如:Cu粉中混有的Fe粉可用过量的稀硫酸溶液除去,然后洗涤即可。
CaCO3中混有少量NaCl,可用少量水溶解后,过滤,洗涤,烘干即可。
3.物质分离、提纯的常用方法(1)常用物理方法①过滤适用范围:固体和液体混合物分离。
注意事项:一贴:滤纸紧贴漏斗内壁;二低:滤纸低于漏斗口,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端紧靠烧杯内壁。

用结晶法提纯纯碱的原理
结晶法是一种常用的物质分离纯化方法,也适用于纯碱的提纯过程。
其原理可以概括为以下几个步骤:
1. 选择合适的溶剂:纯碱通常是以碳酸钠(Na2CO3)的形式存在于固体或液体中。
结晶法的原理是利用溶质在溶剂中的溶解度随温度变化而产生差异,选择适当的溶剂使得纯碱在高温下溶解度较大,而在低温下溶解度较小。
2. 溶解纯碱:将纯碱加入选择的溶剂中,加热使纯碱溶解。
3. 过滤杂质:如果纯碱溶解液中含有不溶于溶剂的杂质,可以通过过滤等方法将杂质分离。
4. 结晶:将溶解液冷却,使纯碱溶解度降低,纯碱便会从溶液中结晶出来。
结晶速率和结晶纯度可以通过控制冷却速率和搅拌速率等参数来调节。
5. 提取纯碱晶体:将结晶出的纯碱晶体分离出来,并用纯溶剂洗涤以去除残留的杂质。
6. 干燥:将洗涤干净的纯碱晶体放置在通风干燥的环境中,使其失去结晶溶剂。
通过上述步骤,结晶法能够实现对纯碱的提纯,得到相对纯度较高的纯碱晶体。


结晶分离技术2008-1-23 阅读次数:次结晶(沉淀)分离技术是化工生产中从溶液中分离化学固体物质的一种单元操作,在湿法冶金过程占有十分重要地位。
从湿法冶金溶液中以固体形式分离、回收有价组分常采用结晶、沉淀等操作过程,而又以反应结晶过程居多。
世界上有数百家铀水冶厂,用离子交换法或萃取法从庞大的矿石浸出液中浓集提取铀,得到了浓度较高的含铀的纯化溶液—合格淋洗液或反萃取液。
从这种纯化溶液中沉淀(结晶)铀的浓缩物送纯化工厂进一步精炼,得到核能纯的铀产品。
沉淀铀浓缩物的过程就是一个化学结晶(沉淀)过程。
当向纯化溶液(硫酸铀酰、硝酸铀酰等)中添加沉淀剂:NaOH、NH3H2O、MgO 等的溶液时,立即沉淀(结晶)出重铀酸盐浓缩物(131,黄饼等)中间产品。
铀由水溶液中转化成了固态形式,品位和纯度大大的提高,体积大大减少,给下一步工序的加工带来许多方便,生产设备、规模大大减少。
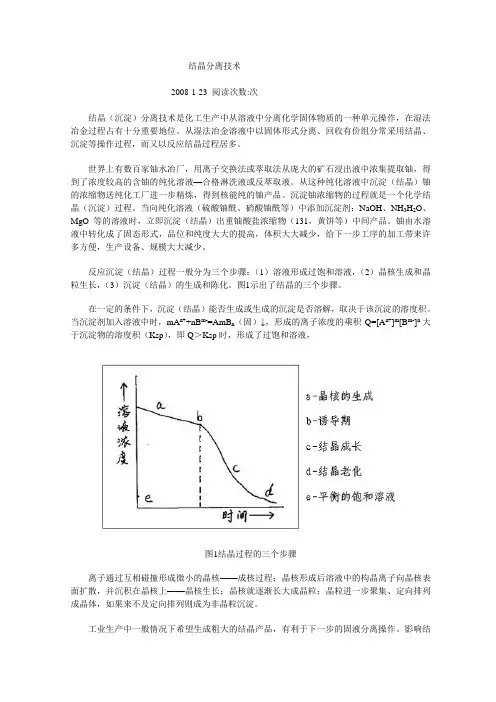
反应沉淀(结晶)过程一般分为三个步骤:(1)溶液形成过饱和溶液,(2)晶核生成和晶粒生长,(3)沉淀(结晶)的生成和陈化。
图1示出了结晶的三个步骤。
在一定的条件下,沉淀(结晶)能否生成或生成的沉淀是否溶解,取决于该沉淀的溶度积。
当沉淀剂加入溶液中时,mA n++nB m-=AmB n(固)↓,形成的离子浓度的乘积Q=[A n+]m[B m-]n大于沉淀物的溶度积(Ksp),即Q>Ksp时,形成了过饱和溶液,图1结晶过程的三个步骤离子通过互相碰撞形成微小的晶核——成核过程;晶核形成后溶液中的构晶离子向晶核表面扩散,并沉积在晶核上——晶核生长;晶核就逐渐长大成晶粒;晶粒进一步聚集、定向排列成晶体,如果来不及定向排列则成为非晶粒沉淀。
工业生产中一般情况下希望生成粗大的结晶产品,有利于下一步的固液分离操作。
影响结晶的因素很多,如过饱和度、浓度、PH值、同离子效应、络合效应、搅拌强度、沉淀剂的加入速度,甚至两种溶液加入先后顺序都有影响。
要使晶体能够生成,必须首先形成过饱和溶液,但过饱和度太大,易产生大量的晶核,形成细小的晶粒或非晶形沉淀,甚至形成胶体,所以过饱和度必须恰当;为了减少沉淀的溶解损失,应加入过量的沉淀剂,利用共同离子效应来降低沉淀的溶解度,但不可加入太多,过量太多的沉淀剂可能引发络合效应,反而使沉淀物的溶解度增大,甚至造成反溶;沉淀过程中要严格控制酸碱度,一般控制在PH1-14的范围内,酸碱度太高或太低时,要么沉淀的不完全,要么沉淀物重新溶解。

实践分享高三化学二轮复习小课题研究——以“结晶法在分离提纯中的应用”为例■徐益宏摘要:化学实验题历来是高考的热点和难点所在,而实验题的核心环节往往是分离提纯,结晶法又是分离提纯的重要方法之一。
笔者从溶解度随温度变化角度、改变溶剂的极性角度、盐析角度等方面,对结晶法在分离提纯中的应用进行研究,从而提高高三化学二轮复习的有效性。
关键词:结晶法;溶解度;温度;极性化学实验题历来是高考的热点和难点所在,而实验题的核心环节往往是分离提纯,结晶法又是分离提纯的重要方法之一。
而在二轮复习中,学生在这一知识体系中暴露出了很多问题:什么时候用蒸发结晶?什么时候用蒸发浓缩、冷却结晶?什么时候用蒸发浓缩、趁热过滤?等。
为让学生真正理解并熟练应用各种结晶法,笔者从以下几个方面进行研究。
一、从溶解度随温度变化角度研究1.单一溶液结晶问题研究(1)如何从NaCl 溶液中得到NaCl 晶体?方法:蒸发结晶。
程度:蒸发至大量晶体出现,少量水用余热蒸干。
适用类型:适用于溶解度随温度变化不大的晶体类型,同时,此类晶体一般比较稳定,受热不易分解,不易水解,不易被氧化等。
溶解度(g )(℃)4(2)如何从CuSO 4溶液中得到五水硫酸铜晶体?方法:蒸发浓缩,冷却结晶,过滤,洗涤,干燥。
程度:蒸发至溶液表面出现晶膜。
适用类型:适用于溶解度随温度变化比较明显的晶体,此类晶体可以带结晶水、受热易分解、易水解、易氧化等。
2.混合溶液结晶问题研究(1)如何从KNO 3、NaCl (1∶1)混合溶液中分别得到KNO 3、NaCl 晶体?方法:蒸发浓缩,趁热过滤(得到NaCl ),滤液冷却结晶(得到不纯的KNO 3)。
(2)如何除去KNO 3中少量的NaCl 杂质?方法:重结晶,即将固体混合物溶于热水中,形成热饱和溶液,然后冷却结晶,得到的晶体为较纯的KNO 3。
如果依旧含有少量NaCl ,可以再进行一次。
(3)如何除去NaCl 中少量的KNO 3杂质?方法:将固体溶于水形成混合溶液,然后蒸发浓缩,趁热过滤,得到NaCl晶体。
结晶分离的基本原理是
结晶分离是一种常用的化学分离方法,利用物质的溶解度差异在溶液中形成结晶并分离出所需物质。
其基本原理有以下几点:
一、溶解度差异原理:
溶液在一定温度和压力下,溶质溶解度与溶剂之间的相互作用力有关。
当溶质在溶液中的溶解度达到饱和时,再增加溶质的量温度或改变其他条件,就可以引发溶液中物质的结晶。
因此,通过调节溶液的温度、浓度、溶剂选择等方式,可以使不同物质的溶解度不同,从而实现结晶分离。
二、溶剂挥发原理:
在液体混合物或溶液中,通过调节溶剂的挥发性,可以控制溶液中物质的浓度。
例如,利用溶剂挥发的方法可以将溶液中的溶质浓缩到超过其溶解度,从而导致结晶的形成。
这种方法常被用于工业生产中,如盐类、有机化合物等的制备。
三、降低温度原理:
大部分物质在降低温度的情况下,其溶解度会减小,从而有利于结晶的形成。
利用这一原理,可以通过控制溶液的温度来实现结晶分离。
例如,将溶质溶解在热溶剂中,然后迅速降低溶液的温度,可促使溶质结晶。
四、化学反应原理:
通过化学反应可以改变物质的性质和溶解度,从而实现结晶分离。
例如,通过加入适当的沉淀剂,在溶液中发生沉淀反应,生成固态的沉淀物,并将其与溶液分离。
综上所述,结晶分离的基本原理包括溶解度差异、溶剂挥发、降低温度和化学反应等。
这些原理可以相互结合使用,根据不同的分离需求选择合适的方法和操作条件,实现物质的结晶分离。
在实践中,结晶分离广泛应用于化学、制药、食品加工、环保等领域,为提取纯净物质、回收溶剂、除去杂质等提供了有效的手段。
化学提纯结晶方法
化学提纯结晶是一种常见的高纯度物质分离技术,一般利用溶剂
萃取、离子交换、沉淀、蒸馏等方法进行提纯结晶。
具体步骤如下:
1.溶剂萃取:以某些有丰富溶剂性能的溶剂将需要提纯的物质进
行萃取,其中可溶的物质从液体萃取到溶剂中,不可溶的物质被滤液;
2.离子交换法:利用它可以实现未知混合溶液中某物质的离子分离;
3.沉淀法:具有某种化学性质的物质可以在溶液中沉淀,即萃取
成分物质改变性质时沉淀于液体表面;
4.蒸馏法:利用趋势不同物质不同温度蒸发的原理,具有不同沸
点的组份可以通过蒸馏法把他们分离出来。
常见物质分离提纯的9种方法1.结晶和重结晶:利用物质在溶液中溶解度随温度变化较大,如NaCl,KNO3。
2.蒸馏冷却法:在沸点上差值大。
乙醇中(水):加入新制的CaO吸收大部分水再蒸馏。
3.过滤法:溶与不溶。
4.升华法:SiO2(I2)。
5.萃取:如用CCl4来萃取I2水中的I2。
6.溶解法:Fe粉(A1粉):溶解在过量的NaOH溶液里过滤分离。
7.增加法:把杂质转化成所需要的物质,如CO2(CO):通过热的CuO;CO2(SO2):通过饱和的NaHCO3溶液。
8.吸收法:用做除去混合气体中的气体杂质,气体杂质必须被药品吸收:N2(O2):将混合气体通过铜网吸收O2。
9.转化法:两种物质难以直接分离,加药品变得容易分离,然后再还原回去:Al(OH)3,Fe(OH)3:先加NaOH溶液把Al(OH)3溶解,过滤,除去Fe(OH)3,再加酸让NaAlO2转化成A1(OH)3。
化学实验中的先与后22例1.加热试管时,应先均匀加热后局部加热。
2.用排水法收集气体时,先拿出导管后撤酒精灯。
3.制取气体时,先检验气密性后装药品。
4.收集气体时,先排净装置中的空气后再收集。
5.稀释浓硫酸时,烧杯中先装一定量蒸馏水后再沿器壁缓慢注入浓硫酸。
6.点燃H2、CH4、C2H4、C2H2等可燃气体时,先检验纯度再点燃。
7.检验卤化烃分子的卤元素时,在水解后的溶液中先加稀HNO3中和碱液再加AgNO3溶液。
8.检验NH3(用红色石蕊试纸)、Cl2(用淀粉KI试纸)、H2S(用Pb(Ac)2试纸]等气体时,先用蒸馏水润湿试纸后再与气体接触。
9.做固体药品之间的反应实验时,先单独研碎后再混合。
10.配制FeCl3,SnCl2等易水解的盐溶液时,先溶于少量浓盐酸中,再稀释。
11.中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准掖;先用待测液润洗后再移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点。
重结晶的过程和原理
重结晶是一种提纯和分离固体的常用技术手段,其过程可概括为:1. 找到待分离物质的合适溶剂,配制饱和溶液。
2. 加热溶液至完全溶解,并过滤除杂质。
3. 慢慢冷却溶液至一定程度,通常为室温或略低于室温。
4. 保持缓慢搅拌,待溶液轻度过饱和后,停止搅拌。
5. 将过饱和溶液静置一段时间,通常几天到一周。
6. 溶液中会慢慢生成晶核和结晶,目标物质从溶液中结晶出来。
7. 用过滤分离结晶出的固体,洗涤后干燥即得。
其结晶原理在于溶解度与温度和溶液浓度有关。
适当调节这两个因素,可以使溶质从溶液中结晶出来,实现分离提纯。
重结晶可以提高产品的纯度和结晶度,是化工、冶金、食品等行业常用的精制技术。
但操作过程需要控制缓慢,否则会形成大量细小晶体。