化学反应与能量复习课
- 格式:ppt
- 大小:1.28 MB
- 文档页数:20
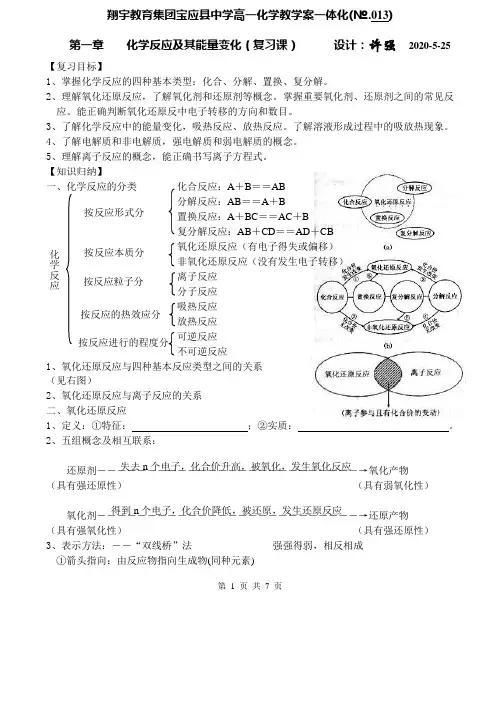
第 1 页 共 7 页翔宇教育集团宝应县中学高一化学教学案一体化(№.013)第一章 化学反应及其能量变化(复习课) 设计:许强 2013-3-30【复习目标】1、掌握化学反应的四种基本类型:化合、分解、置换、复分解。
2、理解氧化还原反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
能正确判断氧化还原反中电子转移的方向和数目。
3、了解化学反应中的能量变化,吸热反应、放热反应。
了解溶液形成过程中的吸放热现象。
4、了解电解质和非电解质,强电解质和弱电解质的概念。
5、理解离子反应的概念,能正确书写离子方程式。
【知识归纳】 一、化学反应的分类化合反应:A +B ==AB分解反应:AB ==A +B置换反应:A +BC ==AC +B复分解反应:AB +CD ==AD +CB氧化还原反应(有电子得失或偏移) 非氧化还原反应(没有发生电子转移) 离子反应 分子反应 吸热反应 放热反应 可逆反应 不可逆反应 1、氧化还原反应与四种基本反应类型之间的关系(见右图)2、氧化还原反应与离子反应的关系二、氧化还原反应1、定义:①特征: ;②实质: 。
2、五组概念及相互联系:还原剂――――――――――――――――――――――――――→氧化产物(具有强还原性) (具有弱氧化性)氧化剂――――――――――――――――――――――――――→还原产物(具有强氧化性) (具有强还原性)3、表示方法:――“双线桥”法 强强得弱,相反相成①箭头指向:由反应物指向生成物(同种元素)②电子数目:化合价升高(或降低)总数 按反应形式分 按反应本质分 按反应粒子分 按反应的热效应分 按反应进行的程度分 化学反应失去n 个电子,化合价升高,被氧化,发生氧化反应 得到n 个电子,化合价降低,被还原,发生还原反应第 2 页 共 7 页离子化合物 共价化合物 化合物 纯净物氧化剂 +() (较弱氧化性) 4、规律 (1)守恒律——化合价升高和降低总数 ,电子得失总数 。



例:灼热的炭与二氧化碳的反应、炭和水蒸气的反应、氢气还原氧化铜、Ba(OH)2·8H 2O 与NH 4Cl 的反应、大多数分解反应等。
(二)、化学能与电能⑴化学能与电能的相互转化①火力发电——化学能间接转化为电能化学能−−−→−燃烧热能−−→−蒸气机械能−−−→−发电机电能 ②原电池——化学能直接转化为电能的装置。
⑵①铜—锌原电池的工作原理:②原电池形成的一般条件:Ⅰ 有能自发进行的氧化还原反应。
Ⅱ 相连接的两个电极(金属或非金属导体及其它可以做电极材料的物质)。
Ⅲ 两电极同时与电解质溶液接触。
Ⅳ 形成闭合回路。
③原电池的实质:氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移给氧化剂。
④原电池原理的应用:Ⅰ 实验室制氢气。
为加快氢气的产生速率,可用粗Zn 或Zn 粒,先用CuSO 4溶液浸泡一会儿 或向反应液中加入少量的CuSO 4溶液。
Ⅱ 可判断金属的活泼性。
若由两种活动性不同的金属做电极,则较活泼的金属做负极(一般情况下)。
Ⅲ 制化学电源(电池)。
如干电池、蓄电池、燃料电池、高能电池。
a .一次电池:放电之后不能充电(内部的氧化还原反应是不可逆的)。
如干电池等。
b .二次电池(充电电池):在放电时所进行的氧化还原反应,在充电时可以逆向进行(一般通过充电器将交流电转变为直流电),使电池恢复到放电前的状态。
这样可以实现化学能转变为电能(放电),再由电能转变为化学能(充电)的循环。
如铅蓄电池、镍镉电池、镍氢电池等。
c .燃料电池:利用原电池的工作原理将燃料和氧化剂(如氧气)反应所放出的能量直接转化为电能。
通常通过外设装备将燃料送入原电池的负极,而将氧化剂送入原电池的正极,这时电池起着类似于试管、Ⅰ尽可能使燃料充分燃烧,提高能量的转化率。
关键是燃料与空气或氧气要尽可能充分地接触,且空气要适当过量。
Ⅱ尽可能充分地利用燃料燃烧所释放的热能,提高热能的利用率。
提高燃料的燃烧效率实质上是从多方面控制燃烧反应的条件(包括环境)。




高一化学化学反应与能量复习学案编号:04【学习目标】1、能正确书写热化学方程式。
2、燃烧热的计算3、能用盖斯定律和热化学方程式进行有关反应热的简单计算。
【使用说明】利用一节课,认真阅读课本完成学案,下课收齐。
下节课修改10 分钟后结合错题统计讨论10分钟,师生探究、学生展示20分钟,巩固落实5分钟。
加*的内容为本章重难点。
【基础自学】一、化学键与化学反应中能量变化的关系1、化学反应中能量变化的原因物质中的原子之间是通过相结合的,断开反应物中的化学键要能量;形成生成物中的化学键要能量。
2、决定化学反应中能量变化的因素(1)E(吸收) E(释放)——放热反应E(吸收) E(释放)——吸热反应(2)∑E(反应物)∑E(生成物)————放热反应∑E(反应物)∑E(生成物)————吸热反应二、化学能与热能的相互转化1、两条基本的自然定律⑴质量守恒定律:自然界中物质发生变化时,不变。
⑵能量守恒定律:化学能是能量的一种形式,可以转化为能量,如转化为等。
2、化学能转化为热能——放热反应常见的放热反应有3、热能转化为化学能——吸热反应常见的吸热反应有【思维拓展】1、“放热反应都不需要加热,吸热反应都需要加热”这种说法对吗?不对吸放热与反应条件无关。
2、凡是有能量变化的过程一定发生了化学变化吗?3、是否存在反应物的总能量等于生成物的总能量的化学反应?为什么?4、吸热反应(放热反应)与反应物、生成物具有的总能量、化学键强弱有何关系?三、焓变、反应热1、在吸热反应中,由于生成物的总能量反应物的总能量,所以吸热反应的反应热 0,即△H为、(填+、—)。
在放热反应中,由于生成物的总能量小于反应物的总能量,所以放热反应的反应热 0,即△H为。
2、计算△H的方法:△H= 的总能量- 的总能量=*四、热化学方程式观察例1——例3中的热化学方程式例1.在2000C、101KPa时,1molH2与碘蒸气作用生成HI的反应,有关文献上表示为:例2.在250C、101KPa时,有2mol由H2和O2化合生成1molH2O的反应,一个生成气态水,一个生成液态水,其化学方程式可表示为:例3. 合成氨的反应热可以表示为:【自主总结】:1、热化学方程式定义:能表示参加反应和关系的化学方程式。



《化学反应与能量》复习课王季常一.清楚复习课的重要功效,除了形成知识网络,更重要的是整合提升学生的能力培养学生的能力当然不能只依靠复习课,平时的化学课堂教学才是培养学生学科素养的重要阵地,而复习课更多的是整合提升学生的综合能力。
化学需要培养学生如下的能力1. 接受、吸收、整合化学信息的能力(1) 能够对中学化学基础知识融会贯通,有正确复述、再现、辨认的能力(2) 能够通过对实际事物、实验现象、实物、模型、图形、图表的观察,以及对自然界、社会、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储的能力。
(3) 能够从提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力。
2. 分析问题和解决(解答)化学问题的能力(1) 能够将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。
(2) 能够将分析解决问题的过程和成果,用正确的化学术语及文字、图表、模型、图形等表达,并作出解释的能力。
3. 化学实验与探究能力(1) 了解并初步实践化学实验研究的一般过程,掌握化学实验的基本方法和技能。
(2) 在解决简单化学问题的过程中,运用科学的方法,初步了解化学变化规律,并对化学现象提出科学合理的解释。
二.了解高考考纲,使复习课能让学生达到考纲所要求的知识要求在高二的课堂教学中,主要是不断复习旧知识,了解一些新知识,并通过这些知识的学习达到培养目标,因此课堂教学中不能围绕高考进行教学。
在复习课中,教师要了解所教知识块的高考考纲目标要求,这样在每章节的复习课中使学生的能力进一步提升。
因此复习课与平时的课堂教学要有些不同。
高考考纲要求(1) 了解化学反应中能量转化的原因,能说出常见的能量转化形式(2) 了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念(3) 了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算(4) 了解能源是人类生存和社会发展的重要基础。
第38讲反应热热化学方程式[复习目标] 1.知道常见的吸热反应和放热反应,了解反应热、焓变的概念以及反应热产生的原因。
2.了解热化学方程式的含义,能正确书写热化学方程式。
3.了解燃烧热的含义和能源及能源利用的意义。
考点一反应热焓变1.反应热和焓变(1)反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量。
(2)焓变①焓(H):与内能有关的物理量。
②焓变(ΔH):生成物的焓与反应物的焓之差。
③焓变与反应热的关系等压条件下的反应热等于反应的焓变,常用ΔH表示反应热,常用单位:kJ·mol-1。
2.常见的吸热反应和放热反应吸热反应(ΔH>0)放热反应(ΔH<0)①Ba(OH)2·8H2O与NH4Cl的反应②大多数的分解反应③弱电解质的电离④盐类水解⑤C和H2O(g)、C和CO2的反应①中和反应②燃烧反应③金属与酸或氧气的反应④铝热反应⑤酸性氧化物或碱性氧化物与水的反应⑥大多数的化合反应3.吸热、放热的原因分析(1)从能量图分析物质能量变化与焓变的关系:ΔH=E(生成物的总能量)-E(反应物的总能量)。
(2)从化学键变化分析总结利用键能计算焓变(ΔH),通过ΔH的正、负轻松判断化学反应是吸热还是放热。
ΔH=反应物键能之和-生成物键能之和。
1.放热反应不需要加热就能发生,吸热反应不加热就不能发生()2.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关()3.吸热反应中,反应物化学键断裂吸收的总能量高于生成物形成化学键放出的总能量() 4.活化能越大,表明化学反应吸收的能量越多()答案 1.× 2.√ 3.√ 4.×一、对反应过程能量图的理解1.科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。
反应过程的示意图如图。
回答下列问题:(1)从状态Ⅰ到状态Ⅲ为 (填“吸热”或“放热”)反应。
(2)从状态Ⅰ到状态Ⅱ需要 (填“吸收”或“释放”)能量,CO 分子 (填“是”或“否”)需要断键形成C 和O 。