2019年高考化学必考知识点双向细目表
- 格式:docx
- 大小:28.62 KB
- 文档页数:8
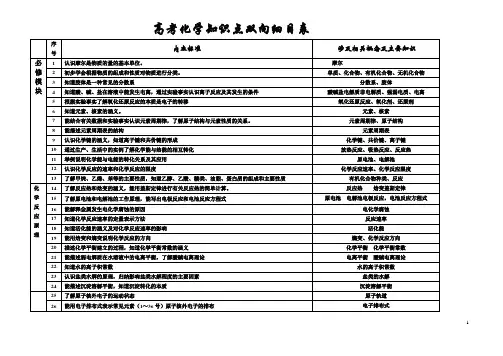


命题区间一化学基本素养的考查角度一关注“化学与技术、社会环境”的协调发展1.高考有关“化学与社会和谐发展”试题的选材热点总结(1)安全与健康——人体必需的营养元素;重金属对人体的危害;食品添加剂;有关化学与健康方面的材料等。
(2)大气污染雾霾——大气中可吸入颗粒物(PM10、PM2.5)过多,产生的主要原因有汽车尾气、化石燃料的燃烧、工业排放的废气(如:冶金、窑炉与锅炉、机电制造业等)、建筑工地和道路交通产生的扬尘。
酸雨(pH<5.6)——大气中含硫氧化物、含氮氧化物过多,与化石燃料的燃烧、工业废气的排放(如硫酸、硝酸的生产、冶金)、雷电等有关。
光化学烟雾——大气中的氮氧化物过多,与汽车尾气、化石燃料的燃烧有关。
(3)白色污染——人们对难降解的塑料垃圾(多指塑料袋)污染环境现象的一种形象称谓。
(4)能源清洁能源——天然气、氢气等在燃烧时不产生烟尘的能源;化石能源——天然气、石油和煤等能源;绿色能源——不产生负效应的能源,如氢能、风能、太阳能等;新能源——最新开发利用的能源,如氢能、风能、太阳能、核能等。
(5)无机材料一般可以分为传统的和新型的无机材料两大类。
传统的无机材料是指以二氧化硅及其硅酸盐化合物为主要成分制备的材料,因此又称硅酸盐材料,主要包括水泥、玻璃和陶瓷。
新型无机材料是指用氧化物、氮化物、碳化物、硼化物、硫化物、硅化物以及各种非金属化合物经特殊的先进工艺制成的具有某种优异性能的材料。
2.绿色化学的特点研究对环境没有任何副作用的化学试剂、化学制品和化学工艺。
它包括:(1)开发绿色反应,将原子利用率提高到100%;(2)使用无毒无害的原料;(3)选用无毒无害的催化剂;(4)使用无毒无害的溶剂;(5)发展“绿色工艺”;(6)开发和生产绿色产品。
角度二关注生产和生活中的常见物质1.熟记常见物质的俗名及化学式(1)明矾:KAl(SO4)2·12H2O(2)胆矾、蓝矾:CuSO4·5H2O(3)绿矾:FeSO4·7H2O(4)钡餐、重晶石:BaSO4(5)孔雀石(铜绿):Cu2(OH)2CO3(6)水晶、石英:SiO2(7)纯碱、苏打:Na2CO3(8)磁性氧化铁:Fe3O42.熟记生活中的下列物质(1)无机盐净水剂:氯化铁,硫酸亚铁,硫酸铁,硫酸铝,氯化铝,明矾。
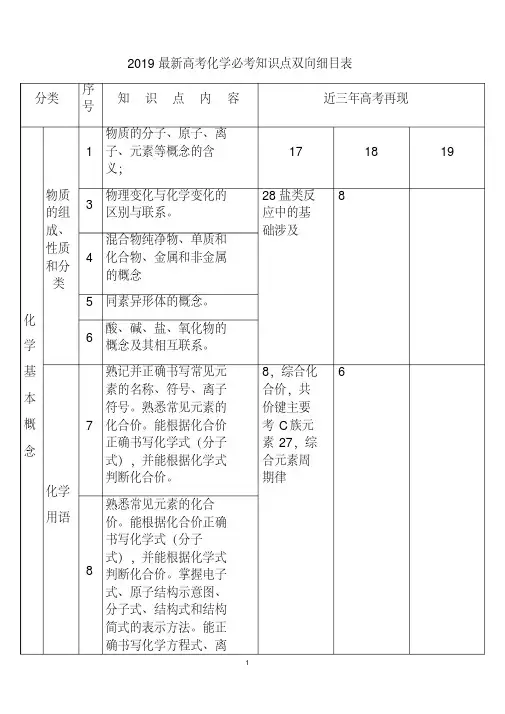
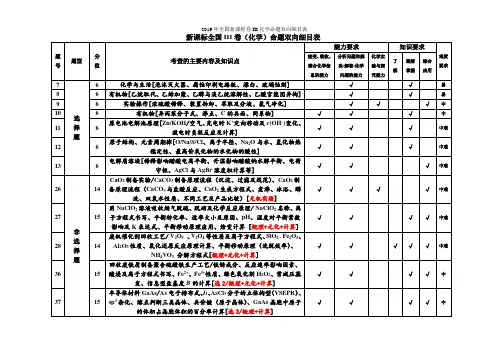
2019最新高考化学必考知识点双向细目表分类序号知识点内容近三年高考再现化学基本概念物质的组成、性质和分类1物质的分子、原子、离子、元素等概念的含义;17 18 193物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及84混合物纯净物、单质和化合物、金属和非金属的概念5 同素异形体的概念。
6酸、碱、盐、氧化物的概念及其相互联系。
化学用语7熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律68熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
化学中常用计量12了解相对原子质量、相对分子质量的含义。
11,综合原子结构中等6,氧化还原涉及简单13物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)。
14物质的量浓度(mol·L-1)、阿伏加德罗常数。
15掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
化学反应与能量16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算中等26题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合10,得失电子守恒,方程式配平17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19 了解化学反应中的能量变化,吸热反应、放热26,热方程,反应11热化学书写反应7热化学书写反应反应、反应热、燃烧热和中和热及新能源的开发等概念。
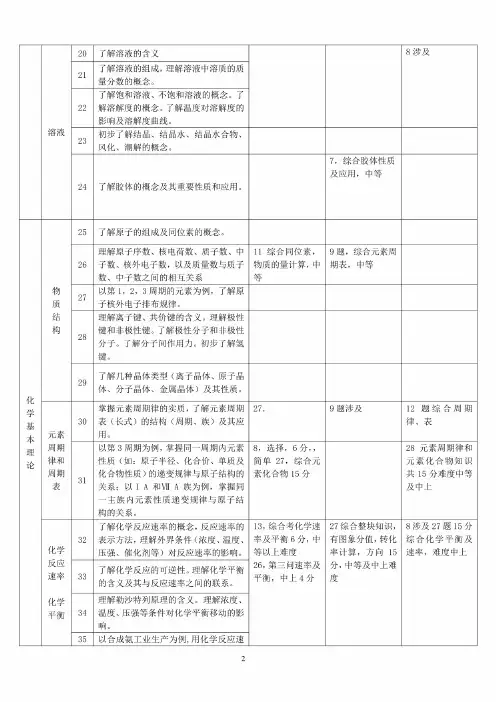
2019年高考化学知识点双向细目表分类序号知识点内容近三年高考再现化学基本概念物质的组成、性质和分类1物质的分子、原子、离子、元素等概念的含义;171819 3物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及84混合物纯净物、单质和化合物、金属和非金属的概念5同素异形体的概念。
6酸、碱、盐、氧化物的概念及其相互联系。
化学用语7熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律68熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
化学中常用计量12了解相对原子质量、相对分子质量的含义。
11,综合原子结构中等6,氧化还原涉及简单13物质的量的单位一摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g・molT、L-mol-1)o14物质的量浓度(mol-L-1)、阿伏加德罗常数。
15掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
化学反应与能量16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算中等26题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合10,得失电子守恒,方程式配平17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念。
26,热方程,反应热7分11热化学书写反应热,中等7热化学书写反应热,中等溶液20了解溶液的含义8涉及21了解溶液的组成,理解溶液中溶质的质量分数的概念。
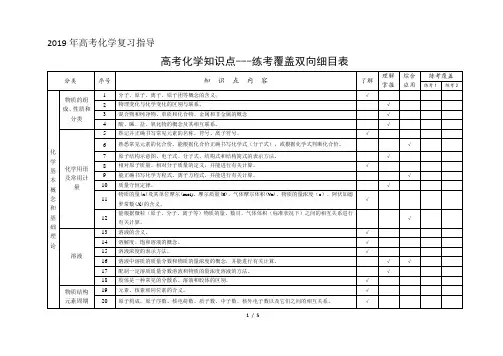
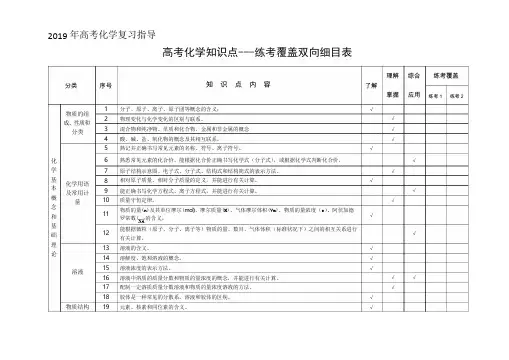
)2019 年高考化学复习指导高考化学知识点---练考覆盖双向细目表理解 综合 练考覆盖分类 序号知 识 点 内 容了解物质的组 成、性质和分类12 3 45 分子、原子、离子、原子团等概念的含义; 物理变化与化学变化的区别与联系。
混合物和纯净物、单质和化合物、金属和非金属的概念 酸、碱、盐、氧化物的概念及其相互联系。
熟记并正确书写常见元素的名称、符号、离子符号。
√√掌握√√√应用练考 1 练考 2化 6 熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。
√学 7原子结构示意图、电子式、分子式、结构式和结构简式的表示方法。
√基 本 概 念 和 基 础化学用语 及常用计量8910 1112 相对原子质量、相对分子质量的定义,并能进行有关计算。
能正确书写化学方程式、离子方程式,并能进行有关计算。
质量守恒定律。
物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c )、阿伏加德 罗常数(NA 的含义。
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行 有关计算。
√√√√√理 论1314溶液的含义。
溶解度、饱和溶液的概念。
√√ 溶液1516 溶液浓度的表示方法。
溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
√√√17 配制一定溶质质量分数溶液和物质的量浓度溶液的方法。
√18物质结构19胶体是一种常见的分散系。
溶液和胶体的区别。
元素、核素和同位素的含义。
√√元素周期律2021原子构成。
原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
原子核外电子排布规律。
√√22元素周期律的实质。
√23元素周期表(长式)的结构(周期、族)及其应用。
√2425以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系以IA和ⅦA族为例,掌握同一主族元素性质递变规律与原子结构的关系。
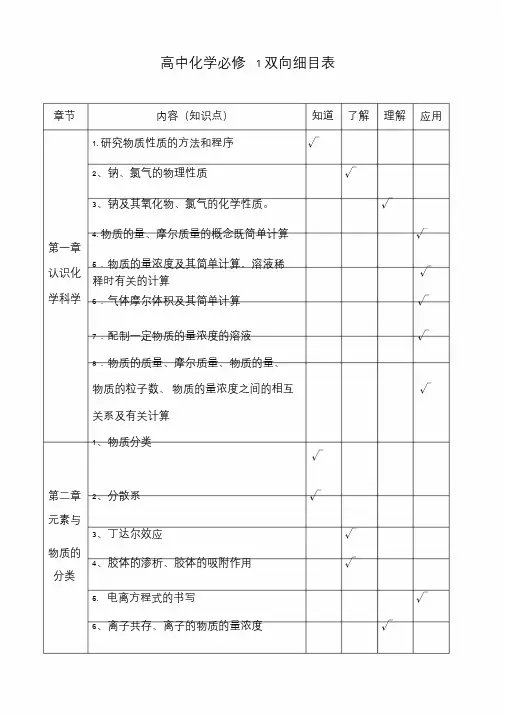
高中化学必修 1 双向细目表章节内容(知识点)知道了解理解应用1. 研究物质性质的方法和程序√2、钠、氯气的物理性质√3、钠及其氧化物、氯气的化学性质。
√第一章4. 物质的量、摩尔质量的概念既简单计算√认识化5.物质的量浓度及其简单计算,溶液稀释时有关的计算√学科学6.气体摩尔体积及其简单计算√7.配制一定物质的量浓度的溶液√8.物质的质量、摩尔质量、物质的量、物质的粒子数、物质的量浓度之间的相互√关系及有关计算1、物质分类√第二章2、分散系√元素与3、丁达尔效应√物质的分类4、胶体的渗析、胶体的吸附作用√5. 电离方程式的书写√6、离子共存、离子的物质的量浓度√7、Cl - 、SO2- 、CO2- 的检验方法√4 38.氧化还原反应、氧化、还原、氧化剂、√ 还原剂等概念9.简单的氧化还原反应方程式的配平、√标出电子转移的方向和数目1、同素异形体的概念,√2、碳酸钠和碳酸氢钠的主要性质。
√3、碳单质、一氧化碳、二氧化碳、碳酸√ 盐、碳酸氢盐之间的转化。
4.自然界中的氮循环及人类活动对氮循第三章√环的影响;自然界5、生物固氮和人工固氮形式,认识N2 、中的元√NO 、NO2 的性质;素6、NH3 性质及制取、铵盐的性质及铵态氮√ 肥的使用问题;7、HNO3 的性质。
√8、硫的主要性质;√9、不同价态硫元素之间的相互转化√10、二氧化硫和浓硫酸的主要性质。
√11、硫及其化合物在生产中的应用及酸雨√ 的危害12、镁单质的还原性和重要用途。
√13、氯、溴、碘单质的氧化性和氧化性递变顺序及溴单质和溴的化合物的重要用√途。
14、海水中微量元素的存在和应用及在工业生产和高科技领域的潜在价值,认识到√综合开发利用海水化学资源的重要意义。
1、硅的存在及用途。
√2、二氧化硅的物理、化学性质及其用途。
√3、硅酸的性质(弱酸性、水溶性、硅胶√第四章的吸水性)及制备方法。
元素与材4.硅酸钠(Na2SiO3)的性质、用途。

高中化学命题双向细目表
高中化学命题双向细目表是一个指导教师命题的重要工具,它详细列出了高中化学的各个知识点和技能,以及它们在试卷中的比重和难度。
以下是一个简化的高中化学命题双向细目表,供您参考:
高中化学命题双向细目表
一、目标领域与认知层级
1. 知识
回忆
理解
应用
2. 技能
分析
判断
实验
3. 态度与价值观
兴趣与好奇心
安全意识
环境保护
二、内容主题
1. 物质结构与性质
分子、原子、离子的基本性质
元素周期表与元素性质
酸、碱、盐、氧化物的性质与反应2. 化学反应与能量
化学反应的类型与能量变化
电化学基础(原电池、电解池)3. 有机化学基础
常见有机物的结构与性质
有机反应类型与机理
4. 实验技能与安全
实验操作与仪器使用
实验设计与数据处理
实验安全与环境保护
5. 化学计算
物质的量与摩尔质量计算
化学反应中的定量关系与计算
6. 化学工艺流程与合成
实际生产中的化学工艺流程
有机合成与高分子合成基础
7. 综合应用
各主题的综合应用与分析解决实际问题能力。