完整超全高一化学必修二第一章物质结构元素周期律知识点总结
- 格式:doc
- 大小:84.54 KB
- 文档页数:8

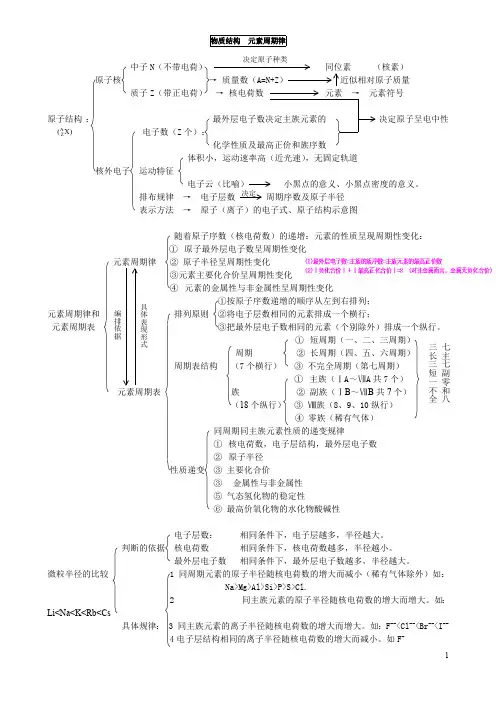
第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子)原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电..........子排布的周期性变化.........的必然结果。

高一化学必修二期中考试知识点总结归纳第一章物质结构元素周期律一、原子结构原子序数=核电荷数=质子数=原子的核外电子数★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号:K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同..。
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数2.结构特点:三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是...元素原子核外电子排布的周期性变化................的必然结果。
2.同周期元素性质递变规律第ⅠA族碱金属元素:Li Na K Rb Cs Fr (Fr是金属性最强的元素,位于周期表左下方)第ⅦA族卤族元素:F Cl Br I At (F是非金属性最强的元素,位于周期表右上方)★判断元素金属性和非金属性强弱的方法:(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu。
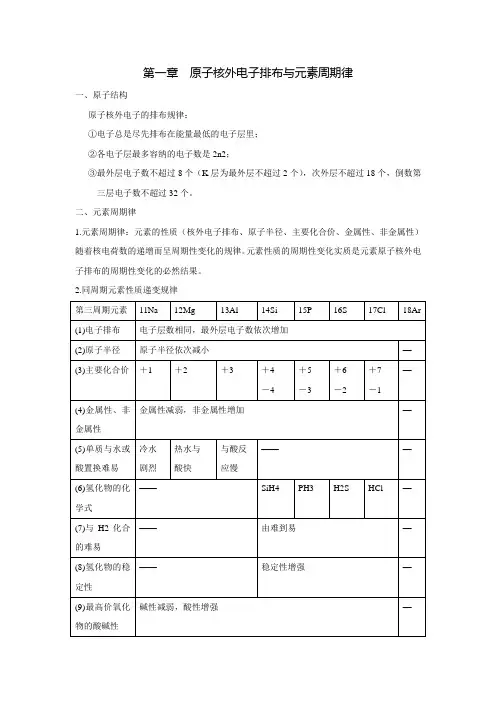
第一章原子核外电子排布与元素周期律
一、原子结构
原子核外电子的排布规律:
①电子总是尽先排布在能量最低的电子层里;
②各电子层最多容纳的电子数是2n2;
③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第
三层电子数不超过32个。
二、元素周期律
1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电子排布的周期性变化的必然结果。
2.同周期元素性质递变规律
★判断元素金属性和非金属性强弱的方法:
(1)金属性强(弱)
①单质与水或酸反应生成氢气容易(难);
②氢氧化物碱性强(弱);
③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu。
(2)非金属性强(弱)
①单质与氢气易(难)反应;
②生成的氢化物稳定(不稳定);
③最高价氧化物的水化物(含氧酸)酸性强(弱);
④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2。
三、离子键与共价键的比较
离子化合物:由离子键构成的化合物叫做离子化合物。
(一定有离子键,可能有共价键)共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。
(只有共价键一定没有离子键)
极性共价键(简称极性键):由不同种原子形成,A-B型,如,H-Cl。
非极性共价键(简称非极性键):由同种原子形成,A-A型,如,Cl-Cl。

第一章物质的结构元素周期律元素周期表1.复习要点1.周期表的结构。
理解地点、结构、性质三者之间的关系。
2.依据“位—构—性”之间的关系,会进行元素推测和确立几种元素形成化合物形式。
2.难点聚焦二、周期表结构1.位、构、性三者关系结构决定地点,结构决定性质,地点表现性质。
确立决定2.几个量的关系反响反响周期数 =电子层数推测主族数 =最外层电子数 =最高正价数地点性质| 最高正价 |+| 负价 |=8推测3.周期表中部分规律总结⑴最外层电子数大于或等于 3 而又小于 8的元素必定是主族元素;最外层电子数为1或 2 的元素可能是主族、副族或 0 族 (He)元素;最外层电子数为 8 的元素是稀有气体元素(He 除外 )。
⑵在周期表中,第Ⅱ A 与Ⅲ A 族元素的原子序数差异有以下三种状况:①第 1~3 周期 (短周期 )元素原子序数相差1;②第 4、 5 周期相差11;③第6、7 周期相差 15。
⑶每一周期排布元素的种类满足以下规律:设n 为周期序数,则奇数周期中为(n1) 22种,偶数周期中为(n2)22种。
⑷同主族相邻元素的原子序数差异有以下二种状况:①第ⅠA、Ⅱ A 族,上一周期元素的原子序数 +该周期元素的数量=下一同期元素的原子序数;②第ⅣA~Ⅶ A 族,上一周期元素的原子序数 +下一周期元素的数量 =下一周期元素的原子序数。
⑸设主族元素族序数为a,周期数为 b,则有:① a/ b<1 时,为金属元素,其最高氧化物为碱性氧化物,最高氧化物对应的水化物为碱;②a/ b=1 时,为两性元素 (H 除外 ),其最高氧化物为两性氧化物,最高氧化物对应的水化物为两性氢氧化物;③a/ b>1 时,为非金属元素,其最高氧化物为酸性氧化物,最高氧化物对应的水化物为酸。
无论是同周期还是同主族元素中, a/b 的值越小,元素的金属性越强,其最高氧化物对应水化物的碱性就越强;反之, a/ b 的值越大,元素的非金属性越强,其最高氧化物对应水化物的酸性就越强。

第一章 物质结构 元素周期律 一、原子结构质子(Z 个)原子核中子(N 个)1. X核外电子(Z 个)2.Z A n R的质子数与质量数,中子数,电子数之间的关系:(1)、数量关系:核内质子数=核外电子数(2)、电性关系:原子 核电荷数=核内质子数=核外电子数= 原子序数阳离子 核外电子数=核内质子数-电荷数 阴离子 核外电子数=核内质子数+电荷数(3)、质量关系:质量数(A )=质子数(Z )+中子数(N )例1.某元素二价阳离子的核外有18个电子,质量数为40,该元素的原子核中的中子数为 ( )A.16 B.18 C.20 D.22例2.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为 A .57 B .47 C .61 D .293 例3.下列关于3 2He 的说法正确的是A .3 2He 原子核内含有2个中子B .32He 原子核内含有3个质子 C .3 2He 原子核外有3个电子 D .3 2He 和4 2He 是两种不同的核素3.(1)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca (2).原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七对应表示符号: K L M N O P Q例4.下列说法正确的是( )A .原子最外层电子数等于或大于3(小于8)的元素一定是非金属元素B .原子最外层只有1个电子的元素一定是金属元素C .最外层电子数比次外层电子数多的元素一定位于第二周期D .某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 例5. 画出下列各微粒的结构示意图:(1)最外层电子数为次外层电子数两倍的原子__________; (2)L 层电子数为K ,M 层电子数之和的原子________; (3)M 层电子数为K 层电子数三倍的原子__________; (4)与Ne 原子电子层结构相同的 2价阴离子__________。
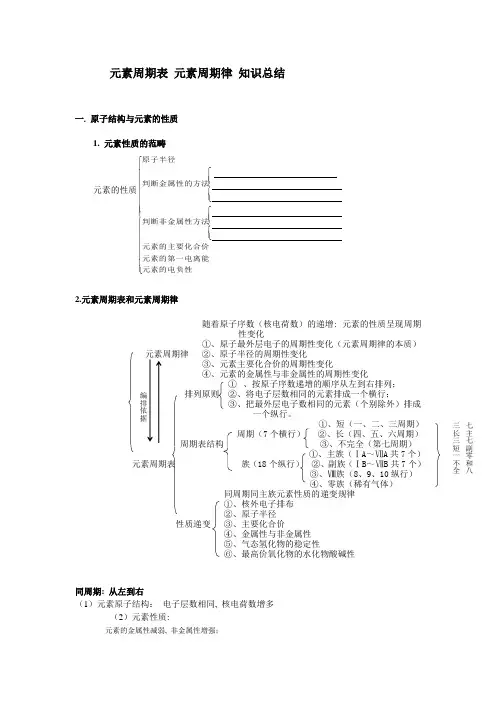
元素周期表 元素周期律 知识总结一. 原子结构与元素的性质1. 元素性质的范畴元素的性质⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧元素的电负性元素的第一电离能元素的主要化合价判断非金属性方法判断金属性的方法原子半径2.元素周期表和元素周期律随着原子序数(核电荷数)的递增: 元素的性质呈现周期性变化①、原子最外层电子的周期性变化(元素周期律的本质)元素周期律 ②、原子半径的周期性变化③、元素主要化合价的周期性变化④、元素的金属性与非金属性的周期性变化① 、按原子序数递增的顺序从左到右排列;排列原则 ②、将电子层数相同的元素排成一个横行; ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短(一、二、三周期)周期(7个横行) ②、长(四、五、六周期)周期表结构 ③、不完全(第七周期)①、主族(ⅠA ~ⅦA 共7个)元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个)③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径性质递变 ③、主要化合价④、金属性与非金属性 ⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性同周期: 从左到右(1)元素原子结构: 电子层数相同, 核电荷数增多(2)元素性质:元素的金属性减弱, 非金属性增强;编排依据七主七副零和八三长三短一不全原子半径减小;金属单质的还原性减弱, 非金属单质的氧化性增强; 金属阳离子的氧化性增强, 非金属阴离子的还原性减弱。
同主族: 从上到下(1)原子结构 (2)元素性质最外层电子 原子半径增大 金属性增强 金属阳离子的氧化性减弱 数相同, 非金属性减弱电子层数增多。
金属单质的还原性增强 非金属阴离子的还原性增强 非金属单质的氧化性减弱元素周期表中的规律(1)“三角形”规律所谓“三角形”, 即A.B 处于同周期, A.C 处于同主族的位置 (2)“对角线”规律 有些元素在周期表中虽然既非同周期, 又非同主族, 但其单质与同类化合物的化学性质却很相似, 如Li 和Mg, B 和Si 等。

1、元素周期表:第一章 物质结构元素周期律知识点总结5、化学反应方程式:(金属锂只有一种氧化物)点燃点燃4Li + O 2 Li 2O 2Na + O 2 Na 2O 22 Na + 2H 2O = 2NaOH + H 2↑ 2K + 2H 2O = 2KOH + H 2↑2R + 2 H 2O = 2 ROH + H 2 ↑Na 、K 需保存于煤油中,但 Li 的密度比煤油小,所以 Li 必须保存在密度更小的石蜡油中或密封于石蜡二、卤族元素:1、氟氯溴碘砹(F 、Cl 、Br 、I 、At )2、物理递变:①颜色:逐渐加深;②状态:g →l →s ;③密度:不断增大;④熔沸点逐渐升高。
3、化学特性:①非金属性(氧气性):F 2>Cl 2>Br 2>I 2;②阳离子的还原性:F -<Cl -<Br -<I-;③与 H2 反应的难易:易→难;④氢化物的稳定性:HF >HCl >HBr >HI ;⑤氢化物的还原性:HF ﹤HCl <HBr <HI ;⑥氢化物溶于水形成酸的酸性:HF<HCl<HBr<HI ;最高价氧化物对应水化物的酸性:HClO >HBrO >HIO2、元素周期表的结构分解:4、特殊性质⑴F 无正价,无含氧酸;4 4 4⑵F 2 与水反应放出氧气 2F 2+2H 2O=4HF+O 2 ,HF 在 HX 中沸点最高,因为分子间存在氢键。
⑶卤素间的置换反应:氧化性强的可以置换出氧化性弱的。
⑸HF 为弱酸能腐蚀玻璃;⑹AgF 易溶于水,无感光性;⑺Cl2 易液化,Br2 是唯一常温下为液态的非金属单质, 易挥发;I 2 易升华,遇淀粉变蓝。
三、核素:1、质量数(A )=质子数(Z )+中子数(N )。
2、把具有一定数目质子和一定数目中子的一种原子叫做核素。
(指原子)3、质子数相同而中子数不同的同一元素的不同原子互称为同位素。
4、同素异形体:由同种元素组成的结构性质不同的单质。

一、原子结构质子(Z 个)原子核注意:中子(N 个) 质量数(A)=质子数(Z)+中子数(N)1.原子) 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z 个)阳离子中:核电荷数=离子核外电子数 + 离子电荷数 阴离子中:核电荷数=离子核外电子数 - 离子电荷数 2、电子层划分 3、核外电子排布规律(1)核外电子总是尽先排布在能量 低 的电子层,然后由 里 向 外 从能量低的电子层逐步向能量高的电子层摆布(即排满K 层再排L 层,排满L 层再排M 层)。
(2)各电子层最多容纳的电子数是 2n 2个(n 表示电子层)(3)最外层电子数不超过8个(K 层是最外层时,最多不超过2 个);次外层电子数不超过18 个;倒数第三层不超过32 个。
4、概念元素:具有相同 核电荷数(质子数)的同一类原子的总称核电荷数决定元素种类 核素:具有一定数目 质子 和一定数目 中子 的一种原子。
同位素:质子数 相同而 中子数 不同的同一元素的不同原子之间的互称。
例:氕(1 1H )、氘(2 1D )、氚(3 1T ) 同素异形体:同种元素原子组成结构不同的不同单质之间的互称。
例:O 2与O 3,白磷与红磷,石墨与金刚石等[粒子半径大小的比较](1)同周期元素的原子或最高价阳离子的半径随着核电荷数的增大而逐渐减小(除稀有气体外)。
例:Na>Mg>Al>Si, Na +>Mg 2+>Al 3+(2)同主族元素的原子或离子随核电荷数增大而逐渐增大。
例:Li<Na<K, Li +<Na +<K +(3)电子层结构相同(核外电子排布相同)的离子半径(包括阴阳离子)随核电荷数的增加而减小。
例:O 2->F ->Na +>Mg 2+>Al 3+(上一周期元素形成的阴离子与下一周期元素形成的阳离子有此规律)(4)同种元素原子形成的粒子半径大小为:阳离子<中性原子<阴离子;价态越高的粒子半径越小。

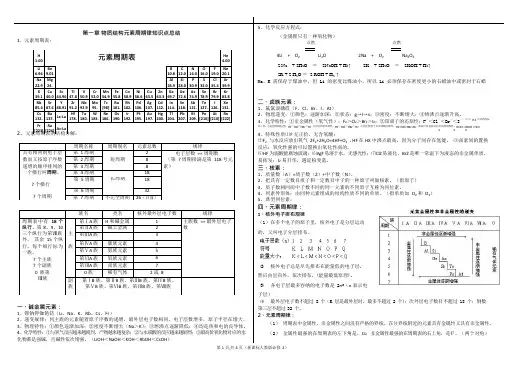
第一章物质结构元素周期律知识点总结1、元素周期表:H 1.00 元素周期表He4.00Li 6.94Be9.01B10.8C12.0N14.0O16.0F19.0Ne20.1Na 22.9 Mg24.Al26.9Si28.0P30.9S32.0Cl35.4Ar39.9K 39.1Ca40.0Sc44.96Ti47.8V50.9Cr52.0Mn54.9Fe55.8Co58.9Ni58.6Cu63.5Zn63.3Ga69.7Ge72.6As74.9Se78.9Br79.9Kr83.8Rb 85.4Sr87.6Y88.91Zr91.2Nb92.9Mo95.Tc[98]Ru101.Rh102.Pd106.Ag107.Cd112.In114.Sn118.Sb121.Te127.I126.Xe131.Cs 132.Ba137.La-LuHf178.Ta180.W183.Re186.Os190.Ir192.Pt195.Au197.Hg200.Tl204.Pb207.Bi209.Po[210]At[210]Rn[222]Fr [223]Ra [226]Ac-La2、元素周期表的结构分解:周期名称周期别名元素总数规律具有相同的电子层数而又按原子序数递增的顺序排列的一个横行叫周期。
7个横行7个周期第1周期短周期2 电子层数== 周期数(第7周期排满是第118号元素)第2周期8第3周期8第4周期长周期18第5周期18第6周期32第7周期不完全周期26(目前)族名类名核外最外层电子数规律周期表中有18个纵行,第8、9、10三个纵行为第Ⅷ族外,其余15个纵行,每个纵行标为一族。
7个主族7个副族0族第Ⅷ族主族第ⅠA族H和碱金属 1 主族数== 最外层电子数第ⅡA族碱土金属 2第ⅢA族 3第ⅣA族碳族元素 4第ⅤA族氮族元素 5第ⅥA族氧族元素 6第ⅦA族卤族元素70族稀有气体2或8副族第ⅠB族、第ⅡB族、第ⅢB族、第ⅣB族、第ⅤB族、第ⅥB族、第ⅦB族、第Ⅷ族一、碱金属元素:1、锂钠钾铷铯钫(Li、Na、K、Rb、Cs、Fr)2、递变规律:同主族的元素随着原子序数的递增,最外层电子数相同,电子层数增多,原子半径在增大。
化学必修二知识点:物质结构、元素周期律元素是非常重要的自然物质,今天小编要和大家分享的是高一化学必修二知识点总结:物质结构、元素周期律,希望能够帮助到大家好好学习并掌握这部分知识,赶快学习起来吧。
高一化学必修二知识点总结:物质结构、元素周期律人教版高一化学必修二知识总结,第一章物质结构、元素周期律,元素的性质是由原子结构决定,尤其是最外层电子数,由元素在元素周期表中的位置可以推断其性质。
下面根据考纲,总结知识点。
第一节元素周期表第二节元素周期律第三节化学键考纲要求(1)了解元素、核素和同位素的含义。
(2)了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
(3)了解原子核外电子排布。
(4)掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
(5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
(6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
(7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。
(8)了解化学键的定义。
了解离子键、共价键的形成。
第一节元素周期表一、原子结构1、原子是由原子核和核外电子组成,原子核有带正电的质子和不带电的中子构成,核外电子绕核运动。
点击图片可在新窗口打开2、原子中的等量关系质量数(A)=质子数(Z)+中子数(N);原子序数=核电荷数=质子数=原子的核外电子数。
3、熟悉1~20号元素及原子核外电子的排布:H、He、Li、Be、B、C、N、O、F、Ne、Na、Mg、Al、Si、P、S、Cl、Ar、K、Ca。
4、原子核外电子的排布规律(1)电子总是尽先排布在能量最低的电子层里;(2)各电子层最多容纳的电子数是2n2;(3)最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
5、元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
第一章物质结构元素周期律知识点总结1、元素周期表:H 元素周期表HeLi Be B C N O F Ne Na Mg24.Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br KrRb Sr Y Zr Nb Mo95.Tc[98]Ru101.Rh102.Pd106.Ag107.Cd112.In114.Sn118.Sb121.Te127.I126.Xe131.Cs 132.Ba137.La-LuHf178.Ta180.W183.Re186.Os190.Ir192.Pt195.Au197.Hg200.Tl204.Pb207.Bi209.Po[210]At[210]Rn[222]Fr [223 ]Ra[226]Ac-La2、元素周期表的结构分解:周期名称周期别名元素总数规律具有相同的电子层数而又按原子序数递增的顺序排列的一个横行叫周期。
7个横行7个周期第1周期短周期2电子层数 == 周期数(第7周期排满是第118号元素)第2周期8第3周期8第4周期长周期18第5周期18第6周期32第7周期不完全周期26(目前)族名类名核外最外层电子数规律周期表中有18个纵行,第8、9、10三个纵行为第Ⅷ族外,其余15个纵行,每个纵行标为一族。
7个主族7个副族0族第Ⅷ族主族第ⅠA族H和碱金属1主族数 == 最外层电子数第ⅡA族碱土金属2第ⅢA族3第ⅣA族碳族元素4第ⅤA族氮族元素5第ⅥA族氧族元素6第ⅦA族卤族元素70族稀有气体2或8副族第ⅠB族、第ⅡB族、第ⅢB族、第ⅣB族、第ⅤB族、第ⅥB族、第ⅦB族、第Ⅷ族一、碱金属元素:1、锂钠钾铷铯钫(Li、Na、K、Rb、Cs、Fr)2、递变规律:同主族的元素随着原子序数的递增,最外层电子数相同,电子层数增多,原子半径在增大。
3、物理特性:①颜色逐渐加深;②密度不断增大(Na>K);③熔沸点逐渐降低;④均是热和电的良导体。
Z 第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子( A X )原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
化学必修2 第一章物质结构元素周期律1 元素周期表一、元素周期表1.门捷列夫制出了第一张元素周期表。
2.原子序数=核电荷数=质子数=核外电子数3.元素周期表一共有7个周期,每一周期分别有:2,8,8,18,18,32,32,(50)(50)个元素4.元素周期表一共有18纵行,16个族,7个主族7个副族,第Ⅷ族,0族。
(注意书写)5.第ⅠA族(除H):碱金属元素第ⅦA族(第8,9,10纵行):卤族元素0族:稀有气体元素(化学性质不活泼,通常很难与其他物质反应,化合价定位0)6.前三周期是短周期,其他周期是长周期。
7.*尽可能完整地默写元素周期表。
二、元素的性质与原子结构1.*碱金属元素原子结构示意图2.随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,金属性逐渐增强。
(表现为:与氧气或水反应时的剧烈程度。
)3.碱金属的物理性质:除铯外,都是银白色。
导热性导电性很好:液态钠可用作核反应堆的传热介质。
从上到下,密度逐渐增大(K反常),熔沸点逐渐下降。
4.碱金属元素的保存Li封存在石蜡中(一般固体,液体也可以)Na浸没在煤油里K浸没在煤油或石蜡油铷和铯过于活泼,一般实验室保存不了5.碱金属元素的化学方程式与现象Li, Na K比水轻。
Na:浮融游响红Rb,Cs比水重,故与水反应时,应沉在水底。
③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂6.8.*相关的化学方程式三、核素1.质量数(A)=质子数(Z)+中子数(N)2.同种元素原子的原子核中,中子数不一定相同。
如氢:氕、氘、氚3.质子数相同而中子数不同的同一元素的不同原子互称为同位素。
4.同位素的应用:14C考古时测定文物年代,氘氚用于造氢弹、利用放射性同位素释放的射线育种、治疗恶性肿瘤。
2.元素周期律*指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的递增呈周期性变化的规律。
5、化学反应方程式:物质结构元素周期律知识点总结第一章1、元素周期表:点燃点燃(金属锂只有一种氧化物)He H 元素周期表 4.001.00O + O NaO + O Li 2Na 4Li 2 22 22 Ne B C O N Li Be F↑=2KOH + H 2K + 2HO + 2H2 Na O =2NaOH + H↑20.1 16.0 19.0 10.8 12.0 14.0 6.949.01 2222 Ar P Na Mg Al S Si Cl ↑2 ROH + H O 2R + 2 H=39.9 32.0 22.9 24. 26.9 30.9 35.4 28.0 2 2必须保存在密度更小的石蜡油中或密封于石蜡的密度比煤油小,所以LiNa、K需保存于煤油中,但Li KrAs V Sc Cu Ga Ge Se Br Zn Ni Co Fe Mn Cr Ti Ca K83.8 39.1 40.0 50.9 72.6 79.9 69.7 78.9 55.8 54.9 58.9 58.6 63.5 63.3 44.96 47.8 74.9 52.0Xe Sn Pd In Ag Te Ru Rh Cd Rb Sr Y Zr Sb Nb I Mo Tc131. 126. 101. 107. 102. 85.4 87.6 88.91 118. [98] 91.2 112. 114. 92.9 106. 121. 95. 127. 二、卤族元素:Rn Cs Os Hg Hf At Pb Ir Ta Au Tl W Bi BaPt Po Re La-Lu)、At1、氟氯溴碘砹(F、Cl、Br、I[222]190.197. 180.207.195.[210] 183.132. 137. 192.209.[210] 200.178.186.204.;③密度:不断增大;④熔沸点逐渐升高。
→s2、物理递变:①颜色:逐渐加深;②状态:g→l RaFr Ac-LaI;③与<>I;②阳离子的还原性:F<ClBr<3、化学特性:①非金属性(氧气性):F>----H2Cl>Br[226][223] 2222;⑥<HI>HI;⑤氢化物的还原性:HF﹤HCl<HBr反应的难易:易→难;④氢化物的稳定性:HF>HCl>HBr 2、元素周期表的结构分解:>HIOHClO>HBrO氢化物溶于水形成酸的酸性:HF<HCl<HBr<HI;最高价氧化物对应水化物的酸性:4 44 4、特殊性质⑴F无正价,无含氧酸;周期别名规律元素总数周期名称⑶卤素间的置换因为分子间存在氢键。
+2HO=4HF+O ,HF在HX 中沸点最高,⑵F 与水反应放出氧气2F22222 == 周期数周期第1 电子层数具有相同的电子层反应:氧化性强的可以置换出氧化性弱的。
短周期号元1188 数而又按原子序数(第7周期排满是第2周期第是唯一常温下为液态的非金属单Cl2易液化,Br2⑸HF为弱酸能腐蚀玻璃;⑹AgF易溶于水,无感光性;⑺递增的顺序排列的素)8 第3周期质,易挥发;I易升华,遇淀粉变蓝。
2。
周期一个横行叫18 第4周期三、核素:长周期18 第5周期。
)+中子数(N)1、质量数(A)=质子数(Z 7个横行32 第6周期2、把具有一定数目质子和一定数目中子的一种原子叫做核素。
(指原子)个周期7 26 周期不完全周期7第(目前)3、质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(指单质如O和O)4、同素异形体:由同种元素组成的结构性质不同的单质。
32 5、典型同位素:规律类名族名核外最外层电子数四、元素周期律:1最外层和碱金==1周期表中主族第Ⅰ、核外电子排布规律1纵,2子碱土金第A核外电子是分层运动的,在多个电子的原子里,1)三个纵行为第Ⅷ3第个外,其15 又叫电子分层排布4碳族元第行,每个纵行标为 5 氮族元素第ⅤA族一族。
6 氧族元素族第ⅥA 7个主族7 族第ⅦA 卤族元素个副族7 80族或2稀有气体0族然核外电子总是尽先排布在能量低的电子层,(2)第Ⅷ族B族、B副第ⅠB族、第ⅡB族、第Ⅲ族、第Ⅳ。
能量最低原理后由里向外,依次排布。
()族、第Ⅷ族族B第ⅤB族、第Ⅵ族、第ⅦB2nn表示电((3)各电子层最多容纳的电子数是2子层)一、碱金属元素:个;倒数;次外层电子数目不超过18层是最外层时,最多不超过)最外层电子数不超过(48个(K2个))Cs、FrNa、K、Rb、、1、锂钠钾铷铯钫(Li第三层不超过32个。
、递变规律:同主族的元素随着原子序数的递增,最外层电子数相同,电子层数增多,原子半径在增大。
2 2、元素周期律:);③熔沸点逐渐降低;④均是热和电的良导体。
、物理特性:①颜色逐渐加深;②密度不断增大(3Na>K、化学特性:①与氧气反应越来越剧烈,产物越来越复杂;②与水或酸的反应越来越剧烈;③最高价氧化4在分界线附近的元素具有金属性又具有非金属1()周期表中金属性、非金属性之间没有严格的界线。
CsOH)<NaOH<KOHRbOH<<(物对应的水化物都是强碱,且碱性依次增强。
LiOH 性。
)2页(新课标人教版必修5共,页1第三看核外电子数,当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
)金属性最强的在周期表的左下角是,Cs;非金属性最强的在周期表的右上角,是F。
(两个对角)(2)化合价(3O无最高正价。
①元素的最高正价等于主族序数。
特:F无正价,8. ②主族元素的最高正价数与最低负价的绝对值之和等于五、化学键)族(从上到下同周期(从左到右)同主原子半径逐渐减小逐渐增大1.离子键与共价键的比较电子层数递增电子层数相同电子层排布键型离子键共价键最外层电子数相同最外层电子数递增概念阴阳离子之间强烈的相互作用叫做离原子之间通过共用电子对所形成的相互作逐渐增强失电子能力逐渐减弱子键。
用叫做共价键逐渐减弱得电子能力逐渐增强相互作用:静电作用(包含吸引和排斥)逐渐增强金属性逐渐减弱成键方式通过得失电子达到稳定结构通过形成共用电子对达到稳定结构逐渐减弱非金属性逐渐增强成键粒子阴、阳离子原子== +7)最高正价族序数→最高正价(+1 主要化合价―族序数)==―(8 ==非金属负价―(8―族序数)非金属负价成键元素活泼金属与活泼非金属元素之间非金属元素之间酸性逐渐减弱酸性逐渐增强最高氧化物的酸性2、离子化合物:由离子键构成的化合物叫做离子化合物。
(一定有离子键,可能有共价键)碱性逐渐增强对应水化物的碱性碱性逐渐减弱共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。
(只有共价键一定没有离子键)非金属气态氢化物形成由难→难→形成由易易稳定性逐渐减弱稳定性逐渐增强的形成难易、稳定性3、共价键的分类依次增强依次减弱氧化物的稳定性越来越困难与氢气化合越来越容易极性共价键(共用电子对不偏移):由不同种原子形成,A -B型,如,H-Cl。
共价键非极性共价键(共用电子对偏移较强的一方):由同种原子形成,A-A型,如,Cl-Cl。
3、粒子半径比较4、电子式(1)、同种元素的原子或单核离子,化合价越高,半径越小来表示原子的最外层电子(价电子)的式子叫电子式。
或×)定义:在元素符号周围用小黑点( 3+2+<Fe<Fe例如,半径:Fe离子化合物的电子式(2)、具有相同电子层结构的原子或离子,核电荷数越大,半径越小+、2+ Na简单阳离子:离子符号即为电子式,如等、Mg(1)阳离子2--+2+Ca>>ClK>例如,半径:S+ 复杂阳离子:如电子式:NH4)、同主族元素的原子,随核电荷数的增加,半径逐渐增大(3Cs<<K <Rb 例如,半径:Li <NaI<Br <<半径:F Cl 、简单阴离子:2()阴离子带相等电荷数的同主族元素的离子,随核电荷数的增加,半径逐渐增大复杂阴离子:+++++<<RbCs例如,半径:LiNa <<K----< F <ClI <Br 离子化合价电子式:阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子3)(则要标出外层电子,并加上方括号,在右上角标出负电荷。
)、同周期元素的原子(稀有气体除外),随核电荷数的增加,半径逐渐减小4(>Si Na 例如,>Mg >Al >>P S >Cl小结:简单粒子半径大小比较的“三看”规律:一看电子层数,最外层电子数相同时,电子层数越多,半径越大;)电子式表示离子化合物形成过程:(4)阴离子要用方3)相同的原子可以合并写,相同的离子要单个写;(2 ()离子须标明电荷数;(1二看核电荷数,当电子层结构相同时,核电荷数越大,半径越小;)2页(新课标人教版必修5共,页2第)。
)用箭头标明电子转移方向(5(也可不标括号括起;(4)不能把“→”写成“=”;六、特殊规律共价化合物的电子式)(1周期表中特殊的周期和族族;1、没有金属元素的周期是第一周期;含金属元素最多的族是ⅢB 族。
非金属元素种类最多的周期是第二周期。
.族是02、非金属元素种类最多的族;3、全为金属元素的主族是第ⅡA 族;4、全为非金属元素的主族是第ⅦA 族。
5、在常温时,全为气态的族是0、形成化合物种类最多的族是Ⅳ6A族;形成化合物种类最多的周期是第二周期。
)电子式表示共价化合物的形成过程(2 A族,最外层电子数为2个的原子可能位于7、最外层有3个电子的原子一定位于Ⅲ、过渡元素区。
He)ⅡA,0族(短周期元素中具有特殊性排布的原子。
⑴最外层有一个电子的非金属元素:H ⑵最外层电子数等于次外层电子数的元素:Be、Ar。
O、Ne。
3⑶最外层电子数是次外层电子数2、、4倍的元素:依次是C、、分子间作用力和氢键5 2倍的元素:Be。
⑷电子总数是最外层电子数1、分子间作用力。
、S ⑸最外层电子数是电子层数2倍的元素:He、C ⑴定义:把分子聚集在一起的作用力,又称范德华力。
倍的元素:O⑹最外层电子数是电子层数3⑵特点:①分子间作用力比化学键弱得多;Si 。
⑺次外层电子数是最外层电子数2倍的元素:Li、②影响物质的熔点、沸点、溶解性等物理性质;P。
⑻内层电子总数是最外层电子数2倍的元素:Li、⑶变化③只存在于由共价键形成的多数共价化合物和绝大多数气态非金属单质分子,及稀有气体分子之间。
⑼电子层数与最外层电子数相等的元素:H、Be、Al规律:一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔沸点也越熟记常见等电子粒子>I高。
例如,熔沸点:Br。
>>ClF22226、氢键个电子的微粒:1、核外有10⑴定义:分子间存在着一种比分子间作用力稍强的相互作用。
NH、CH。
H(1)分子:Ne、HF、O、432 F、ONH⑵形成条件:除原子外,形成氢键的原子通常是、。