初中化学实验误差分析29页PPT
- 格式:ppt
- 大小:3.08 MB
- 文档页数:29


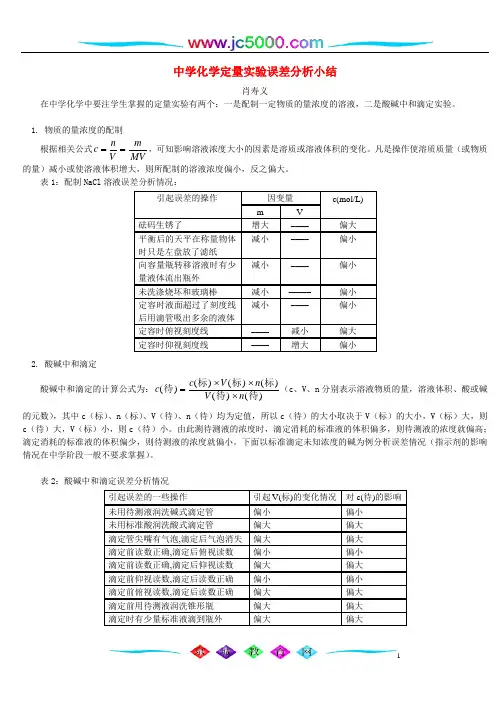
1中学化学定量实验误差分析小结肖寿义在中学化学中要注学生掌握的定量实验有两个:一是配制一定物质的量浓度的溶液,二是酸碱中和滴定实验。
1. 物质的量浓度的配制 根据相关公式c n V mMV==,可知影响溶液浓度大小的因素是溶质或溶液体积的变化。
凡是操作使溶质质量(或物质的量)减小或使溶液体积增大,则所配制的溶液浓度偏小,反之偏大。
表1:配制NaCl 溶液误差分析情况:因变量 引起误差的操作 m V c(mol/L) 砝码生锈了增大 –––– 偏大 平衡后的天平在称量物体时只是左盘放了滤纸 减小 –––– 偏小 向容量瓶转移溶液时有少量液体流出瓶外 减小 –––– 偏小 未洗涤烧坏和玻璃棒 减小 ––––– 偏小 定容时液面超过了刻度线后用滴管吸出多余的液体 减小 –––– 偏小 定容时俯视刻度线 –––– 减小 偏大 定容时仰视刻度线––––增大偏小2. 酸碱中和滴定酸碱中和滴定的计算公式为:c c V n V n ()()()()()()待标标标待待=⨯⨯⨯(c 、V 、n 分别表示溶液物质的量,溶液体积、酸或碱的元数),其中c (标)、n (标)、V (待)、n (待)均为定值,所以c (待)的大小取决于V (标)的大小,V (标)大,则c (待)大,V (标)小,则c (待)小。
由此测待测液的浓度时,滴定消耗的标准液的体积偏多,则待测液的浓度就偏高;滴定消耗的标准液的体积偏少,则待测液的浓度就偏小。
下面以标准滴定未知浓度的碱为例分析误差情况(指示剂的影响情况在中学阶段一般不要求掌握)。
表2:酸碱中和滴定误差分析情况引起误差的一些操作 引起V(标)的变化情况 对c(待)的影响 未用待测液润洗碱式滴定管 偏小 偏小 未用标准酸润洗酸式滴定管 偏大 偏大 滴定管尖嘴有气泡,滴定后气泡消失 偏大偏大 滴定前读数正确,滴定后俯视读数 偏小 偏小 滴定前读数正确,滴定后仰视读数 偏大 偏大 滴定前仰视读数,滴定后读数正确 偏小 偏小 滴定前俯视读数,滴定后读数正确 偏大 偏大 滴定前用待测液润洗锥形瓶 偏大 偏大 滴定时有少量标准液滴到瓶外偏大偏大。

中学化学复习化学实验中的数据处理与误差分析化学实验是中学化学教学中非常重要的一环。
通过实验,学生能够亲身体验和观察化学现象,探索科学的奥秘。
然而,在进行实验的过程中,不可避免地会出现一些数据的测量和处理,并伴随着误差的存在。
本文将就中学化学实验中的数据处理与误差分析进行探讨。
一、数据处理在化学实验中,我们通常会进行一系列的数据测量,包括质量、容积、温度、时间等等。
这些数据对于我们得出实验结论和进行进一步分析非常重要。
然而,原始数据中可能存在一些误差,因此我们需要对数据进行处理,以减小误差并获得更准确的结果。
1. 精确度和准确度:精确度是指进行多次测量时结果的一致性,准确度是指测量结果与真实值的接近程度。
在实验中,我们追求既有高的精确度又有高的准确度。
为了提高精确度,我们可以增加测量次数并取平均值;为了提高准确度,我们需要减小系统误差和随机误差。
2. 四舍五入:在处理数据时,我们需要注意有效数字的规范。
一般来说,保留有效数字的规则是:若末位数字为5,则根据前一位数字的奇偶性确定舍入;若末位数字大于5,则进位;若末位数字小于5,则舍去。
例如,如果测量结果为25.345 g,则保留三个有效数字为25.3 g;如果测量结果为25.356 g,则保留三个有效数字为25.4 g。
3. 绝对误差和相对误差:测量结果与真实值之间存在误差,可以通过计算绝对误差和相对误差来评估测量结果的可靠性。
绝对误差是指测量结果与真实值之间的差异,可以通过测量结果减去真实值来计算;相对误差是指绝对误差与真实值之比,可以通过绝对误差除以真实值再乘以100%来计算。
二、误差分析在化学实验中,误差是不可避免的。
误差可以分为系统误差和随机误差两种类型。
1. 系统误差:系统误差是由于实验装置、仪器等因素引起的,导致每次测量结果都与真实值存在一定的偏差。
系统误差是可预测和可修正的,一般通过仪器校准、装置调整等手段来减小。
例如,如果在测量容器体积时,容器的刻度不准确,则每次测量结果都会偏离真实值。






初中化学实验中有三个定量实验:一是用托盘天平称量物质的质量,二是用量筒时取液体的体积,三是用pH试纸测量溶液的pH。
(1)托盘天平称量物质时引起误差①天平没有平衡引入正负误差。
②物码错位引起误差。
正确放置:左物有码物质质量:砝码质量+游码质量。
错位放置:左码右物物质质量=砝码质量-游码质量。
(2)量筒量取液体时引起误差①量取液体量与量筒的大小不匹配如量取10mL.液体用10mL.量筒即可,如果用 50mL量简或100mL。
量筒会引起误差。
②观察量筒液向引入误筹如果俯视观察凹液面(沿A线) 观察值>实际值如果平视观察凹液面(沿B线) 观察值=实际值如果仰视观察凹液面(沿C线) 观察值<实际值(3)pH试纸测定溶液pH引起误差pH试纸在测量前用水润湿相当于将溶液稀释,如果测定酸性溶液,pH偏大;如果测定碱性溶液,pH 偏小。
化学实验现象的规律:第一种是物质燃烧实验;第二种是加热固体物质实验;第三种是在溶液中进行的化学实验。
不同化学实验现象:1.物质燃烧实验都有三个明显的现象(1)放出大量的热。
(2)生成了一种或几种不同于反应物(指物质的色、态、味)的产物。
(3)固体直接燃烧则发出一定颜色和强度的光;气体或固、液体转变成气体再燃烧则发出一定颜色和强度的火焰(描述物质的燃烧现象:一光、二热、三生成)例如:镁条燃烧的现象是:①发出耀眼的白光;②放出大量的热;③生成一种白色固体。
再如,硫在氧气中燃烧的现象:①发出明亮的蓝紫色的火焰(硫受热先熔化,再汽化,最后才燃烧);②放出大量的热;③生成一种有刺激性气味的气体。
2.加热固体物质的实验现象主要包括物质的状态、颜色、质量变化及产物中是否有水和气体产生例如:加热碳酸氢铵的现象:(1)有一股刺激性的气味产生;(2)试管壁上有水珠生成;(3)有使澄清石灰水变浑浊的气体生成;(4)试管内的白色固体逐渐消失。
3.在溶液中进行的化学反应的实验现象主要包括反应物(液态)的物质和颜色变化及溶液中是否有沉淀(包括沉淀颜色)和气泡产生。
