初中化学常见化学用语
- 格式:doc
- 大小:164.00 KB
- 文档页数:3
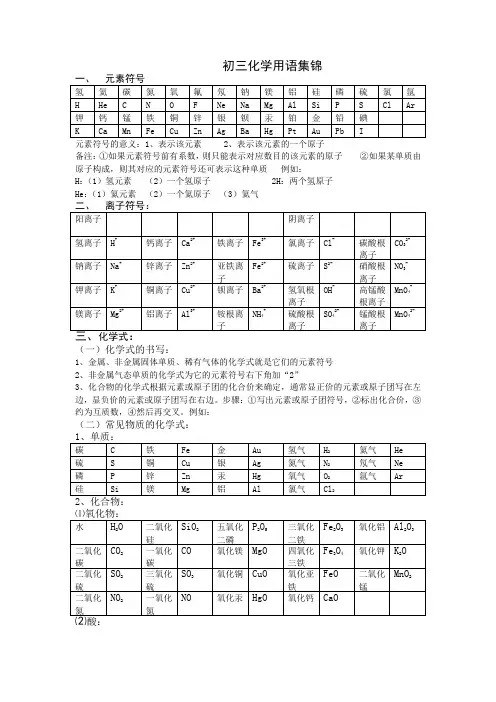
初三化学用语集锦元素符号的意义:1、表示该元素 2、表示该元素的一个原子备注:①如果元素符号前有系数,则只能表示对应数目的该元素的原子②如果某单质由原子构成,则其对应的元素符号还可表示这种单质例如:H:(1)氢元素(2)一个氢原子 2H:两个氢原子He:(1)氦元素(2)一个氦原子(3)氦气(一)化学式的书写:1、金属、非金属固体单质、稀有气体的化学式就是它们的元素符号2、非金属气态单质的化学式为它的元素符号右下角加“2”3、化合物的化学式根据元素或原子团的化合价来确定,通常显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。
步骤:①写出元素或原子团符号,②标出化合价,③约为互质数,④然后再交叉。
例如:(二)常见物质的化学式:其他:过氧化氢 H2O2甲烷 CH4乙醇 C2H5OH 醋酸CH3COOH 葡萄糖C6H12O6尿素 CO(NH2)2O附录一、常见物质的颜色1、固体的颜色2、溶液中离子的颜色3、沉淀的颜色二、火焰的颜色三、离子的共存离子能否共存取决于两种离子相遇后能否生成水、气体或沉淀,如能生成上述物质则离子不能共存。
常见的有:1、H+和OH-会反应会生成H2O2、NH4+和OH-生成NH3和H2O3、H+和CO32-会生成H2CO3,分解后生成H2O和CO2气体4、Ca2+和CO32-会生成CaCO3沉淀,Cu2+、Fe3+与OH-会生成Cu(OH)2、Fe(OH)3沉淀,Ag+与Cl-生成AgCl沉淀,Ba2+与SO42-、CO32-生成BaSO4和BaCO3沉淀。
初中全部化学方程式方程式:4H2O+3Fe 高温Fe3O4+4H2式量: 72 168 232 8描述:赤热的铁跟水蒸气反应生成四氧化三铁和氢气。
方程式:4FeS2+11O2 高温2Fe2O3+8SO2式量: 480 352 320 512描述:燃烧硫铁矿(主要成分是FeS2)生成Fe2O3和SO2方程式:C+O2 点燃CO2式量: 12 32 44 描述:碳在氧气中充分燃烧方程式:S+O2 点燃SO2式量: 32 32 64 描述:硫粉在空气中燃烧方程式:4P+5O2 点燃2P2O5式量: 124 160 284 描述:红磷在空气中燃烧方程式:3Fe+2O2 点燃Fe3O4式量: 168 64 232 描述:铁在氧气中燃烧方程式:2C2H2+5O2 点燃4CO2+2H2O式量: 52 160 176 36 描述:方程式:CH4+2O2 点燃CO2+2H2O式量: 16 64 44 36 描述:甲烷在空气中燃烧方程式:2H2+O2 点燃2H2O式量: 4 32 36 描述:氢气中空气中燃烧方程式:2Mg+O2 点燃2MgO式量: 48 32 80 描述:镁在空气中燃烧方程式:2Cu+O2 △2CuO式量: 127 32 159 描述:铜在空气中受热方程式:4Al+3O2 △2Al2O3式量: 108 96 204 描述:铝在空气中燃烧方程式:2KClO3 △2KCl+3O2↑式量: 245 149 96描述:加热氯酸钾方程式:2KClO3MnO2△2KCl+3O2↑式量: 245 149 96描述:加热氯酸钾(有少量的二氧化锰)方程式:2KMnO4 △K2MnO4+MnO2+O2↑式量: 316 197 87 32 描述:加热高锰酸钾方程式:NH4HCO3 △NH3↑+H2O+CO2↑式量: 79 17 18 44 描述:方程式:Cu2(OH)2CO3 △2CuO+CO2↑+H2O式量: 221 159 44 18描述:加热碱式碳酸铜方程式:2HgO △2Hg+O2↑式量: 434 402 32 描述:方程式:2H2O 电解2H2↑+2O2↑式量: 36 4 64描述:水在直流电的作用下分解方程式:Zn+H2SO4 ZnSO4+H2↑式量: 65 98 161 2描述:锌和稀硫酸方程式:Mg+H2SO4 MgSO4+H2↑式量: 24 98 120 2描述:镁和稀硫酸方程式:Zn+2HCl ZnCl2+H2↑式量: 65 73 136 2描述:锌和稀盐酸方程式:Fe+2HCl FeCl2+H2↑式量: 56 73 127 2描述:铁和稀盐酸方程式:ZnO+2HCl ZnCl2+H2O 式量: 81 73 136 18描述:方程式:8Al+3Fe3O4 点燃9Fe+4Al2O3式量: 216 696 504 408 描述:方程式:Al2O3+3H2SO4 Al2(SO4)3+3H2O 式量: 102 294 342 54描述:方程式:CuO+H2 △Cu+H2O式量: 79.5 2 63.5 18描述:氢气还原氧化铜方程式:CuSO4+2NaOH Na2SO4+Cu(OH)2↓式量: 159.5 80 142 97.5描述:方程式:Fe3O4+4CO 高温3Fe+4CO2式量: 232 112 168 176描述:一氧化碳还原四氧化三铁方程式:Fe2(SO4)3+6NaOH 2Fe(OH)3↓+3Na2SO4式量: 400 240 214 426 描述:方程式:MnO2+4HCl △MnCl2+2H2O+Cl2↑式量: 87 146 126 36 71 描述:方程式:2C2H6+7O2 点燃4CO2+6H2O式量: 60 224 176 108描述:方程式:Cu+4HNO3 Cu(NO3)2+2NO2↑+2H2O 式量: 63.5 252 187.5 92 36描述:方程式:Zn+CuSO4 ZnSO4+Cu式量: 65 159.5 161 63.5描述:方程式:2Al+3H2SO4 Al2(SO4)3+3H2↑式量: 54 294 342 6描述:铝和稀硫酸方程式:C2H4+3O2 点燃2CO2+2H2O式量: 28 96 88 36描述:方程式:2Na+2H2O 2NaOH+H2↑式量: 46 36 80 2描述:方程式:CO2+C 高温2CO式量: 44 12 56 描述:方程式:CuO+CO △Cu+CO2式量: 79.5 28 63.5 44 描述:一氧化碳还原氧化铜方程式:2CO+O2 点燃2CO2式量: 56 32 88 描述:一氧化碳在氧气中燃烧方程式:2CuO+C △2Cu+CO2↑式量: 159 12 127 44 描述:木炭还原氧化铜方程式:2Fe2O3+3C 高温4Fe+3CO2↑式量: 320 36 224 132 描述:焦炭还原氧化铁方程式:CO2+H2O H2CO3 式量: 44 18 62描述:二氧化碳溶解于水方程式:H2CO3 H2O+CO2↑式量: 62 18 44描述:碳酸不稳定而分解方程式:CaCO3 高温CaO+CO2↑式量: 100 56 44描述:高温煅烧石灰石方程式:CaCO3+CO2+H2O Ca(HCO3)2式量: 100 44 18 162描述:方程式:Ca(HCO3)2 CaCO3↓+H2O+CO2↑式量: 162 100 18 44描述:方程式:CaCO3+2HCl CaCl2+H2CO3式量: 100 73 111 62描述:方程式:CaCO3+2HCl CaCl2+H2O+CO2↑式量: 100 73 111 18 44描述:大理石与稀盐酸反应方程式:C+H2O 高温CO+H2↑式量: 12 18 28 2描述:方程式:Na2CO3+2HCl 2NaCl2+H2O+CO2↑式量: 106 73 188 18 44 描述:碳酸钠与稀盐酸反应方程式:C2H5OH+3O2 点燃2CO2+3H2O式量: 46 96 88 54 描述:酒精在空气中燃烧方程式:2CH3OH+3O2 点燃2CO2+4H2O式量: 64 96 88 72 描述:方程式:Fe+H2SO4 FeSO4+H2↑式量: 56 98 152 2描述:方程式:Fe+CuSO4 FeSO4+Cu 式量: 56 159.5 152 63.5描述:方程式:Fe2O3+6HCl 2FeCl3+3H2O式量: 160 219 325 54描述:方程式:Cu(OH)2+2HCl CuCl2+2H2O式量: 97.5 73 134.5 36描述:方程式:AgNO3+HCl AgCl↓+HNO3式量: 170 36.5 143.5 63描述:方程式:Fe2O3+3H2SO4 Fe2(SO4)3+3H2O 式量: 160 294 400 54描述:方程式:Cu(OH)2+H2SO4 CuSO4+2H2O式量: 97.5 98 159.5 36描述:方程式:BaCl2+H2SO4 BaSO4↓+2HCl式量: 208 98 233 73描述:方程式:ZnO+2HNO3 Zn(NO3)2+H2O式量: 81 126 189 18描述:方程式:Mg(OH)2+2HNO3 Mg(NO3)2+2H2O 式量: 58 126 148 36描述:方程式:CuO+H2SO4 CuSO4+H2O式量: 79.5 98 159.5 18描述:方程式:NaOH+HCl NaCl+H2O式量: 40 36.5 58.5 18描述:方程式:2NaOH+CO2 Na2CO3+H2O式量: 80 44 106 18描述:方程式:2NaOH+SO2 Na2SO3+H2O式量: 80 64 126 18描述:方程式:2NaOH+H2SO4 Na2SO4+2H2O式量: 80 98 142 36描述:方程式:NaOH+HNO3 NaNO3+H2O式量: 40 63 85 18描述:方程式:2NaOH+CuSO4 Cu(OH)2↓+Na2SO4 式量: 80 159.5 97.5 142描述:方程式:3NaOH+FeCl3 Fe(OH)3↓+3NaCl式量: 120 162.5 107 175.5描述:方程式:CaO+H2O Ca(OH)2式量: 56 18 74描述:生石灰(CaO)溶于水生成熟石灰Ca(OH)2方程式:Ca(OH)2+SO3 CaSO4+H2O式量: 74 80 136 18描述:方程式:Ca(OH)2+CO2 CaCO3↓+H2O式量: 74 44 100 18描述:方程式:Ca(OH)2+Na2CO3 CaCO3↓+2NaOH 式量: 74 106 100 80描述:方程式:2NaOH+SO3 Na2SO4+H2O式量: 80 80 142 18描述:方程式:Zn+CuSO4 ZnSO4+Cu式量: 65 159.5 161 63.5描述:方程式:Hg(NO3)2+Cu Cu(NO3)2+Hg式量: 325 63.5 187.5 201描述:方程式:NaOH+NH4NO3 NaNO3+NH3↑+H2O 式量: 40 80 85 17 18。

初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根铵根OH- NO3- CO32- SO4 2- NH4+2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O42、红色固体:Cu、Fe2O3、红磷▲硫磺:淡黄色▲绿色:碱式碳酸铜(铜锈,俗称铜绿)3、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。

一分耕耘一分收获初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:O氧H氢N氮Cl氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba钡原子团 ( 根 ) :氢氧根硝酸根碳酸根硫酸根铵根--OH NO 32-CO 32-+SO4NH 42、 (1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2)常见原子团 ( 根 ) 化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
3、必须熟记的常见物质的俗称、化学名称、化学式、用途俗称化学名称化学式用途金刚石、石墨、木炭等碳单质 C 金刚石做钻头、切割玻璃石墨做铅笔芯、电极干冰二氧化碳固体CO 人工降雨,致冷剂2水水H2O 最常见溶剂铁锈氧化铁Fe2O3生石灰氧化钙CaO 食品干燥剂熟石灰、消石灰(澄清石灰水)氢氧化钙Ca(OH)2 改良酸性土壤石灰石、大理石(蛋壳、水垢等)碳酸钙CaCO 建筑材料、工业制取 CO3 2 火碱、烧碱、苛性钠氢氧化钠NaOH 氢氧化钠固体作干燥剂、化工原料、清洁剂盐酸( 氯化氢 ) HCl 除铁锈、胃酸主要成分纯碱、苏打碳酸钠23玻璃、造纸、纺织、洗涤Na CO碳酸氢钠小苏打 3 发酵粉、治疗胃酸过多NaHCO天然气、沼气、瓦斯甲烷CH4 燃料酒精乙醇C2H5OH 燃料、乙醇汽油4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑( 2)实验室制取氧气二:2H 2O2 ===2H2O+O2↑(3)实验室制取氧气三: 2KClO 3===2KCl+3O2↑(4)实验室制法 CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑( 5)实验室制取氢气:Zn+H 2SO4==ZnSO4+H2↑ Zn + 2HCl = ZnCl 2 +H2↑(6)电解水制取氢气: 2H 2O===2H↑ +O2↑( 7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(Fe与盐、酸反应都生成的是+2 价亚铁离子)( 8)炼铁原理:3CO+Fe2O3===2Fe+3CO(Fe2O3与酸反应生成的是+3 价铁离子)(9)熟灰水 [Ca(OH) 2 ] 的制取方法: CaO+H2O==Ca(OH)2(10)生石灰 ( 氧化钙 ) 制取方法: CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al,Zn Fe Sn Pb (H),Cu Hg Ag Pt Au。

初中化学必背知识点初中化学必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:氧(O)、氢(H)、氮(N)、氯(Cl)、碳(C)、磷(P)、硫(S)金属:钾(K)、钙(Ca)、钠(Na)、镁(Mg)、铝(Al)、锌(Zn)、铁(Fe)、铜(Cu)、汞(Hg)、银(Ag)、锰(Mn)、钡(Ba)原子团(根):氢氧根(OH)、硝酸根(NO3碳酸根(CO3硫酸根(SO4磷酸根(PO4铵根(NH42、化合价口诀1)常见元素化合价口诀:钾钠银氢正一价;氟氯溴碘负一价;钙镁钡锌正二价;铜一二铁二三铝三硅四氧负二二四六硫二四碳2)常见原子团(根)化学价口诀:一价硝酸氢氧根;二价硫酸碳酸根;三价常见磷酸根;通常负价除铵根。
3)熟练默写常见元素的常用的化合价1价:钾(K)、钠(Na)、氢(H)、银(Ag)、铵(NH42价:钙(Ca)、镁(Mg)、锌(Zn)、铜(Cu)、汞(Hg)、亚铁(Fe)1价:氟(F)、氯(Cl)、溴(Br)、碘(I)2价:氧(O)、硫(S)、碳酸根(CO3硫酸根(SO43价:磷酸根(PO43、必须熟记的常见物质的俗称、化学名称、化学式、用途C碳单质:金刚石、石墨、木炭等Hg水银汞CO2二氧化碳固体:干冰水:H2O、双氧水:H2O2过氧化氢Fe2O3CaO:铁锈、生石灰、氧化钙氢氧化钙:熟石灰、消石灰(澄清石灰水)CaCO3石灰石、大理石(蛋壳、水垢等)氯化氢:盐酸CH4天然气、沼气、瓦斯甲烷C2H5OH:酒精、乙醇4、必须熟记的制取物质的化学方程式1)实验室制取氧气一:2KMnO4K2MnO4MnO2O22)实验室制取氧气二:2H 2O22H2O+O23)实验室制取氧气三:2KClO 32KCl+3O2↑4)实验室制法CO2CaCO32HCl→CaCl2H2O+CO25)实验室制取氢气:Zn+H 2SO4ZnSO4H26)电解水制取氢气:2H2O→2H2O27)湿法炼铜术(铁置换出铜):Fe+CuSO 4FeSO4Cu8)炼铁原理:3CO+Fe2O32Fe+3CO2固体也可用于制作气泡饮料。

初中化学必背知识点打印版一、化学用语。
1. 元素符号。
- 前20号元素:氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)、氖(Ne)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、氩(Ar)、钾(K)、钙(Ca)。
- 常见金属元素:铁(Fe)、铜(Cu)、锌(Zn)、银(Ag)、金(Au)、汞(Hg)等。
2. 化学式。
- 单质化学式。
- 金属单质:用元素符号表示,如铁(Fe)、铜(Cu)等。
- 固态非金属单质:一般用元素符号表示,如碳(C)、硫(S)等;但碘(I₂)除外。
- 稀有气体:用元素符号表示,如氦气(He)、氖气(Ne)等。
- 气态非金属单质:在元素符号右下角写上表示分子中所含原子数的数字,如氢气(H₂)、氧气(O₂)、氮气(N₂)等。
- 化合物化学式。
- 书写原则:正价在前,负价在后,根据化合物中正负化合价代数和为零的原则确定原子个数比。
- 例如:水(H₂O),其中氢元素化合价为 + 1,氧元素化合价为 - 2;氯化钠(NaCl),钠元素化合价为+1,氯元素化合价为 - 1。
3. 化学方程式。
- 书写原则。
- 一是必须以客观事实为基础;二是要遵守质量守恒定律,等号两边各原子的种类和数目必须相等。
- 例如:- 镁在空气中燃烧:2Mg + O₂{点燃}{===}2MgO。
- 实验室制取氧气:- 加热高锰酸钾:2KMnO₄{}{===}K₂MnO₄+MnO₂+O₂↑。
- 过氧化氢分解:2H₂O₂{MnO_2}{===}2H₂O+O₂↑。
- 化学方程式的意义。
- 质的方面:表示反应物、生成物和反应条件。
如氢气和氧气在点燃条件下反应生成水。
- 量的方面:- 宏观上:表示反应物、生成物之间的质量比。
在2H₂+O₂{点燃}{===}2H₂O中,氢气、氧气和水的质量比为4:32:36 = 1:8:9。
- 微观上:表示反应物、生成物之间的粒子个数比。

初中化学用语汇总1. 原子:构成分子的最小粒子。
2. 元素:由同种原子组成的物质。
4. 分子:由两个及以上原子组成的不带电荷的粒子。
6. 原子量:一个原子质量单位。
8. 周期表:元素根据其原子核结构的排列方式排列的表格。
9. 金属:具有良好的导电性和热传导性质的物质。
11. 金属元素:处于周期表左侧的元素。
16. 原子核:由质子和中子组成的原子中心部分。
17. 共价键:由电子对共享形成的键。
18. 离子键:带正电荷和负电荷之间的相互作用。
21. 化学键:元素通过共享或转移电子形成的化学物质的力。
22. 化学式:用元素符号表示化合物的组成。
23. 反应物:在化学反应中参与反应的物质。
25. 化学反应:物质之间的化学相互作用。
26. 酸:会释放出氢离子的物质。
28. 盐:由阳离子和阴离子组成的离子化合物。
30. 溶解:由固体或气体转变为液体。
31. 溶质:溶解在溶剂中的物质。
34. 沉淀:在溶液中形成的固体颗粒。
36. 电离:在溶液中将电解质分解为离子。
39. 化学平衡:反应物和生成物在化学反应中达到平衡状态。
40. 配位化合物:由中心金属离子和其它分子和离子中的原子和分子共价结合而成的化合物。
41. 化学式计算:根据化学式计算元素的质量。
42. 摩尔质量:化学式中一个摩尔的质量。
43. 密度:单位体积内的物质质量。
44. 燃烧:化合物与氧气彻底反应的化学反应。
46. 温度:温度代表了物体内部分子的平均运动速度。
47. 热力学系统:研究热和压力与化学反应之间的关系。
48. 热能:热能是物体或系统储存的能量。
49. 热动力学:热的能量学,研究物质内部热运动的规律。
50. 热量:由于温度差异而流动的能量。
51. 热容:物质单位质量的温度变化时吸收或释放的热量。
52. 热传导:热能通过物质的传递。
53. 热平衡:两个物体之间热能的交换达到相同的温度。
54. 热力学第一性原理:能量守恒。
55. 内能:热力学系统内分子内部相互作用引起的能量总和。

初三化学全册必背知识点(精华)初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O 氧 H 氢 N 氮 Cl 氯 C 碳 P 磷 S 硫 金属: K 钾 Ca 钙 Na 钠 Mg 镁 Al 铝 Zn 锌 Fe 铁 Cu 铜 Hg 汞 Ag 银 Mn 锰 Ba 钡 原子团(根):氢氧根 硝酸根 碳酸根 硫酸根 铵根 OH - NO 3- CO 32- SO 4 2- NH 4+ 2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
3、必须熟记的常见物质的俗称、化学名称、化学式、用途俗称化学名称化学式用途金刚石、石墨、木炭等碳单质C 金刚石做钻头、切割玻璃石墨做铅笔芯、电极干冰二氧化碳固体CO 2人工降雨,致冷剂水水H 2O 最常见溶剂铁锈氧化铁Fe 2O 3生石灰氧化钙CaO 食品干燥剂熟石灰、消石灰(澄清石灰水)氢氧化钙Ca(OH)2改良酸性土壤石灰石、大理石(蛋壳、水垢等)碳酸钙CaCO 3建筑材料、工业制取CO 2火碱、烧碱、苛性钠氢氧化钠NaOH 氢氧化钠固体作干燥剂、化工原料、清洁剂盐酸(氯化氢)HCl 除铁锈、胃酸主要成分纯碱、苏打碳酸钠Na 2CO 3玻璃、造纸、纺织、洗涤碳酸氢钠小苏打NaHCO3发酵粉、治疗胃酸过多天然气、沼气、瓦斯甲烷CH4燃料酒精乙醇C2H5OH燃料、乙醇汽油4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理:3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe SnPb (H) ,Cu Hg Ag Pt Au 。
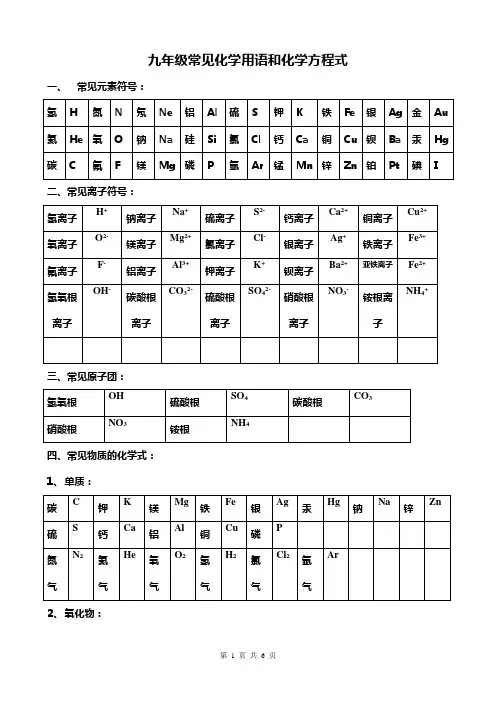
九年级常见化学用语和化学方程式五、课本中的化学方程式:第二单元:1、红磷在氧气中燃烧4 P + 5 O2 2 P2O52、碳在氧气中燃烧 C + O2CO23、硫在氧气中燃烧S + O2 SO24、铁在氧气中燃烧 3 Fe + 2 O2Fe3O45、铝在氧气中燃烧 4 Al + 3 O2 2 Al2O36、用过氧化氢制氧气 2 H2O2 2 H2O + O2↑7、用高锰酸钾制氧气2KMnO4K2MnO4+ MnO2+ O2↑8、用氯酸钾和二氧化锰的混合物制氧气 2 KClO3 2 KCl + 3 O2↑第三单元:9、水通电分解(电解水) 2 H2O 2 H2↑+ O2↑10、汞受热2Hg+O22HgO11、氧化汞受热分解2HgO2Hg+O2↑12、氢气在空气中燃烧 2 H2 + O2 2 H2O13、氢气还原氧化铜H2 + CuO Cu + H2O第四单元:第五单元:14、铁和硫酸铜溶液反应Fe + CuSO 4FeSO4 + Cu15、碳酸钠和盐酸反应Na 2CO3+2HCl2NaCl+H2O+CO2↑16、镁条在空气中燃烧 2 Mg + O2 2 MgO17、高温煅烧石灰石(二氧化碳的工业制法)CaCO3CaO + CO2↑第六单元:2 CO18、碳在氧气中不充分燃烧 2 C + O2 (不足)19、碳跟氧化铜反应 C + 2 CuO 2 Cu + CO2↑20、碳跟氧化铁反应 3 C + 2 Fe2O3 4 Fe + 3 CO2 ↑21、碳跟二氧化碳反应C+CO22CO+ 2HCl CaCl2 + CO2↑+ H2O22、实验室制取二氧化碳CaCO23、二氧化碳与水反应CO 2 + H2O H2CO324、碳酸分解H 2CO3CO2 ↑+ H2O25、二氧化碳与氢氧化钙溶液反应(二氧化碳的检验方法)CO 2 + Ca(OH)2CaCO3↓+ H2O26、一氧化碳燃烧 2 CO + O2 2 CO227、一氧化碳还原氧化铜CO +CuO Cu + CO228、一氧化碳还原氧化铁 3 CO +Fe2O3 2 Fe + 3 CO2第七单元:29、甲烷燃烧CH4 + 2 O2CO2 + 2 H2O30、酒精燃烧C2H5OH + 3 O2 2 CO2 + 3 H2O第八单元:31、镁和稀盐酸反应镁和稀硫酸反应Mg + 2 HCl MgCl+ H2↑Mg + H2SO4MgSO4 + H2↑32、锌和稀盐酸反应锌和稀硫酸反应(实验室制取氢气)Zn + 2 HCl ZnCl+ H2↑Zn + H2SO4ZnSO4 + H2↑33、铁和稀盐酸反应铁和稀硫酸反应+ H2↑Fe + H2SO4FeSO4 + H2↑Fe + 2 HCl FeCl34、铝和稀盐酸反应铝和稀硫酸反应+3H2↑2Al+ 3H2SO4Al2(SO4)3 +3 H2↑2Al+6HCl2AlCl35、铝和硫酸铜溶液反应 2 A l + 3 CuSO 4Al2(SO4)3 + 3CuCu(NO3)2 + 2 Ag36、铜和硝酸银溶液反应Cu + 2 AgNO第十单元:37、铁锈与稀盐酸反应铁锈与稀硫酸反应FeO3+6HCl2FeCl3+3H2O Fe2O3+3H2SO4Fe2(SO4)3+3H2O38、氧化铜与稀硫酸反应H2SO4+ CuO Cu SO4+ H2O39、氧化钙与水的反应CaO+HO Ca(OH)240、氢氧化钠溶液与二氧化碳反应2NaOH+CO 2Na2CO3+H2O41、二氧化硫与氢氧化钠溶液反应2NaOH+SO 2Na2SO3+H2O42、三氧化硫与氢氧化钠溶液反应2NaOH+SO 3Na2SO4+H2O43、氢氧化钠与盐酸反应氢氧化钠与硫酸反应NaOH+HCl NaCl+H 2O 2NaOH+H2SO4Na2SO4+H2O44、氢氧化钙与盐酸反应氢氧化钙与硫酸反应+2HCl CaCl2+2H2O Ca(OH)2+H2SO4CaSO4+2H2OCa(OH)第十一单元:45、碳酸氢钠与盐酸反应NaHCO 3+HCl NaCl+H2O+CO2↑CO3+Ca(OH)2CaCO3↓+2NaOH46、碳酸钠溶液与氢氧化钙溶液反应Na初中化学常见物质的颜色(后面是物质化学式或物质名称,前面是颜色)1. 常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。

初三化学常化学用语必背“化学是一门记忆加实验的科学”,这也许不太符合一些同学的思维习惯。
下面是小偏整理的初三化学常化学用语必背,感谢您的每一次阅读。
初三化学常化学用语必背一、熟记下列元素名称及符号: 1、H氢O氧 N氮 Cl氯 C碳 P 磷 S硫 2、K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag 银 Mn锰 Ba钡二、熟记下列物质的化学式: 1、单质: H2氢气 O2氧气 N2氮气 C碳 P磷 S硫 Fe铁 Cu铜 Hg汞 2、化合物 (1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷 Fe2O3氧化铁Fe3O4四氧化三铁 CaO氧化钙 MgO氧化镁 CuO氧化铜 ZnO氧化锌 FeO氧化亚铁MnO2二氧化锰-Na2O氧化钠(2)酸:HCl盐酸H2SO4硫酸HNO3硝酸 H2CO3碳酸 -H2SO3亚硫酸(3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡 Cu(OH)2氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁(4)盐:NaCl氯化钠Na2CO3碳酸钠NaHCO3碳酸氢钠 CaCO3碳酸钙 CaCl2氯化钙 KCl氯化钾ZnCl2氯化锌AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝 BaCl2氯化钡 Na2SO4硫酸钠CuSO4硫酸铜FeSO4硫酸亚铁Fe2(SO4)3硫酸铁ZnSO4硫酸锌BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾 Ag NO3硝酸银 Cu(NO3)2硝酸铜-NH4Cl氯化铵-NH4NO3硝酸铵-(NH4)2SO4硫酸铵- NH4HCO3碳酸氢铵(5)有机物:CH4甲烷C2H5OH乙醇(酒精) C6H12O6葡萄糖(C6H10O5)n淀粉 -CO(NH2)2尿素三、熟记下列元素在化合物中的化合价:(1) 正价(多为金属)+1 +1 +1 +1 +2 +2 +2 +2 +2 +3 +2 +3 H K Na Ag Ca Mg Zn Ba Cu Al Fe(FeO) Fe(Fe2O3) (2) 负价(非金属)-2 -1 -2 O Cl S (3) 原子团+1 -1 -1 -1 -1 -2 -2 -2 -3 -1 NH4 OH NO3 ClO3 MnO4(KMnO4) CO3 SO4 SO3 PO4 HCO3四、熟记下列常用离子(比较与相应化合价的联系)(1)阳离子H+ K+ Na+ Ca2+ Fe2+ Mg2+ Cu2+ Fe3+(2)阴离子Cl- OH - NO3- CO32- SO4 2-五、熟记下列化学方程式:(一)化合反应(A+B→C):1、木炭在氧气中燃烧:C+O2 点燃CO2 2、硫在氧气中燃烧:S+O2 点燃SO2 3、镁在空气中燃烧:2Mg+O2 点燃 2MgO 4、铁在氧气中燃烧: 3Fe+2O2 点燃 Fe3O4 5、磷在氧气中燃烧:4P+5O2 点燃2P2O5 6、铜在空气中加热:2Cu+O2 △ 2CuO 7、氢气在氧气中燃烧:2H2+O2 点燃 2H2O8、一氧化碳在空气中燃烧:2CO+O2 点燃2CO2 9、碳不充分燃烧:2C+O2(不充分)点燃2CO 10、二氧化碳通过灼热的碳层:CO2 + C 高温2CO 11、二氧化碳与水反应:CO2+H2O === H2CO3-12、三氧化硫溶于水:SO3+H2O === H2SO4 (酸雨的成因)13、生石灰和水化合:CaO+H2O === Ca(OH)2(二)分解反应(C→A+B):14 过氧化氢用二氧化锰作催化剂分解(实验室制O2):2H2O2 2 H2O + O2↑15、氯酸钾与二氧化锰共热(实验室制O2):2KClO3 2KCl+3O2↑ 16、加热高锰酸钾:2KMn O4 △ K2MnO4 + MnO2 + O2↑ 17、电解水:2H2O通电2H2↑ + O2↑18、碳酸不稳定分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石:CaCO3 高温 CaO + CO2↑-20、氢氧化铜受热分解:Cu(OH)2 △ CuO + H2O(三)置换反应(A+BC→B+AC):21、锌和稀硫酸反应(实验室制H2):Zn+H2SO4 === ZnSO4 + H2↑ 22、锌和盐酸的反应:Zn+2HCl === ZnCl2 + H2↑ 23、铁和盐酸: Fe+2HCl === FeCl2 + H2↑ 24、铁和稀硫酸:Fe+H2SO4 === FeSO4 + H2↑ 25、氢气还原氧化铜:H2+CuO △ Cu + H2O26、氢气还原氧化铁:3H2 + Fe2O3 △ 2Fe + 2H2O27、木炭还原氧化铜:C+2CuO高温2Cu + CO2↑ 28、焦碳还原氧化铁:3C+2Fe2O3 高温4Fe+3CO2↑ 29、铁和硫酸铜溶液:Fe + CuSO4 === Cu + FeSO4 30、铜和硝酸银溶液:Cu + 2AgNO3 === 2Ag + Cu(NO3)231、铝和稀硫酸:2Al+3H2SO4 === Al2(SO4)3 + 3H2↑32、铝和硫酸铜溶液:2Al + 3CuSO4 === 3Cu + Al2(SO4)3-33、钠和水反应:2Na+2H2O === 2NaOH+H2↑(四)复分解反应(AB+CD→AD+CB):34、大理石和稀盐酸(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 35、碳酸钠和盐酸(灭火器原理):Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑36、碳酸氢钠和盐酸:NaHCO3 + HCl === NaCl + H2O + CO2↑37、碳酸钾(草木灰)和盐酸:K2CO3 + 2HCl === 2KCl + H2O + CO2↑38、盐酸和氢氧化钠(中和反应):HCl + NaOH === NaCl + H2O 39、硫酸和氢氧化钠溶液:H2SO4 + 2NaOH === Na2SO4 + 2H2O 40、硫酸与氯化钡溶液:H2SO4 + BaCl2 === BaSO4↓(白)+ 2HCl 41、盐酸与硝酸银溶液:HCl + AgN O3 === AgCl↓(白)+ HNO342、氢氧化钠和硫酸铜:2NaOH+CuSO4 === Cu(OH)2↓(蓝色) + Na2SO443、氢氧化钠和氯化铁溶液:3NaOH+FeCl3 === Fe(OH)3↓(红褐色)+ 3NaCl44、碳酸钠和石灰水:Na2CO3 + Ca(OH)2 === CaCO3↓ + 2NaOH45、硫酸钠和氯化钡:Na2SO4 + BaCl2 === BaSO4↓ + 2NaCl 46、氯化钠和硝酸银:NaCl + AgNO3 === AgCl↓ + NaNO347、氢氧化铝和盐酸(中和胃酸):Al(OH)3 + 3HCl === AlCl3 + 3H2O 48、氢氧化镁和盐酸(去除水垢):Mg(OH)2 + 2HCl === MgCl2 + 2 H2O 49、盐酸除铁锈:Fe2O3 + 6HCl === 2FeCl3 + 3H2O 50、氧化铜和硫酸:CuO + H2SO4 === CuSO4 + H2O -51、硝酸铵和氢氧化钠:NH4NO3 + NaOH △ NaNO3 + H2O + NH3↑(五)其他:52、二氧化碳使澄清石灰水变浑浊(实验室用于鉴定CO2):CO2 + Ca(OH)2 === CaCO3↓ + H2O 53、二氧化碳通入氢氧化钠溶液(实验室用于吸收CO2): CO2 + 2NaOH === Na2CO3 + H2O 54、用氢氧化钠溶液吸收三氧化硫:SO3 + 2NaOH === Na2SO4 + H2O 55、一氧化碳还原氧化铜:CO + CuO △ Cu + CO256、一氧化碳还原氧化铁(炼铁):3CO + Fe2O3 高温 2Fe + 3CO257、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 58、乙醇在空气中燃烧:C2H5OH+3O2 点燃 2CO2+3H2O-59、葡萄糖在人体组织中氧化:C6H12O6 + 6O2 =酶6CO2+6H2O化学学习经典方法技巧一:形成网络,优化忆技巧二:突出关键,浓缩记忆技巧三:分析对比,理解记忆技巧四:形象比喻,增强记忆技巧五:口诀韵语,灵活记忆技巧六:前后联想,巩固记忆“化学是一门记忆加实验的科学”,这也许不太符合一些同学的思维习惯。

初中化学知识点总结化学是一门充满神奇和趣味的学科,它存在于我们生活的方方面面。
对于初中生来说,掌握好化学的基础知识是非常重要的。
下面就让我们一起来总结一下初中化学的重要知识点。
一、化学用语1、元素符号元素符号是用来表示元素的特定符号,例如:氢(H)、氧(O)、碳(C)等。
要记住常见元素的符号和名称。
2、化学式用元素符号表示物质组成的式子叫化学式。
比如水的化学式是H₂O,表示一个水分子由两个氢原子和一个氧原子构成。
3、化学方程式化学方程式是用化学式表示化学反应的式子。
它反映了反应物、生成物以及反应条件之间的关系。
例如:2H₂+ O₂点燃 2H₂O 表示氢气和氧气在点燃的条件下生成水。
二、物质的组成1、原子原子是化学变化中的最小粒子。
原子由原子核和核外电子构成,原子核又由质子和中子组成。
2、分子分子是保持物质化学性质的最小粒子。
例如氧气(O₂)就是由氧分子构成的。
3、离子离子是带电的原子或原子团。
比如钠离子(Na⁺)、氯离子(Cl⁻)。
三、物质的性质和变化1、物理性质和化学性质物理性质包括颜色、状态、气味、熔点、沸点、密度等,不需要发生化学变化就能表现出来。
化学性质则是在化学变化中表现出来的性质,比如可燃性、氧化性等。
2、物理变化和化学变化物理变化没有新物质生成,只是物质的形态或状态发生了改变,比如水的蒸发。
化学变化有新物质生成,比如铁生锈。
四、常见的化学反应类型1、化合反应由两种或两种以上物质生成一种新物质的反应。
例如:C + O₂点燃 CO₂2、分解反应一种物质生成两种或两种以上其他物质的反应。
比如:2H₂O₂二氧化锰 2H₂O + O₂↑3、置换反应一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
如:Fe + CuSO₄= FeSO₄+ Cu4、复分解反应两种化合物相互交换成分,生成另外两种化合物的反应。
例如:HCl + NaOH = NaCl + H₂O五、常见的物质1、氧气氧气是一种无色无味的气体,能支持燃烧和供给呼吸。

51.铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 =ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3高温 4Fe + 3CO2↑七、酸、碱、盐56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl =CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH =Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl =2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH (4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 =AgCl↓ + NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
初中化学用语知识点总结初中化学是学生接触化学科学的起始阶段,为了帮助学生更好地理解和掌握化学知识,本文将对初中化学的一些基本用语和知识点进行总结。
# 基本概念1. 物质:物质是构成宇宙万物的基本实体,它可以是固体、液体或气体。
2. 元素:由相同类型的原子组成的纯物质称为元素。
3. 化合物:由两种或两种以上不同元素的原子以固定比例结合而成的纯物质。
4. 混合物:由两种或两种以上不同物质混合而成,各组成部分保持其原有性质。
5. 分子:由两个或多个原子通过化学键结合而成的稳定粒子。
6. 原子:物质的基本单位,由原子核和电子组成。
7. 原子核:位于原子中心,由质子和中子组成。
8. 电子:带负电的基本粒子,围绕原子核运动。
9. 离子:带有正电荷或负电荷的原子或分子。
# 化学用语1. 化学式:用元素符号和数字表示物质组成的式子。
- 例如:水的化学式为H₂O,表示每个水分子由两个氢原子和一个氧原子组成。
2. 化学方程式:表示化学反应的式子,用化学式和箭头表示反应物、生成物和反应条件。
- 例如:氢气与氧气反应生成水的化学方程式为2H₂ + O₂ →2H₂O。
3. 摩尔:物质的量的单位,1摩尔物质含有与12克纯碳中原子数相同的原子数目,即阿伏伽德罗常数,约为6.022×10²³个。
4. 相对原子质量:以碳-12原子质量的1/12为标准,其他原子质量与这个标准的比值。
5. 相对分子质量:一个分子中所有原子相对原子质量的总和。
6. 离子符号:表示离子的符号,正离子符号在元素符号右上角标出正电荷数,负离子在元素符号右上角标出负电荷数。
- 例如:Na⁺表示钠离子,Cl⁻表示氯离子。
# 化学反应1. 合成反应:两种或两种以上的物质反应生成一种新物质的反应。
- 例如:氢气与氧气反应生成水,2H₂ + O₂ → 2H₂O。
2. 分解反应:一种物质分解成两种或两种以上的物质的反应。
- 例如:电解水生成氢气和氧气,2H₂O → 2H₂ + O₂。
初中化学必背知识点
一、化学用语
1、原子:由核、电子及中子等构成的最小的原子粒子。
2、元素:不可分解的物质,其中包括质子、中子等原子核粒子。
3、分子:原子之间相互结合成的最小的化学单位,也可以是否定离子。
4、化合物:由不同的原子构成的物质,由不同的元素组成的分子。
5、混合物:是由不同的纯物质(元素或化合物)混合而成的物质。
6、溶液:是溶解物以不等的比例混合而成的物质,溶解度可以被称
为浓度。
7、反应物:是参加化学反应的各种原料,它们在反应过程中的相对
位置可以用方程式表示。
8、生成物:是反应的结果,它们与反应物在化学方程式中拥有相同
的位置。
9、滴定:是一种用来测定特定溶液中其中一种物质含量的实验方法,它可以用滴定液的滴定曲线来表示。
10、量热:是一种用来测量特定物质吸热或放热能力的实验方法,它
可以用量热曲线来表示。
二、基本概念
1、原子的构成:原子由核、电子及中子等组成,电子质量很小,但占原子质量的很大一部分,核是很小的一部分,但质量是原子质量中的一大部分,中子是原子质量中的一部分。
2、原子核的结构:原子核的结构可以用质子和中子的模型来表示,原子核中的质子数量与原子序数相等,而中子的数量则取决于原子序数与元素类型。
初中化学用语一、元素符号元素符号就像是化学世界里每个元素的小名片。
比如说氧元素,它的符号是“O”,这小小的字母可代表着咱们呼吸离不开的氧气哦。
还有氢元素“H”,这可是组成水的重要元素呢。
记忆元素符号的时候呀,就像认识新朋友,多和它们打打交道就熟悉啦。
咱们可以编一些小口诀来记,像“氧是O,氮是N,镁的符号Mg真迷人”,这样俏皮的口诀,是不是让元素符号的记忆变得轻松又好玩啦?而且元素符号可是写化学方程式的基础呢,就像盖房子的小砖块,缺了它们可不行。
二、化学式化学式呢,就像是元素们组合在一起的小家庭的名字。
像水的化学式是H₂O,这表示一个水分子是由两个氢原子和一个氧原子组成的。
你看,这就像一个小家庭里有两个氢宝宝和一个氧妈妈。
二氧化碳的化学式是CO₂,这就告诉我们一个二氧化碳分子里有一个碳原子和两个氧原子。
在写化学式的时候呀,我们要遵循一定的规则,化合价就是这个规则里很重要的一部分呢。
就像在这个化学小家庭里,每个元素都有自己的地位和价值,这个价值就体现在化合价上啦。
如果化合价搞错了,那这个化学式可就写错啦,就像给人家小家庭乱起名字一样,可不行哦。
三、化学方程式化学方程式可算是化学用语里的大明星啦。
它就像一个故事,讲述了化学反应是怎么发生的。
比如说氢气和氧气反应生成水的化学方程式2H₂+O₂=2H₂O。
这个方程式就像在说,两个氢气小家庭和一个氧气小家庭在一起发生了奇妙的变化,最后变成了两个水小家庭。
在化学方程式里,等号左边的是反应物,就像故事的开头;等号右边的是生成物,那就是故事的结尾啦。
而且化学方程式要遵循质量守恒定律呢,就像在这个故事里,原子的种类和数目可不能变,就像参加派对的人数不能突然变多或者变少一样。
我们在写化学方程式的时候,要先把反应物和生成物的化学式写对,然后再根据质量守恒定律去配平。
这就像搭积木一样,要一块一块地搭好,让两边的原子数目相等,这样化学方程式才是正确的呢。
四、离子符号离子符号也很有意思哦。
初中化学必背知识点化学是一门充满神奇和趣味的学科,对于初中生来说,掌握一些必背的知识点是学好化学的基础。
以下就是为大家整理的初中化学必背知识点。
一、化学用语1、元素符号要记住常见元素的符号,如氢(H)、氧(O)、碳(C)、氮(N)、钠(Na)、镁(Mg)、铝(Al)、铁(Fe)等。
元素符号不仅表示一种元素,还表示这种元素的一个原子。
2、化学式用元素符号表示物质组成的式子叫化学式。
比如水的化学式是H₂O,表示一个水分子由两个氢原子和一个氧原子构成。
要能根据化合价正确书写化学式,并且能根据化学式计算元素的化合价。
3、化学方程式化学方程式是用化学式表示化学反应的式子。
书写化学方程式要遵循质量守恒定律,即反应前后原子的种类、数目和质量都不变。
例如氢气燃烧生成水的化学方程式是 2H₂+ O₂点燃 2H₂O。
二、物质的性质和变化1、物理变化和化学变化物理变化是没有生成新物质的变化,比如水的蒸发、蜡烛的熔化等。
化学变化是生成新物质的变化,比如铁的生锈、燃烧等。
2、物理性质和化学性质物理性质是不需要发生化学变化就能表现出来的性质,如颜色、状态、气味、熔点、沸点、硬度、密度等。
化学性质是在化学变化中表现出来的性质,如可燃性、氧化性、还原性、酸碱性等。
三、常见的物质1、空气空气的主要成分是氮气(N₂)和氧气(O₂),按体积分数计算,氮气约占 78%,氧气约占 21%。
此外,空气中还含有少量的二氧化碳(CO₂)、稀有气体等。
2、氧气氧气是一种无色无味的气体,具有助燃性,能支持燃烧和供给呼吸。
实验室制取氧气的方法有加热高锰酸钾、分解过氧化氢溶液等。
3、水水是由氢元素和氧元素组成的,一个水分子由两个氢原子和一个氧原子构成。
水的净化方法有沉淀、过滤、吸附、蒸馏等。
4、碳及其化合物常见的碳单质有金刚石、石墨和 C₆₀。
金刚石硬度大,可用于切割玻璃;石墨能导电,可用于制作电极。
二氧化碳(CO₂)是一种无色无味的气体,能使澄清石灰水变浑浊,常用于灭火和光合作用。