最新 中考化学化学除杂分离和提纯(word)
- 格式:doc
- 大小:96.00 KB
- 文档页数:7


中考化学实验专题复习:物质的分离、除杂和提纯(教案)一、教学目标:1. 理解物质的分离、除杂和提纯的基本原理。
2. 掌握常见的物质分离和提纯方法,如过滤、蒸发、蒸馏、萃取等。
3. 能够运用所学的知识解决实际问题,提高实验操作能力和科学思维。
二、教学内容:1. 物质的分离方法:过滤、蒸发、蒸馏、萃取等。
2. 除杂原则:不增、不减、易分离、易复原。
3. 提纯方法:结晶、干燥、吸附等。
4. 实验操作技巧和注意事项。
三、教学过程:1. 导入:通过回顾已学的物质分离和提纯方法,引导学生思考如何选择合适的方法进行实验。
2. 讲解:详细讲解物质的分离、除杂和提纯的基本原理和方法,结合实例进行解释。
3. 演示:进行实验演示,展示常见的物质分离和提纯操作,让学生直观地理解实验过程。
4. 练习:学生分组进行实验练习,运用所学的知识进行物质的分离和提纯操作。
5. 讨论:学生分组讨论实验过程中遇到的问题和解决方法,分享实验心得。
四、教学评价:1. 学生能够理解物质的分离、除杂和提纯的基本原理。
2. 学生能够掌握常见的物质分离和提纯方法,并能够运用所学的知识解决实际问题。
3. 学生具备一定的实验操作能力和科学思维。
五、教学资源:1. 实验仪器和试剂:烧杯、漏斗、滤纸、蒸馏器、萃取剂等。
2. 教学课件和教案:提供详细的课件和教案,帮助学生理解和掌握所学内容。
3. 参考资料:提供相关的参考书籍和网络资源,供学生进一步学习。
六、教学重点与难点:教学重点:1. 掌握过滤、蒸发、蒸馏、萃取等物质分离方法的操作步骤及适用条件。
2. 理解除杂原则及应用。
3. 学会使用结晶、干燥、吸附等方法进行物质的提纯。
教学难点:1. 不同分离方法的选择与操作。
2. 除杂原则在实际操作中的应用。
3. 复杂物质体系中物质的分离与提纯。
七、教学方法:1. 采用问题驱动的教学方法,引导学生思考和探索。
2. 利用实验演示和分组实践,提高学生的动手操作能力。
3. 采用讨论和小组合作的方式,培养学生的团队协作和沟通能力。

一、中考初中化学除杂分离和提纯1.除去下列物质中所含的杂质,所用的试剂和方法正确的是:A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的试剂错误。
B、Ca(OH)2能与过量K2CO3溶液反应生成碳酸钙沉淀和氢氧化钾,能除去杂质且入了新的杂质碳酸钾(过量的),不符合除杂原则,故选项所采取的方法错误。
C、CaCO3固体高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、FeSO4和CuSO4均能与适量的锌粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则;故选项所采取的方法错误。
故选:C。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
2.下列实验操作中(括号内为待检验物质或杂质)不能达到实验目的是()A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A. 鉴别C、CuO,加入稀硫酸,氧化铜会与硫酸反应逐渐溶解,生成蓝色的硫酸铜溶液,而木炭不反应,所以通过观察溶液颜色变化可以鉴别它们,方案可行。
故A不符合题意;B.二氧化碳和氯化氢气体分别通入石蕊试液都会使石蕊试液会由紫色变成红色,所以通过观察溶液颜色的变化检验二氧化碳中的氯化氢不可行。
故B符合题意;C. 要除去KNO3固体中的NH4HCO3,充分加热至固体质量不变,碳酸氢铵发生分解生成氨气、水、二氧化碳,这三种物质都会变成气态挥发走。
方案可行。
故C不符合题意;D. 要分离CaCO3、CaCl2固体,溶解:碳酸钙不溶,氯化钙能溶;过滤:除去不溶的碳酸钙固体;洗涤:洗去碳酸钙表面的氯离子和钙离子;烘干:烘干滤渣碳酸钙;蒸发:蒸发结晶得到氯化钙固体。
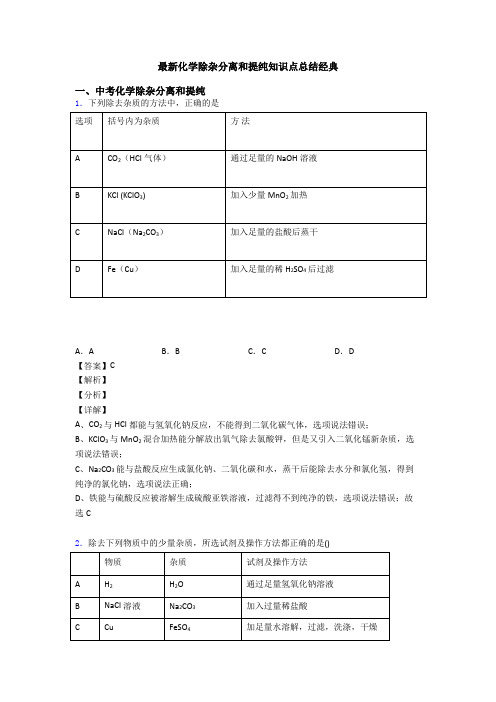
最新化学除杂分离和提纯知识点总结经典一、中考化学除杂分离和提纯1.下列除去杂质的方法中,正确的是A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、CO2与HCl都能与氢氧化钠反应,不能得到二氧化碳气体,选项说法错误;B、KClO3与MnO2混合加热能分解放出氧气除去氯酸钾,但是又引入二氧化锰新杂质,选项说法错误;C、Na2CO3能与盐酸反应生成氯化钠、二氧化碳和水,蒸干后能除去水分和氯化氢,得到纯净的氯化钠,选项说法正确;D、铁能与硫酸反应被溶解生成硫酸亚铁溶液,过滤得不到纯净的铁,选项说法错误;故选C2.除去下列物质中的少量杂质,所选试剂及操作方法都正确的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、氢氧化钠溶液不具有吸水性,不能除去水蒸气,不符合除杂原则,故选项所采取的方法错误。
B、Na2CO3能与过量稀盐酸反应生成氯化钠、水和二氧化碳,能除去杂质但引入了新的杂质盐酸,不符合除杂原则,故选项所采取的方法错误。
C、加足量水溶解,硫酸亚铁溶于水形成溶液,铜难溶于水,再过滤,洗涤,干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、明矾能对杂质进行吸附,使杂质沉降,但不能除去异味,不符合除杂原则,故选项所采取的方法错误。
故选:C。
【点睛】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
3.除去下列物质中的杂质,所选用的方法正确的是()A.A B.B C.C D.D【答案】C【解析】【分析】【详解】A、除去CO2中的HCl,把气体先通过过量氢氧化钠溶液,再通过浓硫酸,氢氧化钠溶液既能吸收氯化氢气体,也能吸收二氧化碳气体,A不正确;B、除去NaCl溶液中的Na2CO3,加稀硫酸至恰好不再产生气泡为止,碳酸钠与稀硫酸反应生成硫酸钠、水和二氧化碳,虽然除去了碳酸钠,但又生成了硫酸钠,引进新的杂质,B 不正确;C、除去CuSO4溶液中的H2SO4,加过量氧化铜粉末,硫酸与氧化铜反应生成硫酸铜和水,从而除去了硫酸,过量的氧化铜用过滤除去,C正确;D、除去铁粉中的锌粉,加过量CuSO4溶液充分反应后过滤、洗涤、干燥。

初三化学专题:除杂与提纯除杂与提纯1. 除杂题:(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。
2. 混合物的提纯:(1)可溶性与难溶性物质的混合物——常用溶解、过滤、蒸发三步操作加以分离提纯,分别得到纯净物。
如:粗盐的提纯;BaSO4和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑——结晶法。
即冷却热饱和溶液的方法加以分离。
如:NaCl和KNO3的混合物。
(3)两种物质均溶于水时,可考虑用化学方法分离。
如BaCl2和NaCl 的混合物。
可将混合物先溶于水,加入适量Na2CO3溶液,得到BaCO3和NaCl溶液。
BaCl2+ Na2CO3=BaCO3↓+2NaCl。
将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCl2溶液,CO2逸出。
BaCO3+2HCl =BaCl2+H2O+CO2↑。
最后分别将NaCl溶液和BaCl2溶液蒸发,分别得到纯净的NaCl固体和BaCl2固体。
注意:用化学方法或用物理方法进行混合物分离时,要区别除杂质与分离物质的不同点是:除杂质时只要求把杂质除掉、保留原物质即可;而混合物分离是几种物质用一定的方法分开,原混合物中各成分都必须保留。
例1除去NaCl溶液中的杂质Ba(OH)2,若只准加入一种试剂,则这种试剂是_______。
【分析】除去杂质的方法有多种,原则是不引入新的杂质,对所提纯的物质不能改变,把杂质转化成所需要的物质,便于分离。
如将杂质被溶液吸收;将杂质转化为气体或沉淀;2-将不溶的杂质转为可溶物等。

初中化学化学除杂分离和提纯的技巧及练习题及练习题(含答案)一、中考化学除杂分离和提纯1.如表中除去物质所含少量杂质的方法,错误的是()A.A B.B C.C D.D【答案】C【解析】试题分析:A、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. B、碳酸钙高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. C、盐酸能与过量氢氧化钙溶液反应生成氯化钙和水,能除去杂质但引入了新的杂质氢氧化钙(过量的),不符合除杂原则,故选项所采取的方法错误. D、氯化镁能与过量氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,再过滤、向滤液中加适量稀盐酸除去过量的氢氧化钠,至溶液pH=7,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.故选C.考点:物质除杂或净化的探究;常见气体的检验与除杂方法;酸的化学性质;盐的化学性质.2.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是( )B MgCl2溶液HCl过量Mg(OH)2过滤C CO2水蒸气足量NaOH固体干燥D CaCO3CaO无高温煅烧A.A B.BC.C D.D【答案】B【解析】【分析】除杂条件是不引入新的杂质,加入的物质不和原物质反应。
【详解】A、碳酸钡为沉淀,不能与硫酸钾发生反应,故A不正确;B、加入过量氢氧化镁,氢氧化镁能与盐酸反应生成氯化镁和水,再过滤掉剩余氢氧化镁得到氯化镁溶液,故B正确;C、氢氧化钠与原物质二氧化碳能发生反应,故C不正确;D、高温燃烧时原物质碳酸钙发生分解反应,故D不正确。
故选B。
【点睛】物质除杂时选择的药品要只与杂质发生反应,不与原物质反应,且在除杂时不能引入新杂质。
3.下列除去杂质的方法错误的是选项物质(括号内为杂质)除去杂质的方法A CO2(CO)通过NaOH溶液B N2(O2)通过灼热的铜网C CaCl2(CaCO3)加水、过滤、蒸发D HNO3溶液(HCl)加适量AgNO3溶液、过滤A.A B.B C.C D.D【答案】A【解析】【分析】物质除杂时,可以根据物质性质,采用物理方法或化学方法,原则上选用的除杂试剂不能与原有物质反应,反应后不能引入新的杂质.【详解】A、氢氧化钠容易与二氧化碳反应而不与一氧化碳反应,所以使用氢氧化钠不仅除不去一氧化碳,反而把二氧化碳吸收了,所以A不正确;B、将氮气和氧气的混合气体通过灼热的铜网,氧气会与铜反应,而氮气不会,所以能将氧气除掉,故B正确;C、氯化钙易溶于水,而碳酸钙不溶于水,加水溶解后再过滤,可以除去碳酸钙,将滤液蒸发即可得氯化钙,故C正确;D、硝酸中混有盐酸,使用的硝酸银溶液只与盐酸反应,反应后生成氯化银沉淀和硝酸,再经过滤操作除去氯化银沉淀即可得硝酸,故D正确,故选A.4.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是A.N2(O2)——通过灼热的铜网B.FeCl2溶液(CuCl2)——加入过量的铁粉,充分反应后过滤C.CaO(CaCO3)——加入足量的水溶解,过滤,蒸发结晶D.KCl(MnO2)——加入足量的水溶解,过滤,蒸发结晶【答案】C【解析】【详解】A、将混合气体通过灼热的铜网,铜与氧气反应生成氧化铜,除去氧气,不符合题意;B、加入过量的铁粉,铁与氯化铜反应生成氯化亚铁和铜,充分反应后过滤,可得氯化亚铁溶液,不符合题意;C、加入足量的水,氧化钙与水反应生成氢氧化钙,碳酸钙难溶于水,过滤,除去了碳酸钙,但是也除去了原物质,符合题意;D、氯化钾溶于水,二氧化锰不溶于水,加入足量的水溶解,过滤,除去二氧化锰,蒸发结晶得到氯化钾,不符合题意。
初三化学化学除杂分离和提纯试题(有答案和解析)一、中考化学除杂分离和提纯1.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是()A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、将混合气体通过足量的铜网,铜与氮气不反应,铜与氧气能在加热的条件下反应生成氧化铜,但是常温下铜与氧气不反应,常温下,通过足量的铜网,不能除去混合气体中的氧气,不符合题意;B、氯化钾能溶于水,二氧化锰不溶于水,加水溶解、过滤,除去二氧化锰,蒸发、结晶得到氯化钾,符合题意;C、活性炭具有吸附性,能吸附水中的色素和异味,故加活性炭可除去水中的臭味,过滤,除去活性炭,才能得到水,需加过滤步骤,不符合题意;D、将混合气体通过适量的氢氧化钠溶液,氢氧化钠与二氧化碳反应生成碳酸钠和水,虽然除去了杂质二氧化碳,但是一氧化碳通过氢氧化钠溶液会携带上水蒸气,引入了新的杂质水蒸气,不符合题意。
故选B。
2.除去CO气体中少量CO2,可采用的方法是()A.把混合气体点燃B.把混合气体通过水中C.把混合气体通过灼热的CuO粉末D.把混合气体通过足量的澄清石灰水【答案】D【解析】【分析】【详解】A、一氧化碳能与氧气反应生成二氧化碳,反而会把原物质除去,不符合除杂原则,故选项错误。
B、二氧化碳能与水反应生成碳酸,但是碳酸不稳定会分解成二氧化碳和水,不能彻底除去杂质,故选项出错误。
C、一氧化碳能与灼热的氧化铜反应生成铜和二氧化碳,二氧化碳不能与灼热的氧化铜反应,反而会把原物质除去,不符合除杂原则,故选项错误。
D、CO2能与足量澄清石灰水反应生成碳酸钙和水,CO不与足量澄清石灰水反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项正确。
故选:D。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.3.为除去粗盐中的泥沙、Ca2+、Mg2+、SO42-等杂质,可将粗盐溶于水,再进行下列五步操作:①过滤②加过量的氢氧化钠溶液③加稍过量的盐酸④加过量的碳酸钠溶液⑤加过量的氯化钡溶液⑥蒸发结晶。
九年级化学化学除杂分离和提纯试题(有答案和解析)及解析一、中考化学除杂分离和提纯1.海水晒制的粗盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主SO、Ca2+、Mg2+的形式存在。
为将这些杂质除净,可向粗盐浴液中加入过量的氢氧要以2-4化钠、碳酸钠、氯化钡溶液、加入盐酸调至溶液pH=7、还有过滤等操作,最后经过蒸发得到精盐。
下列操作及加入溶液顺序错误的是A.BaCl2、NaOH、Na2CO3、过滤、HClB.BaCl2、Na2CO3、 NaOH、过滤、HClC.NaOH、 BaCl2、 Na2CO3、过滤、HClD.Na2CO3、BaCl2、 NaOH、过滤、HCl【答案】D【解析】【分析】【详解】镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀;先除镁离子,或者先除硫酸根离子都可以,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了之后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子。
据此分析各选项,D选项不符合上述要求。
故选D。
【点睛】粗盐精制中碳酸钠要在氯化钡之后加入,这样可除去过量的氯化钡。
2.下列实验方案中,能达到目的的是()A.分离CaCO3和NaCl的混合物:加水溶解、过滤、干燥B..制取Mg(OH)2:将Ba(OH)2溶液和MgSO4溶液混合后过滤C.除去H2中水蒸气和HCl气体:依次通过浓硫酸和NaOH溶液D..检验KCl溶液中混有的K2CO3:取样,加入足量的Ca(OH)2溶液【答案】D【解析】【分析】【详解】A、CaCO3和NaCl的混合物加水溶解、过滤得到碳酸钙和氯化钠溶液,氯化钠溶液需要蒸发结晶才能得到氯化钠,故A错;B、将Ba(OH)2溶液和MgSO4溶液混合后过滤,得到的是硫酸钡沉淀和氢氧化镁沉淀的混合物,故B错;C、除去H2中水蒸气和HCl气体,应依次通过NaOH溶液和浓硫酸,否则氢气中还会有水蒸气,C错;D、检验KCl溶液中混有的K2CO3,取样,加入足量的Ca(OH)2溶液,氢氧化钙能够和碳酸钾生成碳酸钙沉淀和氯化钾,有白色沉淀说明有碳酸钾,D正确;故选:D3.除去下列物质中少量杂质(括号内为杂质),所用除去杂质的方法正确的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、向混合溶液中加入适量锌粉,锌能与硫酸铜反应生成硫酸锌和铜,虽然除去了杂质,但是引入了新的杂质,不符合题意;B、氯化钾溶于水,二氧化锰不溶于水,加水溶解、过滤,可将二氧化锰除去,然后蒸发结晶可得氯化钾,不符合题意;C、向混合溶液中加入过量的氢氧化钠,氢氧化钠与氯化铁反应生成氢氧化铁和氯化钠,虽然除去了杂质,但是氢氧化钠过量,引入了新的杂质,不符合题意;D、将混合气体通过灼热足量的氧化铜,氧化铜与一氧化碳反应生成铜和二氧化碳,可将杂质除去,符合题意。
中考化学实验专题复习——物质的分离、除杂和提纯一、教学目标1. 理解物质的分离、除杂和提纯的基本原理;2. 掌握常用的物质分离和提纯方法,如过滤、蒸馏、萃取、分液等;3. 能够分析实际问题,选择合适的分离和提纯方法;4. 提高实验操作能力和实验思维。
二、教学内容1. 物质的分离方法:过滤、蒸馏、萃取、分液等;2. 物质的除杂方法:吸附、沉淀、离子交换等;3. 物质的提纯方法:蒸发、结晶、吸收等;4. 实际问题分析与解决。
三、教学过程1. 引入:通过生活中的实例,引出物质的分离、除杂和提纯的概念;2. 讲解:详细讲解各种分离、除杂和提纯方法的原理和操作步骤;3. 演示:进行实验演示,让学生直观地理解各种方法的操作过程;4. 练习:给出一些实际问题,让学生运用所学知识进行分析;5. 总结:对本节课的内容进行总结,强化学生的记忆。
四、教学评价1. 学生能熟练掌握各种分离、除杂和提纯方法的原理和操作步骤;2. 学生能独立分析实际问题,选择合适的分离和提纯方法;3. 学生能完成相关的实验操作,具备一定的实验能力。
五、教学资源1. 实验室设备:显微镜、漏斗、烧杯、蒸馏器等;2. 实验试剂:食盐水、酒精、碘酒等;3. 教学课件:物质的分离、除杂和提纯的相关课件;4. 教学参考书:中考化学实验专题复习资料。
六、教学重点与难点教学重点:1. 掌握过滤、蒸馏、萃取、分液等基本分离方法的操作步骤和适用条件。
2. 理解吸附、沉淀、离子交换等除杂方法的原理和应用。
3. 学会通过实验操作对混合物进行有效的提纯。
教学难点:1. 蒸馏和分液的原理理解及操作技巧。
2. 针对不同混合物选择合适的分离提纯方法。
3. 实验中可能出现的意外情况的处理。
七、教学方法1. 采用问题驱动的教学方法,引导学生通过实验观察和思考。
2. 使用案例分析和小组讨论的方式,提高学生的参与度和合作能力。
3. 通过实验演示和实操练习,增强学生的动手能力和实验技能。
一、中考初中化学溶液的除杂分离和提纯1.除去下列物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是A.A B.B C.C D.D【答案】A【解析】【分析】【详解】A、加入过量的CuCl2溶液和铁充分反应,得到铜和氯化亚铁溶液,过滤得到铜,洗涤、干燥得到纯净的铜,符合题意;B、KC1中的杂质MnO2,加入足量的水溶解,是KC1溶解,MnO2不能溶解,过滤、洗涤、后面应该蒸发结晶才能得到KC1,不符合题意;C、NaCl中的杂质NaNO3,加入适量的硝酸银溶液是和主要物质NaCl发生反应,没有除去杂质NaNO3,不符合题意;D、Cu中的杂质C,在空气中灼烧,Cu、C都会与氧气反应,Cu反应生成氧化铜,C反应产生二氧化碳,主要物质被反应了,不符合题意。
故选A。
2.下列除杂所选用试制与操作方法均正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,过滤可除去碳酸钙,但是也把原物质除去了,不符合除杂原则,不符合题意;B、碳酸钠能与过量稀盐酸反应生成氯化钠、水和二氧化碳,盐酸具有挥发性,再蒸发除去盐酸,能除去杂质且没有引入新的杂质,符合除杂原则,符合题意;C、硫酸钠能与过量氯化钡溶液反应生成硫酸钡沉淀和氯化钠,能除去杂质但引入了新的杂质(过量的)氯化钡,不符合除杂原则,不符合题意;D、CO和氢气均能与灼热的CuO反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,不符合题意。
故选B。
【点睛】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。
除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
3.下表列出了除去物质中所含少量杂质的方法,其中错误的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、氢氧化钠溶液能与HCl气体反应,不与H2反应,将混合气体通入足量的氢氧化钠溶液,再干燥,可得到H2,此选项不符合题意;B、稀盐酸将碳酸钠溶液除去的同时,也将氢氧化钠溶液除去了,此选项符合题意;C、NaCl易溶于水,泥沙难溶于水,加入足量的水溶解、过滤,可滤出泥沙,然后蒸发水,得到氯化钠,此选项不符合题意;D、氧化铜与氧气不反应,碳粉能与氧气反应,生成的气体逸出。
最新中考化学化学除杂分离和提纯(word)一、中考化学除杂分离和提纯1.除去下列物质中混有的少量杂质所选试剂的操作方法正确的是()A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、将气体通过足量NaOH溶液,NaOH能与HCl反应生成NaCl和水,氢氧化钠也能与二氧化碳反应生成碳酸钠和水,虽然除去了杂质,也除去了原物质,不符合题意;B、加入适量稀盐酸,氧化铜能与稀盐酸反应生成氯化铜和水,碳不与稀盐酸反应,过滤、洗涤、干燥可得碳,不但没有除去杂质,反而除去了原物质,不符合题意;C、加入适量K2CO3溶液,氯化钙能与碳酸钾反应生成碳酸钙和氯化钾,过滤,除去碳酸钙,虽然除去了杂质,但是引入了新的杂质氯化钾,不符合题意;D、加入适量AgNO3溶液,氯化铜能与硝酸银反应生成硝酸铜和氯化银,过滤,除去氯化银,可得硝酸铜,符合题意。
故选D。
【点睛】除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
2.除去下列各物质中混有的少量杂质,所用试剂和操作均正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、Ba(NO3)2溶液会和Na2SO4溶液发生反应,生成硫酸钡沉淀和硝酸钠,虽然过滤去除了硫酸钡沉淀,溶液中还有硝酸钠,不符合题意;B、通过足量的NaOH溶液可以去除HCl,通过浓硫酸可以去除水蒸气,进而得到纯净的H2,操作正确,符合题意;C、CO在CO2中不能点燃,不符合题意;D、加入足量的稀盐酸不仅会和Fe2O3反应,还会和铁粉反应,不符合题意;故选:B3.下列除去杂质的方法正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、二氧化碳不燃烧,也不支持燃烧,故二氧化碳中混有少量一氧化碳,无法点燃,不符合题意;B、加水溶解、加入过量铁粉,铁与氯化铜反应生成氯化亚铁和铜,过滤除去生成的铜和过量的铁,即可得到氯化亚铁,符合题意;C、加入适量稀盐酸,氢氧化钙与稀盐酸反应生成氯化钙和水,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,虽然除去了碳酸钙,也除去了原物质,不符合题意;D、加适量硝酸银溶液,硝酸银与氯化钠反应生成氯化银和硝酸钠,盐酸与硝酸银反应生成氯化银和硝酸,虽然除去了杂质,也除去了原物质,不符合题意。
故选B。
【点睛】除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
4.下列除去杂质所选用的方法正确的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、除去二氧化碳中的一氧化碳不能够点燃,这是因为会引入新的气体杂质,且当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误。
B、NaOH固体易溶于水,氢氧化铜固体难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法正确。
C、碳酸钠和NaOH溶液均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
D、锌粉能与过量硫酸亚铁溶液反应生成硫酸亚铁溶液和铁,能除去杂质但引入了新的杂质铁,不符合除杂原则,故选项所采取的方法错误。
故选:B。
【点睛】物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。
5.下列除杂试剂使用正确的是A.A B.B C.C D.D【答案】C【解析】【详解】A、用足量AgNO3溶液除去Fe中的Cu,Fe和Cu在金属活动性顺序中都排在银的前面,AgNO3溶液把铁和铜都除去,得到固体为银,A不正确;B、用适量Ba(OH)2溶液除去CaCl2溶液中的HCl,酸碱反应,除去了盐酸,但同时也生成氯化钡,引进了新的杂质,B不正确;C、用适量稀盐酸除去KCl中的K2CO3,盐酸与氯化钾不反应,却能与碳酸钾反应,生成氯化钾,从而除去了碳酸钾,得到氯化钾,C正确;D、用过量Na2CO3溶液除去NaOH溶液中的Ca(OH)2,碳酸钠与氢氧化钙反应,生成氢氧化钠和碳酸钙沉淀,虽然除去了氢氧化钙,但也引进了过量的碳酸钠,D不正确。
故选C。
【点睛】利用化学方法选择试剂除杂质时,既要把杂质除去,又不能引进新的杂质。
6.除去下列各物质中混有的少量杂质,所用试剂、操作方法均正确的是A.A B.B C.C D.D【答案】B【解析】【详解】A、CaO和CaCO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、蒸发结晶的方法进行分离除杂,故选项所采取的方法正确。
C、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
D、K2SO4能与适量的BaCl2溶液反应生成硫酸钡沉淀和氯化钾,能除去杂质但引入了新的杂质氯化钾,不符合除杂原则,故选项所采取的方法错误。
故选:B。
【点睛】除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
7.下列有关物质的检验、鉴别、分离、除杂所用试剂或方法不正确的是()A.检验自来水中是否含有C1-,可用硝酸银和稀硝酸溶液B.鉴别羊毛纤维和合成纤维,可抽丝灼烧闻气味C.分离碳酸钙和氯化钠固体,可溶解、过滤、蒸发D.除去氯化钡溶液中的氢氧化钡,可加入适量的稀硫酸后过滤【答案】D【解析】【详解】A、检验自来水中是否含有C1-,可向自来水中加入硝酸银溶液,产生白色沉淀,再滴加稀硝酸溶液,沉淀不溶解,说明自来水中含有氯离子,故选项A正确;B、鉴别羊毛纤维和合成纤维,可抽丝灼烧,有烧焦羽毛气味的是羊毛纤维,没有烧焦羽毛气味的是合成纤维,故选项B正确;C、要分离碳酸钙和氯化钠固体,碳酸钙难溶于水,氯化钠易溶于水,只要加入足量的水,溶解、过滤、蒸发,就把碳酸钙与氯化钠分离,故选项C正确;D、除去氯化钡溶液中的氢氧化钡,加入适量的稀硫酸,稀硫酸既能与氯化钡反应,又能与氢氧化钡反应,所以加入适量的稀硫酸后过滤,不能除去氯化钡溶液中的氢氧化钡,故D不正确。
故选:D。
8.下列实验方案或结论不正确的是()A.除去铜粉中含有的少量铁粉:将混合固体加入到足量稀盐酸中,充分反应后过滤、洗涤、干燥B.不用其它任何试剂就能将CuSO4溶液、稀H2SO4、NaCl溶液、NaOH溶液鉴别出来C.除去CO2中的少量HC1气体:先通过NaOH溶液,再通过浓硫酸D.鉴别NaCl、Na2SO4和(NH4)2SO4三种溶液:各取少量于试管中,分别滴加Ba (OH) 2溶液【答案】C【解析】【详解】A、铁粉能与足量稀盐酸反应生成氯化亚铁溶液和氢气,铜不能与稀盐酸反应,充分反应后过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项实验方案或结论正确;B、CuSO4溶液是蓝色的,能与CuSO4溶液反应产生蓝色沉淀的是的是NaOH溶液,再将剩余的两种溶液分别滴加至蓝色沉淀中,能使沉淀消失的是稀硫酸,无明显变化的是氯化钠溶液,不加其他试剂可以鉴别,且鉴别的顺序为①④②③或①④③②,故选项实验方案或结论正确;C、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项实验方案或结论错误;D、分别滴加Ba(OH)2溶液,只产生白色沉淀的是Na 2SO4溶液,产生白色沉淀和刺激性气味气体的是(NH4)2SO4溶液,无明显变化的是NaCl溶液,可以鉴别,故选项实验方案或结论正确。
故选C。
【点睛】除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
9.除去下列各组物质中括号内的杂质,不能达到实验目的的是A.A B.B C.C D.D【答案】B【解析】【分析】【详解】A、将混合固体在空气中充分灼烧,木炭粉会与氧气反应生成二氧化碳,从而除去氧化铜中混有的木炭粉,不符合题意;B、将混合气体通过灼热的木炭,木炭可与氧气反应生成二氧化碳,但是二氧化碳也能和碳反应生成一氧化碳,虽然除去了氧气,但是也除去了原物质,符合题意;C、铁粉能被磁铁吸引,铜粉不能被磁铁吸引,可以用磁铁除去铜粉中混有的铁粉,不符合题意;D、将混合气体通过足量灼热的氧化铜,一氧化碳能与氧化铜反应生成铜和二氧化碳,从而除去二氧化碳中混有的一氧化碳,不符合题意。
故选B。
【点睛】除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
10.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是A.A B.B C.C D.D【答案】C【解析】【详解】A、MnO2不溶于水,KCI易溶于水,要除去MnO2中的KCl,正确的操作步骤是:溶解、过滤、洗涤烘干,故A错误;B、CO2中含有少量CO,当CO2含量过高时,CO是无法点燃的。
除去CO2中的CO,应该将混合气体通过灼热的CuO,CO与CuO反应转变成CO2,故B错误;C、Na2SO4能和Ba( NO3)2溶液发生反应生成BaSO4沉淀和NaNO3,过滤可除去BaSO4沉淀,故C正确;D、过量的AgNO3溶液能和稀盐酸反应而不与稀硝酸反应,会将被提纯的物质除去,故D 错误。
故选C。
【点睛】除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。