最新医疗器械内部审核资料
- 格式:doc
- 大小:57.50 KB
- 文档页数:6

最新医疗器械内部审核资料2最新医疗器械内部审核资料2为了确保医疗器械的质量和安全性,对医疗器械进行内部审核是非常重要的环节。
本文将对医疗器械内部审核的目的、内容、步骤和要点进行介绍,以便充分了解医疗器械内部审核的重要性和操作流程。
1.目的医疗器械内部审核的主要目的是评估和验证医疗器械是否符合相关法规和标准的要求,确认其质量和安全性,并找出在生产、销售、使用等过程中存在的问题和风险,以便采取相应的纠正措施,确保医疗器械的质量和安全性。
2.内容医疗器械内部审核的内容包括但不限于以下几个方面:-产品质量管理-设备和设施的管理-原材料的管理-生产和工艺流程的管理-风险管理-培训和教育-设备维护和校准-记录和文件的管理-不良事件的管理-监控和测量3.步骤医疗器械内部审核的步骤主要包括以下几个环节:-确定内部审核的范围和目标-制定内部审核计划-进行内部审核的准备工作,如审核员的培训和审核文件的准备-进行实地审核,包括现场查看、询问员工、检查文件等-整理审核结果,编写审核报告,并提出问题和建议-制定纠正和预防措施,并跟踪和验证实施情况-审核结束后进行总结和评价,提出改进意见和建议4.要点医疗器械内部审核的要点主要包括以下几个方面:-审核员应具备相关知识和技能,并熟悉相关法规和标准-内部审核应针对医疗器械的各个环节和流程进行全面、系统的评估-内部审核应注重问题的发现和风险的评估,提出相应的纠正和预防措施-内部审核应注重培训和教育,提高员工的质量意识和技能水平-内部审核应定期进行,确保医疗器械的质量和安全性不断改进和提升综上所述,医疗器械内部审核是确保医疗器械质量和安全性的重要环节。
通过对医疗器械的各个环节和流程的全面评估,发现和纠正问题,以及采取预防措施,可以持续改进医疗器械的质量和安全性,保障患者的生命健康。
因此,医疗器械企业应加强对内部审核的重视,确保内部审核的科学性和有效性。

医疗器械质量管理体系的内部审核随着医疗技术的不断发展和人们对健康安全的日益关注,医疗器械的质量管理成为医疗机构和制造商必须高度重视的问题。
而医疗器械质量管理体系的内部审核,作为确保质量合规的一个重要环节,起着举足轻重的作用。
一、背景介绍医疗器械质量管理体系是指制造商或经营者为确保产品的质量和安全性,采取的一系列组织措施和控制手段。
这个体系的有效运行体现了医疗器械制造商或经营者对质量的重视和对法规要求的遵循。
而内部审核作为医疗器械质量管理体系的重要组成部分,是制造商或经营者对自身质量管理体系的有效性进行评估和完善的手段。
通过内部审核,可以发现潜在的问题和风险,促进及时纠正和改进。
二、内部审核的目的和意义1. 评估质量管理体系的合规性内部审核旨在评估医疗器械质量管理体系是否符合相应的法规要求和标准,是否能够保障产品的质量和安全性。
通过对各项管理要求的检查和跟踪,可以发现和纠正潜在的质量问题,减少合规风险。
2. 发现问题和风险内部审核可以帮助制造商或经营者发现质量管理体系中存在的问题和风险,从而及时采取措施进行纠正和改进。
这对于提升产品质量和安全性,降低事故和风险的发生具有重要意义。
3. 促进持续改进内部审核是持续改进的重要手段。
通过对质量管理体系的评估和分析,可以识别出改进的机会,并制定有效的措施和目标。
持续改进可以使医疗器械质量管理体系不断提升,适应市场需求和法规变化。
三、内部审核的步骤和要点1. 制定内部审核计划在进行内部审核前,制造商或经营者需要制定内部审核计划,明确审核的范围、目标和时间。
确定好审核的时间节点和参与人员,保证审核的全面性和有效性。
2. 进行审核准备审核前应进行充分的准备工作,包括审核文件的准备、审核程序的制定和审核人员的培训等。
确保审核的过程能够顺利进行,并能够得出准确、可靠的结论。
3. 实施内部审核根据审核计划,进行内部审核的实施。
内部审核应全面、客观、公正地进行,对质量管理体系的各个环节进行仔细检查和评估。

******2021年度内部质量管理体系审核报告为确保公司符合医疗器械质量管理体系的要求,推进质量管理体系持续有效的地运行,经公司研究决定,于二○一五年一月十六日对公司内部的质量管理体系进行全面的审核,现将审核情况报告如下:一、检查与考核目的:通过内部审核,评价本公司医疗器械质量体系的符合性、适宜性和有效性并对本公司医疗器械质量管理制度的执行情况做评价,找出不符合项,提出改良措施和防止不合格再发生的预防措施,不断完善质量管理。
二、审核范围:全公司所有部门及岗位三、审核依据:1、医疗器械经营监督管理方法】;2、【医疗器械说明书和标签管理规定】;3、【医疗器械经营质量管理标准】;4、【食品产品监管总局关于印发国家重点监管医疗器械目录的通知】和相关法规、公司质量管理制度和相关文件;5、公司现行的质量管理体系文件五、审核组成员六、内审时间安排2015年5月16日一天上午:对需现场检查的工程进行检查,包括岗位人员的实际操作,现场提问等。
下午:对医疗器械的文件、制度、人员培训、购销存等记录进行检查。
七、审核结论在公司领导的重视下,在各部门的大力支持配合下,使我们能在预定的1天时间内,以完成了对公司的质量管理体系总的运行情况和现状进行全面的、深入的内部审核工作。
通过查阅资料,检查相关记录及表格、现场观察、抽查提问等方式,对逐项查对,得出如下结论:〔一〕、对公司已建立医疗器械质量管理运行情况现状进行全面的内部审核。
我们的审核是按照医疗器械监督管理条例及公司有关制度等逐项进行抽样检查,得出以下结论:共56项,经检查结果出现2项不合格。
经审核组讨论并一致认为:公司目前的质量管理体系运转正常,是适宜有效的,符合医疗器械质量管理标准,具体如下:1、管理职责:〔1〕公司严格按许可证核准的经营方式和经营范围从事产品经营活动,无发现超范围经营的情况。
〔2〕公司组织结构及岗位设置合理,各岗位人员职责清晰,责任明确,按照医疗器械质量管理标准要求和公司实施管理需要,建立了以总经理为首、质量副总为辅的组织机构,下设质管部,、人事行政部、储运部、业务部、信息部,并成立了质量领导小组及质量管理机构。

医疗器械内部审核控制程序1. 引言医疗器械内部审核是指对医疗器械企业内部运营、管理以及相关流程的审核和检查。
它旨在确保医疗器械企业的内部运营符合相关法规和标准要求,提高产品质量,保障患者安全。
本文档旨在介绍医疗器械内部审核的控制程序。
2. 审核目的医疗器械内部审核的目的是确保医疗器械企业的运营符合法规和标准要求,并不断改进和提高企业的管理实践和流程。
通过内部审核,可以识别和纠正存在的问题,减少质量风险,提高产品可靠性和安全性。
3. 审核范围医疗器械内部审核的范围涉及企业的各个方面,包括但不限于以下内容:•产品研发和生产的流程和标准操作程序•供应商选择和管理•生产设备和工艺控制•内部质量管理体系•产品质量检验和检测•销售和售后服务流程•合规性和法规要求4. 审核程序医疗器械内部审核的程序包括以下步骤:4.1 确定审核计划医疗器械企业应制定内部审核计划,明确审核的时间安排和范围。
审核计划应根据企业的情况和需求进行调整和更新。
4.2 审核准备审核准备阶段包括收集审核所需的资料和信息,准备审核的工具和模板,确定审核的目标和标准。
还应确定审核的审核员和被审核部门的联系人。
4.3 信息收集与审核审核员根据审核计划和准备阶段的工作,对被审核部门的文件、记录和操作进行审核。
审核员应采用合适的方法,例如文件审查、访谈、观察等,收集和验证相关信息。
4.4 发现问题和记录在审核过程中,审核员应记录发现的问题、不符合项和改进机会。
记录应准确、详细,并包括相关的证据和依据。
4.5 编制审核报告审核结束后,审核员应根据审核记录编制审核报告。
审核报告应包括审核的结论、问题和改进机会的总结、建议和推荐措施。
4.6 审核结论的确认和复核审核报告应提交给被审核部门,对审核发现的问题和改进机会进行确认和复核。
被审核部门应制定纠正措施和改进计划,并跟踪执行和效果。
4.7 审核跟踪和验证医疗器械企业应建立审核跟踪和验证的机制,确保纠正和改进措施的有效实施和效果。


医疗器械管理体系内部管理评审全套资料➢内部管理评审管理程序➢内部管理评审报告(12-33页)X X X 股份有限公司2023年ISO13485:2016医疗器械管理体系认证文件文件编制 编制日期 年月日文件接收部门 □总经理 □管 代 □行政部 □品质部 □物流部 □财务部 □业务部 □文件审核 审核日期 年月日文件批准 批准日期 年月日文件编号 受控状态 接收人员 发布日期 2023年 02 月 20 日 ☑受控 □非受控 发放编号程序文件更改履历表序号 更改人 更改原因 更改内容 版本号管理评审管理程序1.目的通过编制管理评审程序文件,明确管理评审流程,确保最高管理者按已文件化的策划时间间隔评审组织的质量管理体系,以确认运行中的ISO13485 医疗器械质量管理体系是否具有适宜性、充分性和有效性,并通过对管理评审输出结果改进项和变更项的完成以实现对医疗器械质量管理体系的持续改进。
2.范围适用于公司对质量管理体系的运行情况进行的管理评审管理。
3.职责3.1 总经理主持管理评审并做出决策;3.2 管理者代表负责向总经理报告质量管理体系的运行情况,向总经理提出召开管理评审会议的建议,协助改进措施的制订与实施;3.3 质量部负责管理评审会议的具体组织工作及会议决策的落实;3.4 各部门负责提供本部门有关管理评审输入所需的资料及上次管理评审提出的改进措施完成情况的资料、参加会议及决策措施的实施。
4.工作程序4.1质量部制定评审计划4.1.1管理评审每年至少一次。
若因市场发生重大变化、组织机构发生重大变化、产品质量发生重大问题、质量法规和质量标准发生重大改变、顾客严重投诉时,由管理者代表提议、总经理决定,适时增加管理评审。
4.1.2评审计划内容包括:评审频次、时间、评审范围、参加部门和人员、地点,明确输入要求和责任单位。
4.2管理者代表审核管理评审计划,总经理批准管理评审计划。
4.3评审输入4.3.1 反馈;4.3.2 抱怨处理;4.3.3 向监管机构的报告;4.3.4 审核;4.3.5 过程的监视和测量;4.3.6 产品的监视和测量;4.3.7 纠正措施;4.3.8 预防措施;4.3.9 以往管理评审的跟踪措施;4.3.10 影响质量管理体系的变更;4.3.11 改进的建议;4.3.12 适用的新的或修订的法规要求。


医疗器械注册质量管理体系核查提交资料一、公司基本情况:1.公司注册资料,包括公司名称、注册地址、经营范围等信息。
2.公司组织机构架构图,清晰展示公司内部各个部门的分工和职责。
二、质量管理体系文件:1.公司的质量管理体系文件,包括质量手册、程序文件和标准文件等。
这些文件应当符合国家相关法律法规以及医疗器械质量管理体系的要求。
2.内部质量目标和质量方针,以及对于产品质量的承诺和保证。
三、质量管理体系运行情况:1.公司的质量管理职责分配和运行机制,包括质量管理部门和各个部门的职责和权限分工。
2.公司的质量管理评审活动记录,包括质量管理体系的定期评审和持续改进的情况。
四、质量管理体系的持续改进:1.公司的质量管理持续改进活动的记录和措施,包括质量管理体系的内部和外部质量审核的情况。
2.公司的质量事件管理和不良事件报告的处理情况。
五、质量控制和测试设备:1.公司的质量控制和测试设备的鉴定和检验报告,确保设备的准确性和可靠性。
2.公司的质量控制和测试设备的维护和校准记录。
六、人员培训和教育:1.公司的员工培训和教育计划和培训记录,包括员工的质量意识和技能培养情况。
2.公司的专业技术人员的资质和培训记录。
七、风险管理和控制:1.公司的风险管理体系,包括风险评估和风险控制的相关文件和记录。
2.公司的不良事件报告和召回记录。
以上是医疗器械注册质量管理体系核查提交资料的主要内容。
在准备资料时,需要遵循国家相关法律法规和质量管理体系的要求,确保所提交的资料真实、准确并符合要求。
同时,还可以根据具体情况补充其他相关资料,以便更好地展示公司的质量管理水平和能力。

医疗器械内部审核控制程序医疗器械是保障人们健康的重要工具,因此其质量与安全管理十分关键。
医疗器械企业应建立完善的内部审核控制程序,以确保其产品的合规性和质量可靠性。
本文将从内部审核的定义、目的、重要性以及建立内部审核控制程序的步骤等方面展开探讨。
一、内部审核的定义内部审核是指医疗器械企业内部对其质量管理体系进行检查和评价的一项工作。
通过内部审核,企业可以发现和纠正质量管理体系中存在的问题和不足之处,以确保其质量目标的实现和持续改进。
二、内部审核的目的1.发现问题与风险:通过内部审核,企业可以发现潜在的问题和风险,包括生产过程中的不合规情况、员工操作不当、设备故障等。
通过及时纠正,可以避免事故的发生,确保产品的质量和安全。
2.持续改进:内部审核是质量管理体系的重要环节,通过不断的审核和评估,企业可以发现质量管理体系中的问题和不足,及时采取措施进行改进和完善。
3.符合法规要求:医疗器械企业需要符合相关法规和标准的要求,内部审核可以帮助企业确保其产品的合规性,避免不合规行为带来的风险和处罚。
4.提升客户满意度:通过内部审核,企业可以提升产品的质量和安全水平,从而提升客户的满意度和信任度,增加企业的市场竞争力。
三、内部审核的重要性1.风险防控:内部审核可以帮助企业发现和解决生产过程中存在的问题和不足,降低产品质量和安全方面的风险。
2.制度落实:内部审核可以促使企业内部管理制度的落实和执行,确保各项制度的有效实施。
3.持续改进:内部审核是不断改进质量管理体系的有效手段,通过发现和纠正问题,从而实现持续改进的目标。
4.提升企业形象:通过建立完善的内部审核制度,企业可以提升其质量管理水平,塑造良好的企业形象,增强市场竞争力。
四、建立内部审核控制程序的步骤1.确定审核范围:首先,企业需要确定内部审核的范围,包括审核的对象、审核的领域以及审核的周期等。
2.制定审核计划:企业需要制定内部审核计划,明确审核的时间、地点、审核的目标和标准等。

最新医疗器械内部审核资料为了确保医疗器械的安全性和有效性,以保障公众的健康和安全,每一款医疗器械在市场上销售之前都需经过严格的内部审核。
下面是一份关于最新医疗器械内部审核资料的简要说明。
一、审核目的本次医疗器械内部审核主要是为了评估该器械是否具备安全性、有效性和符合法规及标准等基本要求,确保该器械在使用过程中不会对人体造成伤害,并能正常发挥其预期功能。
二、审核范围本次审核主要涵盖以下几个方面:1.法规要求:对该医疗器械所涉及的法规要求进行全面调查,确保该器械的设计、生产和销售过程符合相关法规和标准。
2.设计和制造:对器械的设计和制造过程进行详细评估,包括材料选择、结构设计、工艺流程等,确保器械的质量和可靠性。
3.安全性评估:对器械的安全性进行全面评估,包括使用过程中可能产生的危险、使用限制、操作要求等,以尽量消除人员受伤的可能性。
4.有效性评估:对器械的有效性进行评估,包括对其预期功能的验证和效果的评估,确保其在实际使用中能够达到预期效果。
5.临床试验:如有需要,进行临床试验以进一步验证器械的安全性和有效性,并收集相关数据和经验。
三、审核程序本次审核主要分为以下几个步骤:1.信息收集:收集有关该器械的相关信息,包括设计文档、制造过程记录、安全性评估报告、临床试验数据等。
2.文档评估:对收集到的文档进行评估,评估的重点包括设计和制造过程的合规性、安全性评估的全面性和有效性评估的可靠性。
3.过程检查:对该器械的设计和制造过程进行现场检查,确保其合理性和符合法规要求。
4.安全性评估:对该器械的安全性进行评估,包括对可能的风险进行分析和评估,并提出相应的风险控制措施。
5.有效性评估:对该器械的有效性进行评估,包括验证其预期功能的可行性,并评估其在实际使用中的效果。
四、审核结论基于以上审核步骤的评估结果,将对该医疗器械做出以下结论:1.符合要求:如果该器械在各个方面均符合要求,且没有明显的问题和隐患,则可做出审核通过的结论。
医疗器械内审流程及内容英文回答:Internal Audit Process and Content for Medical Devices.1. Planning and Preparation.Determine the scope and objectives of the audit.Identify the audit team and assign responsibilities. Develop an audit plan and timeline.Gather necessary documentation and data.2. Execution.Conduct interviews with key personnel.Review relevant documents and records.Observe operations and processes.Assess compliance with regulations and standards.3. Reporting and Findings.Summarize the audit findings and conclusions.Identify areas for improvement.Recommend corrective actions.Communicate audit results to management.4. Follow-Up.Monitor the implementation of corrective actions. Reassess the audit findings periodically.Make necessary adjustments to the audit process.Contents of Medical Device Internal Audits.Quality Management System (QMS): Compliance with ISO 13485 and other applicable regulations.Design and Development: Adherence to design specifications, risk management, and validation.Production and Control: Implementation of good manufacturing practices (GMP), sterilization, and quality control.Purchasing and Supply Chain: Supplier qualification, incoming material inspection, and inventory management.Sales and Distribution: Compliance with regulatory requirements for device marketing and distribution.Service and Support: Management of customer complaints, field service, and product recalls.Post-Market Surveillance: Monitoring of product performance and safety.中文回答:医疗器械内部审计流程及内容。
******有限公司2015年度内部质量管理体系审核报告为确保公司符合医疗器械质量管理体系的要求,推进质量管理体系持续有效的地运行,经公司研究决定,于二○一五年一月十六日对公司内部的质量管理体系进行全面的审核,现将审核情况报告如下:一、检查与考核目的:通过内部审核,评价本公司医疗器械质量体系的符合性、适宜性和有效性并对本公司医疗器械质量管理制度的执行情况做评价,找出不符合项,提出改进措施和防止不合格再发生的预防措施,不断完善质量管理。
二、审核范围:全公司所有部门及岗位三、审核依据:1、医疗器械经营监督管理办法》;2、《医疗器械说明书和标签管理规定》;3、《医疗器械经营质量管理规范》;4、《食品产品监管总局关于印发国家重点监管医疗器械目录的通知》和相关法规、公司质量管理制度和相关文件;5、公司现行的质量管理体系文件五、审核组成员六、内审时间安排2015年5月16日一天上午:对需现场检查的项目进行检查,包括岗位人员的实际操作,现场提问等。
下午:对医疗器械的文件、制度、人员培训、购销存等记录进行检查。
七、审核结论在公司领导的重视下,在各部门的大力支持配合下,使我们能在预定的1天时间内,以完成了对公司的质量管理体系总的运行情况和现状进行全面的、深入的内部审核工作。
通过查阅资料,检查相关记录及表格、现场观察、抽查提问等方式,对逐项查对,得出如下结论:(一)、对公司已建立医疗器械质量管理运行情况现状进行全面的内部审核。
我们的审核是按照医疗器械监督管理条例及公司有关制度等逐项进行抽样检查,得出以下结论:共56项,经检查结果出现2项不合格。
经审核组讨论并一致认为:公司目前的质量管理体系运转正常,是适宜有效的,符合医疗器械质量管理标准,具体如下:1、管理职责:(1)公司严格按许可证核准的经营方式和经营范围从事产品经营活动,无发现超范围经营的情况。
(2)公司组织结构及岗位设置合理,各岗位人员职责清晰,责任明确,按照医疗器械质量管理标准要求和公司实施管理需要,建立了以总经理为首、质量副总为辅的组织机构,下设质管部,、人事行政部、储运部、业务部、信息部,并成立了质量领导小组及质量管理机构。
最新13485-2016医疗器械质量管理体
系全套内审资料
2018年度内部医疗器械质量管理体系审核方案
图例说明:
计划审核已进行纠正措施已制定纠正措施已验证编制:审核:批准:
日期:日期:日期:
表格编号:Q3-HR-005 B/0
内部质量和环境审核计划
表格编号:Q3-HR-006 B/0
内审首次/末次会议签到表
表格编号:Q3-HR-007 B/0
表格编号:Q3-HR-008 B/0
备注:各部门请分开用一份表格填写。
表格编号:Q3-HR-009 B/0
备注:各部门请分开用一份表格填写。
表格编号:Q3-HR-009 B/0
内部审核不符合项报告
表格编号:Q3-HR-010 B/0
内部医疗器械质量管理体系总结报告
表格编号:Q3-HR-011 B/0。
******有限公司2015年度内部质量管理体系审核报告为确保公司符合医疗器械质量管理体系的要求,推进质量管理体系持续有效的地运行,经公司研究决定,于二○一五年一月十六日对公司内部的质量管理体系进行全面的审核,现将审核情况报告如下:一、检查与考核目的:通过内部审核,评价本公司医疗器械质量体系的符合性、适宜性和有效性并对本公司医疗器械质量管理制度的执行情况做评价,找出不符合项,提出改进措施和防止不合格再发生的预防措施,不断完善质量管理。
二、审核范围:全公司所有部门及岗位三、审核依据:1、医疗器械经营监督管理办法》;2、《医疗器械说明书和标签管理规定》;3、《医疗器械经营质量管理规范》;4、《食品产品监管总局关于印发国家重点监管医疗器械目录的通知》和相关法规、公司质量管理制度和相关文件;5、公司现行的质量管理体系文件五、审核组成员六、内审时间安排2015年5月16日一天上午:对需现场检查的项目进行检查,包括岗位人员的实际操作,现场提问等。
下午:对医疗器械的文件、制度、人员培训、购销存等记录进行检查。
七、审核结论在公司领导的重视下,在各部门的大力支持配合下,使我们能在预定的1天时间内,以完成了对公司的质量管理体系总的运行情况和现状进行全面的、深入的内部审核工作。
通过查阅资料,检查相关记录及表格、现场观察、抽查提问等方式,对逐项查对,得出如下结论:(一)、对公司已建立医疗器械质量管理运行情况现状进行全面的内部审核。
我们的审核是按照医疗器械监督管理条例及公司有关制度等逐项进行抽样检查,得出以下结论:共56项,经检查结果出现2项不合格。
经审核组讨论并一致认为:公司目前的质量管理体系运转正常,是适宜有效的,符合医疗器械质量管理标准,具体如下:1、管理职责:(1)公司严格按许可证核准的经营方式和经营范围从事产品经营活动,无发现超范围经营的情况。
(2)公司组织结构及岗位设置合理,各岗位人员职责清晰,责任明确,按照医疗器械质量管理标准要求和公司实施管理需要,建立了以总经理为首、质量副总为辅的组织机构,下设质管部,、人事行政部、储运部、业务部、信息部,并成立了质量领导小组及质量管理机构。
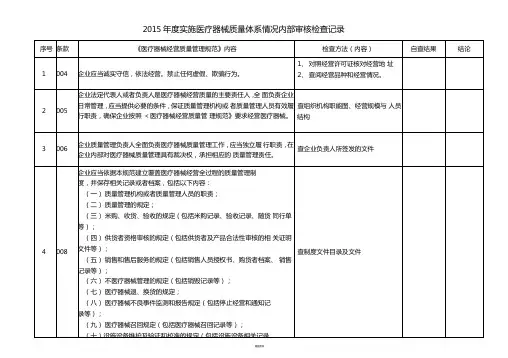
内部质量体系审核资料**********医疗器械有限公司2016 年度目录1、年度内审计划2、关于 2016 年质量管理体系内部审核的通知3、内审实施计划4、内审首次会议签到表5、首次会议记录6、内审检查表7、内审末次会议签到表8、末次会议记录9、不合格报告10、内审报告年度内审计划审核目的:检查本公司质量管理体系是否正常运行,评价质量管理体系运行的适宜性、充分性、有效性,纠正不合格项。
被审核部门:总经理、管代、办公室、生产部(含车间)、采购部(含仓库)、质管部、研发部、销售部。
审核依据:医疗器械生产质量管理规范,公司质量手册及质量管理体系文件。
审核方法:集中式审核时间、持续时间:2016 年 5月上旬表单编号: 014制表:核准:关于 2016 年质量管理体系内部审核的通知公司领导及部室、车间:根据质量管理体系年度审核计划安排,经研究决定于 2016 年 05 月 03 日~ 05 月 05 日(上午 8:0011 :30 ,下午 1:305 :0)在公司会议室进行内审,整个内审工作由管理者代表胡德斌负责。
请公司领导及被审核部门负责人、内审员等有关人员按时参加。
公司办公室2016 年4月28日审核组组长:胡德斌组员:杨金伟、胡成武、程敏洁1审核目的:对质量管理体系进行内部质量审核,评价体系运行的适宜性、充分性、有效性。
审核依据:医疗器械生产质量管理规范,公司质量手册及质量管理体系文件。
2 审核覆盖产品:小型医用***** 、医用 ***** 器。
3审核时间: 2016 年 05 月 03 日至 2016 年 05 月 05 日首次会议时间: 2016 年 05 月 03 日 8 时 00 分末次会议时间: 2016 年 05 月 05 日 15 时 30 分4现场审核期间请被审核方有关人员参加下列活动:首、末次会议:总经理、管理者代表及与审核有关的部门负责人、管理人员参加。
审核活动:按审核日程安排,被审核方有关人员在本岗位。