中考状元必备笔记_初中化学资料—着火点
- 格式:doc
- 大小:24.50 KB
- 文档页数:1

中考化学考试知识考点之燃烧和灭火中考化学考试知识考点:燃烧和灭火1、燃烧的条件:(缺一不可)(1)可燃物 (2)氧气(或空气) (3)温度达到着火点2、灭火的原理:(只要消除燃烧条件的任意一个即可)(1)消除可燃物 (2)隔绝氧气(或空气) (3)降温到着火点以下3、影响燃烧现象的因素:可燃物的性质、氧气的浓度、与氧气的接触面积使燃料充分燃烧的两个条件:(1)要有足够多的空气(2)燃料与空气有足够大的接触面积。
4、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
中考化学“燃烧”考点归类例析一、燃烧的条件、灭火的原理和方法物质燃烧必须具备的条件是:(1)可燃物;(2)与氧气(或空气)充分接触;(3)温度达到燃烧所需的最低温度(着火点)。
三者缺一不可,否则物质不能发生燃烧现象。
灭火的原理实质就是破坏燃烧的三个条件中的任意一个。
根据燃烧的条件可确定灭火的原理和方法:(1)清除(或隔离)可燃物;(2)隔绝氧气(或空气);(3)使可燃物温度降低到着火点以下。
究竟利用哪种方法灭火,要根据具体情况具体分析。
例1:白磷着火点为40℃,红磷着火点为240℃,五氧化二磷能污染空气,五氧化二磷易溶于水。
(1)在探究可燃物燃烧条件的课堂上,老师用甲图所示装置进行实验。
实验时观察到的现象是:铜片上的红磷和水中的白磷不燃烧,铜片上的白磷______。
(2)小明同学设计了乙、丙两个对比实验,完成了探究过程。
得到以下实验事实:①不通入空气时,冷水中的白磷不燃烧;②通入空气时,冷水中的白磷不燃烧;③ 不通入空气时,热水中的白磷不燃烧;④通入空气时,热水中的白磷燃烧。
该实验中,能证明可燃物的温度必须达到着火点才能燃烧的事实是(填序号,下同)______;能证明可燃物通常需要接触空气才能燃烧的事实是______。
(3)结合老师与小明设计的实验,小强设计了实验装置丁。


初中化学资料—着火点
着火点之一
可燃物在空气或氧气中燃烧,必须要达到该物质着火燃烧所需要的最低温度,这个最低温度叫做该物质的着火点。
不同的物质,着火点不同。
着火点之二
着火点又称燃点。
指可燃性液体表面的蒸气和空气的混合物与火接触而发生火焰,且能维持继续燃烧不少于5s的温度。
它是可燃性液体性质的重要指标之一。
〔闪点〕是指可燃性液体表面蒸气与空气混合物初次发生闪蓝色火光时的温度。
它比燃点低。
例如酒精的着火点是696K(423℃)闪点是286K(13℃)。
闪点也是可燃性液体的重要指标之一。
着火点之三
着火点是使物质能够持续燃烧的最低温度。
着火点不是固定不变的。
对固体燃料来说,着火点的高低跟表面积的大小、组织的粗细、导热系数的大小等都有关系。
颗粒越细,表面积越大,着火点越低;导热系数越小,着火点越低。
对液体燃料和气体燃料来说,火焰接触它们的情况和外界压强的大小也都有关系。

2019年中考化学燃烧及其利用知识点总结一、燃烧和灭火1、燃烧的条件:(缺一不可)(1)可燃物(2)氧气(或空气)(3)温度达到着火点2、灭火的原理:(只要消除燃烧条件的任意一个即可)(1)消除可燃物(2)隔绝氧气(或空气)(3)降温到着火点以下3、影响燃烧现象的因素:可燃物的性质、氧气的浓度、与氧气的接触面积使燃料充分燃烧的两个条件:(1)要有足够多的空气(2)燃料与空气有足够大的接触面积。
4、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
二、燃料和能量1、三大化石燃料:煤、石油、天然气(混合物、均为不可再生能源)(1)煤:“工业的粮食”(主要含碳元素);煤燃烧排放的污染物:SO2、NO2(引起酸雨)、CO、烟尘等(2)石油:“工业的血液”(主要含碳、氢元素);汽车尾气中污染物:CO、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘(3)天然气是气体矿物燃料(主要成分:甲烷),是较清洁的能源。
2、两种绿色能源:沼气、乙醇(1)沼气的主要成分:甲烷甲烷的化学式:CH4(最简单的有机物,相对分子质量最小的有机物)物理性质:无色,无味的气体,密度比空气小,极难溶于水。
化学性质:可燃性CH4+2O2点燃CO2+2H2O(发出蓝色火焰)(2)乙醇(俗称:酒精,化学式:C2H5OH)化学性质:可燃性C2H5OH+3O2点燃2CO2+3H2O工业酒精中常含有有毒的甲醇CH3OH,故不能用工业酒精配制酒!乙醇汽油:优点(1)节约石油资源(2)减少汽车尾气(3)促进农业发展(4)乙醇可以再生3、化学反应中的能量变化(1)放热反应:如所有的燃烧(2)吸热反应:如C+CO2高温2CO4、新能源:氢能源、太阳能、核能、风能、地热能、潮汐能氢气是最理想的燃料:(1)优点:资源丰富,放热量多,无污染。
(2)需解决问题:①如何大量廉价的制取氢气?②如何安全地运输、贮存氢气?。
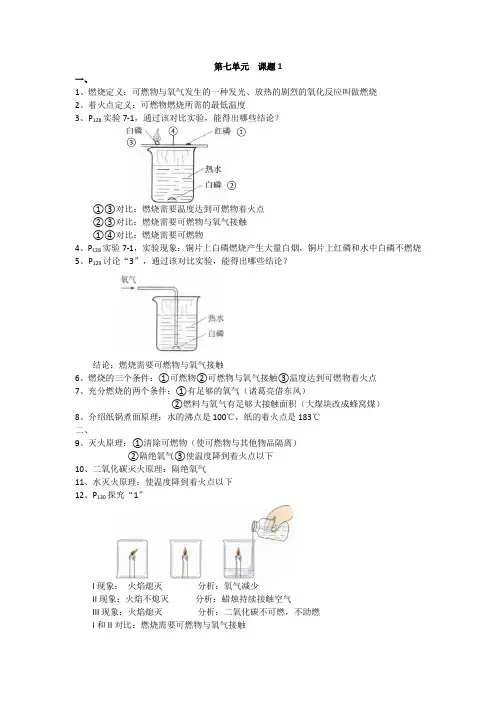
第七单元课题1一、1、燃烧定义:可燃物与氧气发生的一种发光、放热的剧烈的氧化反应叫做燃烧2、着火点定义:可燃物燃烧所需的最低温度3、P128实验7-1,通过该对比实验,能得出哪些结论?①③对比:燃烧需要温度达到可燃物着火点②③对比:燃烧需要可燃物与氧气接触①④对比:燃烧需要可燃物4、P128实验7-1,实验现象:铜片上白磷燃烧产生大量白烟,铜片上红磷和水中白磷不燃烧5、P129讨论“3”,通过该对比实验,能得出哪些结论?结论:燃烧需要可燃物与氧气接触6、燃烧的三个条件:①可燃物②可燃物与氧气接触③温度达到可燃物着火点7、充分燃烧的两个条件:①有足够的氧气(诸葛亮借东风)②燃料与氧气有足够大接触面积(大煤块改成蜂窝煤)8、介绍纸锅煮面原理:水的沸点是100℃,纸的着火点是183℃二、9、灭火原理:①清除可燃物(使可燃物与其他物品隔离)②隔绝氧气③使温度降到着火点以下10、二氧化碳灭火原理:隔绝氧气11、水灭火原理:使温度降到着火点以下12、P130探究“1”I现象:火焰熄灭分析:氧气减少II现象:火焰不熄灭分析:蜡烛持续接触空气III现象:火焰熄灭分析:二氧化碳不可燃,不助燃I和II对比:燃烧需要可燃物与氧气接触13、介绍P130探究“2”14、碳酸钠和盐酸反应方程式:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(现象:产生气泡)Na2CO3是白色粉末状固体,溶于水会形成无色溶液,本单元用的是溶液15、影响燃烧现象因素:①可燃物种类②氧气浓度③与氧气接触面积(铁丝螺旋状)16、P131表7-2(除“了解”部分,其他部分需要背)①干粉灭火器:利用压缩的二氧化碳吹出干粉(主要成分含碳酸氢钠或磷酸铵盐)碳酸氢钠受热分解方程式:2NaHCO3△Na2CO3+H2O+CO2↑灭火类型:一般失火、油、气②二氧化碳灭火器:加压时将液态二氧化碳压缩在小钢瓶中,灭火时再将其喷出,有降温和隔绝空气的作用灭火类型:图书、档案、贵重设备、精密仪器③水基灭火器:不能用水灭“油”,但可用水基灭火器,可见水基灭火器中的“水”中有特别之处水基型灭火器其灭火器机理为物理性灭火器原理。

燃烧和灭火一、燃烧及燃烧条件1、燃烧:通常情况下,可燃物与_____发生的一种_____、_____的_______________。
2、燃烧条件的探究实验(1)铜片上的白磷和红磷的现象:白磷燃烧,产生大量_____,放出_____;红磷:_____结论:燃烧需要温度达到可燃物燃烧需要的__________,即温度达到可燃物的_____。
注:着火点:是指使可燃物持续燃烧所需的最低温度。
是物质的固有性质,一般不可改变(2)用导管对准烧杯中的白磷通入氧气的现象:白磷_____,产生_____结论:燃烧需要可燃物与__________接触。
3、燃烧的条件_____、_______________、_________________________二、灭火的原理和方法1、灭火的根本是_______________。
具体为_________________________,_________________________、_________________________(注:因为着火点是物质的固有性质,一般不可随意改变,灭火时只能____________________,而不能____________________)2、常见的灭火方法:熄灭酒精灯的方法__________,原理为__________;扑灭桌面上燃着的酒精_______________,原理_______________;炒菜时油锅中的油着火,可用_______________或_______________,原理____________________;纸箱着火,用__________,原理____________________;油罐着火时需用__________,原理_______________;扑灭森林火灾的方法之一是_________________________,形成__________,原理_______________;液化气和煤气着火应__________,原理为__________;熄灭蜡烛的方法_____,原理__________。

中考化学关于燃烧考点梳理(备考)熄灭是物体快速氧化,发生光和热的进程。
熄灭的实质是氧化恢复反响。
狭义熄灭不一定要有氧气参与,任何发光、发热、猛烈的氧化恢复反响,都可以叫熄灭,更多关于中考化学关于熄灭考点的内容请看下文。
【着火点的定义】
着火点:到达熄灭所需的最高温度。
着火点是物质自身的固有属性。
因此不能说用降低着火点的方法来灭火,而只能是降温到着火点以下。
【熄灭的条件】(缺一不可):
(1)可燃物(2)氧气(或空气)(3)温度到达着火点
中考化学知识点温习:熄灭及熄灭的条件
【灭火的原理】(只需消弭熄灭条件的恣意一个即可) (1)消弭可燃物(2)隔绝氧气(或空气)(3)降温到着火点以下【影响熄灭现象的要素】中考化学考点总结:影响熄灭现象的要素
【灭火的原理和方法】
灭火的原理:(破坏熄灭的条件,三者破坏其一就可灭火,也可同时都破坏)
⑴肃清可燃物或使可燃物跟其他物品隔离;
⑵隔绝氧气(或空气)
⑶使温度降低到着火点以下中考化学知识点温习:灭火的
原理和方法
【化石燃料】
【自然气】【煤】【石油】。

【化学知识点】初中化学必背重点知识点化学是初中的重要科目,下面给大家分享一些初中必背的化学知识点,希望能帮助大家学习化学。
1.O2:用带火星的木条深入到集气瓶中,木条复燃。
2.H2:点燃、发出淡蓝色火焰,罩一个干冷的烧杯,有水滴出现。
3.CO2:通入澄清石灰水,石灰水变浑浊。
4.CO:点燃(或通过灼热的氧化铜,) ,将生成的气体通入澄清石灰水,石灰水变浑浊。
5.CH4:点燃,罩一个干冷的烧杯,有水滴出现,片刻,迅速倒转烧杯,加入适量的澄清石灰水,石灰水变浑浊。
6.N2:用燃着的木条深入到集气瓶中,加入适量的澄清石灰水,木条熄灭,石灰水不浑浊。
7.酸(H+):滴加石蕊试剂,溶液变红;或加入活泼金属,产生气体。
8.碱(OH-):滴加酚酞试剂,溶液变红,或加入硫酸铜溶液,产生蓝色沉淀。
9.碳酸盐(CO32-):加入适量氢离子,产生能使澄清石灰水变浑浊的气体。
10.水(H2O):无水硫酸铜遇水变蓝。
(一)单质与氧气的反应:1.镁在空气中燃烧:2Mg+O2点燃2MgO2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O43.铜在空气中受热:2Cu+O2加热2CuO4.铝在空气中燃烧:4Al+3O2点燃2Al2O35.氢气中空气中燃烧:2H2+O2点燃2H2O6.红磷在空气中燃烧:4P+5O2点燃2P2O57.硫粉在空气中燃烧:S+O2点燃SO28.碳在氧气中充分燃烧:C+O2点燃CO29.碳在氧气中不充分燃烧:2C+O2点燃2CO(二)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO211.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O1.空气:氮气(N2)和氧气(O2)2.水煤气:一氧化碳(CO)和氢气(H2)3.煤气:一氧化碳(CO)4.天然气:甲烷(CH4)5.石灰石/大理石:(CaCO3)6.生铁/钢:(Fe)7.木炭/焦炭/炭黑/活性炭:(C)8.铁锈:(Fe2O3)1.地壳中含量最多的金属元素是铝。

第七单元燃烧及其利用一、燃烧和灭火1、燃烧的条件:(缺一不可)(1)可燃物(2)氧气(或空气)(3)温度达到着火点2、灭火的原理:(只要消除燃烧条件的任意一个即可)(1)消除可燃物(2)隔绝氧气(或空气)(3)降温到着火点以下3、影响燃烧现象的因素:可燃物的性质、氧气的浓度、与氧气的接触面积使燃料充分燃烧的两个条件:(1)要有足够多的空气(2)燃料与空气有足够大的接触面积。
4、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。
一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。
二、燃料和能量1、三大化石燃料: 煤、石油、天然气(混合物、均为不可再生能源)(1)煤:“工业的粮食”(主要含碳元素);煤燃烧排放的污染物:SO2、NO2(引起酸雨)、CO、烟尘等(2)石油:“工业的血液”(主要含碳、氢元素);汽车尾气中污染物:CO、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘(3)天然气是气体矿物燃料(主要成分:甲烷),是较清洁的能源。
2、两种绿色能源:沼气、乙醇(1)沼气的主要成分:甲烷甲烷的化学式: CH4 (最简单的有机物,相对分子质量最小的有机物)物理性质:无色,无味的气体,密度比空气小,极难溶于水。
化学性质: 可燃性 CH4+2O2点燃CO2+2H2O (发出蓝色火焰)(2)乙醇 (俗称:酒精, 化学式:C2H5OH)化学性质: 可燃性 C2H5OH+ 3O2点燃2CO2+3H2O工业酒精中常含有有毒的甲醇CH3OH,故不能用工业酒精配制酒!乙醇汽油:优点(1)节约石油资源(2)减少汽车尾气(3)促进农业发展(4)乙醇可以再生3、化学反应中的能量变化(1)放热反应:如所有的燃烧(2)吸热反应:如一般条件为“高温”的反应4、新能源:氢能源、太阳能、核能、风能、地热能、潮汐能氢气是最理想的燃料:(1)优点:资源丰富,放热量多,无污染。
(2)需解决问题:①如何大量廉价的制取氢气?②如何安全地运输、贮存氢气?2020年中考化学模拟试卷一、选择题1.下列归纳不完全正确的一组是A.A B.B C.C D.D2.将一根铁棒放在硫酸铜溶液中一段时间。

初三化学学霸笔记最全整理都1、木炭在氧气中所燃烧:C+O2=点燃=CO22、硫在氧气中燃烧:S+O2=点燃=SO2 ;3、镁在空气中燃烧:2Mg+O2=点燃=2MgO4、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O45、磷在氧气中燃烧:4P+5O2=点燃=2P2O56、铜在空气中加热:2Cu+O2=△=2CuO7、水蒸气在氧气中燃烧:2H2+O2=点燃=2H2O8、一氧化碳在空气中所燃烧:2CO+O2=点燃=2CO29、碳不充分燃烧:2C+O2(不充分)=点燃=2CO10、二氧化碳通过灼热的碳层:CO2+C=高温=2CO11、二氧化碳与水反应:CO2+H2O=H2CO312、生石灰和水化合:CaO+H2O=Ca(OH)213、氯酸钾与二氧化锰共热(实验室制O2):2KClO3=(MnO2=△=2KCl+3O2↑14、加热高锰酸钾:2KMnO4=△=K2MnO4+MnO2+O2↑15、电解水:2H2O=通电=2H2↑+O2↑1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
2、一些多种不同物质的颜色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)蓝色:CuSO4?5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、液态固态O2(淡蓝色)红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)黄色:硫磺(单质S)、含Fe3+ 的溶液(棕黄色)绿色:FeSO4?7H2O、含Fe2+ 的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3]无色气体:N2、CO2、CO、O2、H2、CH4有色气体:Cl2(黄绿色)、NO2(红棕色)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2① 酸性氧化物和降解酸都可跟酸反应生成盐和水:CO2 + 2NaOH == Na2CO3 + H2O(H2CO3 + 2NaOH == Na2CO3 + 2H2O)SO2 + 2KOH == K2SO3 + H2OH2SO3 + 2KOH == K2SO3 + 2H2OSO3 + 2NaOH == Na2SO4 + H2OH2SO4 + 2NaOH == Na2SO4 + 2H2O② 酸性混合物跟水反应生成副反应对应的酸:(各概念的化合价不变)CO2 + H20 == H2CO3SO2 + H2O == H2SO3SO3 + H2O == H2SO4N205 + H2O == 2HNO3(说明这些酸性氧化物并使气体都能使湿润pH试纸变红色)。

中考化学知识点总结1. 燃烧1、燃烧的条件:(1)物体要能燃烧,即具有可燃性(2)可燃物要与空气(氧气)充分接触(3)温度要达到着火点以上。
以上三个燃烧条件缺一不可,否则燃烧不能进行。
2、灭火原理:(1)清除可燃物或隔离可燃物(2)隔绝空气(氧气)(3)降低温度到可燃物着火点以下。
3、灭火方法:(1)用水扑灭火灾,水的作用是通过水的蒸发吸热使温度降低到可燃物的着火点以下。
(2)清除可燃物,设置防火隔离带,如扑灭森林火灾时,将大火前面的一片树木砍掉。
(3)隔绝空气(或氧气),如油锅着火,盖上锅盖,使其与空气隔绝。
2. 常见的化肥植物的肥料可分为:氮肥(化学式中含氮元素)、磷肥(含磷元素)、钾肥(含钾元素)、复合肥(同时提供2种或2种以上的肥料)。
铵态氮肥不能与碱性物质一起使用,因为铵态氮肥中的NH4+遇到OH—会生成易挥发的氨气,降低肥效;硫酸铵不宜长期使用,以免造成土壤酸性增强或土壤板结;使用氨水或磷酸二氢铵时要防止挥发,人要站在上风口,因为氨气有腐蚀性,对人的眼鼻粘膜有刺激作用。
区分化肥:NH4HCO3有强烈的氨味,而尿素无氨味;氮肥加熟石灰放出有刺激性气味的氨气;磷肥为灰色粉末,氮肥、钾肥为白色晶体,据此外观可判别磷肥。
3. 木炭还原氧化铜(1)反应方程式 C + CuO 高温2Cu+ CO2↑;实验现象:黑色粉末变为红色,产生的气体能使澄清石灰水变浑浊。
(2)实验注意事项:A、试管稍向下倾斜,防止药品潮湿产生的水蒸气冷凝倒流,炸裂试管B、木炭应过量,目的是使氧化铜充分反应,也可防止生成的铜重新被氧化成氧化铜C、实验结束时,先把导管撤出在熄灭酒精灯,防止石灰水倒流炸裂试管。
4. 化学实验基本操作口诀:固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖。
液体应盛细口瓶,手贴标签再倾倒。
读数要与切面平,仰视偏低俯视高。
滴管滴加捏胶头,垂直悬空不玷污,不平不倒不乱放,用完清洗莫忘记。
托盘天平须放平,游码旋螺针对中;左放物来右放码,镊子夹大后夹小;试纸测液先剪小,玻棒沾液测最好。
初中化学知识点全面总结1. 燃烧1、燃烧的条件:(1)物体要能燃烧,即具有可燃性(2)可燃物要与空气(氧气)充分接触(3)温度要达到着火点以上。
以上三个燃烧条件缺一不可,否则燃烧不能进行。
2、灭火原理:(1)清除可燃物或隔离可燃物(2)隔绝空气(氧气)(3)降低温度到可燃物着火点以下。
3、灭火方法:(1)用水扑灭火灾,水的作用是通过水的蒸发吸热使温度降低到可燃物的着火点以下。
(2)清除可燃物,设置防火隔离带,如扑灭森林火灾时,将大火前面的一片树木砍掉。
(3)隔绝空气(或氧气),如油锅着火,盖上锅盖,使其与空气隔绝。
2. 化学实验(1)实验时要严格按照实验规定的用量取用药品。
如果没有说明用量,应按最少量取用:液体取(1~2)毫升,固体只需盖满试管底部。
实验剩余的药品不能放回原瓶,要放入指定的容器内。
(2)固体药品用药匙取用,块状药品可用镊子夹取,块状药品或密度大的金属不能竖直放入容器。
(3)取用细口瓶里的液体药品,要先拿下瓶塞,倒放在桌面上,标签对准手心,瓶口与试管口挨紧。
用完立即盖紧瓶塞,把瓶子放回原处。
(4)试管:可用作反应器,可收集少量气体,可直接加热。
盛放液体不超过容积的1/3,试管与桌面成45°角;加热固体时管口略向下倾斜。
(5)烧杯:溶解物质、配制溶液用,可用作反应器,可加热,加热时要下垫石棉网。
(6)平底烧瓶:用作固体和液体之间的反应器,可加热,要下垫石棉网。
(7)酒精灯:熄灭时要用盖灭,不可用嘴吹灭,不可用燃着的酒精灯去点另一只酒精灯。
酒精灯的火焰分为:外焰、内焰和焰心。
外焰温度最高,加热时用外焰。
(8)可直接加热的仪器:试管、蒸发皿、坩埚、燃烧匙;可用于加热但必须在下面垫石棉网的仪器:烧杯,烧瓶;不能加热的仪器:水槽、量筒、集气瓶。
(9)量筒:量取一定量体积的液体,使用时应尽量选取一次量取全部液体的最小规格的量筒。
不能作反应器,不能溶解物质,不能加热读数时。
量筒平放,视线与液体的凹液面的最低处保持水平。
初三化学必背知识点什么是可燃冰初三化学必背知识点:木炭在氧气中燃烧:C+O2=点燃=CO2;硫在氧气中燃烧:S+O2=点燃=SO2;镁在空气中燃烧:2Mg+O2=点燃=2MgO;铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O4;氢气还原氧化铜:H2+CuO=△=Cu+H2O;木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑。
初三化学必背知识点1、木炭在氧气中燃烧:C+O2=点燃=CO2。
2、硫在氧气中燃烧:S+O2=点燃=SO2。
3、镁在空气中燃烧:2Mg+O2=点燃=2MgO。
4、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O4。
5、氢气还原氧化铜:H2+CuO=△=Cu+H2O。
6、木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑。
7、碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑。
8、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO4。
9、具有刺激性气体的气体:NH3(氨气)、SO2、HCl(皆为无色);无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)、空气、稀有气体注:具有刺激性气味的液体:盐酸、硝酸、醋酸(即醋);氨水;酒精为有特殊气体的液体。
10、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。
(高锰酸钾溶液为紫红色)。
什么是可燃冰1、可燃冰是天然气水合物。
2、因其外观像冰一样而且遇火即可燃烧,所以又被称作“可燃冰”(Combustibleice)或者“固体瓦斯”和“汽冰”。
其实是一个固态块状物。
天然气水合物在自然界广泛分布在大陆永久冻土、岛屿的斜坡地带、活动和被动大陆边缘的隆起处、极地大陆架以及海洋和一些内陆湖的深水环境。
3、可燃冰分布范围可燃冰在自然界广泛分布在大陆、岛屿的斜坡地带、活动和被动大陆边缘的隆起处、极地大陆架以及海洋和一些内陆湖的深水环境。
初中化学资料—着火点
初中化学
2013-03-28 14:58
着火点之一
可燃物在空气或氧气中燃烧,必须要达到该物质着火燃烧所需要的最低温度,这个最低温度叫做该物质的着火点。
不同的物质,着火点不同。
着火点之二
着火点又称燃点。
指可燃性液体表面的蒸气和空气的混合物与火接触而发生火焰,且能维持继续燃烧不少于5s的温度。
它是可燃性液体性质的重要指标之一。
〔闪点〕是指可燃性液体表面蒸气与空气混合物初次发生闪蓝色火光时的温度。
它比燃点低。
例如酒精的着火点是696K(423℃)闪点是286K (13℃)。
闪点也是可燃性液体的重要指标之一。
着火点之三
着火点是使物质能够持续燃烧的最低温度。
着火点不是固定不变的。
对固体燃料来说,着火点的高低跟表面积的大小、组织的粗细、导热系数的大小等都有关系。
颗粒越细,表面积越大,着火点越低;导热系数越小,着火点越低。
对液体燃料和气体燃料来说,火焰接触它们的情况和外界压强的大小也都有关系。
∙ (2013-03-25 10:53:34)
∙ (2013-03-25 10:50:29)
∙ (2013-03-24 19:11:24)
∙ (2013-03-22 16:04:23)
∙(2013-03-22 15:23:48)
∙ (2011-08-01 21:08:17)
∙ (2011-08-01 21:05:36)
∙ (2011-07-04 15:57:26)
∙ (2011-07-04 15:49:02)
∙ (2011-06-30 14:35:55)。