正丁醇表面张力的测定-最终版
- 格式:xls
- 大小:22.00 KB
- 文档页数:1

正丁醇表面张力的测定实验报告实验目的:- 了解正丁醇表面张力测定的方法和原理;- 掌握测定表面张力的基本操作和步骤;- 探究温度对正丁醇表面张力的影响。
实验原理:表面张力(T)是指单位长度的表面所能承受的最小力,单位是N/m。
通过测量液体的表面张力,可以了解液体的表面性质,如渗透性、流速、黏度等等。
测量表面张力的方法有很多种,常见的有均匀膜法和压降法。
在本次实验中,我们采用均匀膜法来测量正丁醇的表面张力。
均匀膜法是指加入一定量液体在测量池内,慢慢地添加被测液体,形成一个平衡膜,然后测量膜的长度和被测液体的体积,从而计算出表面张力。
在均匀膜法中,有一个重要的参量叫做膜厚度(h),它是指平衡膜的厚度,单位是米(m)。
膜厚度的大小对表面张力的测定影响很大,所以需要在实验中注意精确控制。
实验步骤:1.准备工作(1)将测量池清洗干净,用纯水冲洗,然后用酒精擦拭干净;(2)准备一小瓶正丁醇;(3)打开表面张力仪,检查各项指标是否正常。
2.测定过程(1)将测量池放在表面张力仪上,调节好仪器的温度;(2)向测量池中加入一定量的纯水,记录体积和温度;(3)将一滴正丁醇滴在纯水表面,使其均匀分布;(4)逐渐加入正丁醇,直到形成均匀膜,注意控制滴加速度和控制膜厚度;(5)测量膜的长度L和膜厚度h,在计算表面张力之前,还需要进行一些修正,比如摩擦修正和悬滴修正等,这些均可以在仪器中自动进行。
3.数据处理通过实验测量数据和仪器处理数据,可以计算出正丁醇的表面张力,通常情况下,正丁醇的表面张力在20-30 mN/m之间。
4.影响因素分析在实验过程中,我们还发现了一个有趣的现象,那就是温度对正丁醇的表面张力有很大的影响。
随着温度的升高,正丁醇的表面张力逐渐降低。
这是因为温度的升高会使分子运动更加剧烈,分子间的相互作用力也会减弱,从而导致表面张力降低。
结论:通过本次实验,我们对正丁醇的表面张力测定方法和原理有了更深入的了解,同时还探究了温度对表面张力的影响。
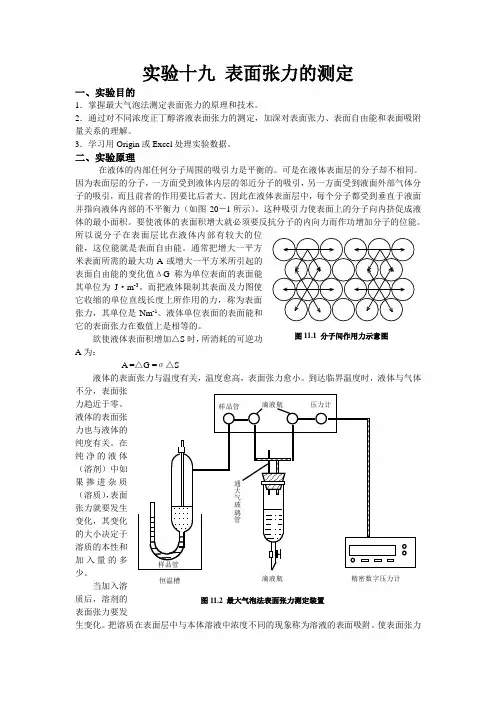
实验十九 表面张力的测定一、实验目的1.掌握最大气泡法测定表面张力的原理和技术。
2.通过对不同浓度正丁醇溶液表面张力的测定,加深对表面张力、表面自由能和表面吸附量关系的理解。
3.学习用Origin 或Excel 处理实验数据。
二、实验原理在液体的内部任何分子周围的吸引力是平衡的。
可是在液体表面层的分子却不相同。
因为表面层的分子,一方面受到液体内层的邻近分子的吸引,另一方面受到液面外部气体分子的吸引,而且前者的作用要比后者大。
因此在液体表面层中,每个分子都受到垂直于液面并指向液体内部的不平衡力(如图20-l 所示)。
这种吸引力使表面上的分子向内挤促成液体的最小面积。
要使液体的表面积增大就必须要反抗分子的内向力而作功增加分子的位能。
所以说分子在表面层比在液体内部有较大的位能,这位能就是表面自由能。
通常把增大一平方米表面所需的最大功A 或增大一平方米所引起的表面自由能的变化值ΔG 称为单位表面的表面能其单位为J ·m -3。
而把液体限制其表面及力图使它收缩的单位直线长度上所作用的力,称为表面张力,其单位是Nm -1。
液体单位表面的表面能和它的表面张力在数值上是相等的。
欲使液体表面积增加△S 时,所消耗的可逆功A 为:-A =△G =σ△S液体的表面张力与温度有关,温度愈高,表面张力愈小。
到达临界温度时,液体与气体不分,表面张力趋近于零。
液体的表面张力也与液体的纯度有关。
在纯净的液体(溶剂)中如果掺进杂质(溶质),表面张力就要发生变化,其变化的大小决定于溶质的本性和加入量的多少。
当加入溶质后,溶剂的表面张力要发生变化。
把溶质在表面层中与本体溶液中浓度不同的现象称为溶液的表面吸附。
使表面张力图11.1 分子间作用力示意图样品管滴液瓶压力计样品管恒温槽滴液瓶通大气玻璃管精密数字压力计图11.2 最大气泡法表面张力测定装置降低的物质称为表面活性物质。
用吉布斯公式(Gibbs)表示:Tc d RT dc σ⎛⎫Γ=⎪⎝⎭ (11-1) 式中:Γ为表面吸附量(mol ·m -2),σ为表面张力(J ·m -2)。

正丁醇表面张力正丁醇是一种常用的有机溶剂,具有重要的应用价值。
而它的表面张力在其应用中也是一个比较重要的参数。
正丁醇表面张力的研究,对于了解其物理性质,优化应用性能具有重要意义。
一、表面张力概述表面张力,指液体表面上分子间的相互作用力。
当液体中分子间的相互作用力与表面上分子间的相互作用力不同时,便会形成表面张力。
表面张力越大,液面越难展开,越小,则液面越容易展平。
二、正丁醇表面张力的实验研究实验方法:威尔逊法测定表面张力实验步骤:1. 准备一个表面张力计,调零。
2. 准备两种液体,分别是正丁醇和甲醇。
3. 抽取少量液体分别滴于两只试管中。
4. 然后将试管接在表面张力计上,直到液面平衡。
5. 根据威尔逊公式计算出求数值。
实验结果:正丁醇表面张力为23.6 mN/m。
三、正丁醇表面张力的影响因素1. 温度:正丁醇表面张力随着温度升高而降低。
这是因为温度升高,分子热运动加剧,使表面分子受到局部拉扯力降低,表面张力也随之降低。
2. 杂质:正丁醇中含有杂质可以影响表面张力的大小和稳定性。
杂质能够破坏正丁醇表面的分子排列,使分子分布不均匀,从而影响表面张力。
3. 溶质:溶质的存在也会影响正丁醇表面张力。
当溶质分子尺寸小于正丁醇分子时,会占据液体表面的空位,导致正丁醇表面的张力变小。
四、正丁醇表面张力的应用正丁醇的表面张力在其应用中具有重要的作用。
在工业中,正丁醇被广泛应用于涂料、树脂、荧光增白剂、合成材料等领域。
在这些应用中,正丁醇的表面张力直接影响产品的抗水性、附着力和混合性。
五、总结正丁醇表面张力的研究,对于了解其物理性质和优化应用性能具有重要的意义。
通过实验可以发现,正丁醇的表面张力大小受到温度、杂质、溶质等多个因素的影响。
在工业中,正丁醇表面张力的大小也是影响产品性能的一个关键因素。
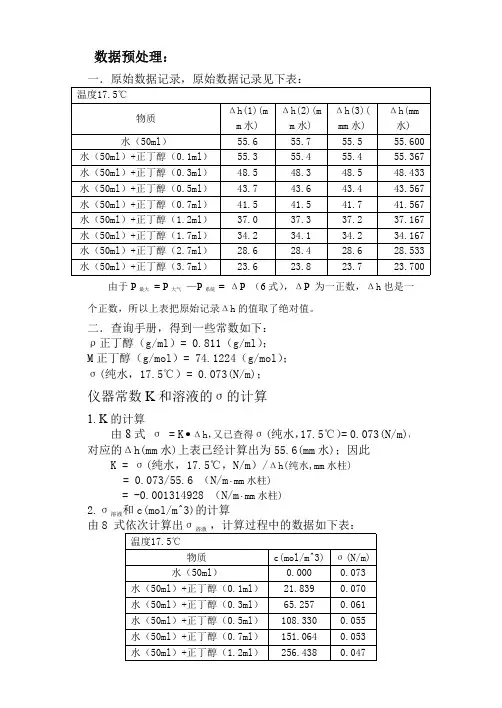
数据预处理:一.原始数据记录,原始数据记录见下表:温度17.5℃物质Δh(1)(mm水)Δh(2)(mm水)Δh(3)(mm水)Δh(mm水)水(50ml)55.655.755.555.600水(50ml)+正丁醇(0.1ml)55.355.455.455.367水(50ml)+正丁醇(0.3ml)48.548.348.548.433水(50ml)+正丁醇(0.5ml)43.743.643.443.567水(50ml)+正丁醇(0.7ml)41.541.541.741.567水(50ml)+正丁醇(1.2ml)37.037.337.237.167水(50ml)+正丁醇(1.7ml)34.234.134.234.167水(50ml)+正丁醇(2.7ml)28.628.428.628.533水(50ml)+正丁醇(3.7ml)23.623.823.723.700由于P最大=P大气—P系统=ΔP(6式),ΔP为一正数,Δh也是一个正数,所以上表把原始记录Δh的值取了绝对值。
二.查询手册,得到一些常数如下:ρ正丁醇(g/ml)=0.811(g/ml);M正丁醇(g/mol)=74.1224(g/mol);σ(纯水,17.5℃)=0.073(N/m);仪器常数K和溶液的σ的计算1.K的计算由8式σ=K•Δh,又已查得σ(纯水,17.5℃)=0.073(N/m),对应的Δh(mm水)上表已经计算出为55.6(mm水);因此K=σ(纯水,17.5℃,N/m)/Δh(纯水,mm水柱)=0.073/55.6(N/m⋅mm水柱)=-0.001314928(N/m⋅mm水柱)2.σ溶液和c(mol/m^3)的计算由8式依次计算出σ溶液,计算过程中的数据如下表:温度17.5℃物质c(mol/m^3)σ(N/m)水(50ml)0.0000.073水(50ml)+正丁醇(0.1ml)21.8390.070水(50ml)+正丁醇(0.3ml)65.2570.061水(50ml)+正丁醇(0.5ml)108.3300.055水(50ml)+正丁醇(0.7ml)151.0640.053水(50ml)+正丁醇(1.2ml)256.4380.0470.030.040.050.060.070.08s (N /m )c(mol/m^3)水(50ml)+正丁醇(1.7ml)359.7740.043水(50ml)+正丁醇(2.7ml)560.5630.036水(50ml)+正丁醇(3.7ml)753.8740.030计算机处理过程一.σ-c 数据处理及散点图表1σ-c 数据处理表格温度17.5(℃)物质σ(N/m)c(mol/m^3)水(50ml)0.0731********0.000000000水(50ml)+正丁醇(0.1ml)0.07280318345321.83904562水(50ml)+正丁醇(0.3ml)0.06368634892165.25663135水(50ml)+正丁醇(0.5ml)0.057287032374108.3303154水(50ml)+正丁醇(0.7ml)0.054657176259151.0641676水(50ml)+正丁醇(1.2ml)0.048871492806256.4381685水(50ml)+正丁醇(1.7ml)0.044926708633359.7739875水(50ml)+正丁醇(2.7ml)0.037519280576560.5631311水(50ml)+正丁醇(3.7ml)0.0311********753.8740943用上表中的数据画σ-c 散点图,并拟合如下拟合曲线类型Log3P1:图1σ-c 散点图-100100200300400500600700800-0.00020-0.00018-0.00016-0.00014-0.00012-0.00010-0.00008-0.00006-0.00004-0.000020.00000d s /d c (N *m o l ^-1*m ^4)c(mol/m^3)Origin 7.5在拟合过程中计算出的部分参数如下:Model:Log3P1Equation:y =a -b*ln(x+c)Weighting:y No weighting Chi^2/DoF R^2----------------------------------------4.5064E-70.99838----------------------------------------Parameter Value Error ----------------------------------------a 0.157110.00681b 0.018650.00103c 89.986812.41971----------------------------------------二.求dσ/dc用origin 7.5对图1的拟合曲线求出它的斜率曲线如下图:图2dσ/dc 曲线求算出dσ/dc 的部分数据如下表2:表2dσ/dc 的部分数据c(mol/m^3)dσ/dc(N*mol^-1*m^4)c(mol/m^3)dσ/dc(N*mol^-1*m^4)0.00000-2.93368E-04383.32581-3.50175E-0512.77753-2.63933E-04396.10334-3.40025E-0525.55505-2.14925E-04408.88086-3.30448E-0538.33258-1.81389E-04421.65839-3.21395E-0551.11011-1.56959E-04434.43592-3.12825E-0563.88764-1.38355E-04447.21345-3.04700E-0576.66516-1.23709E-04459.99097-2.96987E-0589.44269-1.11876E-04472.76850-2.89655E-05102.22022-1.02113E-04485.54603-2.82676E-05114.99774-9.39214E-05498.32355-2.76026E-05三.由dcd σ•−=R c Γ求得部分Γ如下表3Γ的部分数据c(mol/m^3)Γ(mol*m^-2)c(mol/m^3)Γ(mol*m^-2)0.000000.00000E+00383.32581 5.59916E-0612.77753 1.40673E-06396.10334 5.61810E-0625.55505 2.29105E-06408.88086 5.63599E-0638.33258 2.90034E-06421.65839 5.65288E-0651.11011 3.34629E-06434.43592 5.66888E-0663.88764 3.68707E-06447.21345 5.68404E-0676.66516 3.95612E-06459.99097 5.69845E-0689.44269 4.17399E-06472.76850 5.71215E-06102.220224.35399E-06485.546035.72518E-06四.由表3的Γ求出C/Γ与C 的部分关系如下表4:表4C/Γ与C 的部分关系c(mol/m^3)C/Γc(mol/m^3)C/Γc(mol/m^3)C/Γ12.777534349439.853370.5482887394634.523587.76624138659017.97425.555055488380.616383.3258190410404.005689.98646162780250.94038.332588698864.235396.1033493426386.767702.76399165796334.96551.1101111803658.101600.54377141674531.909715.54151168810855.39963.8876414870867.918613.32130144689597.028728.31904171825885.64376.6651617920033.854626.09882147704528.022741.09657174841754.18889.4426920959282.653638.87635150720410.956753.87409176361119.525102.2202223992240.753651.65388153735311.867408.8808696442042.788114.9977427021196.830664.43141156750618.534421.6583999457842.2520.00E+0002.00E+0074.00E+0076.00E+0078.00E+0071.00E+0081.20E+0081.40E+0081.60E+0081.80E+0082.00E+008CC/G127.7752730047267.826600.54377141674531.909434.43592102473888.430140.5528033071242.628613.32130144689597.028447.21345105489399.423153.3303236093706.738626.09882147704528.022459.99097108505000.355166.1078539115010.037677.20893159765407.983472.76850111520320.124178.8853842135308.641357.7707684378634.915485.54603114536105.023191.6629145154954.153408.8808696442042.788498.32355117551473.522204.4404348173906.620421.6583999457842.252511.10108120566817.527217.2179651192433.532434.43592102473888.430523.87861123582099.885229.9954954210528.533447.21345105489399.423536.65613126597873.409242.7730157228250.364459.99097108505000.355549.43366129613210.797255.5505460245687.638472.76850111520320.124562.21119132628076.360268.3280763262912.413485.54603114536105.023574.98872135643437.554293.8831269296701.397511.10108120566817.527600.54377141674531.909306.6606572313352.159523.87861123582099.885613.32130144689597.028319.4381875329796.115536.65613126597873.409626.09882147704528.022332.2157078346183.172549.43366129613210.797638.87635150720410.956344.9932381362505.490562.21119132628076.360651.65388153735311.867五.拟合C/Γ与C 的直线:用表4的数据作C/Γ与C 的直线并拟合该曲线得到一条直线如下图3,在拟合过程中计算出的部分参数也已经给出,在图3下面。

溶液表面张力的测定测定姓名:夏胜军 学号:2015011944 班级:材52 同组:韦尧洁 实验日期:2016年11月17日 提交报告日期:2016年11月22日助教:段炼1 引言1.1 实验目的1.1.1 测定不同浓度正丁醇溶液的表面张力。
1.1.2 根据吉布斯公式计算正丁醇溶液的表面吸附量。
1.1.3 掌握用最大气泡法测定表面张力的原理和技术。
1.2 实验原理在液体内部,任何分子受周围分子的吸引力是平衡的。
可是表面层的分子受内层分子的吸引与受表面层外介质的吸引并不相同,所以,表面层的分子处于力不平衡状态,表面层的分子比液体内部分子具有较大势能,如欲使液体产生新的表面,就需要对其做功。
在温度、压力和组成恒定时,可逆地使表面积增加dA 所需做的功为γdA =δW - (1)比例系数γ表示在等温等压下形成单位表面所需的可逆功,其数值等于作用在界面上每单位长度边缘的力,称为表面张力。
纯物质表面层的组成与内部的组成相同,因此纯液体降低表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质使溶剂表面张力发生变化,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,表面层溶质的浓度比内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
显然,在指定的温度和压力下,溶质的吸附量与溶液的浓度及溶液的表面张力随浓度的变化率有关,从热力学方法可知它们之间的关系遵守吉布斯公式:p T dc d RT c ,⎪⎭⎫ ⎝⎛-=Γγ (2) 式中:Γ为表面吸附量(mol •m -2);γ为表面张力(N •m -1);c 为溶质的浓度(-3m mol ⋅);T 为热力学温度(K );R 为摩尔气体常数(8.314-1K mol J ⋅⋅)。
Γ值可正可负,正值为正吸附,负值为负吸附。
显然,Γ不仅能表明吸附的性质,而且其值还能说明表面吸附的程度:Γ=0表明无吸附现象;其值越远离0,表明吸附程度越大。




正丁醇溶液表面张力测定的数据处理表1 原始数据记录及数据处理c/(mol·dm -3)Δp/(kPa )表面张力/(N·m -1)σ吸附量×106/Γ(mol·m -2)710-⨯Γc0.7440.072140.0000/0.020.6990.067781.56971.27420.050.6430.062353.02991.65020.10.5790.056144.39172.27700.150.5390.052265.16562.90380.200.4950.048005.66473.53060.250.4490.043546.01334.15740.300.4330.041986.27064.78420.350.4040.039176.4683 5.4110 自定义c ~σ函数拟合根据经验公式进行自定义函数拟)21ln(100P cP +⨯⨯-=σσσ合;拟合结果:P2=81.63965; P1=0.27398吸附量Γ表面吸附量由Gibbs 吸附等温式将上述公式求导后整理并进Γ行计算得到T dc d RT c ⎪⎭⎫ ⎝⎛-=Γσ210P c c RT P +⨯=σ曲线线c c~Γ性拟合计算饱和吸附量∞Γ线性拟合直线的斜率为125360.0;取倒数得到饱和吸附量Γ∞为7.97706E-06 mol·m -2被测分子的横截面积S 0L S ⋅Γ=∞10;S 0=2.01219E-19m 2(1)由原始实验数据根据式①求出各浓度下正丁醇溶液表面张力:σ①00σσp p ∆∆=式中各项的含义:为溶液的最大附加压力(取平均值),单位kPa ;p ∆为纯溶剂(水)的最大附加压力(取平均值),单位kPa ;0p ∆为实验温度下纯溶剂(水)的表面张力,可查表得到。
例如 T=298K 时水的0σ表面张力为0.07214 N·m -1为实验温度下溶液的表面张力,单位为N·m -1σ(2)由数据通过origin 绘制散点图如图1所示,并进行自定义函数拟合c ~σ出参数P1和P2的数值表面张力和浓度之间符合下列公式②)21ln(100P cP +⨯⨯-=σσσ式中各项的含义:- 溶液的表面张力,单位为N·m -1σ -纯溶剂的表面张力。


溶液表面张力的测定——最大气泡法周阳 2009030009 生94实验日期:2011年4月16日星期六 提交报告日期:2011年4月23日星期六助教老师:张老师 同组实验同学:曹逸涵1 引言1.1 实验目的1. 用最大气泡法测定不同浓度正丁醇溶液的表面张力。
2. 利用吉布斯公式计算不同浓度下正丁醇溶液的吸附量,进而求出正丁醇分子截面积和饱和吸附分子层厚度。
3. 学会镜面法作切线的方法。
1.2 实验原理1.2.1 表面张力分子在表面层内比在液体内部有较大的势能,这势能就是表面自由能。
在恒温、恒压及组成不变的条件下,使表面积可逆地增加dA ,体系自由能的增量dG 应等于环境对体系所做的表面功−δw ′即dG =−δw ′=γdA (1)式中γ为比例常数,称为比表面自由能,其量纲为J ·m ‐2。
因其量纲又可以写成N /m, 所以γ还可称为表面张力1.2.2 溶液的表面吸附溶质能引起溶剂表面张力的变化,在一定的温度和压力下,吉布斯用热力学的方法推导出了溶液表面吸附量与溶液的表面张力和溶液浓度之间的关系,即Tdc d RT c ⎟⎠⎞⎜⎝⎛−=Γγ (2) 式中Γ为表面吸附量(mol ·m ‐2), γ为溶液的表面张力(J ·m ‐2),T 为热力学温度(K ),c 为溶液的浓度(mol ·dm ‐3),R 为气体常数。
由吉布斯吸附等温式可看出,只要测得某—温度下不同浓度溶液的表面张力,以γ~ c 作图,在γ~c 的曲线上作不同浓度下的切线,可获得不同浓度所对应的斜率Tdc d ⎟⎠⎞⎜⎝⎛γ,将斜率代入(2)式中,即可求出不同浓度时气一液界面上的吸附量Γ。
1.2.3 饱和吸附量和溶质分子的横截面积在一定的温度下,吸附量Γ与浓度c 之间的关系,可用Langmuir 吸附等温式表示KcKc+Γ=Γ∞1 (3)式中Γ∞ 为饱和吸附量,K 为经验常数,其值与溶质的表面活性大小有关。
实验名称:最大气泡压力法测定正丁醇溶液的表面张力实验目的:1. 进一步熟悉恒温槽的使用;2. 了解溶液的表面吸附对表面张力的影响;3. 学会用气泡最大压力法测定液体的表面张力;4. 测定不同浓度下正丁醇溶液的表面张力,作σ ~ C 曲线,进而求得表面吸附量和正丁醇分子的截面积。
实验原理:据Gibbs 吸附等温式:C d RT dCσΓ=-(其中σ —表面张力,Γ—表面超量),极性有机物和表面活性物质,dC>0时d σ<0,则Γ >0,发生正吸附,即表层浓度大于本体浓度。
其σ ~ C 是一条曲线,曲线上某点作切线,切线斜率即d σ /dC ,可求得此浓度时的表面超量Γ。
又溶液表面吸附是单分子层吸附,符合Langmuir 吸附等温式,即1bC bC∞Γ=Γ+,可转换成11C C b ∞∞=+ΓΓΓ,以C /Γ ~ C 作图,可得一直线,其斜率倒数即为饱和吸附量Γ∞,每个分子在溶液表面所占的截面积1Aq N ∞=Γ⋅。
本实验采用最大气泡法测定溶液的表面张力,当外管压力下降时,外界大气通过毛细管进入,在管底端形成弯曲液面,并且弯曲程度越来越大,直至形成一个气泡,气泡最完整最大时,曲率半径最小,等于毛细管半径,此时产生的附加压力2p r σ∆=最大。
气泡外围的压力00p p p p =-∆=-真空度,则p ∆=真空度,即读数。
对水有2p rσ∆=水水,溶液有2p rσ∆=液液,则p p σσ∆=⨯∆液液水水。
实验步骤:1.恒温槽调节——装配好恒温槽,在水槽中加入5/6的水量,设定好控制温度(一般要比环境温度高5 ~ 10℃),并开启恒温槽;2. 玻璃仪器清洗——将毛细管插入洗涤剂溶液中,至少浸泡10 min ,取出,套在橡皮管中冲洗干净;将二通试管用洗涤剂清洗,并冲洗干净,然后二者用蒸馏水润洗,备用。
3. 表面张力测定装置准备——在二通试管中装入蒸馏水,插入毛细管,塞紧塞子,将多余的水通过二通排出,直至毛细管末端与水相切。
测定正丁醇溶液中的吸附作用和表面张力——最大气泡压力法 PB10。
中国科学技术大学材料科学系摘要:本实验利用最大气泡压力法测定了液体表面张力,即测定气体从毛细管口逸出时的气压,此时气压的作用力略大于毛细管口溶液的表面张力;并通过对不同浓度下表面活性物质正丙醇溶液的表面张力和浓度之间的关系,求得溶液界面上的吸附量和单个正丁醇分子的截面积。
关键词:吸附作用表面张力最大气泡压力法表面活性物质序言:液体表面的分子和内部的分子所处的环境不同,因此能量也不同。
根据能量最低原理,溶质能降低溶液的表面张力时,表面层中溶质的浓度应比溶液内部大,反之,溶质使溶液的表面张力升高时,它在表面层中的浓度比在内部的浓度低。
表面张力就是内部分子对表面分子的作用力,它是液体的重要属性之一,与所处的温度、压力、液体的组成共存的另一面的组成等因素都有关。
对于溶液,由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面自由能。
本实验采用最大气泡法法测定液体不同浓度条件下的表面张力,由此计算溶液的表面自由能、最大吸附量、表面活性物质正丁醇的横截面积,并验证了表面化学的相关基础理论。
实验部分:一、实验设计1.在指定温度和压力下,吸附与溶液的表面张力及溶液的浓度有关。
Gibbs 用热力学的方法推导出: Tc RT c ⎪⎭⎫ ⎝⎛∂∂Γσ=- 在已知 σ与c 关系式和c 、T 值后可以求得吸附量 Г。
2.在一定温度下,吸附量与溶液浓度之间的关系由Langmuir 等温式表示:Kc1Kc +=∞ΓΓ ∞Γ为饱和吸附量,K 为经验常数,与溶质的表面活性大小有关。
将上式转化为直线方程,有: ∞Γ∞ΓΓK 1c c +=若以Γc~c 做图可得一条直线,由直线斜率可得∞Γ。
在饱和吸附的情况下,正丁醇分子在气-液界面上铺满一层单分子层,则可用下式来求正丁醇分子的横截面积:AN 1So ∞Γ= 3.最大气压法测微压差:当表面张力仪中的毛细管截面与欲测液面相齐时,液面沿毛细管上升。