粗蛋白检测方法
- 格式:docx
- 大小:21.70 KB
- 文档页数:1

实验步骤⑴消化称取经粉碎通过(40-60)目式样(0.5-1)g(视含氮量而定)无损地置入已洗涤烘干的试管中加催化剂一片和10ml硫酸。
将消化管分别放入消化架各个孔内,然后置于消化炉上,然后开启抽吸泵水阀,使抽吸泵处于抽吸状态。
接通电源,在加热初始阶段,须注意观察,防止式样因急沸而飞溅。
(电压调至180V-200V温度不宜太高)。
消化反应过程主要如下:(蛋白质)R·C·H·NH2·COOH+H2SO4→CO2+SO2+NH3+H2O2NH3+H2SO4→(NH4)2SO4⑵蒸馏分别用橡皮管与各进出水连接,出水口,排水口用橡胶管连接后置入水池中。
冷却水接口与自来水龙头连接,H2O、NaOH输入接口与橡胶管连接后分别置入蒸馏水、氢氧化钠盛器桶内,并关闭开关阀门。
打开电源开关,H2O开关,蒸馏水即自动进入发生炉内,达到一定液位高度,受液位控制器控制停止进水,进入电加热状态。
在250ml锥形瓶中加入2%的硼酸,50ml和(2-3)滴混合指示剂1,将该瓶套在接收管上,并让管口浸没在硼酸溶液液面以下。
取消化冷却后的消化试管置入适量的H2O后,扳动蒸馏消化管托盘架,使消化管固定在蒸馏器托盘架上,开启NaOH开关,注入50ml氢氧化钠溶液。
蒸馏器内冷却水经稳压器流入蒸汽发生炉内,炉内因水位上升使电极圈产生电流,炉内蒸馏水经(1-2)min加热后,水被煮沸产生的蒸汽进入消化管内,对以消煮的样品进行蒸馏,将消化过程中产生的硫酸铵转化成氨并与接收瓶里的硼酸溶液反应生成硼酸氢铵,待接收瓶液面高于150ml时,将接收瓶下移,使接收管离开液面,用蒸馏水冲洗出气口,取下接收瓶待滴定。
蒸馏过程的主要反应如下:(NH4)2SO4+2NaOH→Na2SO4+2NH4OH2NH4OH→2NH3+2H2ONH3+4H3BO3→NH4HB4O7+5H2O⑶滴定用0.1mol/l的标准盐酸溶液滴定吸收,溶液有蓝绿色变成紫红色为滴定终点。

发酵饲料检测指标发酵饲料是一种比较常见的饲料类型,由于其具有营养成分高、易保存、易消化等特点,备受畜牧业者的青睐。
但是,如果不进行检测,随意选择发酵饲料,可能会对牲畜的身体健康造成影响。
本文将从发酵饲料的检测指标、检测方法以及检测过程中需要注意的事项等方面,来为大家介绍发酵饲料检测相关知识。
1. 检测指标(1)干物质含量干物质含量是指饲料中除去水分后的重量占总重量的比例,是发酵饲料的一项重要指标。
因为,干物质含量的高低会直接影响到饲料的口感、营养成分以及饲用量等因素。
(2)粗蛋白粗蛋白是指饲料中的氮元素乘以6.25,得出的含量值。
作为发酵饲料检测中的一个指标,粗蛋白含量的高低可以反映出饲料中蛋白质的含量,如果饲料中粗蛋白含量高,则饲用量可以相应减少,反之就需要增加。
(3)酸价酸价是指单位质量饲料当中自由脂肪酸的含量。
酸价的高低,对饲料的发酵质量有着重要的影响,因此需要加以管控。
2. 检测方法(1)干物质含量的检测方法将饲料放入预热好的干燥器中,通过称重对饲料进行干燥,然后计算出干燥后的饲料总重量即可计算出干物质含量。
(2)粗蛋白的检测方法将饲料样品中的氮元素含量测定出来,然后根据粗蛋白的定义计算出其含量即可。
(3)酸价的检测方法取一定数量的发酵饲料样品,加入适量盐酸后进行振荡,在一定时间后取出样品,用碱液滴定到中性,然后根据滴定用量算出酸价。
3. 注意事项(1)要选择合适的检测仪器,比如恒温器、溶液计等,确保检测结果的准确性。
(2)检测样品的数量必须充分,保证检测结果的代表性。
(3)在操作过程中要严格按照操作规程进行,确保整个检测过程的严谨性。
综上所述,发酵饲料检测是一项非常重要的工作。
对于畜牧业者来说,选用好的发酵饲料不仅可以为牲畜的身体健康带来保障,还可以提高养殖效益,提高经济效益。
因此,掌握好发酵饲料检测的技术和方法,加强对发酵饲料品质的监测,可以有效地提高牲畜的食品安全质量,保证畜牧业的健康发展。

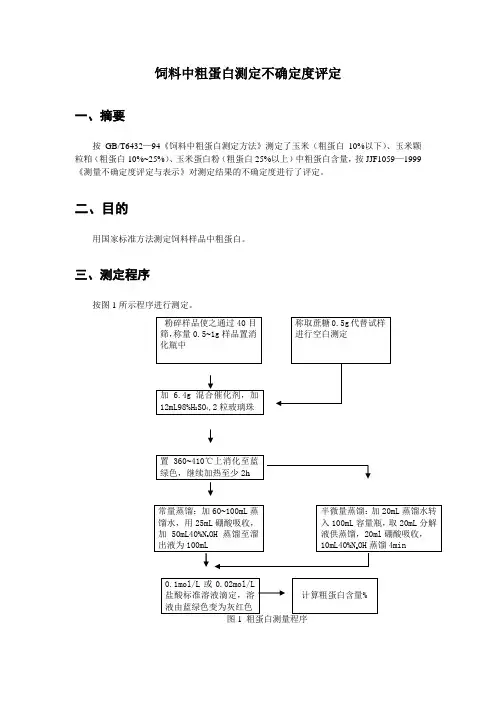
饲料中粗蛋白测定不确定度评定一、摘要按GB/T6432—94《饲料中粗蛋白测定方法》测定了玉米(粗蛋白10%以下)、玉米颗粒粕(粗蛋白10%~25%)、玉米蛋白粉(粗蛋白25%以上)中粗蛋白含量,按JJF1059—1999《测量不确定度评定与表示》对测定结果的不确定度进行了评定。
二、目的用国家标准方法测定饲料样品中粗蛋白。
三、测定程序按图1所示程序进行测定。
图1 粗蛋白测量程序四、被测量粗蛋白含量以占样品质量的百分比表示式中:V 1—滴定试样时所需酸标准溶液体积,mL ; V 2—滴定空白时所需酸标准溶液体积,mL ; C — 酸标准溶液浓度,mol/L ; m — 试样质量,g ;V — 试样分解液总体积,mL ; V 3—试样分解液蒸馏用体积,mL ; 0.0140— 每毫摩尔质量氮的克数;6.25— 氮换算成蛋白质的平均系数。
五、不确定度来源分析不确定度来源见图2— 因果关系图图2 因果关系图10025.60140.0)(321⨯⨯⨯⨯⨯-=Vm C V V P称样m滴定试样(空白)用标液体积V 1、V 2重复性(r)摩尔质量M(N)六、不确定度分量的量化1、 标准溶液浓度标准溶液浓度不确定度是测量不确定度的主要分量之一,同时,标准溶液浓度不确定度也是由多个分量合成所得,按GB601—88《化学试剂 标准溶液制备方法》,使用的盐酸标准溶液是采用标定法配制而成,下面详细描述配制过程。
1.1目的以无水碳酸钠(Na 2CO 3)基准标定0.1mol/L (或0.02mol/L )盐酸溶液。
1.2标定程序见图3,按GB601—88标准有标定程序框图图3 标定程序框图 1.3被测量按下式计算盐酸标准溶液的浓度(GB601-88)05299.0)V V (m C 21⨯=-式中:m —无水碳酸钠质量,g;V 1—滴定用盐酸溶液体积,mL;量取9mL 盐酸注入1000mL 水中V 2—空白试验用盐酸溶液体积,mL;0.05299—每1/2毫摩尔质量碳酸钠的克数。

粗蛋白的测定原理粗蛋白测定的原理是通过测定样品中的总蛋白质含量来确定粗蛋白的含量。
粗蛋白是指除了溶解蛋白和酵素蛋白以外的所有蛋白质,包括结构蛋白、转运蛋白、调节蛋白等。
粗蛋白测定的常用方法有低里氏法、比色法和光学比较法等。
这些方法都是基于蛋白质与某些试剂反应的原理来进行测定的。
低里氏法是一种常用的粗蛋白测定方法,利用碱性铜试剂与蛋白质反应生成络合物,在碱性条件下形成紫色产物,并通过比色法测定溶液中产生的颜色强度来确定蛋白质的含量。
低里氏法的基本原理是蛋白质中的组氨酸在碱性条件下与铜离子发生氧化还原反应,生成紫色络合物。
比色法是另一种常用的粗蛋白测定方法,常常结合使用布拉德福德试剂。
该方法通过蛋白质与染料(如考马斯亮蓝G250)之间的相互作用,形成可见光吸收的复合物进而测定蛋白质的含量。
这种相互作用通常是在酸性环境下进行的,可通过比色计或分光光度计来测定样品的吸光度。
光学比较法是一种简便、快速的粗蛋白测定方法,利用样品和标准品之间的光学密度差来测定样品中粗蛋白的含量。
该方法的原理是利用蛋白质在特定波长下的吸光度差异,通过比较样品与标准品的吸光度差来确定样品中的蛋白质含量。
除了以上的方法,还有其他一些测定粗蛋白的方法,如比重法、稀释法、氮定量法等。
这些方法都有各自的优缺点和适用范围,选择合适的方法要考虑样品性质、测定的目的和实验室的设备条件等因素。
需要注意的是,粗蛋白测定方法都是在一定的实验条件下进行的,所以在进行测定时应尽量控制实验条件的一致性以确保测定结果的准确性。
此外,不同的方法对不同类型的蛋白质可能存在一定的选择性,因此在选择方法时也要考虑样品中可能存在的其他干扰物的影响。
总之,粗蛋白测定是确定样品中总蛋白质含量的方法,不同的测定方法基于不同的原理进行测定,样品的选择和实验条件的控制都对测定结果有影响。
因此,在进行粗蛋白测定时应综合考虑不同的因素,选择合适的方法来获得准确的测定结果。

实验三、饲料中粗蛋白质的测定【学习目标】掌握饲料中粗蛋白质的测定方法,并能用此方法测定饲料中粗蛋白质的含量。
一、原理饲料中纯蛋白质和非蛋白氮总称粗蛋白质。
凯氏法的基本原理是用浓H2SO4在催化剂(CuSO4、K2SO4、Na2SO4等)的催化作用下消化饲料样本,使其中的蛋白质和非蛋白氮都转变为 (NH4)2SO4,(NH4)2SO4在浓碱作用下放出NH3,通过蒸馏,氨气随水蒸汽沿冷凝管流入硼酸吸收液被硼酸吸收并与之结合成为四硼酸铵,然后以甲基红、溴甲酚绿作指示剂,用标准HCL溶液滴定,求出氮含量,根据氮含量再乘以系数(通常为 6.25),即为粗蛋白质的含量。
上述原理的主要化学反应如下:催化剂1.2CH3CHNH2COOH+13H2SO (NH4)2SO4+6CO2↑+12SO2↑+16H2O加热2.(NH4)2SO4+2NaOH 2NH3↑+2H2O+Na2SO43.4H3BO3+NH3 NH4HB4O7+5H2O4.NH4HB4O7+5H2O+HCL NH4CL+4H3BO3系数6.25是根据饲料蛋白质平均含氮量为16.0%而来的,而实际上,各种样本的蛋白质种类不同,含氮量有差异,变动为14.7~19.5%之间,故一般饲料换算系数用6.25,已确定的最好用实际系数。
为方便使用,将已知几种饲料的系数介绍如下:肉类6.25,玉米6.00,小麦、燕麦、黑麦、大豆、箭舌豌豆、蚕豆5.70,牛奶及制品6.28,坚果及油饼类5.30。
二、仪器设备1.样品粉碎机 40目分样筛;2.分析天平感量0.0001g;3.电子天平感量0.0001g;4.工业天平感量0.01g;5.六联电炉 6×800-1000W;6.半微量凯氏定氮仪或改良式半微量凯氏定氮仪(图1、图2);7.酸式滴定管 25.0ml或50.0ml;8.凯氏烧瓶 100.0ml;9.烧杯 250.0ml;10.三角瓶 150.0ml;11.容量瓶 100.0ml;12.移液管 10.0ml;13.量筒 10.0ml、25.0ml。




饲料粗蛋白的检测方法(凯氏半微量定氮法)1 原理凯氏法测定试样含氮量,即在催化剂存在下,用浓硫酸破坏有机物,使含氮物转化成硫酸铵,加入强碱(NaOH)并蒸馏使氨逸出,用硼酸吸收后,用标准盐酸溶液滴定测出含氮量,将结果乘以换算系数6.25,计算出粗蛋白质含量。
2 仪器设备2.1实验室用样品粉碎机或研钵2.2分样筛:孔径0.45mm(40目)2.3分析天平:感量0.0001g2.4消煮炉或电炉2.5滴定管:酸式25mL2.6凯氏烧瓶:100mL2.7凯氏蒸馏装置:半微量水蒸汽蒸馏式2.8锥形瓶:150mL2.9容量瓶:100mL3 试剂3.1硫酸:分析纯3.2硫酸铜:分析纯3.3硫酸鉀:分析纯3.4硒粉:分析纯3.5氢氧化钠:分析纯40g溶于100mL蒸馏水配成40%水溶液。
3.6硼酸:分析纯2g溶于100mL蒸馏水配成2%水溶液。
3.7混合指示剂:甲基红分析纯0.1%乙醇溶液,溴甲酚绿分析纯0.5%乙醇溶液,两溶液等体积混合,阴凉处保存期三个月以内。
3.8 0.02N盐酸标准溶液:1.67mL盐酸分析纯溶于1000mL 蒸馏水中。
3.8.1 0.02N盐酸标准溶液的标定(碳酸钠法)精确称取0.04g于270—300°C灼烧至恒重的基准级无水碳酸钠,准确至蒸馏水(新做蒸馏水或蒸0.0001g,无损失地转入100 mL三角瓶中,加入无CO2馏水煮沸数分钟放凉后使用)50mL溶解,并加入混合指示剂10滴,用盐酸标准溶液滴定至溶液由绿色变为暗红色,煮沸2分钟,冷却后继续滴定至溶液呈暗红色,同时做空白试验。
3.8.2盐酸标准溶液当量浓度的计算GN =(V1-V2)×0.05299式中:G——无水碳酸钠的重量,g;V1——盐酸标准溶液消耗的体积,mL;V2——空白试验所消耗盐酸标准溶液的体积,mL;0.05299——每毫克当量碳酸钠的克数;注:标定各浓度间的相对偏差不大于0.2%。
3.9蔗糖:分析纯3.10硫酸铵:分析纯,干燥。

粗蛋白的测定方法
粗蛋白的测定可以使用以下几种方法:
1. Kjeldahl法:将样品中的蛋白质分解为氨基酸,然后用酸溶液将氨基酸转化为氨,再用碱滴定氨生成的酸,通过计算氨的含量来测定粗蛋白含量。
2. 比色法:利用蛋白质与某些特定试剂反应产生色素,通过测量产生的色素的吸光度来测定粗蛋白含量。
常用的试剂有布鲁斯试剂、费氏试剂等。
3. 紫外吸收法:通过测量蛋白质在特定波长下的紫外吸光度来测定粗蛋白含量。
蛋白质在280 nm处有吸光峰,可以利用这个波长进行测定。
4. 生物传感器法:利用特殊的生物传感器,如免疫传感器或酶传感器,通过与蛋白质特异性结合或酶催化反应来测定粗蛋白含量。
这种方法具有高灵敏度和高选择性。
需要注意的是,不同的测定方法适用于不同类型的样品和需要测定的蛋白质组分,选择合适的方法根据实际情况进行。
粗蛋白测定国标(最新版)目录1.粗蛋白测定的概述2.粗蛋白测定的国标方法3.粗蛋白测定的重要性4.粗蛋白测定的实际应用正文1.粗蛋白测定的概述粗蛋白测定是一种常用的蛋白质检测方法,主要通过测量样品中蛋白质的总含量,从而得出粗蛋白的含量。
在农业、食品和饲料行业中,粗蛋白含量是衡量产品营养价值的重要指标,因此在这些领域中,粗蛋白测定具有重要的应用价值。
2.粗蛋白测定的国标方法在我国,粗蛋白测定的国标方法主要采用凯式定氮法。
该方法的原理是将样品中的蛋白质通过酸消化,转化为含氮物质,然后通过测定含氮物质的含量,最终计算出样品中的粗蛋白含量。
凯式定氮法具有操作简便、结果准确等优点,因此在我国的粗蛋白测定中得到了广泛应用。
3.粗蛋白测定的重要性粗蛋白测定在农业、食品和饲料行业中具有重要的意义。
首先,在农业生产中,通过测定作物的粗蛋白含量,可以评估作物的营养价值,从而指导农业生产和肥料施用。
其次,在食品工业中,粗蛋白含量是衡量食品营养价值的重要指标,对于保障食品安全和营养价值具有重要作用。
最后,在饲料行业中,粗蛋白含量是衡量饲料营养价值的重要指标,对于保证动物的生长发育和健康具有重要意义。
4.粗蛋白测定的实际应用粗蛋白测定在实际应用中具有广泛的应用价值。
在农业生产中,通过测定作物的粗蛋白含量,可以指导农民科学施肥,提高作物产量和品质。
在食品工业中,通过对食品的粗蛋白测定,可以评估食品的营养价值,为消费者提供健康、安全的食品。
在饲料行业中,通过测定饲料的粗蛋白含量,可以保证动物的生长发育和健康,提高饲料的利用率。
总之,粗蛋白测定在农业、食品和饲料行业中具有重要的应用价值。
杜马斯燃烧法测定粗蛋白
杜马斯燃烧法是一种测定样品中粗蛋白的方法,其原理是通过燃烧样品来释放其中的氮,然后测定氮的含量,从而计算出粗蛋白的含量。
这种方法具有较高的准确性和快速性,因此在许多领域得到了广泛应用。
在测定过程中,首先需要称取一定量的样品,并将其置于燃烧管中。
然后,在高纯氧气的环境下,将样品进行燃烧,使样品中的氮元素转化为氮氧化物。
接着,通过还原管将氮氧化物还原为氮气,并使用热导检测器测定氮气的含量。
最后,根据氮的含量和样品的质量,可以计算出样品中粗蛋白的含量。
杜马斯燃烧法具有许多优点,如测定速度快、准确度高、操作简便等。
此外,该方法还可以测定其他元素,如碳、氢、硫等,因此具有广泛的应用范围。
该方法已经被美国、德国、英国、日本等发达国家采用,作为饲料粗蛋白含量的官方测定方法。
在测定过程中,需要注意一些细节,如样品的处理、燃烧条件的控制等,以确保测定结果的准确性和可靠性。
此外,还需要注意该方法可能存在的误差和干扰因素,如样品中其他元素的干扰、燃烧不完全等,需要进行相应的校正和处理。
总之,杜马斯燃烧法是一种准确、快速、简便的测定粗蛋白的方法,在农业、食品、饲料等领域得到了广泛应用。
在实际应用中,需要注意细节和误差的处理,以确保测定结果的准确性和可靠性。
粗蛋白检测操作方法
1. 样品制备
首先,需要根据实验需要选择合适的样品进行制备,可以是动物组织、细胞、血清、尿液等。
样品的含量要足够,一般为0.1~1克的蛋白质。
2. 粗蛋白提取
将样品剁碎后,加入提取缓冲液,放置冰上30min左右,然后离心,收集上清液,即为粗蛋白提取液。
3. BCA或Lowry检测
将粗蛋白提取液分别与BCA或Lowry试剂混合,放置反应30min,利用分光光度计测定其吸光值。
从标准曲线中读取蛋白质含量。
4. SDS-PAGE分析
将粗蛋白提取液进行SDS-PAGE分析,检测其分子量和保真性,评价提取方法的质量。
饲料检测标准国标方法
饲料检测标准国标方法主要包括以下几个方面:
一、饲料中粗蛋白的测定方法
国标方法主要采用凯氏消解法和凯氏氮测定法,其中凯氏消解法是将样品加入到硫酸和过氧化氢的混合液中,加热消解后,用凯氏氮测定法测定样品中的氮含量,从而计算出样品中的粗蛋白含量。
二、饲料中粗脂肪的测定方法
国标方法主要采用苯/氯仿提取法和重量法测定法,其中苯/氯仿提取法是将样品加入到苯/氯仿混合液中,经过提取后,将提取液蒸干,再用重量法测定样品中的粗脂肪含量。
三、饲料中粗纤维的测定方法
国标方法主要采用酸/碱消解法和热水浸提法,其中酸/碱消解法是将样品加入到酸和碱的混合液中,加热消解后,用滤纸过滤,将残渣洗净后干燥,再用重量法测定样品中的粗纤维含量。
四、饲料中灰分的测定方法
国标方法主要采用干燥法和燃烧法,其中干燥法是将样品放入烘箱中干燥,再用重量法测定样品中的灰分含量;燃烧法是将样品放入燃烧炉中燃烧,再用重量法测定样品中的灰分含量。
以上就是饲料检测标准国标方法的主要内容,这些方法都是经过科学验证和实践检验的,能够准确地测定饲料中各项指标的含量,为饲料生产和质量控制提供了有力的技术支持。
饲料中粗蛋白(CP )的测定方法原理各种饲料的有机物质在催化剂的帮助下,用浓硫酸进行消化作用,使蛋白质和氨态氮都转变成氨气,并被浓硫酸吸收变为硫酸铵;其他非含氮物质则以二氧化碳、水、二氧化硫的气体状态逸出。
消化液在浓碱的作用下进行蒸馏,释放出氨气,通过蒸馏随汽水顺着冷凝管流入硼酸吸收液中,并与其结合成硼酸铵,然后以甲基红—溴甲酚绿作混合指示剂,用盐酸标准溶液滴定,求出氮的含量,再乘以一定的换算系数(通常用6.25系数计算),得出样品中粗蛋白质的含量。
1.试剂(1)分析纯98%无氮浓硫酸(2)催化剂:OSS 公司成品催化剂(3)400 g/L 氢氧化钠溶液(4)0.1 mol/L 盐酸标准溶液:量取8.3 mL 盐酸定容至1000 mL 水中。
盐酸浓度的标定:称取已恒重(270~300℃,2 h )的无水碳酸钠0.2 g (精确至0.0001g )溶于50 mL 水,加入10滴混合指示剂,用新配置好的盐酸滴定至紫红色,煮沸2min 冷却后继续滴定至暗红色,消耗盐酸体积记为V 1(保留小数点后两位)。
同时做空白实验,消耗盐酸体积记为V 0。
10()0.05299m c V V =-⨯(结果保留小数点后四位) (6)混合指示剂:1.0 g/L 甲基红乙醇溶液与等体积5.0 g/L 溴甲酚绿乙醇溶液混合。
(7)磷酸二氢铵(参比物)或硫酸铵(8)硼酸吸收液:1000 mL 10.0 g/L 硼酸溶液溶液中,加入1.0 g/L 甲基红—乙醇溶液7 mL ,5.0 g/L 溴甲酚绿—乙醇溶液10 mL 。
2.仪器(1)实验室用样品粉碎机或研钵(2)感量0.0001 g 的分析天平(3)消煮炉或电炉(4)250 mL 消煮管(5)定氮仪3. 操作步骤(1)试样的选取和制备。
取有代表性试样用四分法缩减至200 g ,粉碎过40目筛,装入密封容器中,防止试样成分的变化或变质。
液体或膏状黏液试样应注意取样的代表性。
蛋白质的测定方法
1、原理
蛋白质是含氮有机化合物,与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵,然后在碱性条件下蒸馏使氨游离,用硼酸吸收后再以盐酸标准溶液滴定,根据酸的消耗量再乘以换算系数,即位蛋白质含量。
2、试剂
2.1、硫酸铜
2.2、硫酸钾
2.3、硫酸
2.4、2%硼酸溶液
2.5、混合指示剂:1份0.1%的甲基红与3份0.1%溴甲酚绿混合。
2.6、30%氢氧化钠溶液。
2.7、0.1M 盐酸标准溶液。
3、操作步骤
3.1、样品处理:称取0.1g-0.15g 固体样品置于消化管内再加入0.2g 硫酸铜,3g 硫酸钾及10ml 硫酸,然后放入消化装置中设定温度430℃,消化3h 。
3.2、打开蒸馏装置的电源,开启作为冷凝水的自来水龙头。
3.3、将消化好的消化管置于蒸馏装置的托盘上,落下安全门。
3.4、仪器开启后,按“设定”键光标显示在“换算系数”栏目中输入需要换算的数值6.25。
3.5、按“↑”键将光标移入“碱量”栏目中,输入需要的碱量体积50ml 。
3.6、按“↑”键将光标移入“吸收液量”栏目中,输入需要的吸收液量的体积30ml 。
3.7、按“↑”键将光标移入“样品量”栏目中,输入需要的样品量质量。
3.8、按“↑”键将光标移入“样品编号”栏目中,输入样品编号。
3.9、按“RUN ”键开始蒸馏工作,同时保存设定的参数。
4.0、滴定至终点时,仪器自动停止蒸馏。
4.1、按“保存”键返回主界面,再按“数据键”进去查看数据,选择要查看的样品编号,按“确定”键查看结果。
4、结果
()00.014 6.25100HCl V V C M
-⨯⨯⨯=⨯粗蛋白含量(%) V -样品消耗盐酸标准溶液的体积,单位ml ;
V 0-试剂空白消耗盐酸标准溶液的体积,单位ml ;
M -样品质量,单位g ;
0.014-盐酸标准溶液1ml 相当于氮克数;
6.25-氮换算成蛋白质的平均系数;。