全国高中学生化学竞赛决赛实验试题
- 格式:docx
- 大小:10.10 KB
- 文档页数:2

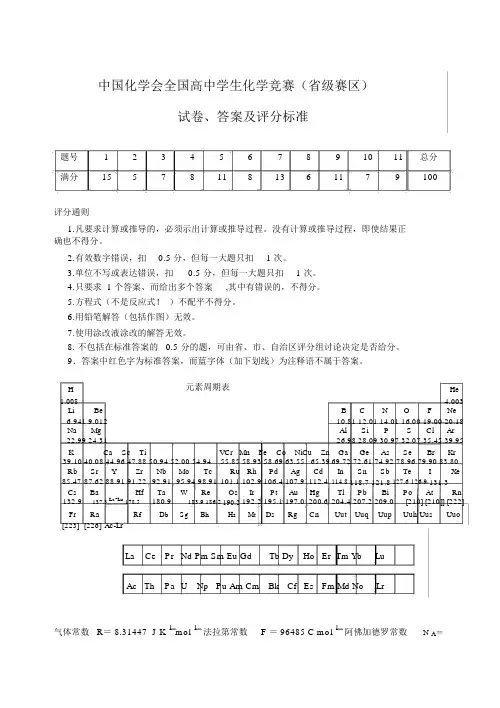
中国化学会全国高中学生化学竞赛(省级赛区)试卷、答案及评分标准题号1234567891011总分满分155781181361179100评分通则1.凡要求计算或推导的,必须示出计算或推导过程。
没有计算或推导过程,即使结果正确也不得分。
2.有效数字错误,扣0.5 分,但每一大题只扣 1 次。
3.单位不写或表达错误,扣0.5 分,但每一大题只扣 1 次。
4.只要求 1 个答案、而给出多个答案,其中有错误的,不得分。
5.方程式(不是反应式!)不配平不得分。
6.用铅笔解答(包括作图)无效。
7.使用涂改液涂改的解答无效。
8.不包括在标准答案的 0.5 分的题,可由省、市、自治区评分组讨论决定是否给分。
9.答案中红色字为标准答案,而蓝字体(加下划线)为注释语不属于答案。
H元素周期表He 1.008 4.003Li Be B C N O F Ne6.941 9.01210.81 12.01 14.01 16.00 19.00 20.18Na Mg Al Si P S Cl Ar22.99 24.3126.98 28.09 30.97 32.07 35.45 39.95K Ca Sc Ti VCr Mn Fe Co NiCu Zn Ga Ge As Se Br Kr39.1040.08 44.96 47.88 50.94 52.00 54.9455.8558.93 58.69 63.5565.3969.72 72.61 74.92 78.96 79.90 83.80Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe85.4787.62 88.91 91.2292.9195.94 98.91101.1102.9 106.4 107.9112.4114.8 118.7 121.8 127.6 126.9 131.3Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.9137.3 La-Lu 178.5180.9183.9 186.2 190.2192.2 195.1 197.0200.6204.4 207.2 209.0[210] [210]] [222]Fr RaAc-Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo[223][226]La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb LuAc Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr气体常数R= 8.31447 J K 1 mol 1法拉第常数 F = 96485 C mol 1阿佛加德罗常数N A=6.022142 ×1023 mol 1第1题 (15分)1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。

全国高中学生化学竞赛实验试题营号从盐泥中提取七水合硫酸镁注意事项:1、实验考试总分计为100分。
实验考试用纸包括“实验试题”和“实验报告”两部分。
实验试题第6页由监考教师逐人发放。
2、实验考试时间为5小时,每超过5分钟扣3分,最长不得超过20分钟。
请考生仔细阅读试题内容,合理安排时间。
可用自备的计算器处理数据。
3、实验前请检查所提供的仪器,若有问题,向监考教师报告。
4、若制备实验失败,可向监考教师索要产品进行分析,但要扣除30分。
若出现制备实验重做,每索要一次原料扣除10分。
分析实验中,平行测定少做一次扣3分,重称1次扣2分。
5、需监考教师签字处,考生务必主动配合,未签字者实验结果按无效论处。
伪造数据者,按零分计。
6、注意安全,必须配戴防护眼镜和手套。
7、废弃物和回收的溶剂应放入指定的容器内。
8、完成全部实验内容后将产品、实验报告和实验试题交给监考教师,并由监考教师签字。
清洗仪器并整理桌面后方可离开考场(清理时间不计入实验时间)。
一、实验内容盐泥是氯碱工业中的废渣,分为一次盐泥和二次盐泥。
一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分,其中含镁(以Mg(OH)2计)约15%。
本实验要求从一次盐泥中提取MgSO4·7H2O。
本实验考试具体内容包括下列三个部分:1、从一次盐泥中提取MgSO4·7H2O。
2、测定MgSO4·7H2O的含量。
3、回答思考题并完成实验报告。
二、物质的某些性质1、K sp [Mg(OH)2]=6.0×10-10K sp [Ca(OH)2]=3.7×10-6K sp [Fe(OH)3]=3.0×10-39 K sp [Fe(OH)2]=8.0×10-16 K sp [Mn(OH)2]=4.0×10-14K sp [Al(OH)3]=1.3×10-332、物质的溶解度(g/100gH2O)3、相对原子质量:H l.01,O 16.00,S 32.07,Mg 24.31,Zn 65.39三、主要试剂和仪器1、试剂各人实验桌上:工业盐泥(26克),6 mol·L-1HCl,1:1 NH3·H2O,铬黑T指示剂,EDTA标准溶液(500 mL)。

化学竞赛决赛试题及答案一、选择题(每题3分,共30分)1. 下列哪种元素的原子序数最小?A. 氢B. 氦C. 锂D. 铍答案:A2. 化学反应中,能量变化通常表现为哪两种形式?A. 光能和热能B. 电能和热能C. 光能和电能D. 机械能和热能答案:A3. 根据元素周期表,下列元素中属于第ⅢA族的是?A. 硼(B)B. 铝(Al)C. 镓(Ga)D. 铟(In)答案:C4. 以下哪个化学式表示的是二氧化硫?A. SO2B. SO3C. SO4D. S2O2答案:A5. 酸碱中和反应的实质是什么?A. 酸碱的离子交换B. 酸碱的电子转移C. 酸碱的质子转移D. 酸碱的分子结合答案:C6. 哪种类型的晶体结构中,原子排列是三维周期性的?A. 非晶态B. 多晶态C. 单晶态D. 混合晶体答案:C7. 根据化学键理论,下列哪种键属于离子键?A. 氢键B. 金属键C. 共价键D. 离子键答案:D8. 以下哪种物质是强酸?A. 醋酸B. 碳酸C. 硫酸D. 氢氧化钠答案:C9. 哪种元素的电子构型是1s²2s²2p⁶3s²3p⁶?A. 氧(O)B. 钠(Na)C. 镁(Mg)D. 硫(S)答案:B10. 以下哪种反应属于氧化还原反应?A. 酸碱中和B. 沉淀形成C. 单质之间的反应D. 同素异形体之间的转化答案:C二、填空题(每题4分,共20分)1. 元素周期表中,第______周期包含的元素种类最多。
答案:六2. 一个水分子(H₂O)中含有______个原子。
答案:33. 化学方程式2H₂ + O₂ → 2H₂O中,反应物和生成物的摩尔比是______。
答案:1:14. 元素周期表中,第ⅤⅡA族元素的原子序数范围是______。
答案:57-715. 摩尔质量的单位是______。
答案:g/mol三、简答题(每题10分,共30分)1. 请简述什么是化学平衡,并举例说明。
答案:化学平衡是指在一个封闭系统中,正向反应和逆向反应的速率相等,反应物和生成物的浓度不再发生变化的状态。

第35届中国化学奥林匹克(决赛)试题(一)(2021年11月27日8:30-11:30)【说明】国决于11月在武汉举行,上下午各考一份试卷,本卷是第一份试题,共有10个大题。
笔者将每个题目作了比较详细的解析,数据都经过认真验证,因水平有限,不妥之处,敬请批评指正!杭州高级中学高树浪(特级教师)第1题(14分)从电解精炼铜的阳极泥中提取硒的典型步骤为:将混有碳酸钠的阳极泥于650°C 在空气中燃烧(反应1),然后浸水过滤;滤液用稀硫酸中和后,过滤得亚硒酸溶液。
往该溶液中通入SO 2,沉淀出Se 单质(反应2)。
1-1以阳极泥中的Ag 2Se 和Cu 2Se 为例,写出反应1中的化学反应方程式。
1-2写出反应2中的化学反应方程式。
1-3双β衰变是原子核的一种稀有衰变方式,可近似看作连续的两次β衰变。
第一个成功观测到双β衰变现象的原子核是82Se ,写出82Se 发生双β衰变的反应方程式。
1-4GaCl 3和SeCl 4可在室温下发生反应,生成离子型化合物R 。
然而,将等摩尔数的SeO 2、SeCl 4和GaCl 3于50°C 反应,得到等摩尔数的无色晶体P 和液态物质Q 。
单晶X-射线衍射测试表明,无色晶体P 中,Ga 中心为四面体配位几何构型,Se 的配位几何为三角锥形,Q 的分子几何构型为三角锥形。
在800°C 惰性气氛中,P 发生热分解,剩余残渣的质量百分含量约为11%。
1-4-1写出能表明R 结构特征的化学式,分别写出P 和Q 的化学式。
1-4-2根据Se 、Ga 氯化物和氧化物的相关性质,推导出P 的热分解产物,并写出化学反应方程式。
【答案】1-1:Ag 2Se +Na 2CO 3+O 2→2Ag +Na 2SeO 3+CO 2Cu 2Se +Na 2CO 3+2O 2→2CuO +Na 2SeO 3+CO 21-2:H 2SeO 3+2SO 2+H 2O →Se +2H 2SO 41-3:1-4R :[SeCl 3][GaCl 4]P :[Se O Cl][GaCl 4]Q :SeOCl 21-4-25GaSeCl 5O →4SeCl 4↑+3GaCl 3↑+SeO 2↑+Ga 2O 3【解析】1-1:该小题的反应物为碳酸钠、Ag 2Se 和Cu 2Se ,还有氧气,生成物有亚硒酸钠,主要后面产物是金属氧化物,还是单质?由于反应条件是650°C,氧化铜不分解(分解温度1273K),而氧化银分解(573K),这是元素化合物基本常识.所以产物是Ag和CuO.1-2:本题是简单的氧化还原反应,送分题,要注意:氧化性:H 2SeO 3>H 2SeO 4(稀),氧化性:H 2SO 3>H 2SO 4(稀),氧化性:HNO 2>HNO 3(稀),可用极化理论解释。
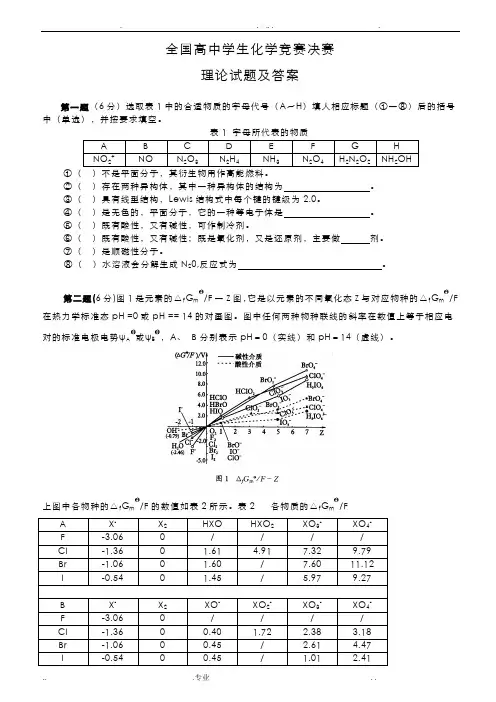
全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
A B C D E F G HNO2+ NO N2O3N2H4NH3 N2O4H2N2O2NH2OH)不是平面分子,其衍生物用作高能燃料。
②()存在两种异构体,其中一种异构体的结构为。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N20,反应式为。
第二题(6分)图1是元素的△f G m/F一Z图,它是以元素的不同氧化态Z与对应物种的△f G m/F 在热力学标准态pH =0或pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△f G m/F的数值如表2所示。
表2 各物质的△f G m/FA X- X2HXO HXO2 XO3- XO4-F -3.06 0 / / / /Cl -1.36 0 1.61 4.91 7.32 9.79Br -1.06 0 1.60 / 7.60 11.12I -0.54 0 1.45 / 5.97 9.27B X-X2XO- XO2- XO3-XO4-F -3.06 0 / / / /Cl -1.36 0 0.40 1.72 2.38 3.18Br -1.06 0 0.45 / 2.61 4.47I -0.54 0 0.45 / 1.01 2.41⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。

全国高中学生化学竞赛实验试题营号从盐泥中提取七水合硫酸镁注意事项:1、实验考试总分计为100分。
实验考试用纸包括“实验试题”和“实验报告”两部分。
实验试题第6页由监考教师逐人发放。
2、实验考试时间为5小时,每超过5分钟扣3分,最长不得超过20分钟。
请考生仔细阅读试题内容,合理安排时间。
可用自备的计算器处理数据。
3、实验前请检查所提供的仪器,若有问题,向监考教师报告。
4、若制备实验失败,可向监考教师索要产品进行分析,但要扣除30分。
若出现制备实验重做,每索要一次原料扣除10分。
分析实验中,平行测定少做一次扣3分,重称1次扣2分。
5、需监考教师签字处,考生务必主动配合,未签字者实验结果按无效论处。
伪造数据者,按零分计。
6、注意安全,必须配戴防护眼镜和手套。
7、废弃物和回收的溶剂应放入指定的容器内。
8、完成全部实验内容后将产品、实验报告和实验试题交给监考教师,并由监考教师签字。
清洗仪器并整理桌面后方可离开考场(清理时间不计入实验时间)。
一、实验内容盐泥是氯碱工业中的废渣,分为一次盐泥和二次盐泥。
一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分,其中含镁(以Mg(OH)2计)约15%。
本实验要求从一次盐泥中提取MgSO4·7H2O。
本实验考试具体内容包括下列三个部分:1、从一次盐泥中提取MgSO4·7H2O。
2、测定MgSO4·7H2O的含量。
3、回答思考题并完成实验报告。
二、物质的某些性质1、K sp [Mg(OH)2]=6.0×10-10K sp [Ca(OH)2]=3.7×10-6K sp [Fe(OH)3]=3.0×10-39 K sp [Fe(OH)2]=8.0×10-16K sp [Mn(OH)2]=4.0×10-14K sp [Al(OH)3]=1.3×10-332、物质的溶解度(g/100gH2O)3、相对原子质量:H l.01,O 16.00,S 32.07,Mg 24.31,Zn 65.39三、主要试剂和仪器1、试剂各人实验桌上:工业盐泥(26克),6 mol·L-1HCl,1:1 NH3·H2O,铬黑T指示剂,EDTA标准溶液(500 mL)。

(共10套)高中化学竞赛测试真题汇总附答案高中化学竞赛试题(一)第1题(12分)最近出版的“重大发现记实”中,Cute教授发表了关于外星文明遗迹的研究结果。
他认为外星人与人类非常相似,他们可能在亿万年前来过地球,留下了非常奇异的碑记。
一些碑文已经破译被证明是外星人当地大学的大学生所用的普通化学教科书的几章。
这些内容的最初几行就相当今人,看上去象是那个奇妙的世界里的物质定律,与我们的星球所遵循的规律不同。
特别是原子结构也用四个量子数来描述,只有一个重大的区别:n=1,2,3……L=0,1,2,3,…,(n-1)M=-2L,-(2L-1),…,-1,0,+1,…,+(2L-1),+2LM S=+1/2,-1/2Cute教授允诺要继续发表相关研究,一旦他找到了财政支持,将继续他的破译工作并描述出X星球上的周期表和一些基础化学内容。
然而以揭示的碑文内容就足以预见一些重要事实。
1-1 试创造出X周期表的前两个周期,为简便起见,用我们的化学符号来表示与我们原子有相同电子的X原子;1-2 猜测在那里可用作洗涤和饮用的X-水可能是什么?写出全部可能,并说明理由。
依据你所构造的X周期表,写出他的化学式。
1-3 写出“甲烷(X的氢化物)在氧气中燃烧”的反应,这是给人类提供能量和热源的主要过程;解释你选择X元素的原因?(1)光气与足量乙醇反应所得产物的化学名称是;(2)光气与足量氨气反应的化学方程式;(3)足量苯在AlCl3催化剂作用下与光气反应所得产物的结构简式;(4)光气与苯胺分两步反应可得异氰酸苯酯,中间产物的结构简式是,异氰酸苯酯的结构简式是。
2-2实验室可用四氯化碳和发烟硫酸(H2SO4·SO3)反应制备光气,写出化学方程式。
2-3BTC是一种稳定的白色结晶体,熔点为78~82℃,沸点为203~206℃。
1mol BTC可在一定条件下分解产生3mol光气,所以又被称为“三光气”。
工业上可以利用碳酸二甲酯的氯代反应制备BTC。

化学奥林匹克中国化学会第22届全国高中学生化学竞赛(决赛)理论试题(2009年1月7日陕西西安)第1题金在自然界中主要以分散的单质形式存在,需要先富集再提炼。
富集后的精矿用混汞法、氰化法等工艺提取金。
混汞法是使矿浆中的金粒与汞生成金汞齐,然后蒸去汞得到海绵金(又称汞金)。
氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为IAu(CN)2]-),再用置换法或电沉积法从浸出液中回收金。
1-1 写出用氰化物溶金反应和用zn粉置换金的化学反应方程式。
设配制的NaCN水溶液的浓度为 1.00X10-3mol/L、生成的[Au(CN)2]-配离子的浓度为1.00 X10-4·mol/L、空气中O2的体积分数为0.210,计算298 K时在空气中溶金反应的自由能变。
1-3 当电极反应中有H+或OH-时,其电极电势E将受pH的影响,E-pH图体现了这种影响。
E-pH图上有3种类型的线:电极反应的E与pH有关,为有一定斜率的直线;电极反应的E与pH无关,是一条平行于横坐标的直线;非氧化还原反应,是一条平行于纵坐标的直线。
电对的E-pH线的上方,是该电对的氧化型的稳定区,E-pH线的下方,是还原型的稳定区;位于高位置线的氧化型易与低位置线的还原型反应;各曲线的交点所处的E和pH,是各电极的氧化型和还原型共存的条件。
下图是氰化法溶金过程的Au-CN-H2O系统的E-pH图,试借助该图对溶金反应和溶金的工艺条件进行讨论。
第2题液氨是一种广泛使用的类水溶剂。
2-1 作为溶剂,NH3分子也能发生类似于H2O分子的缔合作用,说明发生这种缔合的原因和比较这种缔合作用相对于水的大小。
2-2 以液氨作为溶剂最引起化学家兴趣的是它能够溶解一些金属,如电极电势小于-2.5 V的碱金属、部分碱土金属及镧系元素可溶于液氨,形成蓝色的具有异乎寻常性质的亚稳定态溶液,这种溶液具有顺磁性和高的导电性,溶液的密度比纯溶液的密度小。
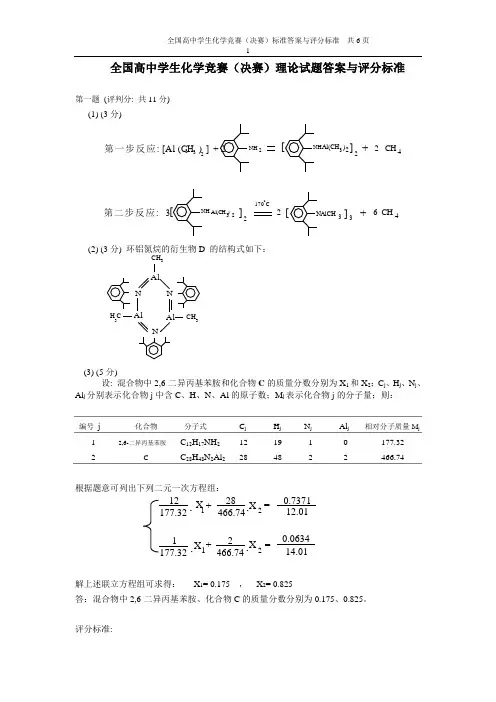
全国高中学生化学竞赛(决赛)理论试题答案与评分标准第一题 (评判分: 共11分)(1) (3分)3NAlCH 第一步反应: [Al (CH ) ] + 2 NH 2332[NH Al(CH )322]+2CH 4]223 Al(CH )NH [第二步反应: 3170C3]+6 CH 42[(2) (3分) 环铝氮烷的衍生物D 的结构式如下:CH 3Al NN AlAl N3CH 3H C(3) (5分)设: 混合物中2,6-二异丙基苯胺和化合物C 的质量分数分别为X 1和X 2;C j 、H j 、N j 、Al j 分别表示化合物j 中含C 、H 、N 、Al 的原子数;M j 表示化合物j 的分子量;则:编号 j 化合物分子式 C j H j N j Al j 相对分子质量M j1 2,6-二异丙基苯胺C 12H 17NH 21219 1 0 177.32 2 CC 28H 48N 2Al 2 284822466.74根据题意可列出下列二元一次方程组:12+28=0.7371177.32466.7412.011+2=0.0634177.32466.7414.01 X X X X 1212....解上述联立方程组可求得: X 1= 0.175 , X 2= 0.825答:混合物中2,6-二异丙基苯胺、化合物C 的质量分数分别为0.175、0.825。
评分标准:全题评判分: 共11分.(1) 评判分: 共3分,其中第一步反应为1分, 第二步反应为2分, 没用结构简式表示的不给分, 未配平、但方程中各化合物结构简式写对的, 第一步扣0.5分, 第二步扣1分;(2) 评判分: 3分(3) 评判分: 共5分, 写对求解联立方程组得3分, 方程结果X1、X2各占1分,全对得2分, 错一个扣1分;用百分数表示者, 只要正确不扣分, 结果数字有效位数不正确者, 每个结果扣0.25分。
第二题(评判分: 共18分)1. (评判分: 6分)第一步反应为CaC2O4·H2O脱水反应, N2和O2对反应无影响, 所以热重曲线相同(2分);第二步反应为CaC2O4的分解,由于CO在O2中氧化放热,使温度升高,加快了反应速率,所以在较低的炉温下CaC2O4即开始分解(2分);第三步反应为CaCO3 的分解,N2和O2对反应无影响,但由于第二步反应分解速率不同,使所生成的CaCO3有所不同,所以曲线有差异(2分)。

竞赛:碘酸钙的制备及含量测定注意事项:●实验时间为 5.0 小时,请仔细阅读试题内容,合理安排时间,完成全部内容。
每超过5 分钟要扣 1 分,最长不超过 20分钟。
●若制备失败可向监考教师索取原料重做,但要扣 5 分;若产品不够纯度测定所需量,可向监考教师索取分析样品,但要扣16.5 分。
●需监考教师签字的,考生务必主动配合,未当场签字者无效。
伪造数据者,以零分计。
●完成全部实验内容后,将产品、实验报告(包括试题)交给监考教师,并清洗所用仪器和整理桌面,经监考教师签字后方可离开考场。
●废弃物应放入指定容器内。
●实验过程请注意安全。
一、实验内容1.产品的合成:碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO 3·HIO 3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应生成碘酸钙。
2.产品的分析:用间接碘量法测定。
3.完成实验报告。
二、主要仪器、试剂及材料1.主要仪器圆底烧瓶 100mL 1 只球形冷凝管(带磨口塞) 1 支磁力搅拌器 1 台电接点温度计(导电表) 1 支电子继电器 1 台电加热器( 300W ) 1 只结晶皿(水浴缸) 1 只温度计 (100℃ ) 1 支漏斗、吸滤瓶、表面皿各 1 只布氏漏斗和抽滤瓶(带橡皮塞) 1 只滴定管夹 1 只烧杯600ml 、 500ml 1 只量筒100ml 1 只150ml 2 只10ml 2 只100ml 1 只玻管(直管、弯管)各 1 支碘量瓶250ml 3 只移液管(胖肚)50ml 1 支橡皮管25ml 1 支碱式滴定管50ml 1 支塑料洗瓶、木夹各 1 只容量瓶250ml 2 只滴管 2 支洗耳球、角匙、镊子各 1 只玻棒 2 支铁架台、铁圈、铁夹 3 付●公用仪器电子天平(最大称量100 克,± 0.0001 克)电炉( 800W )电子天平(最大称量100 克,± 0.01 克)循环水式真空泵2.试剂及材料1 mol · L -1碘化学纯( CP)氯化钙溶液氯酸钾化学纯( CP)1∶ 1高氯酸溶液碘化钾分析纯( AR )碘酸钾标准溶液30%氢氧化钾溶液0.1 mol · L -1硫代硫酸钠标准溶液0.5mol · L -1氢氧化钠溶液0.5%淀粉溶液6 mol· L -1盐酸无水乙醇化学纯( CP)1 mol· L -1硫酸pH 试纸( 1-14)滤纸、称量纸、碎冰3.主要原料和产品的某些性质3. 1几种盐的溶解度(克/100 克水)温度 /℃010********KIO 3 4.60 6.278.0812.618.324.8KCl28.131.234.240.145.851.3KClO 40.76 1.06 1.68 3.737.3013.4Ca(IO 3) 20.119( 5℃)0.195( 15℃) 0.307(25℃ )0.5200.6210.6693. 2 碘酸钙在不同温度下的存在形态碘酸钙存在形态无水盐一水合物六水合物稳定的温度区域>57.5℃32-57.5 ℃<32℃3. 3 摩尔质量 /g mol·-1碘酸钙无水盐 389.88一水合物 407.90六水合物 497.90硫代硫酸钠 158.10碘酸钾 170.80碘 253.80氯酸钾 122.55三、操作步骤1.制备碘酸钙在 100mL 圆底烧瓶中依次加入 2.20 克碘、 2.00 克氯酸钾(均由教师定量供给)和 45mL 水,放入搅拌磁子,然后把烧瓶置入水浴缸内,用铁夹固定,开动搅拌器,使氯酸钾溶解,滴加 6mol·L -1盐酸 8 滴( pH ~ 1),装上冷凝管,通冷却水,冷凝管顶部塞上带玻璃管塞子,用橡皮管把反应产生的气体导向盛有约100mL 氢氧化钠溶液的大烧杯内吸收。
中国化学会第24届全国高中学生化学竞赛(省级赛区)试卷第1题 (15分)1-12009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
117号元素是用249Bk轰击48Ca靶合成的,总共得到6个117号元素的原子,其中1个原子经p次α衰变得到270Db后发生裂变;5个原子则经q次α衰变得到281Rg后发生裂变。
用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。
1-2 写出下列结构的中心原子的杂化轨道类型:1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如下简式表示。
请依样画出其他所有八面体构型的异构体。
第2题 (5 分)最近我国有人报道,将0.1 mol L的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。
2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu2+/Cu)和φӨ(S/S2-)分别为0.345V和 -0.476 V,nFEӨ=RT ln K,EӨ表示反应的标准电动势,n为该反应得失电o2-2金属铜和混浊现象均出现在蛋壳外,这意味着什么?2-4请对此实验结果作一简短评论。
第3题 (7 分) 早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。
它是迄今已知的除金刚石和氮化硼外最硬的固体。
1930年确定了它的理想化学式。
左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。
第4题 (8分)4-1分别将O 2、KO 2、BaO 2 和O 2[AsF 6]填入与O —O键长相对应的空格中。
4-2在配合物A 和B 中,O 2为配体与中心金属离子配位。
A 的化学式为[Co 2O 2(NH 3)10]4+,其O —O 的键长为147 pm ;B 的化学式为Co(bzacen)PyO 2,其O —O 的键长为126 pm ,Py 是吡啶(C 5H 5N),bzacen 是四齿配体 [C 6H 5−C(O -)=CH −C(CH 3)=NCH 2−]2。
中国化学会第25届全国高中学生化学竞赛1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn 相对原子质量Rf Db Sg Bh Hs Mt评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2.有效数字错误,扣0.5分,但每大题只扣1次。
3.单位不写或表达错误,扣0.5分,但每大题只扣1次。
4.只要求1个答案、而给出多个答案,其中有错误的,不得分。
5.方程式不配平不得分。
6.不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题(15分)1-1 2011年是国际化学年,是居里夫人获得诺贝尔化学奖100周年。
全国高中学生化学竞赛试题及答案第1题(5分)阅读如下信息后回答问题:元素M ,其地壳丰度居第12位,是第3种蕴藏最丰富的过渡元素,是海底多金属结核的主要成分,是黑色金属,主要用途:炼钢,也大量用来制作干电池,还是动植物必需的微量元素。
1.M 的元素符号是 。
2.M 的最重要矿物的化学式是 。
3.M 的三种常见化合物是 、 和 。
【答案】1.Mn (1分) 2.MnO 2(1分) 3.M 的三种常见化合物是MnO 2、MnSO 4和KMnO 4。
(3分)注:必须答MnO 2和KMnO 4,而Mn(II)盐也可答硝酸锰等。
第2题(6分)用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。
例如:1.计算机的芯片的主要成分是 ;2.光导纤维的主要成分是 :3.目前应用最多的太阳能电池的光电转化材料是 ;4.用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类称为 的化合物;5.有一大类化合物,结构独特,兼备无机材料和有机材料双重性能,有耐温、电绝缘性好、难燃、憎水、耐腐蚀……等特性,广泛用于航空航天、电子电气、建筑、运输等行业,用于密封、粘合、润滑、涂层、表面活性、防水、防潮……,已为现代社会不可替代的新材料。
这类材料在分子结构上的特点是 和 。
【答案】1.硅(或Si 或单晶硅)(1分) 2.二氧化硅(或SiO 2)(1分) 3.硅(或Si )(1分) 4.铝硅酸盐(或硅铝酸盐)(1分)注:此题明确是分子筛,不应答硅胶,答硅酸盐也不给分。
5.具有Si -O 键 与硅相连的烃基(2分)第3题(3分)最近有人用高能26Mg 核轰击24896Cm 核,发生核合成反应,得到新元素X 。
研究者将X 与氧气一起加热,检出了气态分子XO 4,使X 成为研究了化学性质的最重元素。
已知的X 同位素如下表所示,上述核反应得到的核素是其中之一,该核素的衰变性质保证了其化学性质实验获得成功。
1999年全国高中学生化学竞赛(决赛)实验试题
3一α一呋喃基丙烯酸的制备及含量测定
一、实验内容
1.产品的合成:以呋喃甲醛和乙酸酐为原料,在碱性条件下经Perkin反应制得粗产品,再经纯化得到3一α一呋哺基丙烯酸纯品,干燥并计算产率。
2.产品的分析:用中和滴定法测定产品纯度。
3.完成实验报告。
二、主要仪器、试剂及材料
1.主要仪器
标准磨口仪器1套量筒25mL、50mL 各1支
布氏漏斗和吸滤瓶1套不锈钢刮刀1把
电热套1个研钵1副
升降台1个表面皿(贴标签者用于烘干产品)2块
铁架台2个玻璃棒2支
水浴锅1个称量瓶1个
烧瓶夹1支不锈钢药匙1把
冷凝管夹1支塑料洗瓶1个
滴定管夹1支碱式滴定管50 mL 1支
防护眼镜1副白瓷板1块
手套(棉、塑料)各1支循环水泵(公用)
漏斗2个烘箱(公用)
烧杯400mL、250mL、150m各1个电子天平(公用)最大称量100g,士
锥形瓶50mL、100mL 各2个扭力天平(公用)最大称量100s,士0.005g 250mL 2个台秤(公用)
2.试剂及材料/L的NaOH标准液
呋喃甲醛(新蒸)化学纯cp (已装于试剂瓶中)300 mL
乙酸酐(新蒸)化学纯cp 邻苯二甲酸氢钾(基准物在天平室)
无水碳酸钾化学纯cp 酚酞指示剂:0.2%乙醇水溶液
碳酸钠化学纯cp 5%硝酸银水溶液
浓盐酸化学纯cp 广泛pH试纸
活性碳已活化滤纸
碎冰沸石
1:3乙醇水溶液称样纸
1:1中性乙醇水溶液(经处理)碎滤纸
3.原料和产品的主要性质
呋喃甲醛相对分子质量浅黄色液体,密度/m3,熔点一沸点161.7℃,难溶于水,易溶于乙醇。
3.2乙酸酐相对分子质量无色有刺激气味液体,沸点139℃,遇水水解。
3一α一呋喃基丙烯酸相对分子质量,无色针状晶体,熔点137℃~138o C,难溶于水,易溶于碱液中。
3一α一呋喃基丙烯酸钠易溶于水:
邻苯二甲酸氢钾相对分子质量204.2
三、操作步骤
1.3一α一呋喃基丙烯酸的制备
在100mL圆底烧瓶中,依次加入5mL呋喃甲醛(由教师定量供给)、14mL乙酸酐和6g无水碳酸钾(每人一包),装上空气冷凝管,用电热套加热回流1.5小时。
反应开始时应控制加热速度(由于逸出二氧化碳,最初有泡沫出现)。
搅拌下趁热将反应物倒入盛有100 mL蒸馏水的烧杯中,用固体碳酸钠中和3一α一呋喃基丙烯酸至弱碱性,加入活性炭后煮沸5~10分钟,趁热过滤。
滤液在冰水浴中边搅拌边滴加浓盐酸,至3一α一呋喃基丙烯酸析出完全,抽滤,用少量蒸馏水洗涤2次。
粗产品用适量1:3乙醇水溶液重结晶,抽滤,洗涤,尽量抽干。
将产品移到贴有标签的表面皿上,烘干(大约需要30分钟)。
考生确认已干燥后,由监考教师当场称重,并将产品的重量及外观记录在考生的实验报告上。
考生当场将产品用研钵研细,装入称量瓶中供纯度测定用。
2、产品纯度测定
·L-1NaoH标准溶液的标定
用减量法准确称取0.4~0.6g邻苯二甲酸氢钾基准物质两份分别于两个250 mL锥形瓶中,加入40~50mL水使之溶解(必要时可加热),加入2~3滴酚酞指示剂,用0.1 mol·L-1NaOH标准溶液滴定至呈微红色,保持半分钟内不褪色,即为终点。
计算每次标定的NaoH溶液的浓度、平均浓度及相对极差。
2.2产品纯度的测定
“用增量法准确称取产品~乙用20~30mL1:1乙醇水溶液溶解,加入2~3滴酚酞指示剂,用标准NaOH溶液滴定至呈微红色,保持半分钟内不褪色,即为终点。
平行测定两次,计算每次所测样品中3—α一呋喃基丙烯酸的百分含量、平均百分含量及相对极差。