药物合成反应—第七章还原反应
- 格式:ppt
- 大小:3.13 MB
- 文档页数:30


9 还原反应通过还原反应,可将不饱和结构转化为饱和结构,将羰基化合物转化为醇,等等,可以实现多种官能团的转化,在药物合成中有着广泛的应用。
本章主要内容为,碳-碳(杂)不饱和结构的还原,多种含氧不饱和结构的化学还原以及氢解等,催化多相加氢等大工业生产常见的还原过程以及生物法还原不在本章重点讨论范围之内。
9.1多相催化加氢、催化转移氢化和均相催化加氢多相催化加氢可以完成从酰卤、炔烃、酮、硝基物、芳烃到羧酸,几乎所有不饱和结构的还原。
多相催化加氢以氢气为氢源,适应面广,但有时需加压,而且当底物中存在多个活性基团时,存在还原的选择性问题。
不同官能团被还原的反应活性不同,催化剂及反应条件也不同。
通常情况下,表9.1的内容可作为催化加氢活性顺序(及反应条件)的参考。
表9.1 不同官能团加氢难易顺序表(易→难)当底物分子中含多个可还原基团时,处在表的前部的基团将被优先还原。
例如还原不饱和醛的羰基,可用加氢法,如果是还原其双键,则加氢法不合适。
催化加氢反应示例:Finasteride中间体的合成。
与多相催化加氢用氢气作氢源不同,催化转移氢化的氢源为有机化合物,通常为不饱和脂环烃、不饱和萜类或醇,如环己烯、alpha-蒎烯和异丙醇等。
所用催化剂可以是钯黑或钯/碳,铂和铑的活性较低,而镍一般用于醇作氢源的反应。
催化转移氢化主要适用于碳-碳不饱和键、硝基、偶氮基、亚胺基和氰基的还原,也可用于碳-卤键、苄基及烯丙基的氢解。
具有反应条件温和,操作简单,基团选择性好等优点。
表9.2列举了更多的应用实例。
表9.2 一些催化转移氢化应用实例均相催化加氢的主要特点是催化剂以分子态溶解在反应介质中,起催化作用,其氢源为氢气。
选择性好,反应条件温和。
催化剂一般为第VIII族过渡元素Rh、Ru、Ir、Co以及Pt等的配合物。
常见的配体是Cl、CN、PPh3、CO和胺等给电子体。
在药物合成中,均相催化法主要应用于碳-碳双键的选择性还原,见表9.3。



《药物合成技术》习题集适用于制药技术类专业第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,B r 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应C CH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH32.CH 3SO 2ClCl /AIBN3.OH4CH 3CH 35.2OC O CH 3OHI 2/CaOAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2C CHCH 3CHCH 2Br(CH 3)2C 1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.O2CH 2OH CH 2CH 2OHOCH 2CH 2CH 2CH 2ClCl 6.CH 2OH3CH2Cl37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 32CH 2C(COOC 2H 5)NHCOCH 3CH 2Br2CH 2C(COOC 2H 5)39.CH 2NO 2CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH 2CH 2NO 2CH 2N(CH 2CH 2Cl)2C(COOC 2H 5)310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。


四.缩合反应定义:两个及两个以上有机化合物通过反应形成一个新的较大分子或同一分子内部发生分子内的反应形成新分子的反应称为缩合反应。
Aldol:定义:在稀酸或稀碱催化下(通常为稀碱),一分子醛(或酮)的 氢原子加到另一分子醛(或酮)的羰基氧原子上,其余部分加到羰基碳上,生成 -羟基醛(或酮),这个增长碳链的反应称为α-羟烷基化反应。
但该类化合物不稳定,易消除脱水生成α,β-不饱和醛酮,又称Aldol缩合反应。
Aldol特点:酮:活性小于醛,反应速度慢。
1. 对称酮产物较单纯。
2. 不对称酮的自身缩合,在碱性或酸性催化下,反应都发生在取代较少的羰基碳原子上。
羟醛缩合催化剂碱:弱碱(如Na3PO4、NaOAc、Na2CO3、K2CO3、NaHCO3),强碱(如NaOH、KOH、NaOEt、NaH、NaNH2)酸:盐酸、硫酸、对甲苯磺酸、三氟化硼以及阳离子交换树脂等Cannizzaro反应(歧化反应)定义:凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇。
甲醛的羟甲基化反应和交叉Cannizzaro反应能同时发生,是制备多羟基化合物的有效方法。
定向醇醛(酮)缩合方法:A.烯醇盐法:醛或酮与具位阻的碱如LDA(二异丙胺锂)作用,形成烯醇盐再与另一分子醛或酮作用,B.烯醇硅醚法:醛、酮转变成烯醇硅醚,在TiCl4催化下与另一分子醛、酮分子作用。
C. 醛、酮与胺形成亚胺,与LDA形成亚胺锂盐,再与另一分子醛、酮作用。
Diels-Alder反应含有一个活泼的双键或叁键的烯或炔类和二烯或多烯共轭体系发生1,4-加成,形成六员环状化合物的反应称为Diels-Alder反应。
该反应易进行且反应速度快,应用范围广,是合成环状化合物的一个非常重要的方法。



《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
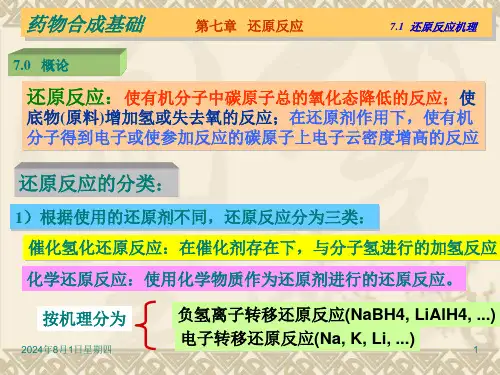
第九章还原反应在还原剂的作用下使有机物分子中增加氢原子或减少氧原子,或者两者兼而有之的反应称为还原反应。
而将硝基、亚硝基、羟氨基、等含碳—氮键的化合物在还原剂作用下制得胺类的方法是还原反应中重要的一类。
同时,不饱和烃的还原、芳烃的还原、羰基的还原、羧酸及其衍生物的还原在药物合成中也有很重要的作用。
还原反应根据所用还原剂及操作方法不同,基本上可分为三类。
凡是使用化学物质包括元素、化合物等作还原剂所进行的还原反应称为化学还原反应,其中包括电化学还原反应。
化学还原反应按机理分主要分为负氢离子转移还原反应和电子转移还原反应。
另一种在催化剂存在下,借助于分子氢进行的还原反应称为催化氢化还原或催化加氢还原。
还有一种利用微生物发酵或活性酶进行的还原反应称为生物还原反应,这里不介绍。
9.1 化学还原反应化学还原反应常有的还原剂有无机和有机还原剂,前者应用更广泛。
9.1.1 金属还原剂1. 底物与进攻试剂金属还原剂包括活泼金属、它们的合金及其盐类。
一般用于还原反应的活泼金属有碱金属、碱土金属、以及铝、锡、铁等。
合金包括钠汞齐、锌汞齐、铝汞齐、镁汞齐等。
金属盐有硫酸亚铁、氯化亚锡等。
金属还原剂在不同的条件下可还原一系列物质,不同的金属还原的应用场合有所差别。
2. 反应机理及影响因素金属还原剂在进行还原时均有电子得失的过程,且同时产生质子的转移。
金属是电子的供给者,而质子供给者是水、醇、酸等化合物。
其还原机理是电子-质子的转移过程。
如羰基化合物用金属还原为差羟基化合物的过程中,是羰基首先自金属原子得到一个电子,五项原则负离子自由基,后者再由金属得到一个电子,形成二价负离子,二价负离子由质子供给者提供质子生成羟基化合物:CO +MC MM-eC MHCH OH(1)铁和低价铁盐为还原剂铁屑在酸性条件下为强还原剂,可将芳香族硝基、脂肪族硝基以及其它含氮氧功能团(亚硝基、羟氨基等)还原成氨基,将偶氮化合物还原成两个胺,将磺酰氯还原成巯基。