《工艺流程图》专题训练(1)
- 格式:pdf
- 大小:706.31 KB
- 文档页数:6



化工流程题的解题策略1.一个完整的无机化工生产流程一般具有下列过程:2.各过程涉及的考点:(1)对原料进行预处理的常用方法及其作用:①研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快反应速率。
②水浸:与水接触反应或溶解。
③酸浸:与酸接触反应或溶解,使可溶性金属离子进入溶液,不溶物通过过滤除去。
④灼烧:除去可燃性杂质或使原料初步转化。
如从海带中提取碘时的灼烧就是为了除去可燃性杂质,将有机碘转化为碘盐。
⑤煅烧:改变结构和组成,使一些物质能溶解;并使一些杂质在高温下氧化、分解,如煅烧高岭土和石灰石。
(2)核心化学反应要掌握:①元素及其化合物知识:化工生产将原料转变成产品的过程,也是物质经历相互转化的过程。
理解物质之间的转化关系,就要用到元素及其化合物的相关知识。
一般围绕铁、铜、铝、镁、氯、硫、磷、硅等元素的单质或化合物的工业制备来进行命题,需要掌握这些元素及其化合物的知识②还要掌握有关化工生产的知识,熟悉的有纯碱工业、氨工业、硅单质的制备、氯碱工业、海水中提取镁、海水中提取溴等;③化学反应原理:化工生产中把原料转变成产品的过程就是化学反应的过程,从化学反应原理的角度选择原料、控制条件和选择设备等,是化工生产的基本思路。
化学反应原理的相关知识包括质量守恒定律、化学反应速率、化学平衡、电化学、化学热力学等,做到能综合运用这些知识分析化工生产中化学反应的情况。
(3)化工生产过程中分离提纯、除杂等环节,与高中化学基本实验的原理紧密联系,包括过滤、洗涤、蒸发、结晶、蒸馏、萃取、分液等基本实验操作及原理,并要熟悉所用到的相关仪器。
(4)对整个工艺流程能进行评价:①体现绿色化学思想(使用无毒无害原料,采用原子利用率高的制备路线,原料的循环利用,副产物综合利用,节能,等);②高效节能方面(原料廉价,工艺简单,产品的纯度高,能耗低等)(5)化学计算:纯度,转化率、产率计算,有效数字的取舍2.解答基本步骤(1)读题头,得目的,划原料,明产品,解决“干什么”一般采用“首尾分析法”:通过阅读题头,了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,通过对比分析工业流程示意图中的第一种物质(原材料)与最后一种物质(产品),弄清从原料出发,要得到最终产品,必须除去什么元素、引进什么元素。

2024年中考化学复习专题:工艺流程题1.合成氨人类科学技术上的一项重大突破,为化肥工业奠定了基础,以下是合成氨的工艺流程图。
(1)“液氮的沸点是−196℃,液氧的沸点是−183℃”,这属于 (填“物理性质”或“化学性质”);氮气常温下化学性质较稳定,可用做 。
(2)下列有关氮气和氢气反应的催化剂说法正确的是 。
a.化学反应前后其化学性质改变了b.其改变了生成物的质量c.只是改变了化学反应速率(3)根据上图,写出氮气和氢气反应生成氨气的文字表达式 。
(4)上述流程图中,“净化压缩”过程,从微观角度解释是气体分子的 改变。
2. 垃圾分类, 有利于变废为宝。
利用废旧白口铁(镀锌铁皮) 制备磁性Fe 3O 4胶体粒子及副产物ZnO ,其工艺流程图如下:(资料:铁不与氢氧化钠溶液反应,锌会与氢氧化钠溶液反应;不溶性碱受热分解生成金属氧化物和水。
)(1)℃中将不溶物和溶液A 分离的操作为 。
(2)℃中发生反应的化学方程式为 。
(3)溶液B 中含有的金属离子为 ,℃中加入适量H 2O 2溶液的目的是 。
3.某品牌电器的废旧电路板中还有Fe 、Cu 、Ag 、Ni (镍,银白色金属)等金属,如下图是某车间回收部分金属的工艺流程,已知22442Δ2Cu+O +2H SO 2CuSO +2H O 。
回答下列问题。
(1)滤渣℃中含有的金属是。
(2)根据以上工艺流程图,可以得出Ni、Fe的金属活动性强弱顺序是Ni Fe(填“>”或“<”)。
(3)滤液℃中加入足量铁粉的主要目的是,固体A除主要含有铜外,还含有一定量的铁,为了进一步提纯铜,可以向固体A中加入适量的稀硫酸,发生反应的化学方程式为。
(4)相比于直接焚烧废旧电路板回收金属,该工艺流程的主要优点是。
4.消毒剂在公共场所进行卫生防疫时发挥着重要作用。
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌消毒剂。
以粗盐为原料生产ClO2的工艺主要包括:℃粗盐精制;℃电解微酸性NaCl 溶液制NaClO3; ℃ClO2的制取。

化学工艺流程图专题( 我国制碱工业先驱侯德榜发明了“侯氏制碱法”。
其模拟流程如下:1)1. (1) 反应①的化学方程式 (2) 工业上用分离液态空气 ,反应②的基本反应类型为 。
的方法制取氢气, 属于 变化(填“物理” 或“化学”)。
(3) 操作 (4) 写出 a 的名称是 ,实验室进行此操作所需的玻璃仪器有烧杯、 玻璃棒、 。
NH 4Cl 的一种用途 。
2. 过氧化钙晶体﹝ Ca O 2· 8H 2O ﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。
以贝壳为原料制备 Ca O 2 流程如下:(1)气体 X 是 C O 2,其名称是 ;将过氧化钙晶体与溶液分离的方法是 。
(2)反应 Y 需控制温度在 0~5℃,可将反应容器放在 中,该反应是化合反。
获得的。
Ca O 2·8H 2O ﹞中 H 、O 元素的质量比应,反应产物是 Ca O 2·8H 2O ,请写出化学方程式 过氧化钙晶体中常含有 Ca(OH)2 杂质,原因是 (3)Ca O 2 的相对分子质量为 ,过氧化钙晶体﹝ 为 。
(4)为测定制得的过氧化钙晶体中 Ca O 2· 8H 2O 的质量分数,设计的实验如下:称取晶体样△2Ca O 2· 8H 2O=====2Ca O + O 2↑+ 16H 2O ↑,杂质不品 50g ,加热到 220℃充分反应(方程式为 发生变化) ,测得生成氧气的质量为 3.2g ,请计算样品中 Ca O 2·8H 2O 的质量分数 (Ca O 2·8H 2O相对分子质量为 216),写出必要的计算过程。
3. 空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。
下图是以空气和其他必要的原料合成氮肥 (NH 4N O 3 ) 的工业流程。
请按要求回答下列问题:( 1)步骤①中发生的是 变化(填“物理”或“化学”)。
( 2)写出步骤③中发生反应的化学方程式 ( 3)上述化学反应中属于化合反应的有 。

工艺流程图高三复习题2017(含答案)化工流程题的解题策略1.一个完整的无机化工生产流程一般具有下列过程:2.各过程涉及的考点:(1)对原料进行预处理的常用方法及其作用:①研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快反应速率。
②水浸:与水接触反应或溶解。
③酸浸:与酸接触反应或溶解,使可溶性金属离子进入溶液,不溶物通过过滤除去。
④灼烧:除去可燃性杂质或使原料初步转化。
如从海带中提取碘时的灼烧就是为了除去可燃性杂质,将有机碘转化为碘盐。
⑤煅烧:改变结构和组成,使一些物质能溶解;并使一些杂质在高温下氧化、分解,如煅烧高岭土和石灰石。
(2)核心化学反应要掌握:①元素及其化合物知识:化工生产将原料转变成产品的过程,也是物质经历相互转化的过程。
理解物质之间的转化关系,就要用到元素及其化合物的相关知识。
一般围绕铁、铜、铝、镁、氯、硫、磷、硅等元素的单质或化合物的工业制备来进行命题,需要掌握这些元素及其化合物的知识②还要掌握有关化工生产的知识,熟悉的有纯碱工业、氨工业、硅单质的制备、氯碱工业、海水中提取镁、海水中提取溴等;③化学反应原理:化工生产中把原料转变成产品的过程就是化学反应的过程,从化学反应原理的角度选择原料、控制条件和选择设备等,是化工生产的基本思路。
化学反应原理的相关知识包括质量守恒定律、化学反应速率、化学平衡、电化学、化学热力学等,做到能综合运用这些知识分析化工生产中化学反应的情况。
(3)化工生产过程中分离提纯、除杂等环节,与高中化学基本实验的原理紧密联系,包括过滤、洗涤、蒸发、结晶、蒸馏、萃取、分液等基本实验操作及原理,并要熟悉所用到的相关仪器。
(4)对整个工艺流程能进行评价:①体现绿色化学思想(使用无毒无害原料,采用原子利用率高的制备路线,原料的循环利用,副产物综合利用,节能,等);②高效节能方面(原料廉价,工艺简单,产品的纯度高,能耗低等)(5)化学计算:纯度,转化率、产率计算,有效数字的取舍2.解答基本步骤(1)读题头,得目的,划原料,明产品,解决“干什么”一般采用“首尾分析法”:通过阅读题头,了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,通过对比分析工业流程示意图中的第一种物质(原材料)与最后一种物质(产品),弄清从原料出发,要得到最终产品,必须除去什么元素、引进什么元素。
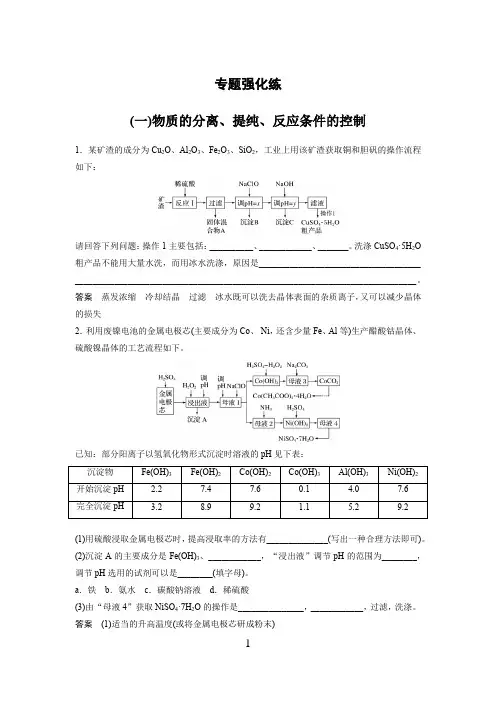
专题强化练(一)物质的分离、提纯、反应条件的控制1.某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:请回答下列问题:操作1主要包括:__________、____________、_______。
洗涤CuSO4·5H2O 粗产品不能用大量水洗,而用冰水洗涤,原因是_____________________________________ ______________________________________________________________________________。
答案蒸发浓缩冷却结晶过滤冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失2.利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物Fe(OH)3Fe(OH)2Co(OH)2Co(OH)3Al(OH)3Ni(OH)2开始沉淀pH 2.27.47.60.1 4.07.6完全沉淀pH 3.28.99.2 1.1 5.29.2(1)用硫酸浸取金属电极芯时,提高浸取率的方法有______________(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、____________,“浸出液”调节pH的范围为________,调节pH选用的试剂可以是________(填字母)。
a.铁b.氨水c.碳酸钠溶液d.稀硫酸(3)由“母液4”获取NiSO4·7H2O的操作是_______________,____________,过滤,洗涤。
答案(1)适当的升高温度(或将金属电极芯研成粉末)(2)Al(OH)3 5.2≤pH<7.6 bc(3)蒸发浓缩 冷却结晶解析 (2)金属电极芯中的主要成分是Co 、Ni ,还含少量Fe 、Al 等,加入稀硫酸酸浸时,金属单质都转化为金属离子(Ni 2+、Co 2+、Fe 2+、Al 3+),浸出液中加入过氧化氢的作用是氧化亚铁离子为铁离子,由流程图中最终产物可知,调节pH 的作用是除去溶液中的Fe 3+、Al 3+,故沉淀A 的主要成分是Fe(OH)3、Al(OH)3;为了保证Fe 3+、Al 3+沉淀完全而Ni 2+、Co 2+不沉淀,由表格数据可知,要调节pH 的范围为5.2≤pH<7.6;调节pH 时不能加入铁,因为铁能还原铁离子为亚铁离子,不能加入稀硫酸,因为要将溶液的pH 调大,由流程图中后续所加试剂可知,调节pH 选用的试剂可以是氨水、碳酸钠溶液。
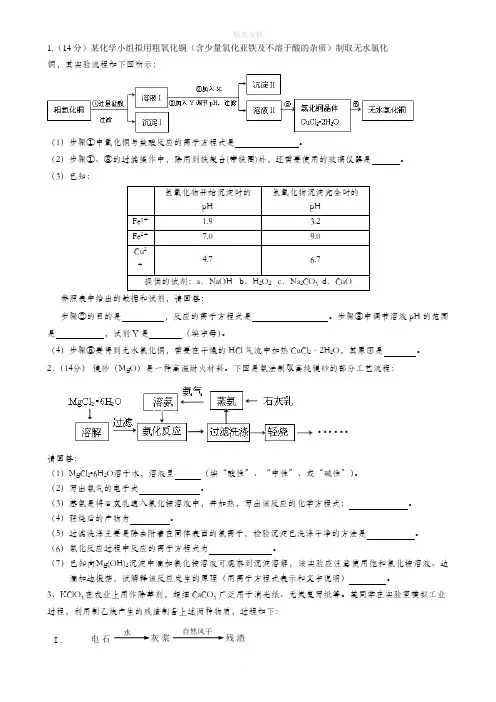
1.(14分)某化学小组拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,其实验流程如下图所示:(1)步骤①中氧化铜与盐酸反应的离子方程式是。
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是。
(3)已知:氢氧化物开始沉淀时的pH 氢氧化物沉淀完全时的pHFe3+ 1.9 3.2Fe2+7.09.0Cu2+4.7 6.7提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO参照表中给出的数据和试剂,请回答:步骤②的目的是,反应的离子方程式是。
步骤③中调节溶液pH的范围是,试剂Y是(填字母)。
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·2H2O,其原因是。
2.(14分)镁砂(MgO)是一种高温耐火材料。
下图是氨法制取高纯镁砂的部分工艺流程:请回答:(1)MgCl2•6H2O溶于水,溶液呈(填“酸性”、“中性”、或“碱性”)。
(2)写出氨气的电子式。
(3)蒸氨是将石灰乳通入氯化铵溶液中,并加热,写出该反应的化学方程式:。
(4)轻烧后的产物为。
(5)过滤洗涤主要是除去附着在固体表面的氯离子,检验沉淀已洗涤干净的方法是。
(6)氨化反应过程中反应的离子方程式为。
(7)已知向Mg(OH)2沉淀中滴加氯化铵溶液可观察到沉淀溶解,该实验应注意使用饱和氯化铵溶液、边滴加边振荡,试解释该反应发生的原理(用离子方程式表示和文字说明)。
3、KClO3在农业上用作除草剂,超细CaCO3广泛用于消光纸、无炭复写纸等。
某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:Ⅰ.电石水灰浆自然风干残渣① 电石与水反应的化学方程式是。
② 残渣..中主要成分是Ca(OH)2 和。
Ⅱ. 将Ⅰ中的部分灰浆..配成浊液,通入Cl2 ,得到Ca(ClO3)2与CaCl2物质的量之比为1∶5的溶液,反应的化学方程式是。
Ⅲ. 向Ⅱ所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体。

工艺流程图专题一、工艺流程路线示意图箭头:进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。
出线、进线:表示物料流向或操作流程;反向线:表示物质循环使用;方框:表示经过反应或操作后剩余的物质。
二、工艺流程题的解题方法与策略1.一般采用首尾分析法,明确原始物质及目标产物2.读流程,观其大略,找出流程主线(即从流程开始到达产品或是达成实验目的的为主线,其他的是支线,如上图)。
3.常考的操作术语及目的:(1)对原料进行预处理的常用方法及其作用①粉碎(研磨):增大反应物的,加快或使反应。
②灼烧(煅烧):使固体在高温下分解或使杂质在高温下氧化、分解等。
使反应充分进行或增大转化率。
(2)明确常用的分离方法①过滤:和的分离。
所需仪器有铁架台(带铁圈)、滤纸、。
洗涤:尽量除去晶体表面的杂质或干扰物质。
干燥:除去固体中的水。
4.答题技巧:(1)所设问题一般都是孤立的,在解答时不要求流程全看懂后再解答,看不懂的地方先跳过去,继续解答后面的问题。
有时候可以直接使用“节点法”进行解题,即进入“节点”的物质是反应物,流出“节点”的是生成物。
(2)抓住一个关键点:一切反应或操作都是为了获得产品或是达成实验的目的。
(3)推断流程图某一步中的物质,可以从上一步操作中反应物可能发生的反应入手进行分析,同时需注意所加试剂是否有过量(剩余),要关注物质在流程“节点”中转移情况(三大转移):反应产物转移;不反应物质转移和过量物质转移。
(4)陌生化学方程式的书写:根据箭头方向,箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物);若从已知信息中找出的反应物和生成物不满足质量守恒定律,可以在反应物或生成物中加上水,然后进行配平,还应注意反应条件的有关信息;若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
(5)循环利用的物质:某物质不在流程的主线上而在流程的支线上,它是某一步骤中的产物同时也是另一步骤中的原料,它即是这个流程中的循环利用物质。

2019年中考专题复习-工艺流程图题(附答案)1.化学研究小组通过CO2催化氢化制甲烷,实现了将CO2转化为有机物。
实验过程如下:将CO2、水、铁粉、镍粉混合物加热至高温,然后冷却并初步分离液体、固体和气体。
对反应后的物质进行检测,发现气体中有甲烷和氢气,液体中有甲酸(HCOOH),固体中有镍粉和四氧化三铁。
问题如下:①反应中的催化剂很可能是镍粉。
②转化成的有机物是甲烷。
③铁粉与水蒸气反应生成Fe3O4和H2,该反应的基本反应类型是还原反应。
④被蚊虫叮咬时,在叮咬处涂抹食盐水或草木灰水会减轻痛痒。
2.某工厂采用海水脱硫技术吸收燃煤烟气中的SO2,其主要设备有海水泵、吸收塔、曝气池①和曝气池②。
海水脱硫设备中,排出的海水呈碱性的是吸收塔。
向曝气池①内通入空气后,主要有两个化合反应发生,其中一个反应的化学方程式为:2HCO3- + O2 → 2CO2 + 2H2O。
曝气池②排放的海水中不含H2SO4的原因是H2SO4与Ca(OH)2反应生成CaSO4↓ + 2H2O。
3.为实现对废旧电路板中锡的绿色回收,某工艺流程如下:先将废旧电路板加热至高温,使其分解为铜、锡和塑料等物质,然后将固体A中的锡与SnCl4反应,生成SnCl2,再将SnCl2还原为Sn。
已知Sn+SnCl4=2SnCl2,SnCl4中锡元素的化合价是+4.铜的金属活动性比锡强,固体A中一定含有铜元素。
步骤②发生反应的化学方程式为:Sn + 2HCl → SnCl2 + H2↑。
相比于直接焚烧废旧电路板回收金属,该工艺主要优点是绿色环保。
4.纳米碳酸钡是一种重要的无机化工产品,某厂生产纳米碳酸钡的工艺流程如下图所示。
试剂A的化学式为BaCl2,操作1和操作2是同一种操作,该操作名称是沉淀。
2.某工厂的废水处理流程该工厂废水处理流程包括三个步骤:中和、沉淀和过滤。
中和过程中,加入NaOH溶液调节废水pH值,使废水中的MgSO4和FeCl3逐渐沉淀。

机械加工工艺流程图单选题100道及答案1. 机械加工工艺流程图中,通常第一步是()A. 毛坯准备B. 划线C. 粗加工D. 热处理答案:A解析:机械加工一般先准备毛坯。
2. 以下哪种符号在工艺流程图中表示加工工序?()A. 三角形B. 圆形C. 矩形D. 菱形答案:C解析:矩形通常表示加工工序。
3. 工艺流程图中,用于表示检验的符号是()A. 正方形B. 椭圆形C. 六边形D. 菱形答案:D解析:菱形符号表示检验。
4. 机械加工中,安排热处理工序的主要目的是()A. 提高硬度B. 改善切削性能C. 消除内应力D. 以上都是答案:D解析:热处理工序能达到提高硬度、改善切削性能、消除内应力等目的。
5. 工艺流程图中,箭头通常表示()A. 工序顺序B. 加工方向C. 材料流动D. 以上都是答案:D解析:箭头在工艺流程图中可表示工序顺序、加工方向、材料流动等。
6. 粗加工之后,通常安排的工序是()A. 半精加工B. 精加工C. 光整加工D. 质检答案:A解析:粗加工后一般进行半精加工。
7. 以下哪种加工方法常在工艺流程图的前端?()A. 磨削B. 车削C. 铣削D. 钻孔答案:B解析:车削常作为较初始的加工方法。
8. 机械加工工艺流程图的制定依据不包括()A. 零件结构B. 生产批量C. 设备条件D. 工人经验答案:D解析:工人经验不是制定工艺流程图的主要依据。
9. 工艺流程图中,用于表示存储的符号是()A. 平行四边形B. 五边形C. 八边形D. 梯形答案:A解析:平行四边形表示存储。
10. 零件精度要求高时,工艺流程图中会增加()A. 加工工序B. 热处理工序C. 检验工序D. 辅助工序答案:C解析:精度要求高会增加检验工序。
11. 以下哪种加工工艺常用于提高零件表面粗糙度?()A. 珩磨B. 刨削C. 插削D. 拉削答案:A解析:珩磨常用于提高零件表面粗糙度。
12. 工艺流程图中,若某工序需要特殊设备,应在()注明。
2020届高考化学三轮冲刺大题强化特训《工业流程(一)》1.某厂废水中含5.00×10-3mol·L-1的Cr2O72-,其毒性较大。
某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:(1)第①步反应的离子方程式是____________________________________;(2)第②步中用pH试纸测定溶液pH的操作是:______________________________;(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有______________________;(4)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。
理论上需要加入__________g FeSO4·7H2O。
【答案】(1)Cr2O72-+ 6Fe2++ 14H+=2Cr3+ + 6Fe3++ 7H2O(2分)(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照(2分)(3)Fe(OH)3、Fe(OH)2(2分) (4)13.9(3分)【解析】(1)Cr2O72-有较强氧化性,FeSO4•7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上;(3)由题给框图可得:Fe2+过量,加NaOH时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物;(4)1 L废水中含n(Cr2O72-)=5.00×10-3 mol。
化工工艺流程专项训练1.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。
以下是过氧化氢法生产亚氯酸钠的工艺流程图:已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为________,若要计算该溶液溶质的质量分数,还需要的一个条件是________________________。
(2)在发生器中鼓入空气的作用可能是________(填序号)。
A.将SO2氧化成SO3,增强酸性B.稀释ClO2以防止爆炸C.将NaClO3氧化成ClO2 (3)吸收塔内的反应的化学方程式为_________________,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:_____________________。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是________________________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。
除H2O2外,还可以选择的还原剂是________(填序号)。
A.Na2O2B.Na2S C.FeCl2 D.PbO(悬浊液)(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________(填序号)。
A.蒸馏B.蒸发C.灼烧D.过滤E.冷却结晶要得到更纯的NaClO2·3H2O晶体必须进行的操作是__(填操作名称)。
2.下图所示是以海水为原料,获得某产物的工艺流程图。
已知在吸收塔中,溶液的pH显著减小。
试回答下列问题:(1)图中两次氯化的作用是否相同?______(选填“是”或“否”)。
化学工艺流程图题题型之一金属资源的回收与利用1.废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对锡的绿色回收,设计如下工艺流程:已知:Sn+SnCl4===2SnCl2。
(1)塑料属于___________(填“有机物”或“无机物”)。
(2)SnCl2中锡元素的化合价是________。
(3)铜的金属活动性比锡的________(填“强”或“弱”);固体A中一定含有的金属元素是________。
(4)写出步骤②发生反应的化学方程式______________________,其基本反应类型是____________。
(5)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是___________(回答一点)。
2.金属钛广泛用于航空航天工业、化工、医疗等领域。
用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如图1所示:图1图2请回答下列问题:(1)构成金属钛的微粒是_______(填“分子”“原子”或“离子”),H2TiO3中钛元素的化合价为______。
(2)反应②需持续通入氩气,氩气的作用是______________________。
(3)反应③的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,则该反应的化学方程式为______________________。
(4)反应①②③中属于分解反应的是___________。
(5)对反应③进行改进,可直接生产锂离子电池的电极材料LiFePO4,工艺流程如图2所示。
写出“高温煅烧”由FePO4制备LiFePO4的化学方程式_________________________________。
3.某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。
现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了_________现象。
题型三工艺流程图题【题型分析】工艺流程图题实际上是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。
工艺流程图题的结构分题头、题干和题尾三部分:题头一般是简单介绍该工艺生产的原材料和工艺生产的目的(包括附产品);题干部分主要用框图形式将原料到产品的主要生产工艺流程表示出来;题尾主要是根据生产过程中涉及的化学知识设置成系列问题,构成一道完整的化学试题。
一般来说,流程题只有两个目的:一是从混合物中分离、提纯某一物质;另一目的就是利用某些物质制备另一物质。
这样可以将流程题分为两个类型:一、除杂、分离、提纯类工艺流程图题本质就是对混合物的除杂、分离、提纯。
①首先,找出要得到的主要物质,混有哪些杂质;②然后,认真分析当加入某一试剂后,能与什么物质发生反应,生成了什么产物;③最后,思考要用什么样的方法才能将杂质除去。
这样才能理解每一步所加试剂或操作的目的。
二、物质制备类工艺流程图题这样的题目一般:①先是确定要制备什么物质,从题干或问题中获取有用信息,了解产品的性质(具有某些特殊性质的产物,要采取必要的措施来避免在生产过程中产生其他杂质,例如,产品受热易分解,可能要低温烘干、减压烘干、减压蒸发等);②分析流程中的每一步骤,从几个方面了解流程:反应物是什么?化学方程式是什么?该反应造成了什么后果?对制造产品有什么作用?③从问题中获取信息,帮助解题。
标准化问题要标准化回答。
物质制备类型的化学工艺流程图题往往也伴随着除杂、分离、提纯的实验操作。
【举例精讲】类型一分离回收金属类例题1 某工厂废液中含有氯化钠、氯化铜和氯化亚铁。
某化学兴趣小组想废物再利用,要从废液中回收铜并得到铁红(主要成分Fe2O3)。
已知物质A是日常生活中使用最广泛的金属。
他们设计的实验方案如图:回答下列问题:(1)步骤①反应的化学方程式为。
(2)固体甲的成分有 (用化学式表示)。
(3)完成步骤④的化学方程式:4Fe(OH)2+O2+ 4Fe(OH)3。