高考化学专题强化训练---物质结构与性质
- 格式:pdf
- 大小:591.49 KB
- 文档页数:13

新高考化学高考化学压轴题物质的结构与性质专项训练分类精编附解析一、物质的结构与性质的综合性考察1.硼(B)、铝及其化合物在化学中有重要的地位。
请回答下列问题:Ⅰ.(1)与B的基态原子电子排布式中成单电子数相同的第二周期元素还有______(填写元素符号)。
Ⅱ.硼酸(H3BO3)是白色片状晶体(层状结构如图1),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
(2)硼酸分子以范德华力、共价键和氢键形成环状结构,每个含有B原子的环中平均含有B原子的个数为______个。
其中B原子的杂化类型为______。
(3)加热时,硼酸的溶解度增大,主要原因是______。
(4)硼酸是一元弱酸,其分子式亦可写为B(OH)3,在水中电离时,硼酸结合水电离出来OH-的而呈酸性,写出硼酸的电离方程式______。
(5)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子的结构式或结构简式为______(标出配位键)。
Ⅲ.硼氢化钠是一种常用的还原剂。
其晶胞结构如图2所示:(6)该晶体中Na+的配位数为______。
(7)若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为______。
(8)LiAlH4也是一种特殊的还原剂,可将羧酸直接还原成醇:CH3COOH CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
Ⅳ.(9)硼化镁晶体在39K时呈超导性。
在硼化镁晶体中,镁原子和硼原子是分层排布的,如图3是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。
则硼化镁的化学式为______。
2.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。
制备石墨烯方法有石墨剥离法、化学气相沉积法等。
石墨烯的球棍模型及分子结构示意图如下:(1)下列有关石墨烯说法正确的是_____。
A 石墨烯的结构与金刚石相似B 石墨烯分子中所有原子可以处于同一平面C 12g 石墨烯含σ键数为 N AD 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。

2.(20xx·湖南名校大联考)钛被称为继铁、铝之后的第三金属,回答下列问题:(1)基态钛原子的价电子排布图为________________________,金属钛晶胞如图1所示,为________(填堆积方式)堆积。
(2)已知TiCl4在通常情况下是无色液体,熔点为-24℃,沸点为136℃,可知TiCl4为________晶体。
图1(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。
化合物乙的沸点明显高于化合物甲,主要原因是______________ ________________。
化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________。
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为________。
(5)钙钛矿晶体的结构如图4所示。
钛原子位于立方晶胞的顶角,被________个氧原子包围成配位八面体;钙原子位于立方晶胞的体心,被________个氧原子包围,钙钛矿晶体的化学式为________。
[解析] (1)Ti为22号元素,由构造原理可知基态Ti原子的3d 能级和4s能级上各有2个电子,则其价电子排布图为;由题图1可知,钛晶体的堆积方式为六方最密堆积。
(2)根据TiCl4在通常情况下呈液态,且熔沸点较低,可知TiCl4为分子晶体。
(3)化合物乙能形成分子间氢键,而化合物甲不能形成分子间氢键,故化合物乙的沸点明显高于化合物甲。
化合物乙中采取sp3杂化的原子有C、N、O,第一电离能N >O>C。
(4)如题图3所示,每个O原子被2个Ti原子共用,每个Ti原子被2个O原子共用,由均摊法可知该阳离子中Ti、O原子个数之比为1∶1,结合Ti为+4价,O为-2价,故该阳离子的化学式为TiO2+(或[ TiO]2n+n)。
(5)钛原子位于立方晶胞的顶角,被6个氧原子包围成配位八面体;钙原子位于立方晶胞的体心,被12个氧原子包围;每个晶胞中含有的钛原子和钙原子均为1个,晶胞的12个边上各有一个氧原子,根据均摊法可知每个晶胞实际占有的氧原子数为12×1 4=3,故该钙钛矿晶体的化学式为CaTiO3。

高考化学复习专题检测—物质结构与性质(含解析)一、选择题(本题包括25小题,每小题2分,共50分,每小题只有一个选项符合题意)1.(2023·黑龙江省绥化市第九中学高三质检)已知在一定条件下,SO2也能体现其氧化性,例如:2H2S+SO2=3S+2H2O,下列化学用语使用正确的是()A.SO2的VSEPR模型:B.HS-电离的离子方程式:HS-+H2O H2S+OH-C.基态硫原子p x轨道的电子云轮廓图:D.基态氧原子最外层电子的轨道表示式:【答案】C【解析】A项,二氧化硫中心原子S的价层电子对数为3,有1对孤电子对,S杂化类型为sp2,VSEPR模型为平面三角形,A错误;B项,HS-电离的离子方程式HS-H++S2-,B错误;C项,基态硫原子P x轨道的电子云轮廓为哑铃型,C正确;D项,基态氧原子最外层电子的轨道表示式:,D错误;故选C。
2.(2023·江苏省南京市江宁区高三期中)尿素CO(NH2)2是一种高效化肥,也是一种化工原料。
反应CO2+2NH3CO(NH2)2+H2O可用于尿素的制备。
下列有关说法不正确...的是()A.NH3与CO(NH2)2均为极性分子B.N2H4分子的电子式为C.NH3的键角大于H2O的键角D.尿素分子σ键和π键的数目之比为6∶1【答案】D【解析】A项,NH3分子为三角锥形,为极性分子,CO(NH2)2中的N原子与NH3中的N成键方式相同,所以二者均为极性分子,A正确;B项,N原子的最外层电子数为5个,要达到稳定结构,N2H4的电子式为:,B正确;C项,NH3分子中有3个σ键,1对孤电子对,H2O分子中有2个σ键和2对孤电子对,孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,所以H2O的键角小于NH3中的键角,C正确;D项,1个单键1个σ键,1个双键1个σ键和1个π键,尿素中含有6个单键和1个双键,7个σ键和1个π键,尿素分子σ键和π键的数目之比为7∶1,D错误;故选D。

专题突破练七 物质结构与性质(B)一、选择题1.(2021广东广州一模)2020年我国北斗三号全球卫星导航系统正式开通,其中“铷(Rb)原子钟”被誉为卫星的“心脏”,下列有关说法错误的是( )A.铷元素位于第ⅠA 族B.铷的金属性比钠弱C .3785Rb 的中子数为48D .3785Rb 和 3787Rb 具有相同的电子数2.(2021 湖南岳阳质量检测二)用化学用语表示C 2H 2+HClC 2H 3Cl(氯乙烯)中的相关粒子,其中正确的是( )A.中子数为7的碳原子:67CB.氯乙烯的结构简式:CH 2CHClC.氯离子的结构示意图:D.HCl 的电子式:H +[··Cl ······]- 3.(双选)(2021山东聊城一模)研究发现,在CO 2低压合成甲醇反应(CO 2+3H 2CH 3OH+H 2O)中,Co 氧化物负载的Mn 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
下列关于该反应的说法中错误的是( )A.CO 2和Mn 都属于金属晶体B.CO 2和CH 3OH 分子中C 原子的杂化形式相同C.该反应利用了H 2的还原性D.干冰晶体中每个CO 2分子周围有12个紧邻分子 4.(2021山东菏泽一模)LiAlH 4是重要的还原剂与储氢材料,在120 ℃下的干燥空气中相对稳定,其合成方法为NaAlH 4+LiCl LiAlH 4+NaCl 。
下列说法正确的是( )A.该反应可以在水溶液中进行B.基态锂原子的电子排布式为1s 22s 1,核外电子的空间运动状态有2种C.LiAlH 4中Al 原子采用sp 3杂化,Al H 4-的空间结构为正方形D.上述所有物质中电负性最大的元素与电负性最小的元素形成的化合物,其电子式为Na +[··H]-5.(2021山东济南十一校联考)下列各组物质性质的比较,结论正确的是( )A.物质的硬度:NaCl<NaBr<NaIB.物质的沸点:AsH 3>PH 3>NH 3C.氢化物水溶液的酸性:HCl>HBr>HID.稳定性:BaCO 3>SrCO 3>CaCO 36.(2021北京丰台区一模)已知1~18号元素的离子a W3+、b X+、c Y2-、d Z-都具有相同电子层结构,下列关系正确的是()A.质子数:c>bB.离子的还原性:Y2->Z-C.氢化物的稳定性:H2Y>HZD.原子半径:X<W7.(2021辽宁丹东一模)下列有关晶体及配合物结构和性质的判断错误的是()贵金属磷化物Rh 2P 可用作电解水的高效催化剂,其立方晶胞如图所示该晶体中磷原子的配位数为配离子[Co(NO)]3-可用于检验K+的存在该离子中8.(2021辽宁葫芦岛第一次模拟)向CuSO4溶液中通入H2S,会生成CuS沉淀,反应为CuSO4+H2SCuS↓+H2SO4。

专题11 第35题物质结构与性质(强化训练)1.氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等。
回答下列问题:(1)基态氟原子中有_________________种能量不同的电子。
(2)NF3是微电子工业中优良的等离子刻蚀气体。
NF3与NH3的空间构型相同,但是NH3(-33° C)的沸点比NF3(-129° C)的高,原因为_____________。
(3)氟硼酸(HBF4,属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因:________。
(4)液态[H2F]+中存在[H2F]+和[HF2]-,[HF2]-的结构可表示为[F-H…F]-,[H2F]+的VSEPR模型名称为________形。
NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。
常温常压下为白色固体,易溶于水,160°C分解。
NaHF2中所含作用力的类型有______. (填字母)。
a 离子键b 共价键c 配位键d 氢键(5)CaF2是难溶化合物,其品胞结构如图所示:①若原子坐标参数A处为(0,0,0),B处为(11,022,),C处为(1,1,1),则D处为_____.②每个Ca2+周围距离最近的Ca2+共有_____个。
③已知:CaF2晶体密度为cg·cm-3 ,则晶胞中Ca2+与最近的F-之间的距离为____nm(设N A表示阿伏加德罗常数的值,用含c、N A的式子表示)。
2.完成下列问题。
(1)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等.①As的基态原子的电子排布式[Ar]_______________.②第一电离能:As___Ga(填“>”、“<”或“=”).(2)配合物Fe(CO)5常温下呈液态,熔点为-20.5 ℃,易溶于CCl4 中,则Fe(CO)5是______分子(非极性或极性)。

第十一章物质结构与性质1.(2024·海南高考)Ⅰ.下列各组物质性质的比较,结论正确的是( )A.分子的极性:BCl3<NCl3B.物质的硬度:NaI<NaFC.物质的沸点:HF<HClD.在CS2中的溶解度:CCl4<H2OⅡ.锰单质及其化合物应用非常广泛。
回答下列问题:(1)Mn位于元素周期表中第四周期________族,基态Mn原子核外未成对电子有________个。
(2)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为________键。
NH3分子的空间构型为________,其中N原子的杂化轨道类型为________。
(3)金属锰有多种晶型,其中δ-Mn的结构为体心立方积累,晶胞参数为a pm,δ-Mn 中锰的原子半径为________pm。
已知阿伏加德罗常数的值为N A,δ-Mn的理论密度ρ=________g·cm-3。
(列出计算式)(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为________,其配位数为________。
答案Ⅰ.ABⅡ.(1)ⅦB 5 (2)配位三角锥形sp3(3)3a42×55N A a3×10-30(4)+2 6解析Ⅰ.BCl3是平面正三角形,分子中正负电荷中心重合,是非极性分子;而NCl3的N 原子上有一对孤电子对,是三角锥形,分子中正负电荷中心不重合,是极性分子,所以分子极性:BCl3<NCl3,A正确;NaF、NaI都是离子晶体,阴、阳离子通过离子键结合,由于离子半径F-<I-,离子半径越小,离子键越强,物质的硬度就越大,所以物质硬度:NaF>NaI,B 正确;HCl分子之间只存在分子间作用力,而HF分子之间除存在分子间作用力外,还存在分子间氢键,因此HF的沸点比HCl的高,C错误;CCl4、CS2都是由非极性分子构成的物质,H2O 是由极性分子构成的物质,依据相像相溶原理可知,由非极性分子构成的溶质CCl4简单溶解在由非极性分子构成的溶剂CS2中,由极性分子H2O构成的溶质不简单溶解在由非极性分子构成的溶剂CS2中,所以溶解度:CCl4>H2O,D错误;故合理选项是AB。

专题突破练七物质结构与性质(A)一、选择题1.(2021北京石景山一模)下列关于元素及元素周期律的说法,正确的是()A.同主族元素的原子,最外层电子数相等且等于主族序数B.铝元素在周期表中位于第四周期ⅢA族C.410Be的原子核内中子数是10D.第117号元素Ts的非金属性强于Br2.(2021湖北八市联考)长征六号运载火箭将卫星送入预定轨道的过程中,提供动力的化学反应为C2H8N2+2N2O43N2+2CO2+4H2O。
下列说法错误的是()A.N2的电子式:··N︙︙N··B.CO2的空间填充模型:C.CO2是氧化产物D.电负性大小:O>N3.(2021湖北七市州教科研协作体联考)NF3与汞共热得到N2F2和一种汞盐,下列有关说法错误的是()A.NF3的空间结构为三角锥形B.N2F2的结构式为F—N N—FC.NF3的沸点一定高于NH3的沸点D.N2F2:分子存在顺反异构4.(2021湖北教科研协作体联考)一种用于治疗流行性感冒的药物的主要成分的结构简式如图。
下列关于该有机物的说法错误的是()A.分子中只有1个手性碳原子B.分子中共平面碳原子最多有7个C.键角α>βD.1 mol该有机物消耗Na与NaOH的物质的量之比为3∶25.(2021山东烟台诊断性测试)已知W、X、Y、Z为短周期元素,原子序数依次增大。
W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。
下列说法一定错误的是()A.电负性:W>Z>Y>XB.气态氢化物熔、沸点:W > ZC.简单离子的半径:W>X>ZD.若X与W原子序数之差为5,则形成化合物的化学式为X3W26.(2021湖南永州第三次模拟)如表所示为元素周期表的一部分,其中X、Y、Z、W为短周期元素,T 的单质常温下为液体。
下列说法错误的是()A.X、Y的单质均存在同素异形体B.Y、Z的简单氢化物的稳定性依次递增C.R的单质可用于制造半导体材料D.Y、Z、W元素简单阴离子的半径大小:Y>Z>W7.(2021辽宁葫芦岛第一次模拟)一种新型电池的电解质是由短周期主族元素组成的化合物,结构如右图所示。

2023届高考化学一轮专题训练题—物质结构与性质 1.(2022·广东广州·模拟预测)环烷酸金属(Cu 、Ni 、Co 、Sn 、Zn )盐常作为合成聚氨酯过程中的有效催化剂。
请回答下列问题:(1)基态Co 原子的价电子排布式为___________。
(2)镍的氨合离子()236Ni NH +⎡⎤⎣⎦中存在的化学键有___________。
A .离子键B .共价键C .配位键D .氢键E .σ键F .π键(3)Cu 、Zn 的第二电离能比较:()2I Cu ___________()2I Zn (填>、=或<)。
(4)锡元素可形成白锡、灰锡、脆锡三种单质。
其中灰锡晶体与金刚石结构相似,但灰锡不如金刚石稳定,其原因是___________。
(5)硒化锌晶胞结构如图所示,其晶胞参数为apm 。
①已知原子坐标:A 点为()0,0,0,B 点为()1,1,1,则C 点原子坐标为___________。
①若硒化锌晶体的密度为-3ρg cm ⋅,则阿伏加德罗常数A N =___________(用含a 、ρ的计算式表示)。
2.(2022·广西南宁·模拟预测)我国“嫦娥”五号首次实现地外天体采样返回,这是我国航天事业的又一突破。
带回的月壤中含有H 、N 、O 、Al 、S 、Cd 、Zn 、Ti 、Cu 、Au 、Cr 等多种元素。
请完成下列问题:(1)N 、O 、Al 、S 四种元素第一电离能从大到小的顺序为_______。
(2)Cu 、Au 是同一副族的元素,Au 的原子序数更大,它们属于_______区元素,基态Au 原子的价电子排布式为_______。
(3)SO 2分子的空间构型为_______,请写出一种与SO 2互为等电子体的单质_______(填化学式)。
(4)某晶体的晶胞结构如图所示,该晶体的化学式为_______。
如果将Se 原子看做密堆积,则其堆积模型为_______。
2023届高考化学一轮备考专题练习题:物质结构与性质一、结构与性质1.(2022·山东滨州·高三期末)前四周期元素A 、B 、C 、D 、E 的原子序数依次增大,A 元素原子的核外电子只有一种运动状态;基态B 原子s 能级的电子总数比p 能级的多1;基态C 原子和基态E 原子中成对电子数均是未成对电子数的3倍;D 形成简单离子的半径在同周期元素形成的简单离子中最小。
回答下列问题:(1)E 的元素名称为_______,它位于元素周期表的_______区。
(2)元素A 、B 、C 中,电负性最大的是_______(填元素符号,下同),元素B 、C 、D 第一电离能由大到小的顺序为_______。
(3)与同族其他元素X 形成的3XA 相比,3BA 易液化的原因是_______。
(4)3BC -中B 原子轨道的杂化类型为_______,3A C +离子的空间结构为_______。
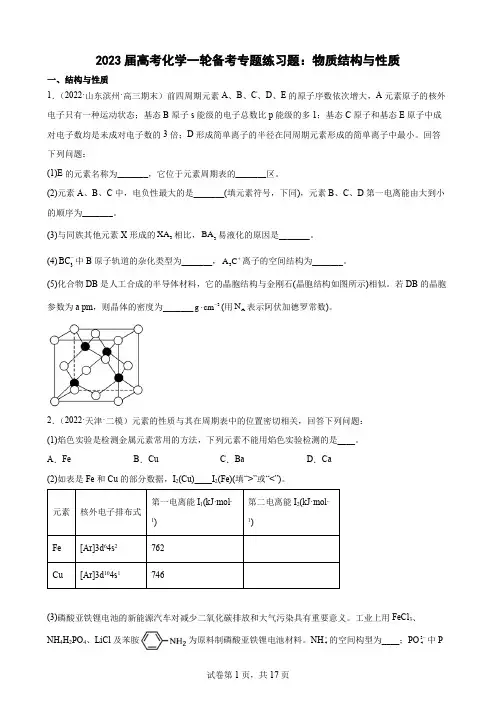
(5)化合物DB 是人工合成的半导体材料,它的晶胞结构与金刚石(晶胞结构如图所示)相似。
若DB 的晶胞参数为a pm ,则晶体的密度为_______3g cm -⋅(用A N 表示阿伏加德罗常数)。
2.(2022·天津·二模)元素的性质与其在周期表中的位置密切相关,回答下列问题:(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是____。
A .FeB .CuC .BaD .Ca(2)如表是Fe 和Cu 的部分数据,I 2(Cu)____I 2(Fe)(填“>”或“<”)。
(3)磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。
工业上用FeCl 3、NH 4H 2PO 4、LiCl 及苯胺为原料制磷酸亚铁锂电池材料。
NH 4+的空间构型为____;PO 34-中P的杂化轨道类型是____;O、P、Cl原子的半径最大的是____。
(填元素符号)(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是____。

2023届高考化学一轮专题复习-----物质结构与性质专题训练1.()24Zn CN -⎡⎤⎣⎦在水溶液中与HCHO 发生如下反应:()()22222444HCHO Zn CN 4H 4H O Zn H O 4HOCH CN -++⎡⎤⎡⎤+++=+⎣⎦⎣⎦。
下列说法正确的是A .HCHO 的分子构型是是三角锥形B .基态2Zn +的电子排布式为[]82Ar 3d 4sC .()224Zn H O +⎡⎤⎣⎦中与2Zn +形成配位键的原子是HD .1mol 2HOCH CN 中所含σ键的数目是6mol 2.下列各项叙述中,正确的是A .SO 2分子的空间构型与它的VSEPR 模型一致B .价电子排布为5s 25p 1的元素位于第五周期第I A 族,是s 区元素C .在同一电子层上运动的电子,其自旋方向可以相同D .s -s σ键与s -p σ键的电子云形状的对称性不相同3.3Fe +由于核外有空的d 轨道,可与一些配体形成配位数为6的配离子。
某同学将淡紫色的()323Fe NO 9H O ⋅晶体溶于水后再依次加KSCN 和NaF ,发现溶液出现下列变化:已知:()3+26Fe H O ⎡⎤⎣⎦为浅紫色,()36Fe SCN -⎡⎤⎣⎦为红色,[]3-6FeF 为无色。
下列说法错误的是A .()323Fe NO 9H O ⋅晶体溶于水后溶液不是浅紫色而是黄色,是因为3Fe +水解生成()3Fe OH 所致B .SCN -与3Fe +形成配位键时,S 原子提供孤电子对C .溶液Ⅱ加NaF 后溶液由红色变为无色,说明SCN -与3Fe +配位键强度不及F -与3Fe +配位键强度D .焰色试验中可用无锈铁丝替代铂丝,说明铁灼烧时无焰色且不会产生发射光谱 4.下列化学用语正确的是 A .硝基苯的结构简式B .丙烷分子的比例模型为C .四氯化碳分子的电子式为D .2-乙基-1,3-丁二烯分子的键线式为5.下列图示与对应的叙述相符的是(夹持装置已略去)A .AB .BC .CD .D6.2022年4月16日,神舟十三号飞船成功着陆,此次飞行为中国建造“天宫”空间站打下重要基石。
2023届高考化学专项练习:物质结构与性质1.(2022·陕西渭南·统考一模)回答下列问题:(1)氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。
如图是氨基酸锌的结构简式。
①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是__________________。
②最简单的氨基酸是甘氨酸(结构简式如图),其结构中π键与σ键的数量比为____________。
(2)分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。
①配合物中每个中心离子的配位数为____________________________。
②Co2+的最高能层电子排布式为________________。
③下列状态的钴中,电离最外层一个电子所需能量最大的是____________(填标号)A.[Ar]3d74s1B.[Ar]3d74s2C.[Ar]3d74s14p1D.[Ar]3d74p1(3)二氯甲醛的结构简式为,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是________________________________________________。
(4)碳酸亚乙酯()是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因______________________________________________。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)m RO n,如果成酸元素R相同,则n值越大的R正电性越高,导致R—O—H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱__________________________。
2.(2022·天津·模拟预测)1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。
化学—选修3:物质结构与性质1.【13新课标Ⅰ】硅是重要的半导体材料,构成了现代电子工业的基础。
回答下列问题: (1)基态Si原子中,电子占据的最高能层符号,该能层具有的原子轨道数为、电子数为。
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。
工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,,该反应的化学方程式为。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是②SiH4的稳定性小于CH4,更易生成氧化物,原因是(6)在硅酸盐中,四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为。
Si与O的原子数之比为化学式为2.【14新课标Ⅰ】早期发现的一种天然二十面准晶颗粒由Al、Cu、Fe三种金属元素组成。
回答下列问题:(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有个未成对电子,Fe3+的电子排布式为:可用硫氰化钾检验Fe3+,形成的配合物的颜色为。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为;1mol乙醛分子中含有的σ键的数目为。
乙酸的沸点明显高于乙醛,其主要原因是:。
氧化亚铜为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 ,列式表示铝单质的密度g·cm-3(不必计算出结果)。
3.【15新课标Ⅰ】碳及其化合物广泛存在于自然界中,回答下列问题:(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用形象化描述。
高考二轮复习强化卷十二:物质结构与性质1、已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A,其结构如图甲。
硫酸铜与次磷酸钠在少量硫酸存在的条件下反应得到CuH红色沉淀,CuH晶体结构单元如图乙所示。
1.Cu元素基态原子的外围电子排布式为__________。
2.1mol氨基乙酸钠中含有σ键的数目为__________。
3.氨基乙酸钠分解产物之一为二氧化碳,写出二氧化碳的一种等电子体__________(写化学式)。
已知二氧化碳在水中溶解度不大,却易溶于二硫化碳,请解释原因:__________。
4.硫酸根离子的空间构型为__________;已知硫酸铜灼烧可以生成一种红色晶体,其结图丙,则该化合物的化学式是__________。
5.配合物A中碳原子的杂化轨道类型是__________。
6.CuH晶体的密度为ρ g/cm3,阿伏加德罗常数的值为N A,则该晶胞中Cu原子与H原子之间的最短距离为__________cm(用含ρ和N A的式子表示)。
2、[化学——选修3:物质结构与性质]常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
1.基态亚铜离子(Cu+)的价层电子排布式为__________;高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:__________。
2.H2O的沸点高于H2Se的沸点(-42℃),其原因是__________。
3. GaCl3和AsF3的立体构型分别是__________,__________。
4.硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为__________。
②[B(OH)4]-的结构式为__________。
5.金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
2023届高考化学一轮专题复习--物质结构与性质专题训练1.化合物G 是一种治疗关节疼痛的药物,其一种合成路线如图所示(部分反应条件已经略去):回答下列问题:(1)有机物A 的名称为_______。
(2)由B 生成C 的反应类型为_______。
(3)C 中官能团的名称为_______;E 中手性碳(注:连有4个不同的原子或基团的碳)的个数为_______。
(4)F 生成G 时,还会有硫酸铵生成,写出反应的化学方程式:_______。
(5)比G 少5个碳原子的G 的同系物为X ,其同分异构体有多种,写出同时符合以下条件的X 的同分异构体的结构简式_______。
①属于芳香酯 ①核磁共振氢谱中有四组峰,且峰的面积之比为3:2:2:1(6)已知222R-CN+H R-CH NH 一定条件−−−−→设计以苯甲醛()为原料制备苯甲胺)的合成路线:_______(其他试剂任选)。
2.环丁基甲酸是有机合成中一种有用的中间体。
某研究小组以丙烯醛为原料,设计了如图所示路线合成环丁基甲酸(部分反应条件、产物已省略)。
已知:①;①。
回答下列问题:(1)化合物A 中的官能团名称为___________。
(2)B→D的化学反应类型为___________。
(3)写出化合物F的结构简式:___________。
(4)下列说法中不正确的是___________(填字母)。
Na CO溶液反应A.化合物A能与23C H OB.化合物G的化学式为684C.化合物B和C能形成高聚物1mol HD.1mol化合物B与足量金属钠能反应生成2(5)写出C→E的化学方程式:___________。
(6)环丁基甲酸与苯酚反应生成一种酯X,化合物X满足下列条件的所有同分异构体有___________种,写出其中一种的结构简式:___________。
FeCl溶液变紫色①能使3①含有丙烯醛中所有的官能团①核磁共振氢谱有5组峰,且峰面积之比为6:2:2:1:1(7)结合已知信息,其他无机试剂任选,设计以2-甲基-1,3-丁二烯和化合物E为原料制备的合成路线___________。
2021届高考化学三轮强化—物质的结构与性质(B)1.二茂铁分子[()Fe C H]是一种金属有机配合物,是燃料油的添加剂,用以552提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。
它的结构如图所示,下列说法正确的是()Fe与环戊二烯离子(55C H-)之间为离子键B. 1mol环戊二烯()中含有σ键的数目为5NAC. 二茂铁分子中存在π键D. Fe2+的电子排布式为22626421s2s2p3s3p3d4s2.下列对一些实验事实的理论解释正确的是()3.我国科学家利用Cu2O/Cu双催化剂在水溶液中用H原子将CO2高效转化为重要工业原料之一的甲醇,反应机理如图所示。
下列有关说法正确的是()A.CO 2生成甲醇是通过多步氧化反应实现的B.催化剂Cu 结合含碳微粒,催化剂Cu 2O 结合氢原子C.反应产物甲醇中可能含有其他副产物D.Cu 2O 中基态Cu +的核外电子排布式为[Ar]3d 94s 14.X 、Y 、Z 和W 为原子序数依次增大的四种短周期主族元素。
X 的一种核素可用于测定文物的年代,基态Y 原子的电子总数是其最高能级电子数的2倍,Z 是短周期中金属性最强的元素,W 的单质为黄绿色气体。
下列说法正确的是( )A. 第一电离能:W X Y Z >>>B. 原子半径:()()()()Z W Y X r r r r >>>C. Z 可与Y 形成化合物22Z YD. X 的氢化物中不存在非极性共价键5.原子序数依次增大的X 、Y 、Z 、W 四种元素,其中X 是形成化合物种类最多的元素,Y 原子基态时最外层电子数是其内层电子数的2倍,Z 原子基态时2p 原子轨道上有3个未成对的电子,W 的原子序数为29。
下列说法正确的是( )A.22Y X 分子中Y 原子轨道的杂化类型为2sp 杂化B.化合物4YX 的沸点比化合物3ZX 的沸点高C.W 的价层电子排布式为923d 4SD.Y 元素的电负性小于Z 元素的电负性6.《GreenChemistry 》报道了我国学者发明的低压高效电催化还原2CO 的新方法,其反应为2NaCl+CO CO+NaClO 通电。
高频热点强化训练(十一)1.(2019·全国卷Ⅰ·35)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。
回答下列问题:(1)下列状态的镁中,电离最外层一个电子所需能量最大的是 A (填标号)。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是 sp3、 sp3。
乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是乙二胺的两个N提供孤对电子给金属离子形成配位键,其中与乙二胺形成的化合物稳定性相对较高的是 Cu2+(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如表所示:解释表中氧化物之间熔点差异的原因 Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。
晶格能MgO>Li2O,分子间力(分子量)P4O6>SO2。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。
图(b)是沿立方格子对角面取得的截图。
可见,Cu原子之间最短距离x4a pm,Mg原子之间最短距离y4a pm。
设阿伏加德罗常数的值为N A,则MgCu2的密度是8×24+16×64N A a×10g·cm-3(列出计算表达式)。
【解析】(1)A.[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高;B.[Ne]3s2属于基态Mg原子,其失去一个电子变为基态Mg+;C.[Ne]3s13p1属于激发态Mg原子,其失去一个电子所需能量低于基态Mg原子;D.[Ne]3p1属于激发态Mg+,其失去一个电子所需能量低于基态Mg+,综上所述,电离最外层一个电子所需能量最大的是[Ne]3s1,答案选A;(2)乙二胺中N形成3个单键,含有1对孤对电子,属于sp3杂化;C形成4个单键,不存在孤对电子,也是sp3杂化;由于乙二胺的两个N可提供孤对电子给金属离子形成配位键,因此乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子;由于铜离子的半径较大且含有的空轨道多于镁离子,因此与乙二胺形成的化合物稳定性相对较高的是Cu 2+;(3)由于Li 2O 、MgO 为离子晶体,P 4O 6、SO 2为分子晶体。
高考化学一轮专题复习----物质结构与性质专题训练1.回答下列问题:(1)符号“x 3p ”没有给出的信息是___________。
A .能层 B .能级C .电子云在空间的伸展方向D .电子的自旋方向(2)将2F 通入稀NaOH 溶液中可生成2OF 。
2OF 中氧原子的杂化方式为___________。
(3)()43Ti BH 是一种储氢材料,可由4TiCl 和4LiBH 反应制得。
基态3+Ti 的电子占据的最高能层符号为___________,该能层具有的原子轨道数为___________,-4BH 的立体结构是___________。
(4)目前发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。
氯化铍在气态时存在2BeCl 分子(a)和二聚分子()22BeCl (b),a 属于___________(填“离子”或“共价”)化合物;b 中Be 原子的杂化方式相同。
且所有原子都在同一平面上,则b 的结构式为___________(标出配位键)。
(5)过渡金属离子与水分子形成的配合物是否有颜色,与其d 轨道电子排布有关。
一般0d 或10d 排布无颜色,19d ~d 排布有颜色。
如()2+26Co H O ⎡⎤⎣⎦显粉红色。
据此判断:()2+26Mn H O ⎡⎤⎣⎦___________(填“无”或“有”)颜色。
(6)过渡金属易与CO 形成羰基配合物,如配合物[]4Ni(CO),常温下为液态,易溶于4CCl 、苯等有机溶剂。
①[]4Ni(CO)固态时属于___________分子(填极性或非极性); ①[]4Ni(CO)中Ni 与CO 的___________原子形成配位键; ①4Ni(CO)分子中π键与σ键个数比为___________。
2.请回答下列问题:(1)(CH 3)3NH +和AlCl 4-可形成离子液体。
离子液体由阴、阳离子构成,熔点低于100①,其挥发性一般比有机溶剂_______(填“大”或“小” ),可用作 _______(填代号) a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料(2)已知X +中所有电子正好充满 K 、L 、M 三个电子层,它与N 3-形成的晶体结构如图所示。