22化学反应的热效应 ppt课件
- 格式:ppt
- 大小:706.00 KB
- 文档页数:53


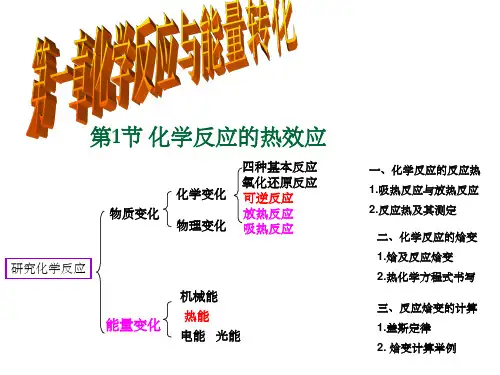
化学人教版(2023)选择性必修1 1.2.1盖斯定律课件(共22张ppt)(共22张PPT)第一章化学反应的热效应第二节反应热的计算第一课时盖斯定律0102运用盖斯定律进行简单计算理解盖斯定律的概念学习目标回顾旧知【回忆一】有哪些方法可以确定一个反应的反应热?① 实验法(量热计测量)----中和反应反应热的测定②宏观角度焓变计算公式:△H=H(生成物总焓)-H(反应物总焓)③微观角度焓变计算公式:△H=E(反应物断键吸收的总能量)- E(生成物成键释放的总能量)△H>0,吸热反应,焓值增大△H<0,放热反应,焓值减小【回忆二】如何判断一个化学反应是吸热反应或放热反应?方法一回顾旧知方法二:图示法判断放热反应吸热反应导入新知【思考】对于化学反应的反应热是否都可通过实验法测得?判断以下反应是否可通过实验法直接测定其反应热。
C(s)+(g)=CO (g)不能,因为燃料碳固体燃烧不可能完全转化为CO,一定有一部分碳会转化为CO2【思考】我们如何得到该反应的反应热呢?盖斯定律新知讲解1、定义:化学反应是一步完成或分几步完成,其反应热相同。
【思考】什么是盖斯定律?2、多角度理解:(爬山)化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
反应热一:盖斯定律理解3、能量守恒的角度理解始态(S)终态(L)△H1 +△H2 = 0推论:同一个热化学反应方程式,正向反应H1与逆向反应H2大小相等,符号相反,即:H1= – H2对于任何一个反应,无论反应的途径如何,其反应的能量不会凭空消失,也不会凭空产生,只会发生形式的转换。
1.反应原理H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此得中和热。
一:盖斯定律理解4.图例说明从反应途径角度:A→D:ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6);从能量守恒角度:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。