硝酸钾的制备和提纯共31页文档
- 格式:ppt
- 大小:3.75 MB
- 文档页数:31

实验4-2 硝酸钾的制备一、实验目的:1.掌握硝酸钾的制备方法;2.了解硝酸钾的性质、用途及保存方法。
二、实验原理:硝酸钾是一种重要的无机化工原料,广泛应用于化肥、火药、玻璃、陶瓷等行业。
硝酸钾可由硝酸银和氯化钾反应制备。
反应方程式如下所示:AgNO3 + KCl → AgCl↓ + KNO3在反应中,硝酸银和氯化钾之间发生置换反应,生成硝酸钾和氯化银。
反应产物通过过滤或沉淀法得到。
三、实验仪器:蒸馏装置、滴液漏斗、pH计、电热板、磁力搅拌器、量筒、烧杯、漏斗、试管、玻璃棒、布、滤纸等。
四、实验步骤:1.向滴液瓶中加入50 mL的硝酸银溶液(0.1 M),并用去离子水定容至100 mL。
3.将硝酸银溶液倒入烧杯中,加热至70-80℃,搅拌均匀。
4.向硝酸银溶液中滴加氯化钾溶液,同时用pH计监测溶液的酸碱度,控制在7左右。
5.溶液放置冷却,产生白色沉淀,用布包在试管中,等沉淀全部收集到试管中。
6.沉淀物用去离子水洗涤,使其纯净。
7.沉淀物放入烘箱中,干燥至恒重。
8.称取干燥的硝酸钾,记录其质量。
五、实验注意事项:1.化学试剂具有一定的危害性,操作时必须注意安全,在试验中要戴上防护镜、手套等,避免与皮肤、眼睛接触,防止误吸、误食。
2.配制溶液时,应按照比例加入试剂,静置后再用玻璃棒搅拌均匀,避免加入过量的试剂。
3.滴加氯化钾溶液时,不能一次性加入,要逐滴滴加,同时用pH计控制反应的酸碱度。
4.反应过程中产生的气体,不能滞留在实验室内,要及时排除。
6.干燥时间不能过长,以免影响反应产物的结晶性。
七、实验结果与分析:本实验中,硝酸银溶液和氯化钾溶液反应生成硝酸钾,反应方程式为:根据反应比例计算,本实验中应加入19.84 g氯化钾溶液(0.1 M)才能使硝酸银被完全反应。
实验中可得硝酸钾质量应为14.84 g,实际称取得硝酸钾质量与理论值相差较大,这可能是由于反应过程中有氯化银和其他杂质和因为干燥时间太长导致反应产物失重等因素影响,同时也提示我们在实验操作中应该更加细心和谨慎。
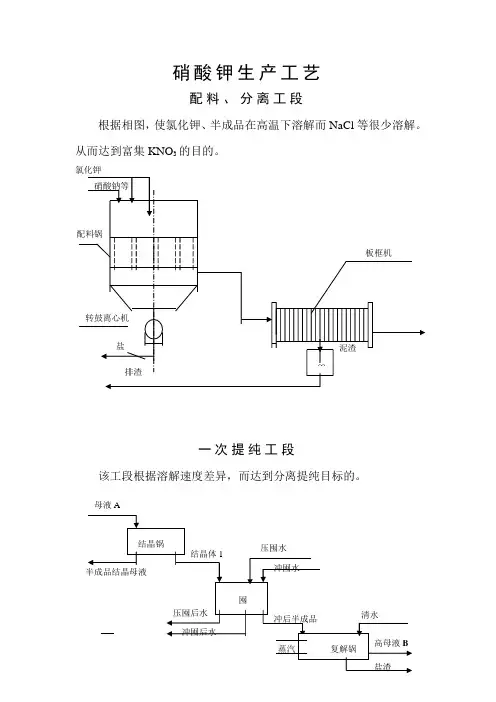
硝酸钾生产工艺配料、分离工段根据相图,使氯化钾、半成品在高温下溶解而NaCl等很少溶解。
从而达到富集KNO3的目的。
一次提纯工段该工段根据溶解速度差异,而达到分离提纯目标的。
母液A二次提纯工段该工段是重复上一工段的重要部分,再次提高产品质量,原理也与上类同,为高温溶解,低温结晶NaCl 溶解速度快等原理。
成品加工工段经以上工段主离子含量已达到合格,而水份较高。
通过干燥器使水份含量达到合格,产品粒度不均通过振动筛使之合格,装袋,即可向外销售,而完成生产工序。
高母液B离心水(同冲囤后水)螺旋输送机硝酸钾,分子式为KNO3。
无色透明棱柱晶体或粉末,溶于水、稀乙醇、甘油,不溶于无水乙醇和乙醚。
无嗅无毒,味咸辣有清凉感。
空气中不潮解。
在334℃分解放出氧,400℃时分解放出氧气,生成亚硝酸钾,继续加热则生成氧化钾。
是强氧化剂,与易燃物,有机物接触能引起燃烧爆炸,并发生有毒和刺激性气体。
与炭或硫一起加热时,能发强光而燃烧。
[1]硝酸钾 - 主要用途医药工业主要用于生产青霉素钾盐、利福平和利尿、发汗、清凉的药剂。
食品工业用于配肉,并在午餐肉中起防腐剂作用。
机械工业用于热处理(金属淬火)作淬火之盐浴。
玻璃工业用于玻璃器皿生产,起耐温硬化玻料的作用,还用作玻璃澄清剂。
农业上用作农作物和花卉的复合肥料。
[1]分析试剂,用于锰、钠的微量分析。
复分解法硝酸钠与氯化钾经复分解反应得硝酸钾和氯化钠。
利用它们的不同溶解度可将其分离。
此法工业上应用较多。
先把硝酸钠溶于热水中,在搅拌下按硝酸钠:氯化钾=100:85的配料比逐渐加入氯化钾,经蒸发浓缩,当温度为119°C时,氯化钠结晶析出。
将分离氯化钠后的母液缓慢冷却,硝酸钾即结晶析出。
经过滤、洗涤和干燥即得产品。
危害性爆炸物危险特性:与有机物、硫磷等混合可爆储运特性:库房通风; 轻装轻卸; 与有机物、还原剂、木炭、硫磷易燃物分开存放可燃性危险特性:高热放出氧气; 遇有机物、还原剂、木炭、硫、磷等易燃物可燃; 燃烧产生有毒氮氧化物烟雾防护措施工程控制:生产过程密闭,加强通风。


硝酸钾的制备和提纯探讨课本实验(一)一、实验目的1、观察验证盐类溶解度和温度的关系;2、利用物质溶解度随温度变化的差别,学习用转化法制备硝酸钾;3、熟悉溶解、蒸发、结晶、过滤等技术,学会用重结晶法提纯物质。
二、实验原理复分解法是制备无机盐类的常用方法。
不溶性盐利用复分解法很容易制得容易制得,但是可溶性盐则需要根据温度反应中几种盐类溶解度的不同影响来处理。
本实验用NaNO3和KCl通过复分解来制取KNO3,其反应为:NaNO3 + KCl ===NaCl + KNO3三、基本操作1、玻璃仪器(烧杯、量筒、蒸发皿、表面皿)使用;2、实验室用的纯水;3、化学试剂;4、加热与冷却;5、固、液分离;*(1)6、查物质的溶解度数据表;*(2)7、重结晶;*(3)8、减压过滤;*(4)9、表面皿的洗涤和使用;表一:硝酸钾,氯化钾,硝酸钠,氯化钠在不同温度下的溶解度(g/100g水)温度(°c)0 10 20 30 40 60 80 100 K N O3 13. 3 20.9 31. 6 45.8 63.9 110 169 24 6 K C l 27. 6 31.0 34.0 37.0 40.0 45. 5 51. 1 56.7 NaNO3 7 3 80 88 9 6 10 4 12 4 148 180 N a C l 35.7 35.8 36.0 36. 3 36. 6 37. 3 38. 4 39.8四、实验步骤1、硝酸钾的制备a用表面皿在台秤上称取用表面皿在台秤上称取NaNO3 8.5g,KCl7.5g 放入烧杯中,加入15ml蒸馏加热至沸,使固体溶解.b待溶液蒸发至原来体积的2/3时便可停止加热,趁热用热滤漏斗进行过滤。
c将滤液冷却至室温,滤液中便有晶体析出。
d用减压过滤的方法分离并抽干此晶体,即得粗产品。
e吸干晶体表面的水分后转移到已称重的洁净表面皿中,用台秤称量,计算粗产品的百分产率。
2、重结晶法提纯KNO3将粗产品放在50mL烧杯中(留0.1g粗产品作对比纯度检验用),加入计算量的蒸馏水并搅拌之,用小火加热,直至晶体全部溶解为止。


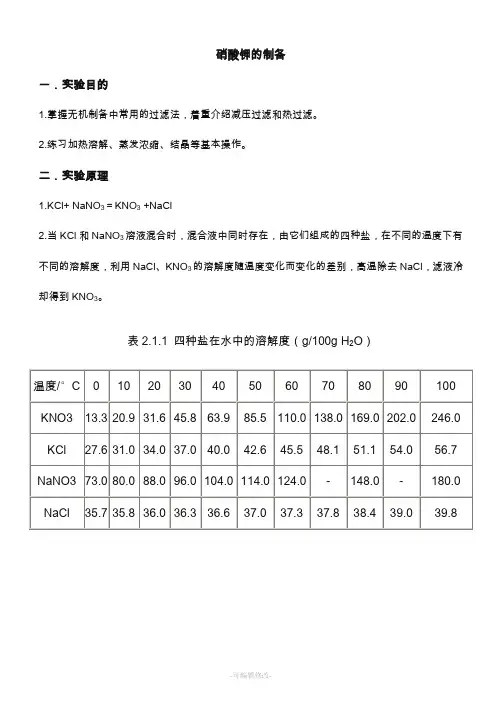
硝酸钾的制备一.实验目的1.掌握无机制备中常用的过滤法,着重介绍减压过滤和热过滤。
2.练习加热溶解、蒸发浓缩、结晶等基本操作。
二.实验原理1.KCl+ NaNO3=KNO3 +NaCl2.当KCl和NaNO3溶液混合时,混合液中同时存在,由它们组成的四种盐,在不同的温度下有不同的溶解度,利用NaCl、KNO3的溶解度随温度变化而变化的差别,高温除去NaCl,滤液冷却得到KNO3。
表2.1.1 四种盐在水中的溶解度(g/100g H2O)三.主要仪器与试剂1 仪器烧杯量筒热过滤漏斗减压过滤装置电子天平。
2 试剂NaNO3(s)、KCl(s)。
四.操作步骤五.实验结果及分析结果:1.上述得到的粗KNO3产品重量为:6.7g2.重结晶后得到的产品重量为:5.00g分析: 1.KCl+NaNO3=KNO3+NaCl7585 101597.5g8.5g10.1g 5.9g★最后体积为:(15*2/3+7.5)*3/4=13.1★母液中留有的硝酸钾:21.2g/100g*13.1g=2.8g ★(在283k时的KNO3溶解度为21.2g/100g水)★本实验粗产品的理论产量是:10.1g-2.8g=7.3g★粗产品的产率为:6.7/7.3*100%=91.8%2 . 理论重结晶率为:(167g-21.2g)/167g*100%=87.3%实际重结晶率为:5.0 /6.7*100%=74.6% (在353k时的溶解度为167g/100g水)六.问题及思考题●问题:1.产品的主要杂质是什么?怎样提纯?答:主要杂质是NaCl,可以通过重结晶来提纯。
2.能否将除去氯化钠后的滤液直接冷却制取硝酸钾?答:不能。
滤液直接冷却可以得到较多的硝酸钾,但会混氯化钠,产品纯度下降。
3.考虑在母液中留有硝酸钾,粗略计算本实验实际得到的最高产量。
答:设室温为293K,此时硝酸钾的溶解度为31.6g/100g水,氯化钠的溶解度为36g/100g水,则10mL水可溶解硝酸钾3.2g ,氯化钠为3.6g ,则析出硝酸钾为10.1-3.2 = 6.9g ,氯化钠为4-3.6 = 0.4g ,故共析出7.3g晶体。


大学化学实验报告本黔南民族师范学院姓名:江边实验室:无机周次:周五实验柜台: 11指导老师:章文伟硫酸亚铁铵的制备一.实验目的1. 学会利用溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质3. 掌握水浴、减压过滤等基本操作4. 学习pH 试纸、吸管、比色管的使用5. 学习用目测比色法检验产品质量。
二.原理铁屑溶于稀硫酸生成硫酸铁。
硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
三.仪器及药品洗瓶、250ml 烧杯、10ml 量筒、50ml 量筒、吸滤瓶、比色管、铁粉、盐酸2mol/L 、3mol/L 硫酸、四.实验步骤1. 硫酸亚铁制备2. 硫酸亚铁铵的制备3. Fe 3+的限量分析五.记录1.实验现象:①小火加热硝酸钠和氯化钾混合溶液过程中,烧杯内会有氯化钠晶体析出。
②热过滤后,漏斗滤纸上出现氯化钠白色晶体。
③滤瓶内液温降低后,出现白色针状的硝酸钾晶体。
④硝酸钾溶液加热浓缩后静置,降至室温出现较多的硝酸钾晶体。
⑤抽滤后漏斗上出现干燥的硝酸钾晶体。
2.产量:粗产品:2.78g3.理论产量:KCl+NaNO3===K NO3+NaClm (K NO3) =(8.5*101.1)/85=10.1g4.产率:2.78/10.1=27.5%六.思考题1.怎样利用溶解度差别从氯化钾—硝酸钠制备硝酸钾?当硝酸钠和氯化钾溶液混合时,溶液中会有硝酸钾、氯化钠、硝酸钠和氯化钾四种盐。
在不同温度下它们在水中溶解度不同,特别是在较高温度,硝酸钾在水中的溶解度比氯化钠的要大得多,所以在冷却过程中氯化钠首先析出,趁热过滤后滤液中即含有硝酸钾。
2.实验成败的关键在何处,应采取哪些措施才能使试验成功?①热过滤分离氯化钠和硝酸钾时要趁热快速,否则液温下降后硝酸钾也会和氯化钠一起析出,减低产量。
②减压过滤时注意不出现穿滤现象。
滤纸不可过大,要全部紧贴漏斗底部,可以用双层滤纸。
3.产品的主要杂质是什么?怎样提纯?产品的主要杂质是氯离子,通过重结晶可以除去。