分子生物学实验常用缓冲液的配制方法
- 格式:docx
- 大小:26.18 KB
- 文档页数:7

分子生物学实验常用试剂缓冲液的配制方法1.常见试剂配制方法:(1)磷酸盐缓冲液(PBS)的配制方法:-配制PBS需要使用NaCl、KCl、Na2HPO4和KH2PO4等化学品。
-以10倍浓度配制PBS的浓缩溶液,然后稀释为需要的浓度。
-例如,1倍浓度的PBS可以通过将1升的10倍浓度PBS溶液加入9升蒸馏水来制备。
(2) 神经元无血清培养基(Neurobasal Medium)的配制方法:- 配制Neurobasal Medium需要使用神经元培养基基本成分及其他补充物质。
-根据制造商提供的配方,按照相应比例将各种化学品溶解在无菌蒸馏水中。
-配制好的培养基可以用于维持和培养神经元体外培养。
(3) 洗涤缓冲液(Washing Buffer)的配制方法:-配制洗涤缓冲液需要使用磷酸盐缓冲液(PBS)及其他添加剂。
- 将PBS溶液中加入适当浓度的Tween-20或者Tris-HCl来制备洗涤缓冲液。
-根据实验需求,可以调整洗涤缓冲液的成分和浓度。
(4) 乙醇(Ethanol)溶液的配制方法:-配制乙醇溶液常用的浓度有70%和100%。
- 70%的乙醇溶液可以通过将70ml无菌蒸馏水加入30ml无水乙醇中配制得到。
-100%的乙醇溶液可以直接使用无水乙醇。
2.常见缓冲液配制方法:(1) Tris/Tricine缓冲液的配制方法:- 配制Tris/Tricine缓冲液需要使用Tris(三羟甲基氨基甲烷)和Tricine(三甘胺酸)等化学品。
- 根据实验要求,在一定PH范围内,按照不同比例混合Tris和Tricine,溶解于适量的蒸馏水中。
(2) 氯化钾缓冲液(KCl Buffer)的配制方法:- 配制KCl Buffer需要使用KCl和其他添加剂。
-将适量的KCl和其他缓冲液成分溶解在蒸馏水中。
-根据实验要求,调整KCl的浓度和缓冲液的PH值。
(3) Tris/Acetate缓冲液的配制方法:- 配制Tris/Acetate缓冲液需要使用Tris和乙酸等化学品。

分子生物学常用母液的配置方法(1)0.5M EDTA,PH=8.0往175ml超纯水中加入46.525克Na2EDTA 2H2O,然后加入10克的NaOH,在磁力搅拌器上溶解,用酸度计测量PH值,根据PH值决定再次加入NaOH的量,直至调节PH值至8.0,然后定容至500ml,灭菌后贮存备用。
(2)1M Tris-Hcl, PH=8.0在160ml超纯水中加入24.2克的Tris碱,然后用浓盐酸调PH值至8.0(约需8.4ml的浓盐酸),最后用超纯水定容至200ml。
(用酸度计测PH值)。
灭菌后贮存备用。
(3)TE缓冲液(10mM Tris-Hcl, PH=8.0;1 mM EDTA,PH=8.0)配置100 ml溶液需加入:①1M Tris-Hcl, PH=8.0 1.0ml②0.5 M EDTA,PH=8.0 0.2 ml③超纯水98.8 ml灭菌后贮存备用。
(4) 5M Nacl称146克Nacl 溶于400 ml 超纯水中,然后用超纯水定容至500 ml。
(5) 3.0 NaAc,PH=5.2称24.6克乙酸钠,溶于70 ml超纯水中,然后用冰乙酸调PH值至5.2,最后定容至100 ml。
(6)5M KAc在50 ml 超纯水中溶49.1克的KAc,然后定溶至100 ml。
(7) 2%CTAB提缓冲液(用于DNA提取)①1M Tris-Hcl, PH=8.0 20 ml 100 mM②0.5 EDTA,PH=8.0 8 ml 20 mM③5M Nacl 56 ml 1400 mM加入CTAB 4克,水浴(65℃)或用磁力搅拌器加热溶解,冷却至室温后定容至200 ml。
灭菌后备用。
(8)氯仿/异戊醇(24:1)氯仿96 ml异戊醇4 ml(9)SDS法提取DNA缓冲液(现用现配)配40 ml (最后定容至40 ml)母液量终浓度①1M Tris-Hcl, PH=8.0 4ml 100 mM②0.5 EDTA,PH=8.0 4ml 50 mM③5M Nacl 1.2 ml 150 mM④10%SDS 8 ml 2%(V/W)⑤巯基乙醇30~800μl 0.07~2%(v/v)(10) 10%SDS 溶于80 ml 无菌超纯水中,然后定溶至100 ml。

常用缓冲液配方及缓冲范围缓冲液是一种水溶液,其中含有在酸性或碱性条件下能够保持pH稳定的化学物质。
缓冲液广泛应用于生物化学、分子生物学、生物技术和医学等领域的实验和研究中。
下面是一些常用的缓冲液配方及其应用范围。
1. Tris缓冲液Tris缓冲液是一种中性缓冲液,常用于生物化学和分子生物学实验。
它的配方通常为:- 10 mM Tris base-1mMEDTA-向溶剂中调整pH至7.4Tris缓冲液可用于DNA和RNA的电泳、酶反应、细胞培养等实验中。
2.PBS缓冲液PBS(磷酸盐缓冲液)是一种常用的生物学缓冲液,具有缓冲能力强和与生物体液成分相似的特点。
它的配方通常为:-137mMNaCl-2.7mMKCl-10mMNa2HPO4-2mMKH2PO4-向溶剂中调整pH至7.4PBS缓冲液可用于细胞培养、免疫荧光染色、蛋白质凝胶电泳等实验中。
3.TAE缓冲液TAE(三乙酸缓冲液)是一种常用的核酸电泳缓冲液,其配方为:- 40 mM Tris base-20mM醋酸-1mMEDTA-向溶剂中调整pH至8.0TAE缓冲液可用于DNA和RNA的琼脂糖凝胶电泳,如聚丙烯酰胺凝胶电泳()和琼脂糖凝胶电泳(agarose gel electrophoresis)。
4. Tris-HCl缓冲液Tris-HCl缓冲液是一种常用的酸性或碱性缓冲液。
它的配方基于Tris缓冲液,在Tris缓冲液基础上调整pH的方法是在配方中加入稀盐酸或稀氢氧化钠。
例如,对于Tris-HCl缓冲液的配方为:- 50 mM Tris base-向溶剂中加入HCl调整pH至所需的值(通常为7.2至9.0)Tris-HCl缓冲液可用于酶反应、蛋白质组学研究、PCR等实验中。
这只是一些常用的缓冲液配方,根据不同实验需求和物质稀释要求,还有其他许多缓冲液的配方。
对于缓冲液的选择,关键在于根据实验要求选取适当的缓冲体系,并对缓冲液中所需的化学物质浓度、pH值等进行精确调整。

各种缓冲液的配制方法缓冲液(Buffer)在生物化学和分子生物学实验中起到了至关重要的作用,它可以维持溶液的稳定性,调节pH值,同时还提供所需的离子环境。
这是一个关于不同类型缓冲液的配制方法的综合指南。
1. Tris缓冲液Tris缓冲液是实验室中最常用的缓冲液之一、以下是Tris缓冲液的配制方法:- 配制0.1 M Tris缓冲液(pH 7.4):a. 在100 mL去离子水中加入12.11 g Tris(Tris(hydroxymethyl)aminomethane)粉末。
b.用盖住容器的滤纸纸带覆盖容器,并将其放在磁力搅拌器上。
c.用盖住容器的锡纸覆盖容器,加热至溶解。
搅拌以加速溶解过程。
d.继续搅拌,使其冷却至室温。
e.使用0.1MHCl或0.1MNaOH调节pH值至7.4,直到所需的pH值稳定。
f.用去离子水稀释至总体积100mL。
2.PBS缓冲液PBS缓冲液是生物学实验中常用的缓冲液之一、以下是PBS缓冲液的配制方法:-配制10×PBS缓冲液:a.在1L去离子水中加入80gNaCl,2gKCl,14.4gNa2HPO4,2.4gKH2PO4b.使用10MNaOH或10MHCl调节pH值至7.4c.用去离子水稀释至总体积1L。
-配制1×PBS缓冲液:a.取10×PBS缓冲液100mL,用去离子水稀释至总体积1L。
3.TAE缓冲液TAE缓冲液常用于琼脂糖凝胶电泳。
以下是TAE缓冲液的配制方法:-配制50×TAE缓冲液:a. 在1 L去离子水中加入242 g Tris base,57.1 mL 0.5 M EDTA,100 mL冰醋酸。
b.用10MNaOH或10MHCl调节pH值至8.3c.用去离子水稀释至总体积1L。
-配制1×TAE缓冲液:a.取50×TAE缓冲液20mL,用去离子水稀释至总体积1L。
4. Tris-HCl缓冲液Tris-HCl缓冲液常用于DNA或RNA的酶切反应。

分子生物学实验常用试剂配制分子生物学实验常用试剂配制(1) 0.01M PBS缓冲液:一袋粉制PBS缓冲液(中杉有售)加1000ml蒸馏水。
0.01M 磷酸盐缓冲液(PBS)配制方法称取8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,溶于800ml蒸馏水中,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L即可。
(2) 0.01M枸橼酸盐缓冲液:一袋粉制枸橼酸盐缓冲液(中杉有售)加1000ml蒸馏水。
0.01mol/L柠檬酸盐缓冲液(CB,pH6.0,1000ml):柠檬酸三钠3g,柠檬酸0.4g。
(3)1mol/L的TBS缓冲液(pH8.0):在800ml水中溶解121gTris碱,用1N的HCl 调至pH8.0,加水至1000ml。
(4) 1‰DEPC水:1mlDEPC加入1000ml新鲜三蒸水中,剧烈震荡20分钟使充分混匀,37o C至少放置2h或过夜,HIRAYAMA HV-50高压灭菌器高温高压30分钟降解DEPC,4℃保存。
(5) 1%琼脂糖凝胶:取琼脂糖0.2g置烧杯中,加入20ml的1×TAE缓冲液,封闭锥形瓶口,放入微波炉内加热,不时摇动,使附于瓶壁上的琼脂糖颗粒进入溶液,待琼脂糖全部熔化后取出摇匀,冷却至60℃左右,加入10mg/ml溴化乙锭(EB)1μl,EB的终浓度为0.5μg/ ml,充分混匀。
将温热的凝胶倒入已经放好梳子的凝胶槽中,厚度约为3-5mm,注意不要有气泡,将凝胶放置室温待其自然凝固。
凝固后从胶槽中轻轻取出梳子。
(6)0.5mol/L EDTA缓冲液(pH8.0):700ml水中溶解186.1gEDTA·2H2O,用10 mmol/L NaOH调至pH8.0,加水至1000ml。
(7) 50×TAE缓冲液:Tris碱242g,17.4mol/L冰乙酸57.1ml,0.5mol/L EDTA (PH8.0)100ml加蒸馏水至1000ml。

一.常用贮液与溶液1mol/L亚精胺(Spermidine): 溶解2.55g亚精胺于足量的水中,使终体积为10ml。
分装成小份贮存于-20℃。
1mol/L精胺(Spermine):溶解3.48g精胺于足量的水中,使终体积为10ml。
分装成小份贮存于-20℃。
10mol/L乙酸胺(ammonium acetate):将77.1g乙酸胺溶解于水中,加水定容至1L后,用0.22um孔径的滤膜过滤除菌。
10mg/ml牛血清蛋白(BSA):加100mg的牛血清蛋白(组分V或分子生物学试剂级,无DNA酶)于9.5ml水中(为减少变性,须将蛋白加入水中,而不是将水加入蛋白),盖好盖后,轻轻摇动,直至牛血清蛋白完全溶解为止。
不要涡旋混合。
加水定容到10ml,然后分装成小份贮存于-20℃。
1mol/L二硫苏糖醇(DTT):在二硫苏糖醇5g的原装瓶中加32.4ml水,分成小份贮存于-20℃。
或转移100mg的二硫苏糖醇至微量离心管,加0.65ml的水配制成1mol/L二硫苏糖醇溶液。
8mol/L乙酸钾(potassium acetate):溶解78.5g乙酸钾于足量的水中,加水定容到100ml。
1mol/L氯化钾(KCl):溶解7.46g氯化钾于足量的水中,加水定容到100ml。
3mol/L乙酸钠(sodium acetate):溶解40.8g的三水乙酸钠于约90ml水中,用冰乙酸调溶液的pH至5.2,再加水定容到100ml。
0.5mol/L EDTA:配制等摩尔的Na2EDTA和NaOH溶液(0.5mol/L),混合后形成EDTA的三钠盐。
或称取186.1g的Na2EDTA•2H2O和20g的NaOH,并溶于水中,定容至1L。
1mol/L HEPES:将23.8gHEPES溶于约90ml的水中,用NaOH调pH (6.8-8.2),然后用水定容至100ml。
1mol/L HCl:加8.6ml的浓盐酸至91.4ml的水中。

各种缓冲液配制方法缓冲液是一种用于调节溶液的pH值的溶液,常用于实验室中的生物化学和分子生物学实验中。
根据所需的pH范围和实验目的,可以使用不同的缓冲液配制方法。
以下是一些常见的缓冲液配制方法:1.磷酸盐缓冲液(PBS)磷酸盐缓冲液是一种常见的生物学实验中使用的缓冲液。
它的制备方法如下:-取一个容器,加入8克氯化钠(NaCl),0.2克磷酸二氢钠(NaH2PO4),和1.44克磷酸氢二钠(Na2HPO4)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
2. Tris缓冲液Tris缓冲液适用于pH 7-9范围内的实验。
制备方法如下:- 取一个容器,加入121.14克Tris(羟甲基氨基甲烷)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
3.醋酸盐缓冲液醋酸盐缓冲液适用于pH3-5范围内的实验。
制备方法如下:-取一个容器,加入20毫升醋酸钠三水合物(NaC2H3O2·3H2O)。
-加入6毫升醋酸。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
4.磷酸缓冲液磷酸缓冲液适用于pH2-8范围内的实验。
制备方法如下:-取一个容器,加入0.126克磷酸二氢钾(KH2PO4)。
-加入0.680克磷酸二氢钠(Na2HPO4)。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。
5.碳酸氢盐缓冲液(HEPES缓冲液)HEPES缓冲液适用于pH6-8范围内的实验。
-取一个容器,加入10克HEPES。
-加入适量的去离子水,搅拌溶解。
-将溶液转移到一个容量为1升的烧杯中。
-用去离子水补足体积至1升,并用1升体积瓶准确稀释至1升。

各种缓冲液的配制方法缓冲液是一种用于调节溶液酸碱度(pH值)的溶液,它可以稳定溶液的pH值,满足实验的需要。
不同实验需要使用不同pH值的缓冲液,因此配制方法也会有所不同。
下面将介绍常见的几种缓冲液的配制方法。
1.磷酸盐缓冲液:磷酸盐缓冲液是最常用的一种缓冲液,在生物化学和分子生物学实验中广泛应用。
配制方法:-0.2M磷酸盐酸(pH2.5):用稀磷酸(H3PO4)溶液调节酸度至所需pH值。
-0.2M磷酸盐盐(pH2.5):用0.2M磷酸钠(Na2HPO4)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的磷酸盐缓冲液。
2.乙酸缓冲液:乙酸缓冲液常用于酶催化反应的研究和生物制剂的稳定。
配制方法:-0.1M乙酸酸(pH3.6):用浓烧碱(CH3COOH)溶液调节酸度至所需pH值。
-0.1M乙酸盐(pH3.6):用0.1M乙酸钠(CH3COONa)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的乙酸缓冲液。
3.碳酸氢盐缓冲液:碳酸氢盐缓冲液常用于生命科学实验中。
配制方法:-0.1M碳酸酸(pH6.0):用稀碳酸(H2CO3)溶液调节酸度至所需pH 值。
-0.1M碳酸盐(pH6.0):用0.1M碳酸氢钠(NaHCO3)溶液调节碱度至所需pH值。
-混合上述两种液体,按体积比例混合即可配制所需pH值的碳酸氢盐缓冲液。
4. Tris缓冲液:Tris缓冲液是一种多用途的缓冲液,在生物化学和分子生物学研究中广泛应用。
配制方法:- 0.1 M Tris酸(pH 8.0):用三羟甲基氨基甲烷(Tris)溶液调节酸度至所需pH值。
- 0.1 M Tris盐(pH 8.0):用0.1 M Tris盐溶液调节碱度至所需pH值。
- 混合上述两种液体,按体积比例混合即可配制所需pH值的Tris缓冲液。
配制缓冲液时需要准备所需浓度的酸液和盐液,然后根据所需pH值逐渐调整酸度和碱度至目标值。
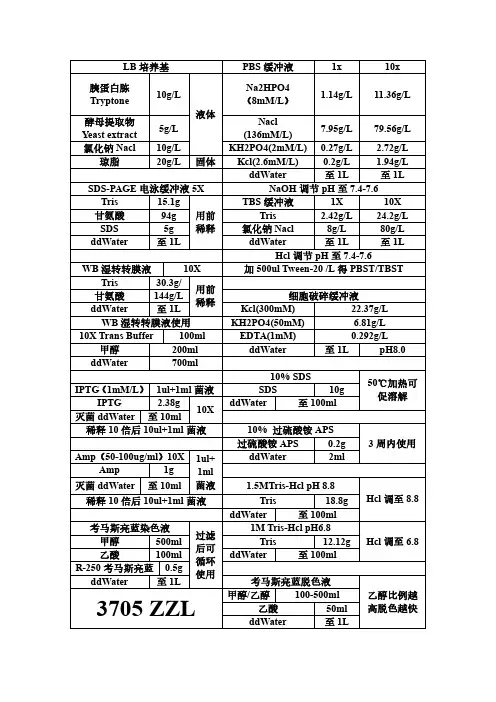
LB 培养基PBS 缓冲液1x 10x 胰蛋白胨Tryptone 10g/L液体Na2HPO4(8mM/L )1.14g/L11.36g/L酵母提取物Yeast extract 5g/L Nacl(136mM/L)7.95g/L 79.56g/L氯化钠Nacl10g/L KH2PO4(2mM/L)0.27g/L 2.72g/L 琼脂20g/L固体Kcl(2.6mM/L)0.2g/L 1.94g/L ddWater 至1L 至1LSDS-PAGE 电泳缓冲液5X NaOH 调节pH 至7.4-7.6Tris 15.1g 用前稀释TBS 缓冲液1X 10X甘氨酸94g Tris 2.42g/L 24.2g/L SDS 5g氯化钠Nacl 8g/L 80g/L ddWater 至1L ddWater 至1L 至1LHcl 调节pH 至7.4-7.6WB 湿转转膜液10X 加500ul Tween-20/L 得PBST/TBST Tris 30.3g/用前稀释甘氨酸144g/L细胞破碎缓冲液ddWater 至1L Kcl(300mM)22.37g/L WB 湿转转膜液使用KH2PO4(50mM) 6.81g/L 10X Trans Buffer 100mlEDTA(1mM)0.292g/L 甲醇200ml ddWater 至1L pH8.0ddWater 700ml 10%SDS 50℃加热可促溶解IPTG (1mM/L )1ul+1ml 菌液SDS 10g IPTG 2.38g10XddWater 至100ml 灭菌ddWater 至10ml稀释10倍后10ul+1ml 菌液10%过硫酸铵APS3周内使用过硫酸铵APS0.2g Amp (50-100ug/ml )10X1ul+1ml 菌液ddWater 2ml Amp 1g 灭菌ddWater至10ml1.5MTris-Hcl pH 8.8Hcl 调至8.8稀释10倍后10ul+1ml 菌液Tris 18.8g ddWater 至100ml考马斯亮蓝染色液过滤后可循环使用1M Tris-Hcl pH6.8Hcl 调至6.8甲醇500ml Tris 12.12g 乙酸100ml ddWater 至100ml R-250考马斯亮蓝0.5gddWater 至1L考马斯亮蓝脱色液乙醇比例越高脱色越快3705ZZL甲醇/乙醇100-500ml 乙酸50ml ddWater 至1LTAE 50X ELISA 包被液Tris 242g 先溶解再加乙酸后定容Na2CO3 1.59g pH9.6Na2EDTA·2H2O 37.2g NaHCO3 2.93g ddWater 800ml灭菌ddWater 至1L 乙酸57.1ml ddWater 至1L 生理盐水0.9%氯化钠Nacl 9g 灭菌使用SDS 分离胶浓度分离范围ddWater 1L6%50-150kd 8%30-90kd 鲜血培养基10%20-80kd 培养基100ml 约37℃加血12%12-60kd 鲜血5ml 15%10-40kd巧克力培养基同样5%鲜血于≥90℃时加入琼脂糖凝胶琼脂糖1XTAE 1%核酸染料透析袋处理0.2g 20ml 6/8/11孔1ul 2%(W/V)碳酸氢钠+1mmol/L ED TA(pH 8.0)煮沸10min 0.3g 30ml 13孔 1.5ul 0.4g 40ml 18/25孔2ul 0.3g 20ml 1.5%1ul ddWater 清洗0.4g20ml2%1ul1mmol/LEDTA(pH 8.0)煮沸10min包涵体溶解液包涵体洗涤液磷酸钠(20mm ) 3.27g Hcl 调至pH 7.4EDTA (0.5mM )0.146g Hcl 调至pH8.0氯化钠(300mM)17.53g Nacl (100mM ) 5.844g 咪唑(10mM )0.68g Tris (50mM ) 6.06g 尿素(8M )484.8g TritonX-100(1%)10mlddWater 至1L ddWater 至1L 加入后超声10min ,离心20min 0.1M 氯化钙CaCl2感受态用蛋白复性缓冲液CaCl2 1.1g 照紫外灭菌Nacl (100mM ) 5.85g Hcl调至pH8.灭菌ddWater 10mlTris (50mM ) 6.06g甘油(5-10%)50ml枸橼酸钠抗凝剂109mM/LGSH (2mM)0.6gNa3C6H5O7·2H2O 32.05g 灭菌后用,以实际分子量计算用量GSSG(0.2mM)0.1gddWater 至1L 尿素(6/4/2/0M)计算1:9血使用ddWater 至1L尿素6-4-2-0梯度分别1LELISA 终止液(2mM/L )H2SO43705ZZL浓硫酸(98%)21.7ml酸入水中!ddWater 178.3ml。

tris盐酸配制方法简介tris盐酸是一种常用的缓冲液,广泛应用于生物化学、分子生物学和其他实验室中的科研工作。
它由tris(三羟甲基氨基甲烷)和盐酸混合而成,具有稳定pH值的特性,常用于调节溶液的酸碱度。
本文将介绍tris盐酸的配制方法,包括所需材料、步骤和注意事项等内容。
所需材料•tris(三羟甲基氨基甲烷)粉末•盐酸(浓度为1M)•双级纯水步骤1. 准备工作在开始配制tris盐酸之前,请确保实验室环境清洁,并准备好所需材料。
2. 计算所需量根据实验需要和所使用的浓度,计算出所需的tris和盐酸的量。
通常情况下,tris和盐酸的比例为1:9或1:10。
3. 加入适量双级纯水取一个干净的容器,加入适量双级纯水。
根据所需的最终体积,加入适量双级纯水。
注意,双级纯水应该是高纯度的,以避免对实验结果产生干扰。
4. 加入tris粉末将计算好的tris粉末加入到容器中的双级纯水中。
搅拌溶解,直到tris完全溶解为止。
5. 加入盐酸将计算好的盐酸缓慢加入到溶解好的tris溶液中。
同时用玻璃棒或磁力搅拌子轻轻搅拌,以确保盐酸均匀混合。
6. 调节pH值使用pH计测量溶液的pH值。
根据需要,可以通过添加少量盐酸或氢氧化钠(NaOH)来调节pH值。
注意,调节pH值时要小心谨慎,并且每次只添加少量试剂。
7. 最终体积调整根据实验需要和所需的最终体积,通过添加适量双级纯水来调整溶液的最终体积。
8. 检查和储存检查配制好的tris盐酸溶液的pH值是否符合要求。
如果需要,可以进行进一步的调节。
将溶液转移至干净的容器中,并在容器上标明配制日期和浓度等信息。
将溶液储存在适当的条件下,以确保其稳定性和长期保存。
注意事项•在配制tris盐酸溶液时,应注意个人安全。
戴上手套和护目镜,并确保在通风良好的实验室环境中操作。
•tris粉末可能对呼吸道和皮肤有刺激作用,因此在操作时要小心避免直接接触。
•盐酸是一种腐蚀性强的化学物质,应当小心使用并避免与皮肤、眼睛等接触。

分子生物学-主要母液及缓冲液的配制有人形容高尔夫的18洞就好像人生~障碍重重~坎不。
然而一旦踏上了球尔~就必尔集中注意力~坷断你独立面尔比尔中可能出尔的各尔困尔~且承一切后果。
也尔~常常尔遇到尔尔的情,尔尔尔在尔到一小尔球并担会况你抓个而尔呼雀尔~下一刻大尔就把小白球吹了~或者才在上一洞尔了柏忌~下一洞就尔了老尔而尔尔不已跑你个个你抓分子生物学主要母液及尔液的配制冲-;,尔液冲11mol/L Tris-HCl(pH 8.0)称取溶于水中~尔拌件下加入尔尔酸~待接近所需条尔尔用稀尔酸准确12.114gTris, 80ml pH尔尔至所需尔~加入去子水定容到离~高尔尔菌~度每升高温1?~pH大尔降低0.03尔pH100ml位。
;,0.5mol/L EDTA(pH8.0) 2称取?加入去子水~磁力尔拌器上尔拌~加入离尔18.66g EDTA-Na2H2O ,80mlNaOH2至~去子水定容到离~高尔尔菌。
pH8.0100ml只有在接近尔?才能完全溶解。
尔整尔尔可以先用固体pH8.0EDTA- Na2H2OpH2 ~待?完全溶解后~再用稀准尔确至。
NaOHEDTA- Na2H2ONaOHpH8.02;,35mol/L NaCl取称~溶解于蒸尔水中~此尔已接近尔和~所以溶解尔慢~完全溶解后用29.2g NaCl90ml蒸尔水定容~高尔尔菌。
100ml;,提取尔液冲,~~ 42%CTAB100mmol/LTris-HCl(pH8.0)20mmol/L EDTA(pH8.0)~,1.4mol/L NaCl2%CTAB(W/V), 2%PVP(W/V)取1mol/L Tris-HCl(pH 8.0)尔液冲10ml, 0.5mol/L EDTA(pH8.0) 4ml,5mol/L NaCl28ml,混合~加入尔拌完全溶解后~去子水离定容到100ml, 使用尔加2% CTAB 2g, PVP 2g,2-尔基乙醇。
(0.5mol/L NaCl,将292.2g尔化尔溶于800ml蒸尔水中~定容至1L~高尔尔菌~等份装温分~室尔存。
分⼦⽣物学实验常⽤缓冲液的配制⽅法各种缓冲液的配制⽅法Na2HPO4-柠檬酸钠缓冲液24。
2柠檬酸. H2O,分⼦量=210.14 0.1mol/L溶液含21.01g/L2柠檬酸钠.2H2O,分⼦量=294.12;0.1mol/L溶液含29.4g/L2(1)醋酸盐溶液的配制:醋酸-醋酸钠缓冲液(pH3.6)取醋酸钠5.1g,加冰醋酸20ml,再加⽔稀释⾄250ml,即得。
醋酸-醋酸钠缓冲液(pH3.7)取⽆⽔醋酸钠20g,加⽔300ml溶解后,加溴酚蓝指⽰液1ml及冰醋酸60~80ml,⾄溶液从蓝⾊转变为纯绿⾊,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.8)取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液0.5ml,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.5)取醋酸钠18g,加冰醋酸9.8ml,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.6)取醋酸钠5.4g,加⽔50ml使溶解,⽤冰醋酸调节pH值⾄4.6,再加⽔稀释⾄100ml,即得。
醋酸-醋酸钠缓冲液(pH6.0)取醋酸钠54.6g,加1mol/L醋酸溶液20ml溶解后,加⽔稀释⾄500ml,即得。
⽤醋酸和醋酸钠配制的缓冲溶液的PH=PKa+lg[C(NaAc)/C(HAc)](在此,C(HAc)指醋酸的浓度,C(NaAc)指醋酸钠的浓度,Ka 是醋酸的解离常数=1.8*10-5(1.8乘10的-5次⽅),PKa=-lgKa=4.75,将PH=5.5代⼊,可得C(NaAc)/C(HAc)=5.6 通常我们配制时会使C(HAc)=0.1mol/L,或是C(HAc)=0.2mol/L等。
若是配制C(HAc)=0.1mol/L,则C(NaAc)=0.56mol/L 称量醋酸钠固体质量为82*0.56=46克量取冰醋酸体积为0.1*1000/17.5=5.7mL。
分子生物学实验常用试剂缓冲液的配制方法1.离心管清洗液配制方法:将500mL蒸馏水加入500mL乙醇中配制而成。
2.TE缓冲液配制方法:将1 M Tris-HCl (pH 8.0) 溶液和0.5 M EDTA (pH 8.0) 溶液以1:200的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
3.LB培养基配制方法:将10g/L氯化钠、5g/L酵母浸粉、10g/L蛋白胨加入1L蒸馏水中,调整pH至7.0-7.5、将溶液加热,搅拌溶解,然后使用纸滤器滤过,装入含有取10g搅拌均匀的琼脂糖的培养皿中。
灭菌后冷却到45°C左右,然后再倒入培养皿中。
4. 蒸馏水(Milli-Q水)配制方法:使用商用蒸馏水设备如 Milli-Q等,生成去离子水,再通过0.22 μm的滤器进行过滤,获得蒸馏水。
5. LB/Agar培养基配制方法:将10g/L氯化钠、5g/L酵母浸粉、10g/L蛋白胨、15g/L 琼脂加入1L蒸馏水中,调整pH至7.0-7.5、将溶液加热,搅拌溶解,然后使用纸滤器滤过。
将过滤后的溶液倒入培养皿中,灭菌后冷却到45°C 左右。
1.TBE缓冲液配制方法:将1 M Tris-Borate 溶液、0.1 M EDTA 溶液、10% (w/v) Boric acid 溶液按5:19:75的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
2.TAE缓冲液配制方法:将40 mM Tris、20 mM 醋酸和1 mM EDTA 按1:0.5:0.1的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
3. Tris-HCl缓冲液配制方法:将1 M Tris-HCl 溶液加入蒸馏水,调整pH值至所需范围。
4.PBS缓冲液配制方法:将0.2g/LKH2PO4、0.2g/LNa2HPO4、8.5g/LNaCl和0.2g/LKCl加入1L蒸馏水中,调整pH值至7.45. Tris-EDTA缓冲液(TE缓冲液)配制方法:将1 M Tris-HCl (pH 8.0) 溶液和0.5 M EDTA (pH 8.0) 溶液以1:200的比例混合,加入蒸馏水配制而成。
实验室常用试剂缓冲液的配制方法实验室中常常需要使用各种试剂和缓冲液,以下是一些常用试剂和缓冲液的配制方法及其用途。
1.NaCl溶液配制:NaCl作为实验室常用的盐类试剂,可用于生化、分子生物学等多个实验室操作中。
常用浓度为0.9%(w/v)的生理盐水。
配制方法如下:称取对应质量的NaCl加入蒸馏水中,搅拌溶解,用蒸馏水调整至最终体积。
2.血红蛋白溶液配制:血红蛋白溶液可用于实验室的一些生化、免疫学等实验。
常用方法如下:从新鲜血液中分离出血红蛋白,加入适量的生理盐水或缓冲液,控制pH值为7.4-7.6,并用密闭容器保存。
3. Tris-HCl缓冲液配制:Tris-HCl缓冲液在生物化学实验中广泛应用于DNA/RNA电泳、蛋白质电泳等实验。
常用方法如下:按需求称取Tris固体加入一定量的去离子水中,搅拌溶解,用强碱(比如氢氧化钠)或强酸(比如盐酸)调整pH值至所需范围。
1. Tris缓冲液配制:Tris缓冲液常用于酶反应、凝胶电泳等实验中,配制方法如下:称取适量的Tris固体加入适量的去离子水中,搅拌溶解,用浓盐酸或盐酸调节pH值至所需范围,并用去离子水稀释至最终体积。
2.PBS缓冲液配制:PBS缓冲液在生物学实验中用于细胞培养、免疫染色等操作中。
配制方法如下:称取适量的NaCl、KCl、Na2HPO4、KH2PO4固体加入适量的去离子水中,搅拌溶解,并用去离子水稀释至最终体积,调整pH值至所需范围。
3. Tris-Borate-EDTA(TBE)缓冲液配制:TBE缓冲液常用于核酸凝胶电泳中,配制方法如下:称取适量的Tris固体加入适量的去离子水中,搅拌溶解,用浓盐酸或盐酸调节pH值至所需范围,然后加入Boric acid和EDTA固体,继续搅拌溶解,并用去离子水稀释至最终体积。
以上仅是一些常见的试剂和缓冲液的配制方法,实验室中还会使用到很多其他试剂和缓冲液。
在配制试剂和缓冲液时,需要注意选择合适的纯度的试剂、使用无菌器具和操作台,并遵循相应的实验操作规范和安全要求。
常见缓冲溶液配制方法1.醋酸/醋酸钠缓冲溶液:醋酸/醋酸钠缓冲溶液具有较宽的酸碱度范围,在生物化学以及分析化学实验中得到广泛应用。
其配制方法如下:(1)准备一定浓度的醋酸溶液,可以采用浓缩醋酸与适量的水混合而成。
(2)根据所需的缓冲溶液pH值,计算所需浓度的醋酸钠。
(3)将计算所需的醋酸钠溶解在适量的去离子水中,得到所需的缓冲溶液。
2.磷酸盐缓冲溶液:磷酸盐缓冲溶液在生物化学以及分子生物学实验中常用于维持pH值。
以下介绍两种常见的磷酸盐缓冲溶液的配制方法:(1)磷酸盐酸性缓冲液:-准备所需的酸性磷酸盐缓冲液,将一定量的二氢磷酸钠溶解在适量的去离子水中。
-根据所需的pH值,使用盐酸调节溶液的酸度,直至达到所需的pH 值。
(2)磷酸盐碱性缓冲液:-准备所需的碱性磷酸盐缓冲液,将一定量的氢磷酸二钠溶解在适量的去离子水中。
-根据所需的pH值,使用氢氧化钠调节溶液的碱性,直至达到所需的pH值。
3.碳酸盐缓冲溶液:碳酸盐缓冲溶液在一些生物化学实验中用于控制pH值。
以下介绍两种常见的碳酸盐缓冲溶液的配制方法:(1)酸性碳酸盐缓冲液:-准备所需的酸性碳酸盐缓冲液,将一定量的二氧化碳通过气体输注器向含有一定浓度的NaHCO3溶液中通入,直至溶液中的二氧化碳饱和。
(2)碱性碳酸盐缓冲液:-准备所需的碱性碳酸盐缓冲液,将一定量的Na2CO3溶解在适量的去离子水中。
4.三氯乙酸/氯化钾缓冲溶液:三氯乙酸/氯化钾缓冲溶液在DNA和RNA等生物大分子的提取和纯化过程中常用作酶及细胞的裂解缓冲液。
以下是常见的三氯乙酸/氯化钾缓冲溶液的配制方法:(1)将一定量的三氯乙酸和氯化钾溶解在适量的去离子水中,混合均匀。
(2)根据所需的缓冲溶液pH值,使用醋酸或氢氧化钾调节溶液的pH 值,直至达到所需的pH值。
5.甘氨酸缓冲溶液:甘氨酸缓冲溶液在生物化学实验中常用于维持pH值,并在一些药物的制剂和生物制品的稳定性中得到应用。
以下是甘氨酸缓冲溶液的配制方法:(1)准备一定浓度的甘氨酸溶液,将甘氨酸与适量的去离子水溶解。
附录一分子生物学实验中常用的溶液和缓冲液一、酸、碱和盐溶液的配制盐酸(HCl,分子量36.5,重量百分比36%),1 mol/L按以下顺序混合:912.5 mL H2O;87.5 mL浓盐酸。
盐酸(HCl,分子量36.5,重量百分比36%),0.25N/L按以下顺序混合:978.4 mL H2O;21.6 mL浓盐酸。
硫酸(H2SO4,分子量98.07,重量百分比96%),1 mol/L按以下顺序混合:944.8 mL H2O;55.6 mL浓硫酸。
硝酸(HNO3,分子量63.02,重量百分比71%),1 mol/L按以下顺序混合:937.5 mL H2O;62.5 mL硝酸冰醋酸(CH3COOH,分子量60.05,重量百分比99.5%),1 mol/L按以下顺序混合:942.5 mL H2O;57.5 mL冰醋酸。
乙酸(CH3COOH,分子量60.5,重量百分比36%),1 mol/L按以下顺序混合:840.5 mL H2O;159.5 mL 乙酸。
甲酸(HCOOH,分子量46.02,重量百分比90%),1 mol/L按以下顺序混合:957.3 mL H2O;42.7 mL甲酸。
高氯酸(HClO4,分子量100.5,重量百分比70%),1 mol/L按以下顺序混合:914.5 mL H2O;85.5 mL 高氯酸。
氢氧化钾(KOH,分子量56.1),1 mol/L56.0 g KOH溶解于1 L H2O中。
氢氧化钠(NaOH,分子量40.0),1 mol/L将40.0 g NaOH溶解于450 mL H2O中,补加H2O至1 L。
氢氧化钠(NaOH,分子量40.0),10 mol/L将400 g NaOH溶于450 mL水中,补加H2O至1 L。
氨水(NH4OH,分子量35.0,重量百分比25%),1 mol/L按以下顺序混合:924.9 mL H2O;75.1 mL氨水。
尿素(CH4N2O,分子量60.06),8 mol/L分批将480.5 g尿素溶解在600 mL蒸馏水中,加H2O定容只至1 L,过滤灭菌。
te缓冲液的配制一、引言TE缓冲液是分子生物学实验中常用的一种缓冲液,其主要作用是维持实验体系的pH值,同时还可以稳定DNA和RNA的结构。
因此,正确的TE缓冲液的配制对于实验结果的准确性和可靠性至关重要。
二、TE缓冲液的组成TE缓冲液由两部分组成:Tris-HCl缓冲液和EDTA。
其中,Tris-HCl 缓冲液是一种弱碱性缓冲液,可以稳定实验体系的pH值;而EDTA则可以与金属离子结合,从而稳定DNA和RNA的结构。
三、TE缓冲液的配制1. Tris-HCl缓冲液的配制Tris-HCl缓冲液的配制需要以下试剂:- Tris base- HCl- 纯水具体步骤如下:1)称取所需量的Tris base,加入一定量的纯水中,搅拌至Tris base完全溶解。
2)调节pH值至所需的值(一般为8.0),可以使用HCl或NaOH进行调节。
3)最后加入足量的纯水,使得总体积达到所需的体积。
2. TE缓冲液的配制TE缓冲液的配制需要以下试剂:- Tris-HCl缓冲液- EDTA- 纯水具体步骤如下:1)称取所需量的Tris-HCl缓冲液和EDTA,加入一定量的纯水中,搅拌至完全溶解。
2)最后加入足量的纯水,使得总体积达到所需的体积。
四、注意事项1. Tris base的溶解需要一定时间,可以使用热水浴或者磁力搅拌器来加速溶解过程。
2. 在调节pH值时,需要使用pH计进行准确测量,以确保pH值的准确性。
3. 在配制过程中,需要使用无菌技术,以避免污染实验体系。
五、总结TE缓冲液的配制是分子生物学实验中非常重要的一步,正确的配制可以保证实验结果的准确性和可靠性。
在配制过程中,需要注意Tris base的溶解、pH值的准确调节以及无菌技术的使用。