工业氢氧化钠中铁含量的测定详解
- 格式:ppt
- 大小:1.97 MB
- 文档页数:22



工业循环水中铁含量的测定一 、实验目的1. 掌握分光光度法测定微量物质的原理和方法。
2. 了解721型分光光度计的构造原理并掌握其使用方法。
3. 学会绘制吸收曲线和求得最大吸收波长(入max ) 。
4. 学会绘制标准曲线,掌握用标准曲线法测定未知物的含量。
二、实验原理分光光度法是通过比较溶液颜色深浅来测定物质含量的方法,它的基础是物质对光的选择性吸收,在选定波长下,被测溶液对光的吸收程度与溶液中吸光组分的浓度有简单的定量关系,即郎伯—比耳定律:当入射光的强度一定时,溶液的吸光度(或称消光度)与溶液的浓度和厚度的乘积成正比:A=KcL式中:A ---溶液的吸光度,表示单色光通过有色溶液时被吸收的程度。
K ---吸光系数(或吸收系数)C --- 溶液的浓度L ---溶液层的厚度应用郎伯—比耳定律可以求算出溶液中有色物质的含量,常用的方法有比较法和标准曲线法(或称工作曲线法)两种。
比较法就是将待测物质与含已知待测组分量的标准溶液在相同的条件下,同时配成有色溶液,装在厚度相同的比色皿内,分别测量其吸光度。
由于比色皿厚度相同,标准溶液和待测物质又是在相同的条件下配成有色溶液,所以两式中的K 和L 均相等,因此从郎伯—比耳定律可得:标准曲线法在分析大批试样时较为方便。
首先制备一系列不同浓度的标准溶液,显色后,分别测量其吸光度,然后以浓度为横坐标,吸光度为纵坐标,绘制出标准曲线 (如下图所示)吸光度(A )浓度(c )浓度C分析样品时,样品也经过与标准溶液相同的处理。
例如,试样溶液在比色前()()()()()()()()*A C A C A C C A ==标准标准待测待测待测待测标准标准经过过滤,则标准溶液也必须进行过滤。
测得吸光度后,即可从标准曲线上查出溶液的浓度。
应用分光光度法测某物质的含量时,通常要经过合理取样,称量,溶解,显色及测量等步骤。
大多数元素的离子是无色的或者颜色比较浅,所以需加入显色剂,把欲测组分变为有色化合物,然后才能进行定量测定,因此控制好显色反映的条件是非常重要的,显色反应即将试样中被测组分转变成有色化合物的化学反应。

工业氢氧化钠标准及残留检测方法工业氢氧化钠本方法参照标准GB209-1993。
适用于水银法、隔膜法、苛化法所制得的氢氧化钠。
工业用固体氢氧化钠主体为白色、有光泽,允许微带颜色。
工业用固体氢氧化钠(包括片碱)应符合1要求。
表1 工业固体氢氧化钠的质量指标指标项目水银法苛化法隔膜法优等品一等品合格品优等品一等品合格品优等品一等品合格品氢氧化钠/% 99.5 99.5 99.0 97.0 97.0 96.0 96.0 96.0 95.0 ? 碳酸钠/% 0.40 0.45 0.90 1.5 1.7 2.5 1.3 1.4 1.6 ? 氯化钠/% 0.06 0.08 0.15 1.1 1.2 1.4 2.7 2.8 3.2 ? 三氧化二铁/% 0.003 0.004 0.005 0.008 0.01 0.01 0.008 0.010.02 ? 钙镁总含量(以Ca0.01 0.02 0.03 计)/%? 二氧化硅/% 0.02 0.03 0.04 0.50 0.55 0.60 ? 汞/% 0.0005 0.00050.0015 ?工业用液体氢氧化钠应符合表2要求。
表2 工业液体氢氧化钠的质量指标指标水银法苛化法隔膜法项目 ?型 ?型优等一等合格优等一等合格优等一等合格一等合格品品品品品品品品品品品氢氧化钠/% 45.0 45.0 42.0 45.0 45.0 42.0 42.0 42.0 42.0 30.0 30.0 ?碳酸钠/% 0.25 0.30 0.35 1.0 1.1 1.5 0.3 0.4 0.6 0.4 0.6 ?氯化钠/% 0.03 0.04 0.05 0.70 0.80 1.00 1.6 1.8 2.0 4.7 5.0 ?0.002 0.003 0.004 0.02 0.02 0.03 0.004 0.007 0.01 0.005 0.01 三氧化二铁/%?钙镁总含量(以Ca计)/% 0.005 0.006 0.007 ?二氧化硅/% 0.01 0.02 0.02 0.50 0.55 0.60 ?汞/% 0.001 0.003 0.003 ?注:1、二氧化硅、汞含量为形式检验项目。


氢氧化钠中微量铁含量的测定一、项目任务利用分光光度法测定测定氢氧化钠中微量铁的含量,并撰写化学报告二、项目的技术要求1、试样加标样的吸光度最好控制在0.7内。
2、对试样进行测定时的吸光度最好控制在0.4~0.45之间。
三、工作计划1、组长:韩廷建对此次试验进行操作上的分配,之前应充分了解本实验的内容,目的等情况。
2、收集资料:郭文怡上网搜索有关邻菲罗啉分光光度计测定氢氧化钠中微量铁含量的资料,了解在操作过程中有可能出现的问题,以便及时解决。
3、设计方案:陈颖在搜索处资料的前提上并依据实验室现有的情况以及本小组所要做的具体内容来设计方案。
4、操作人员:眭世竑助手:吉加伟在设计方案之后,依据方案由助手配置相应的试剂之后由操作人员进行操作。
5、文字撰写:徐娜操作实验之后应对实验数据进行处理并写成文字形式输入电脑。
(2)技术分析进行测定操作时要适时调节入射波长,同时也得计算显色剂的用量,控制溶液的酸度,操作过程中得保持有色配合物的稳定性等四、项目实施方案与项目实施过程及数据记录:1、原理抗坏血酸将F e3+还原为F e2+,在PH=4~4.5的缓冲溶液中,F e2+与邻菲啰啉生成桔红色的络合物,用分光光度法测定。
2、反应方程式2F e3++C6H8O6= 2F e2++ C6H6O6+2H+F e2++3 C2H8N2=[Fe(C2H8N2)3]2+3、仪器与设备分光光度仪(比色皿),容量瓶,移液管,烧瓶,擦镜纸,电子天平4、试剂与溶液1 盐酸溶液(1+1)2 氨水3 乙酸-乙酸钠溶液:PH=4.5称取164CH3COONa·3H2O溶于水加84ml冰乙酸稀释至1000ml4 抗坏血酸溶液: 20mg/ml称取2g抗坏血酸溶于100ml水中。
5 邻菲啰啉溶液:2mg/ml称取0.20g邻菲啰啉加入少量水振摇溶解(必须加热)稀释至100ml。
5、计算与公式1 试样量的计算A=kbc=abc’A=k/m=1.1×104/56=2×1020.2<2×102×1×(ms×w%/100×10-3)<0.710/3<ms<35/3可称取试样10g2 试样加标样中标样量的计算A试+A标<0.7A标<0.7- A试2×102×1×[(0.01g/L×V)]/100×10-3<0.7- A试3 收率的计算P=(C试+标—C试)/C标×100%4 检测限的标准偏差公式S2=∑(Xi-X平均)2/(n-1)→求出S后以3S带入线性回归方程得出浓度5 百分含量的计算W%=C试V/ms×100%6、方案设计与过程1 待测溶液:称取10g的氢氧化钠固体于烧杯中加入少量的水后加(1+1)的盐酸溶液中和到黄色消失为止,在过量2ml(若过量则用氨水调节至6~8)加热煮沸5min,冷却后加入10ml的乙酸-乙酸钠溶液,5ml的邻菲啰啉溶液,2ml的抗坏血酸溶液后稀释至100ml容量瓶中,摇匀,定容。

工业氢氧化钠的分析方法一:工业氢氧化钠中氢氧化钠和碳酸钠含量的联合测定1测定原理1.1氢氧化钠含量的测定原理:试样溶液中首先加入氯化钡,则碳酸钠转化成碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准溶液滴定至终点,反应如下:Na2CO3 + BaCl2 = BaCO3 +2NaClNaOH +HCl = NaCl + H2O1. 2 碳酸钠含量的测定原理:试样溶液以甲基橙为指示剂,用盐酸标准溶液滴定至终点,则得氢氧化钠和碳酸钠含量的总和,再减去氢氧化钠的含量即得碳酸钠的含量。
2仪器和设备一般实验室仪器和磁力搅拌器。
3试剂和溶液本方法要求使用不含二氧化碳的蒸馏水或相当纯度的水。
3. 1 氯化钡(分析纯):10%。
使用前以酚酞为指示剂,用氢氧化钠溶液调至微红色。
3. 2 酚酞指示剂:1%乙醇溶液。
3. 3 甲基橙指示剂:0.1%。
3. 4 无水碳酸钠(基准试剂)。
3. 5 盐酸标准溶液(1M):3. 5. 1 配制:3. 5. 2 标定:称取1.6000克于280摄氏度灼烧至恒重的无水碳酸钠溶于50毫升水中,加2滴甲基橙指示剂,以盐酸标准溶液滴定至溶液呈橙色,加热煮沸2分钟,冷却后继续滴定至橙色为终点。
同时做空白试验。
按下式计算盐酸标准溶液的摩尔浓度:M(HCl) = M0/{ (V1-V0)*0.05299}式中:M O-------- 无水碳酸钠基准试剂的质量(g)。
V1 ------------- 滴定基准试剂所消耗的盐酸标准溶液体积(mL)。
V O------- 空白试验所消耗的盐酸标准溶液体积(mL)。
0.05299 ------------ 碳酸钠的毫克当量数。
3.6试样溶液的制备:用已知重量的称量瓶,迅速称取固体氢氧化钠38.00克或液体氢氧化钠50.00克,转入1000毫升容量瓶中,完全溶解并冷却到室温后稀释到刻度,混匀备用。
4测定手续4.1氢氧化钠含量的测定:吸取已制备好比的试样溶液50.0毫升于250毫升具塞磨口锥形瓶中,加入20.0毫升氯化钡溶液,加入3滴酚酞指示剂,以盐酸标准溶液密闭滴定至溶液呈微红色为终点。

溶液中铁含量的测定1 试剂1.1 盐酸:1+1。
1.2 氢氧化钠:粒状。
1.3 邻二氮杂菲—盐酸羟胺—乙酸钠混合液:称取150 g三水乙酸钠(或称取100 g无水乙酸钠)和5 g盐酸羟胺,分别溶于水;另称0.50 g邻二氮菲溶于15 mL 冰乙酸中。
将三溶液混合,用水稀释至1000 mL,混匀。
1.4 盐酸:3 mol/L。
1.5 三氧化二铁标准贮存溶液:1 mL溶液含1mg三氧化二铁。
称取4.9118 g硫酸亚铁铵〔(NH4)2Fe(SO4)2·6H2O〕于250 mL烧杯中,加入少量水和20 mL盐酸(3.4),溶解后,移入1000 mL容量瓶中,用水稀释至刻度,混匀。
1.6 三氧化二铁标准溶液:1 mL溶液含0.1mg三氧化二铁。
移取100.0 mL三氧化二铁标准贮存溶液(3.5)于1000 mL容量瓶中,加入40 mL盐酸(1+1),用水稀释至刻度,混匀。
此溶液使用时配制。
2 测定2.1 试料量根据具体含量分取一定体积的溶液进行稀释。
2.2 空白试验随同试料作空白试验。
2.2.1 分取5.00 mL试液于100 mL容量瓶中。
2.2.2 加入20.0 mL 邻二氮杂菲—盐酸羟胺—乙酸钠混合液(1.3),用水稀释至刻度,混匀。
2.2.3 将试液(2.2.2)和随同试料所做的空白试样溶液移入1cm比色皿中,于分光光度计波长500 nm处,以水为参比,测量其吸光度。
当试样溶液的吸光度大于0.8时,重新分取测定。
2.2.4 将所测得的吸光度减去随同试料空白溶液的吸光度后,从校准曲线上查出相应的三氧化二铁量。
2.3 校准曲线的绘制于一组100 mL 容量瓶中,分别加入0~10.00 mL 三氧化二铁标准溶液(3.6),加入1.0 mL 盐酸(3.1) 以下按6.5.3~6.5.4进行。
将测得的吸光度减去空白溶液的吸光度后,以三氧化二铁量为横坐标,吸光度为纵坐标,绘制校准曲线。
3 分析结果的表述三氧化二铁量以百分比表示,按以下公式计算:ω(Fe 2O 3)=10001 m m 式中: m 0——分取试液相当于试料量,g ;m 1——在校准曲线上查得三氧化二铁的质量,g 。
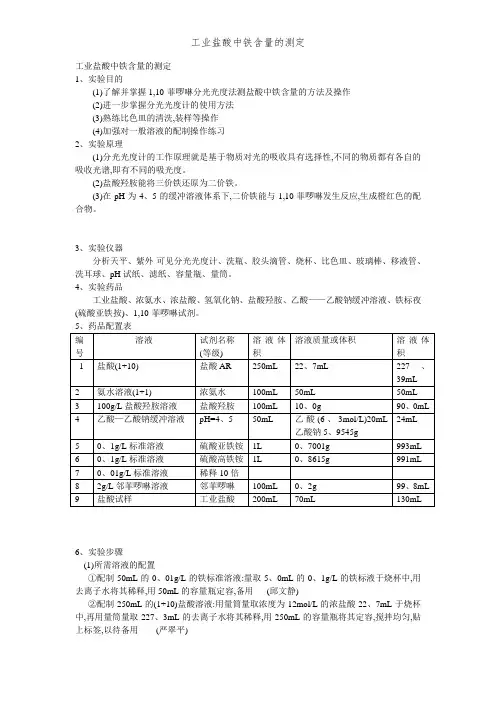
工业盐酸中铁含量的测定1、实验目的(1)了解并掌握1,10-菲啰啉分光光度法测盐酸中铁含量的方法及操作(2)进一步掌握分光光度计的使用方法(3)熟练比色皿的清洗,装样等操作(4)加强对一般溶液的配制操作练习2、实验原理(1)分光光度计的工作原理就是基于物质对光的吸收具有选择性,不同的物质都有各自的吸收光谱,即有不同的吸光度。
(2)盐酸羟胺能将三价铁还原为二价铁。
(3)在pH为4、5的缓冲溶液体系下,二价铁能与1,10-菲啰啉发生反应,生成橙红色的配合物。
3、实验仪器分析天平、紫外-可见分光光度计、洗瓶、胶头滴管、烧杯、比色皿、玻璃棒、移液管、洗耳球、pH试纸、滤纸、容量瓶、量筒。
4、实验药品工业盐酸、浓氨水、浓盐酸、氢氧化钠、盐酸羟胺、乙酸——乙酸钠缓冲溶液、铁标夜(硫酸亚铁按)、1,10-菲啰啉试剂。
6、实验步骤(1)所需溶液的配置①配制50mL的0、01g/L的铁标准溶液:量取5、0mL的0、1g/L的铁标液于烧杯中,用去离子水将其稀释,用50mL的容量瓶定容,备用(邱文静)②配制250mL的(1+10)盐酸溶液:用量筒量取浓度为12mol/L的浓盐酸22、7mL于烧杯中,再用量筒量取227、3mL的去离子水将其稀释,用250mL的容量瓶将其定容,搅拌均匀,贴上标签,以待备用(严翠平)③配制100mL的(1+1)氨水溶液(第二次用的就是氢氧化钠):用量筒量取浓氨水50mL于烧杯中再用量筒量取50mL去离子水将其稀释,搅拌均匀,贴上标签,备用(任云杰)④配制100mL的盐酸羟胺溶液:准确称取10、0g的盐酸羟胺试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,备用(蒋滟耀)⑤配制100mL的1,10-菲啰啉溶液:准确称取0、2g的1,10-菲啰啉试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,以待备用(邱文静)⑥配制100mLHAc--NaAc缓冲溶液(pH=4、5):准确称取11、8908g的乙酸钠,再用量筒量取40mL的冰醋酸于烧杯中,用去离子水稀释,用100mL容量瓶定容贴上标签,以待备用(严翠平)⑦配制200mL的试样溶液:称取早已洗净烘干的空具塞锥形瓶的质量为m mL,在量取70mL的工业盐酸于瓶中,再次称量,在置于内装100mL去离子水的200mL容量瓶中,再用水定容,备用(任云杰)(2)标准曲线绘制——测定铁标液的吸光度②向每个容量瓶中加入10mL的(1+1)的盐酸溶液,加水至20mL处,用氨水溶液调至pH 为2~3,再加入1mL盐酸羟胺溶液,5mLHAc--NaAc缓冲溶液与2mL1,10—菲啰啉溶液,再用水稀释至刻度,摇匀,静置15min。


国标中对氢氧化钠含量的测定标题: 国标中对氢氧化钠含量的测定引言:氢氧化钠是一种常用的无机化合物,在各个工业行业都有广泛的应用。
它的准确含量的测定对于生产和质量控制至关重要。
由于其强碱性和腐蚀性,不正确的使用和测定可能会对健康和环境造成严重影响。
因此,国家制定了一系列标准和规范,以确保氢氧化钠的含量能够得到准确测定。
本文将深入探讨国标中对氢氧化钠含量的测定方法和其重要性。
一、国标中对氢氧化钠含量的测定方法:1. 比色滴定法:比色滴定法是一种常用的氢氧化钠含量测定方法。
它基于氢氧化钠与酸性指示剂在酸性溶液中的反应,通过滴加标准酸溶液的体积,来确定氢氧化钠的含量。
国标中规定了滴定的条件和指示剂的选用,以确保测定结果的准确性和可靠性。
2. 酸碱滴定法:酸碱滴定法也是一种常用的氢氧化钠含量测定方法。
它是基于氢氧化钠与酸性标准溶液之间的酸碱中和反应。
通过滴加标准酸溶液的体积,来确定氢氧化钠的含量。
国标中对滴定条件和标准溶液的选取等方面进行了详细的规定,以确保测定结果的准确性和可靠性。
二、测定准确性的重要性:测定氢氧化钠含量的准确性对于生产和质量控制至关重要。
只有准确测定了氢氧化钠的含量,才能够确保其在各个工业行业中的正确应用。
正确测定氢氧化钠含量的好处包括:1. 生产控制: 通过准确测定氢氧化钠的含量,生产工艺和配方可以更好地控制和调整,以确保产品的质量符合相关标准和要求。
2. 安全性: 正确测定氢氧化钠含量可以减少因过量使用或使用含有不准确含量的氢氧化钠而引起的事故和风险。
这有助于保护人员和设备的安全。
3. 环保: 准确测定氢氧化钠含量可以减少因过量排放废液或处理废液产生的环境污染和影响。
三、总结和回顾:通过国标中对氢氧化钠含量的测定方法,我们能够准确测定氢氧化钠的含量,以确保其在各个工业领域的正确应用。
准确测定氢氧化钠含量的好处包括生产控制、安全性和环保。
通过遵循国标的规定和要求,确保测定的准确性和可靠性,我们能够更好地保护人员和环境的安全,提高产品质量,并节约资源的使用。
工业盐酸中铁含量的测定1、实验目的(1)了解并掌握1,10-菲啰啉分光光度法测盐酸中铁含量的方法及操作(2)进一步掌握分光光度计的使用方法(3)熟练比色皿的清洗,装样等操作(4)加强对一般溶液的配制操作练习2、实验原理(1)分光光度计的工作原理是基于物质对光的吸收具有选择性,不同的物质都有各自的吸收光谱,即有不同的吸光度。
(2)盐酸羟胺能将三价铁还原为二价铁。
(3)在pH为4.5的缓冲溶液体系下,二价铁能与1,10-菲啰啉发生反应,生成橙红色的配合物。
3、实验仪器分析天平、紫外-可见分光光度计、洗瓶、胶头滴管、烧杯、比色皿、玻璃棒、移液管、洗耳球、pH试纸、滤纸、容量瓶、量筒。
4、实验药品工业盐酸、浓氨水、浓盐酸、氢氧化钠、盐酸羟胺、乙酸——乙酸钠缓冲溶液、铁标夜(硫酸亚铁按)、1,10-菲啰啉试剂。
6、实验步骤(1)所需溶液的配置①配制50mL的0.01g/L的铁标准溶液:量取5.0mL的0.1g/L的铁标液于烧杯中,用去离子水将其稀释,用50mL的容量瓶定容,备用(邱文静)②配制250mL的(1+10)盐酸溶液:用量筒量取浓度为12mol/L的浓盐酸22.7mL于烧杯中,再用量筒量取227.3mL的去离子水将其稀释,用250mL的容量瓶将其定容,搅拌均匀,贴上标签,以待备用(严翠平)③配制100mL的(1+1)氨水溶液(第二次用的是氢氧化钠):用量筒量取浓氨水50mL 于烧杯中再用量筒量取50mL去离子水将其稀释,搅拌均匀,贴上标签,备用(任云杰)④配制100mL的盐酸羟胺溶液:准确称取10.0g的盐酸羟胺试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,备用(蒋滟耀)⑤配制100mL的1,10-菲啰啉溶液:准确称取0.2g的1,10-菲啰啉试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,以待备用(邱文静)⑥配制100mLHAc--NaAc缓冲溶液(pH=4.5):准确称取11.8908g的乙酸钠,再用量筒量取40mL的冰醋酸于烧杯中,用去离子水稀释,用100mL容量瓶定容贴上标签,以待备用(严翠平)⑦配制200mL的试样溶液:称取早已洗净烘干的空具塞锥形瓶的质量为m mL,在量取70mL的工业盐酸于瓶中,再次称量,在置于内装100mL去离子水的200mL容量瓶中,再用水定容,备用(任云杰)(2)标准曲线绘制——测定铁标液的吸光度(蒋滟耀)②向每个容量瓶中加入10mL的(1+1)的盐酸溶液,加水至20mL处,用氨水溶液调至pH为2~3,再加入1mL盐酸羟胺溶液,5mLHAc--NaAc缓冲溶液和2mL1,10—菲啰啉溶液,再用水稀释至刻度,摇匀,静置15min。
工业盐酸中铁含量的测定1、实验目的(1)了解并掌握1,10-菲啰啉分光光度法测盐酸中铁含量的方法及操作(2)进一步掌握分光光度计的使用方法(3)熟练比色皿的清洗,装样等操作(4)加强对一般溶液的配制操作练习2、实验原理(1)分光光度计的工作原理是基于物质对光的吸收具有选择性,不同的物质都有各自的吸收光谱,即有不同的吸光度。
(2)盐酸羟胺能将三价铁还原为二价铁。
(3)在pH为4.5的缓冲溶液体系下,二价铁能与1,10-菲啰啉发生反应,生成橙红色的配合物。
3、实验仪器分析天平、紫外-可见分光光度计、洗瓶、胶头滴管、烧杯、比色皿、玻璃棒、移液管、洗耳球、pH试纸、滤纸、容量瓶、量筒。
4、实验药品工业盐酸、浓氨水、浓盐酸、氢氧化钠、盐酸羟胺、乙酸——乙酸钠缓冲溶液、铁标夜(硫酸亚铁按)、1,10-菲啰啉试剂。
6、实验步骤(1)所需溶液的配置①配制50mL的0.01g/L的铁标准溶液:量取5.0mL的0.1g/L的铁标液于烧杯中,用去离子水将其稀释,用50mL的容量瓶定容,备用(邱文静)②配制250mL的(1+10)盐酸溶液:用量筒量取浓度为12mol/L的浓盐酸22.7mL于烧杯中,再用量筒量取227.3mL的去离子水将其稀释,用250mL的容量瓶将其定容,搅拌均匀,贴上标签,以待备用(严翠平)③配制100mL的(1+1)氨水溶液(第二次用的是氢氧化钠):用量筒量取浓氨水50mL 于烧杯中再用量筒量取50mL去离子水将其稀释,搅拌均匀,贴上标签,备用(任云杰)④配制100mL的盐酸羟胺溶液:准确称取10.0g的盐酸羟胺试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,备用(蒋滟耀)⑤配制100mL的1,10-菲啰啉溶液:准确称取0.2g的1,10-菲啰啉试剂于烧杯中,再用适宜量的去离子水将其溶解,搅拌均匀,用100mL的容量瓶将其定容,贴上标签,以待备用(邱文静)⑥配制100mLHAc--NaAc缓冲溶液(pH=4.5):准确称取11.8908g的乙酸钠,再用量筒量取40mL的冰醋酸于烧杯中,用去离子水稀释,用100mL容量瓶定容贴上标签,以待备用(严翠平)⑦配制200mL的试样溶液:称取早已洗净烘干的空具塞锥形瓶的质量为m mL,在量取70mL的工业盐酸于瓶中,再次称量,在置于内装100mL去离子水的200mL容量瓶中,再用水定容,备用(任云杰)(2)标准曲线绘制——测定铁标液的吸光度(蒋滟耀)②向每个容量瓶中加入10mL的(1+1)的盐酸溶液,加水至20mL处,用氨水溶液调至pH为2~3,再加入1mL盐酸羟胺溶液,5mLHAc--NaAc缓冲溶液和2mL1,10—菲啰啉溶液,再用水稀释至刻度,摇匀,静置15min。
高纯氢氧化钠中微量铜和铁含量的测定肖燕燕,滕 琪,钟华兵,胡晓辉,贡 宇(江西立信检测技术有限公司,江西 南昌 330100)摘 要:由于高纯氢氧化钠中铜和铁的含量较低,使用原子吸收分光光度计来分析高纯氢氧化钠中微量铁、铜元素所需的取样量较大,同时由于样品为强碱性,其溶液中钠离子浓度高,对于测定有着较大基体干扰,通过实验比较标准曲线法和标准加入法的检测结果,选出可以有效的减少基体干扰影响,更准确的测定高纯强碱中铁和铜的含量的方法。
关键词:高纯氢氧化钠;强碱;火焰原子吸收分光光度计;铁和铜;标准曲线法;标准加入法中图分类号:O657.75 文献标识码:A 文章编号:1002-5065(2021)23-0139-3Determination of trace copper and iron content in high purity sodium hydroxideXIAO Yan-yan, TENG Qi, ZHONG Hua-bing, HU Xiao-hui, GONG Yu(Jiangxi Lixin Testing Technology Co., Ltd., Nanchang 330100, China)Abstract: Due to the content of copper and iron in high purity sodium hydroxide is low, the use of atomic absorption spectrophotometer to analyze the trace iron, copper elements in high purity sodium hydroxide for sampling amount is larger, at the same time as the sample for strong alkaline, its high concentration of sodium ions in the solution, for the determination of a large matrix interference, by comparing the experimental standard curve method and standard addition method of test results, A method to determine the content of iron and copper in high purity strong base is selected to reduce the interference of matrix.Keywords: high purity sodium hydroxide; Strong alkali; Flame atomic absorption spectrophotometer; Iron and copper; Standard curve method; Standard addition method氢氧化钠被广泛应用于化工行业,作为太阳能光伏储能电池电解液原材料之一,对其纯度有着很高的要求,高纯氢氧化钠所含的铜、铁等杂质含量直接影响到电池质量、性能及寿命。
工业用化工产品铁含量测定的通用方法1,10-菲啰啉分光光度法度法GB/T 3049—2006Chemical products for industrial use - General method for determination of iron content - 1 10-Phenanthroline spectrophotometric method1 范围本标准规定了化工产品中铁含量测定的通用方法1,10-菲啰啉分光光度法。
本标准描述了溶液中铁含量的测定技术。
在制备试验溶液时,应参考与所分析产品有关的标准对本方法进行必要的修改使其适合产品的测定。
2 适用领域本标准适用于所取试液中铁含量为10μg~500μg ,其体积不大于60mL。
大量的碱金属、钙、锶、钡、镁、锰(Ⅱ)、砷(Ⅲ)、砷(Ⅴ)、铀(Ⅵ)、铅、氯离子、溴离子、碘离子、硫氰酸根、乙酸根、氯酸根、硫酸根、硝酸根、硫离子、偏硼酸根、硒酸根、柠檬酸根、酒石酸根、磷酸根和100mg以下的锗(Ⅳ)在试验溶液中,对测定无干扰。
如试验溶液中存在柠檬酸根、酒石酸根、砷酸根或大于100mg的磷酸根,显色速度变慢。
干扰和消除的方法参见附录A3 原理用抗坏血酸将试液中的Fe3+还原成Fe2+。
在pH值为2~9时,Fe2+与1,10-菲啰啉生成橙红色络合物,在分光光度计最大吸收波长(510nm)处测定其吸光度。
在特定的条件下,络合物在pH值为4~6时测定。
4 试剂分析时只能使用分析纯试剂,蒸馏水或纯度相当的水。
4.1 盐酸,180g/L溶液将409mL质量分数为38%的盐酸溶液(ρ=1.19g/mL)用水稀释至1000mL,并混匀(操作时要小心)。
4.2 氨水,85g/L溶液将374mL质量分数为25%氨水(ρ=0.910g/mL)用水稀释至1000mL,并混匀。
4.3 乙酸-乙酸钠缓冲溶液,在20℃时pH=4.5称取164g无水乙酸钠用500mL水溶解,加240mL冰乙酸,用水稀释至1000mL。