几个重要概念
非预期药物不良反应(Unanticipated Adverse Drug Reaction,UADR)
指性质和严重程度与相应的试验药物资 料不一致,或者根据药物特性预料不到 的药物不良反应。
几个重要概念
不良事件(Adverse Event,AE) 病人或临床试验受试者接受一种药物后出现的 不良医学事件,但并不一定与治疗有因果关系。
临床试验安全性保障 —各方的职责
研究者 -主要研究者对试验充分关注 -严格遵循试验方案 -决定是否让受试者继续留在试验中 -及时记录AE、SAE和药品不良反应,并给予恰当的处理
和随访 受试者 -自愿签署知情同意书 -可随时、无条件退出临床试验 伦委会履行了应尽的职责
不良事件和严重不良事件
几个重要概念 AE报告的重要性、报告要点 SAE的报告时限和要求
几个重要概念
药品不良反应(Adverse Drug Reaction,ADR) 在规定剂量正常应用药品的过程中产生的有害 而非所期望的、与药品应用有因果关系的反应。 在一种新药或药物新用途的临床试验中,其治疗 剂量尚未确定时,所有有害而非所期望的、与药 物应用有因果关系的的反应,也应视为ADR。
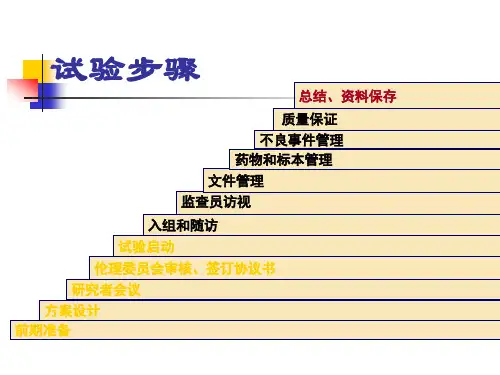
试验步骤
总结、资料保存
质量保证 不良事件管理 药物和标本管理 文件管理 监查员访视
入组和随访 试验启动 伦理委员会审核、签订协议书 研究者会议 方案设计 前期准备
临床试验的安全性评价
贵阳医学院附属医院 药物临床试验机构办公室
何艳
医学的进步是以研究为基础的,这些研 究在一定程度上最终有赖于以人作为受 试者的试验。
医疗判断)
严重不良事件——1
导致死亡 死亡的原因是SAE 死亡只是结果 如确实不明原因死亡,可在SAE报告以死