《大学化学基础》课程试卷(6)全解
- 格式:doc
- 大小:122.00 KB
- 文档页数:8

大学化学基础考试题库题目一1. 请列举常见的元素周期表中的金属元素。
题目二2. 简述原子结构的基本组成和原子模型。
题目三3. 解释离子键和共价键的区别,并举例说明。
题目四4. 请解释化学平衡是什么,并说明利用Le Chatelier原理可以如何改变化学平衡。
题目五5. 请解释酸和碱的性质,并列举一些常见的酸碱反应。
题目六6. 简述有机化合物的特点,并给出两个有机化合物的例子。
题目七7. 解释聚合反应是什么,并说明聚合反应在日常生活中的应用。
题目八8. 请解释氧化还原反应是什么,并说明氧化还原反应在自然界中的重要性。
题目九9. 简述化学反应速率的影响因素,并解释催化剂的作用原理。
题目十10. 请解释电解质和非电解质的区别,并列举两个电解质和两个非电解质的例子。
题目十一11. 简述化学计量和化学方程式的相关概念,并解释如何进行化学计量计算。
题目十二12. 请解释溶解度是什么,并说明影响溶解度的因素。
题目十三13. 简述饱和溶液和过饱和溶液的区别,并说明如何制备饱和溶液。
题目十四14. 请列举几种常见的气体的性质,并解释什么是气体的压强。
题目十五15. 解释化学键的概念,并说明金属键、共价键和离子键的特点。
题目十六16. 简述化学反应的热效应是什么,并说明放热反应和吸热反应的特点。
题目十七17. 请解释物质的密度是什么,并说明如何计算密度。
题目十八18. 简述化学反应中的能量转化过程,并解释反应活化能的概念。
题目十九19. 请解释酸碱指示剂的作用原理,并列举两种常见的酸碱指示剂。
题目二十20. 简述溶液的浓度是什么,并解释如何计算溶液的浓度。
题目二十一21. 请解释化学反应中的化学平衡常数,并说明如何根据化学平衡常数判断反应的方向。
题目二十二22. 简述原子核的组成和原子核的稳定性原理。
题目二十三23. 请解释电离能是什么,并解释为什么不同元素的电离能会有差别。
题目二十四24. 简述放射性衰变和核裂变的过程,并说明放射性衰变的应用。
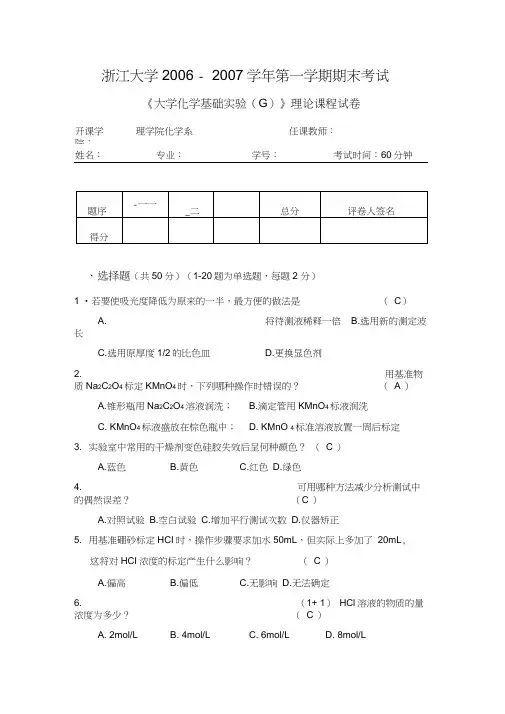
浙江大学2006 - 2007学年第一学期期末考试《大学化学基础实验(G)》理论课程试卷理学院化学系任课教师:开课学院:姓名:专业:学号:考试时间:60分钟、选择题(共50分)(1-20题为单选题,每题2 分)1 •若要使吸光度降低为原来的一半,最方便的做法是(C)A. 将待测液稀释一倍B.选用新的测定波长C.选用原厚度1/2的比色皿D.更换显色剂2. 用基准物质Na2C2O4标定KMnO4时,下列哪种操作时错误的?( A )A.锥形瓶用Na2C2O4溶液润洗;B.滴定管用KMnO4标液润洗C. KMnO4标液盛放在棕色瓶中;D. KMnO 4标准溶液放置一周后标定3. 实验室中常用的干燥剂变色硅胶失效后呈何种颜色?(C )A.蓝色B.黄色C.红色D.绿色4. 可用哪种方法减少分析测试中的偶然误差?(C )A.对照试验B.空白试验C.增加平行测试次数D.仪器矫正5. 用基准硼砂标定HCI时,操作步骤要求加水50mL,但实际上多加了20mL,这将对HCI浓度的标定产生什么影响?( C )A.偏高B.偏低C.无影响D.无法确定6. (1+ 1)HCl溶液的物质的量浓度为多少?( C )A. 2mol/LB. 4mol/LC. 6mol/LD. 8mol/L7. 常量滴定管可估计到±).01mL,若要求滴定的相对误差小于0.1%,在滴定时,耗用体积一般控制在:(B )A. 10 〜20mLB. 20 〜30mLC. 30 〜40mLD. 40 〜50mL8 •定量分析中,基准物质是( D )A.纯物质B.标准参考物质C.组成恒定的物质D.组成一定、纯度高、性质稳定且摩尔质量较大的物质9. 测定复方氢氧化铝药片中Al3+、Mg2+混合液时,EDTA滴定Al3+含量时, 为了消除Mg2+干扰,最简便的方法是:(B )A.沉淀分离法B.控制酸度法C.配位掩蔽法D.溶剂萃取法10•滴定操作中,对实验结果无影响的是:(C )A.滴定管用纯净水洗净后装入标准液滴定;B.滴定中活塞漏水;C.滴定中往锥形瓶中加少量蒸馏水;D.滴定管下端气泡未赶尽;11.下列器皿不能直接用酒精灯加热的是:(A )A.试剂瓶B.蒸发皿C.烧杯D.烧瓶12 .卜列仪器在量取或配制标准溶液前不需要润洗的是:(D )A.吸量管B.移液管C.滴定管D.容量瓶13. 鉴定Ni2+的试剂通常是下列中的哪一种?( A )A. 丁二酮肟B.硝基苯偶氮间苯二酚C.二苯基联苯胺D.硫脲14. 实验室安全知识:因电器失火,应用下列哪种灭火器?( C )A.泡沫灭火器B. CO2灭火器C.干粉灭火器D. CCI4灭火器15•用邻苯二甲酸氢钾标定NaOH溶液浓度时,会造成系统误差的是(A )A.用甲基橙作指示剂B. NaOH溶液吸收了空气中CO2C.每份邻苯二甲酸氢钾质量不同D.每份加入的指示剂量不同16. 有效数字位数是四位的数值是:(B )2A. 0.0002B. 0.1000C. 0.700 102D. pH = 12.8017. 某同学用硼砂标定标准溶液实验中,溶解硼砂时,用玻棒去搅拌锥形瓶中溶液后,不经处理拿出瓶外,标定结果会:(A )A.偏高B.偏低C.不一定D.无影响18. 分析过程中出现下面情况,哪些将造成系统误差:( D )A.天平零点突然有变动B.分光光度计的最后有波动C.滴定管读数最后一位估不准D.以含量为98%的硼砂标定HCI浓度19. 阴离子分离鉴定实验中,Br2在CCl4层显示什么颜色?( A )A.橙色B.紫红色C.蓝色D.黄色20 •标定NaOH溶液的常用基准物质:(B )A.无水碳酸钠B.邻苯二甲酸氢钾C.硼砂D. CaCO 3 以下可能为多选题(2.5分一个,每漏选、多选1个扣1分,扣完为止)21 •用K2Cr2O7基准物质配制0.01667 mol L-1溶液一升,下列操作中合适的是:(B )A. 在分析天平上用差减法准确称取K2Cr2O7 4.903克;B. 以直接称量法用称量纸在分析天平上称取 4.903克;C. 用600 ml烧杯以直接称量法在台天平上称得4.9克;D. 以直接称量法用称量纸在台天平上称取 4.9克22 .在反应转化速率测定的实验中,影响转化速率的因素有:(ACD )A.反应物浓度B.反应时间C.反应温度D.催化剂23 .某学生交给老师的实验报告上有以下四个数据,其中测量数据合理的是(BD )A.用量筒量取5.13mL盐酸;B.用托盘天平称取11.7g氯化钠固体;C. 用广泛PH试纸(pH值由1 —14)测得某溶液的pH值为2.2;D. 在中和滴定时,用去氢氧化钠溶液的体积为21.82 mL。

大学生基础化学考试题及答案一、选择题(每题2分,共20分)1. 化学中,物质的量通常用哪个单位来表示?A. 千克(kg)B. 摩尔(mol)C. 升(L)D. 克(g)答案:B2. 下列哪个元素的化学符号是正确的?A. 铜(Cu)B. 铁(Fe)C. 氧(Oy)D. 钠(Na)答案:A3. 根据周期表,下列哪个元素属于卤素?A. 氟(F)B. 氖(Ne)C. 氩(Ar)D. 氪(Kr)答案:A4. 化学反应中的能量变化通常表现为哪种形式?A. 电能B. 机械能C. 热能D. 光能答案:C5. 哪种类型的化学键在离子化合物中最为常见?A. 共价键B. 金属键C. 离子键D. 氢键答案:C6. 下列哪个反应是分解反应?A. A + B → ABB. AB + C → A + BCC. 2H2 + O2 → 2H2OD. AB → A + B答案:D7. 在标准温度和压力下,1摩尔理想气体的体积是多少?A. 22.4 LB. 5.6 LC. 0.08 LD. 1 L答案:A8. 什么是化学平衡?A. 反应物和产物浓度不再变化的状态B. 反应物完全转化为产物的状态C. 反应速率最快的状态D. 反应物和产物浓度相等的状态答案:A9. 下列哪个是强酸?A. 醋酸(CH3COOH)B. 氢氧化钠(NaOH)C. 硫酸(H2SO4)D. 碳酸(H2CO3)答案:C10. 什么是氧化还原反应?A. 有元素化合价变化的反应B. 有气体产生的反应C. 有沉淀产生的反应D. 有能量释放的反应答案:A二、填空题(每题2分,共20分)11. 原子序数为6的元素是______。
答案:碳(C)12. 1升水的质量大约是______克。
答案:100013. pH值小于7的溶液是______性的。
答案:酸14. 化学反应速率的快慢受______的影响。
答案:温度、浓度、催化剂等15. 在有机化学中,一个碳原子最多可以形成______个共价键。

大学化学基础试题及答案一、选择题(每题2分,共10分)1. 下列物质中,属于酸的是:A. NaOHB. HClC. NaClD. H2O答案:B2. 化学方程式2H2 + O2 → 2H2O表示的化学变化是:A. 置换反应B. 氧化还原反应C. 复分解反应D. 酸碱中和反应答案:B3. 原子序数为6的元素是:A. 碳B. 氧C. 氮D. 氢答案:C4. 在标准状况下,1摩尔气体的体积是:A. 22.4 LB. 22.4 mLC. 224 LD. 224 mL答案:A5. 下列化合物中,属于共价化合物的是:A. NaClB. H2OC. NaOHD. MgO答案:B二、填空题(每题2分,共10分)1. 元素周期表中,第IA族元素的名称是______。
答案:碱金属2. 根据酸碱质子理论,能够释放质子的物质被称为______。
答案:酸3. 化学反应中,如果反应物和生成物的摩尔数相等,则该反应是______。
答案:平衡反应4. 摩尔质量的单位是______。
答案:克/摩尔(g/mol)5. 元素周期表中,第VIII族元素包括铁、钴、镍,它们属于______。
答案:过渡金属三、简答题(每题5分,共20分)1. 简述什么是氧化还原反应,并给出一个例子。
答案:氧化还原反应是指在化学反应中,原子或离子之间发生电子转移的过程。
例如,铁与稀盐酸反应生成氯化亚铁和氢气,铁被氧化,盐酸被还原。
2. 什么是同位素?请列举两个氢的同位素。
答案:同位素是指具有相同原子序数但不同质量数的原子。
氢的两个同位素是氕(1H)和氘(2H)。
3. 什么是化学键?请列举两种不同类型的化学键。
答案:化学键是指原子之间通过电子的相互作用形成的化学连接。
两种不同类型的化学键包括离子键和共价键。
4. 简述什么是酸碱中和反应,并给出一个例子。
答案:酸碱中和反应是指酸和碱在水溶液中发生反应,生成盐和水的过程。
例如,盐酸与氢氧化钠反应生成氯化钠和水。
四、计算题(每题10分,共20分)1. 计算1摩尔硫酸(H2SO4)在标准状况下的体积。

大学基础化学考试试卷真题归纳总结(含答案)大学基础化学考试试卷真题归纳总结(含答案)1、某同学在用半机械加码电光分析天平称量某物的质量时,打开升降枢纽后,此时,标尺的偏转比较慢,于是,将升降枢纽打开至最大,但最后发现显示屏上标线处在标尺的零刻度的左边,这时,该同学的正确操作是 AA.关好升降枢纽,将圈码减少10mg,重新称量B.关好升降枢纽,将圈码增大10mg,重新称量C.直接将圈码减少10mg,稳定后读数D.直接将圈码增大10mg,稳定后读数(实验题)2、滴定管清洗后,内壁应不挂有水珠。
一同学用内壁挂有水珠的酸式滴定管来测定硼砂含量,假定其它操作都无问题,包括用蒸馏水及酸标准液润洗过程,则最后结果,硼砂含量会 AA.偏高B.偏低C.无影响D.无法确定(实验题)3、半机械加码电光分析天平是一种精密的称量仪器。
天平玛瑙刀口锋利程度直接影响到天平的灵敏度,故使用中应特别注意保护刀口。
下列说法中,可以保护刀口的是 DA.旋转升降枢纽时,必须缓慢均匀,过快会使刀刃急触而损坏B.当天平处于工作状态时,决不允许在称盘上取放称物及砝码,一定要关上天平,将天平梁托起后取放称物及砝码C.天平读数时,应将两边边门关上,否则空气流动可能会使天平左右摇摆,从而影响到玛瑙刀口D.以上全都可以(实验题)4、H原子中3d、4s、4p能级之间的能量高低关系为BA.3d<4s<4pB.3d<4s=4pC.3d=4s=4pD.3d>4s=4p5、水具有反常的高沸点是由于存在着CA.共价键B.孤对电子C.氢键D.离子键6、在用可见分光光度法测量时,某有色溶液的浓度变为原来的一半时,其吸收光谱上最大吸收峰的位置和高度将会 DA.位置向短波方向移动,高度不变B.位置向长波方向移动,高度不变C.位置不变,峰的高度也不变D.位置不变,峰的高度变为原来的一半7、由n和l两个量子数可以确定 BA.原子轨道B.能级C.电子运动的状态D.电子云的形状和伸展方向8、以下分子中,偶极距不等于零的极性分子是 CA. BeCl2B. BF3C. H2SD. SiF49、有关配合物的下述说法中错误的是 DA. [Fe(CN)6]3-与[FeF6]3-虽然都是八面体配合物,但其分裂能⊿o不相等B. Cd的原子序数为48,CN-为强场配体,但[Cd(CN)6]4-不能称为低自旋配离子C. EDTA滴定法中控制溶液的pH值相当重要D.在血红色的[Fe(SCN)6]3-配合物中加足量EDTA也不能生成[FeY]-10、下列几组用半透膜隔开的溶液中,水由右向左渗透的是 CA. 5%C12H22O11(蔗糖)│5%C6H12O6(葡萄糖)B. 0.5 mol·L-1CO(NH2)2(尿素)│0.5 mol·L-1NaClC. 0.5 mol·L-1Na2CO3│0.5 mol·L-1 NaClD.0.5 mol·L-1Na2SO4│0.5 mol·L-1CaCl211、有关下列沉淀溶解说法正确的是 CA. CaC2O4既溶于HCl又溶于HAcB. Mg(OH)2溶于HCl不溶于NH4ClC. AgCl溶于NH3·H2OD. AgI溶于NH3·H2O和KCN12、影响缓冲容量的因素是 CA.缓冲溶液的pH值和缓冲比B.共轭酸的p K a和共轭碱的p K bC.缓冲溶液的共轭碱浓度与共轭酸浓度及二者之比D.缓冲溶液的总浓度和共轭酸的p K a13、某一可逆的元反应,在298.15K时,正反应速率常数k1是逆反应速率常数k-1的10倍。

西安交通大学14年6月课程考试《大学化学》考查课试题
二、主观填空题
1、CO 2 、2SiO 、2Na O 、Ca 的晶体类型分别为: 分子晶体 、 原子晶体 、 离
CO。
子晶体、金属晶体;熔点最低的为:
2
2、按物质和能量交换的不同情况可将系统分为:敞开系统、封闭系统、孤立系统。
其中,敞开系统是系统和环境之间既有物质交换又有能量交换, 封闭系统是系统和环境之间只有能量交换,没有物质交换
3、NO2 的严重危害在于它能强烈吸收紫外线,成为光化学烟雾的主要引发剂之
一;温室效应指由于二氧化碳、水蒸气、氟氯烃等微量气体的排放浓度增加
所引起的全球变暖现象。
三、计算题
1、解:Q=mC液·ΔT+C计ΔT=(mC液+C计)ΔT=(4.184*2000+2020)*(24.04-19.84)
=43.63Kj;
Q V=ΔU=-(32.04*43.63/1.922)=-727.3kJ·mol-1
2、电极反应:负极Zn(s)-2e-=Zn2+(aq) 氧化反应;
正极Cu2+(aq)+2e+=Cu(s) 还原反应;
电池反应:Zn(s)+Cu2+(aq)= Cu(s)+ Zn2+(aq)。
3、
HClO H:+1;Cl:+1;O:-2 。
OF2 O:+2;F:-1。
K2S2O8:K:+1;S:+6;O:-1。

大学基础化学题库及答案一、选择题1. 化学元素周期表中,元素按照什么顺序排列?A. 原子量B. 原子序数C. 电子数D. 质子数答案:B2. 下列哪种化合物是共价化合物?A. NaClB. CaOC. H2OD. FeS答案:C3. 摩尔质量的单位是:A. 克B. 千克C. 克/摩尔D. 千克/摩尔答案:C二、填空题1. 原子的核外电子排布遵循______原则,电子在原子核外按照能量的高低,依次填充在不同的能级上。
答案:能量最低2. 化学键分为______、______和金属键三种基本类型。
答案:离子键、共价键3. 1摩尔任何物质所包含的粒子数都等于阿伏伽德罗常数,其数值为______。
答案:6.02×10^23三、简答题1. 什么是化学反应的平衡常数?答案:化学反应的平衡常数是一个衡量化学反应在平衡状态下各物质浓度比的量,它只与温度有关,而与反应物和生成物的浓度无关。
2. 什么是酸碱中和反应?请简述其基本原理。
答案:酸碱中和反应是指酸和碱在一定条件下发生反应,生成盐和水的过程。
其基本原理是酸中的氢离子(H+)与碱中的氢氧根离子(OH-)结合生成水,同时酸和碱中的其他离子结合形成盐。
四、计算题1. 如果有1.5摩尔的硫酸(H2SO4),计算其含有的硫酸根离子(SO4^2-)的物质的量。
答案:硫酸根离子的物质的量为1.5摩尔硫酸中的硫酸根离子数量。
因为每个硫酸分子含有一个硫酸根离子,所以硫酸根离子的物质的量等于硫酸的物质的量,即1.5摩尔。
2. 已知某溶液中NaCl的物质的量浓度为0.1摩尔/升,求1升该溶液中含有的Na+和Cl-的粒子数。
答案:NaCl完全解离为Na+和Cl-,所以1升溶液中Na+和Cl-的物质的量均为0.1摩尔。
根据阿伏伽德罗常数,0.1摩尔的粒子数为0.1 × 6.02×10^23 = 6.02×10^22个。
五、实验题1. 描述如何使用滴定法测定溶液的pH值。
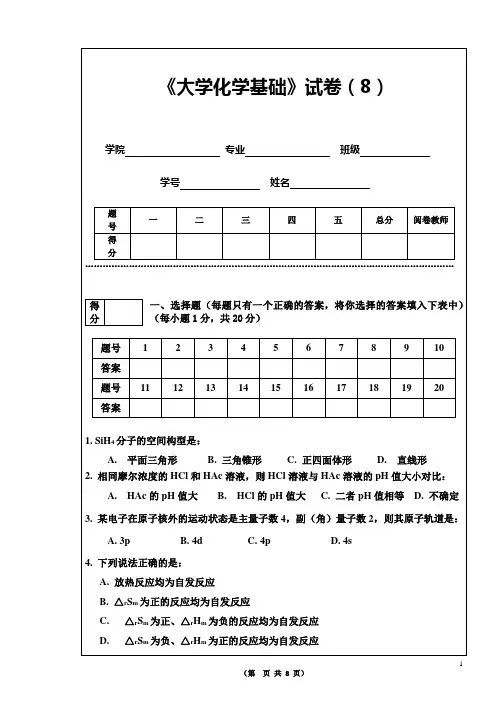
《大学化学基础》试卷(8)学院 专业 班级学号 姓名题 号 一 二 三 四 五 总分 阅卷教师得 分………………………………………………………………………………………………………………一、选择题(每题只有一个正确的答案,将你选择的答案填入下表中)(每小题1分,共20分) 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案1. SiH 4分子的空间构型是:A. 平面三角形B. 三角锥形C. 正四面体形D. 直线形 2. 相同摩尔浓度的HCl 和HAc 溶液,则HCl 溶液与HAc 溶液的pH 值大小对比:A. HAc 的pH 值大B. HCl 的pH 值大C. 二者pH 值相等D. 不确定 3. 某电子在原子核外的运动状态是主量子数4,副(角)量子数2,则其原子轨道是:A. 3pB. 4dC. 4pD. 4s 4. 下列说法正确的是: A. 放热反应均为自发反应 B. △r S m 为正的反应均为自发反应 C. △r S m 为正、△r H m 为负的反应均为自发反应 得 分5. 下列各物质中不存在氢键的分子是:A. NH3B. CH4C. 邻硝基苯酚D. HNO36.已知:(1)CoO(s)+CO(g)= Co(s)+CO2(g),K(2)CO2(g)+H2(g) = CO(g)+H2O(l),K(3)H2O(l) = H2O(g),K则反应CoO(s)+H2(g)=Co(s)+H2O(g)的平衡常数为:A. K K/KB. K K KC. K K/KD. K/K K7. BaCO3能溶于盐酸的最合理解释是:A. BaCO3的K spθ较大;B. BaCO3在水中的溶解度较大;C. 能反应生成CO2气体离开系统,使溶解平衡发生移动;D. BaCO3的K spθ较小;8. 根据分子轨道理论下列物质中不可能存在的是:A. Li2B. B2C. C2D. He29. 下列各项条件改变中,能引起化学反应的标准平衡常数数值改变的是:A. 压力改变;B. 催化剂更换;C. 温度改变;D. 容器的体积改变;10.下列氧化剂中,当其溶液的H+浓度增大时,氧化性增强的是:A. KClO3B. Br2C. FeCl3D. F211. 按配合物的价键理论,配合物中中心原子与配体之间的结合力为A. 离子键B. 配位键C. 氢键D. 正常共价键12. 下列物理量值的大小与化学反应方程式的写法无关的是:A. △r H mB. △r S mC. E(电池电动势)D. △r G m13.下列电对中,Eθ值最小的是:A. H+/H2B. H2O/H2C. HOAc/H2D. HF/H214、欲使AgCl溶解,可加入:A. NH3·H2OB. HClC. NaOHD. NaCl15.具有下列各组量子数的电子能量最高的是:A. 4,2,0,-1/2B. 4,3,1,+ 1/2C. 3,2,1,-1/2D. 3,2,0,+1/2A. K a/2B.KaC 21 C.2/KaC D. C/217. 下列描述中正确的是:A. 因为电对Ni 2++2eNi 的ϕӨ为–0.23 V ,所以2Ni 2++4e2Ni 的ϕӨ为–0.46 VB. 在氧化还原反应中,若两个电对的E θ值相差越大,则反应进行得越快C. 含氧酸根的氧化能力通常随溶液的pH 值减小而增强D. 由于E θ(Fe 2+/Fe)=-0.440V , E θ(Fe 3+/Fe 2+)=0.771V , 故Fe 3+与Fe 2+能发生氧化还原反应18.往1dm 3浓度为0.10 mol·dm -3HAc 溶液中加入一些NaAc 晶体并使之溶解,会发生的情况是:A. HAc 的K a 值增大B. HAc 的K a 值减小C. 溶液的pH 值增大D. 溶液的pH 值减小 19.关于铜、锌和稀硫酸构成的原电池,叙述错误的是:A. 锌是负极B. 铜是正极C. 电子由锌片经导线流入铜片D. 电子由锌片经硫酸溶液流入铜片 20. 某容器中加入相同物质的量的HCl 和O 2,在一定温度下发生反应: 4HCl(g)+O 2(g)2Cl 2(g)+2H 2O(g),平衡时,下列关系正确的是:A. p (HCl)>p (O 2)B. p (HCl)<p (O 2)C. p (HCl)=p (O 2)D. p (HCl)=p (Cl 2)二、是非判断题(判断下列叙述是否正确,正确的画√,错误的画×,请将答案填入下表中) (每小题1分,共10分) 题号 1 2 3 4 5 6 7 8 9 10 答案1. 凡含有极性键的分子都是极性分子。

+一、名词解释(每小题3分,共30分) 1、生物大分子2、二级结构3、同工酶4、磷氧比5、减色效应6、分子杂交7、糖异生8、必需脂肪酸9、密码子10、转氨基作用二、英文缩写(每小题0.5分,共5分)1、Leu2、His3、Ser4、Ala5、Tyr6、TPP7、rRNA8、FAD9、GSH10、BCCP 三、选择题(每小题1分,共10分)1、下面氨基酸中唯一不具有手性碳的氨基酸是( )A 甘氨酸B 谷氨酸C 脯氨酸D 天冬氨酸 2、G-250法测定蛋白质含量实验中选用的波长是( )A 420 nmB 470 nmC 595 nmD 620 nm3、下面四句有关逆转录酶的描述中错误的一项是( ) A 具有DNA 聚合酶活性 B 端粒酶是逆转录酶 C 具有RNaseH 酶活性D RNA 聚合酶是逆转录酶 4、氰化物能够阻断特定部位的电子传递链,该部位为( )A NADH→C oQB FMN→C oQ C Cytb →Cytc 1D Cytaa 3→O 2 5、酶促反应速度达到最大反应速度50%时的K m 等于( )A 1/4[S]B 3/4[S]C 1/2[S]D [S] 6、原核生物中一分子葡萄糖经TCA 彻底氧化能产生多少ATP ( )A 30B 31C 32D 337、饱和脂肪酸从头合成过程中,真正的二碳单位引入形式为( )8、反密码子序列为5'- AUC- 3'的tRNA 可识别的密码子序列是( )A 5'- GAT -3'B 5'- GAU -3'C 5'- TAG -3'D 5'- UAG -3' 9、原核生物蛋白质合成中负责转运起始甲硫氨酸的tRNA 是( )A tRNA MetB tRNA f MetC tRNA i MetD tRNA m Met 10、蛋白质的合成方向是( )A C→NB N→C C 3’→5’D 5’→3’A 丙二酸单酰辅酶AB 乙酰辅酶AC 琥珀酰辅酶AD 辅酶A 2020-2021《基础生物化学》期末课程考试试卷A 考试时间:120分钟 考试方式:闭卷 总分:100分四、填空题(每空1分,共15分)1、氧化型2, 6-二氯酚靛酚在酸性呈现_________色,在碱性环境下呈现_________色。

大学基础化学试题及答案一、选择题(每题2分,共20分)1. 下列哪种元素的原子序数为11?A. 钠B. 镁C. 铝D. 硅答案:A2. 氢的同位素中,不含中子的是:A. 氘B. 氚C. 氦-3D. 氢-1答案:D3. 根据酸碱质子理论,下列物质中属于碱的是:A. HClB. NaOHC. H2SO4D. NH4Cl答案:B4. 摩尔质量的单位是:A. g/molB. kg/molC. mol/gD. g答案:A5. 以下哪种化合物是共价化合物?A. NaClB. MgOC. H2OD. Fe答案:C6. 根据勒夏特列原理,以下哪种情况会使反应N2(g) + 3H2(g) ⇌2NH3(g)向左移动?A. 增加NH3的浓度B. 增加N2的浓度C. 减小H2的浓度D. 增加压力答案:A7. 下列哪种物质不属于碳水化合物?A. 葡萄糖B. 蔗糖C. 淀粉D. 蛋白质答案:D8. 根据亨利定律,气体在溶液中的溶解度与以下哪个因素无关?A. 温度B. 气体的分压C. 气体的分子量D. 溶液的体积答案:D9. 以下哪种元素的电子排布不符合奥芬堡原理?A. 碳(1s2 2s2 2p2)B. 氮(1s2 2s2 2p3)C. 氧(1s2 2s2 2p4)D. 氖(1s2 2s2 2p6)答案:B10. 以下哪种物质的熔点最高?A. 干冰(固态CO2)B. 固态水(冰)C. 固态氯化钠D. 固态硫答案:C二、填空题(每题3分,共15分)1. 元素周期表中,第____周期的元素种类最多,共有____种元素。
答案:六,322. 根据电子排布规律,钠离子(Na+)的电子排布为____。
答案:1s2 2s2 2p63. 化学反应中,如果反应物的总能量高于生成物的总能量,则该反应是____反应。
答案:放热4. 根据酸碱质子理论,水是一种____。
答案:两性溶剂5. 摩尔浓度(M)的定义是每升溶液中所含溶质的摩尔数,其单位为____。

第五章思考题:1. Co(Ⅲ)以通式CoCl m•nNH3生成八面体构型配合物,m及n的值可能是哪些?若1mol的一种上述配位化合物与Ag+离子作用生成1molAgCl沉淀,问m和n的数值各为多少?答:(1)由于Co(Ⅲ) 为+3,则m=3,CoCl m•nNH3为八面体构型配合物,即配位数为6。
n的值可能为6、5、4、3(2)1mol配位化合物与Ag+离子作用生成1molAgCl沉淀,配合物的外界为1,n=6-(3-1) =42. 在不同条件下,可从三氯化铬水溶液中获得3种不同颜色的配合物。
分别加入AgNO3后,紫色的可将氯全部沉淀为AgCl,而蓝绿色的有2/3的氯沉淀出来,绿色的加入AgNO3后只有1/3的氯沉淀为AgCl,根据上述实验现象写出它们的结构式。
答:紫色[Cr(H2O)6]Cl3蓝绿色[CrCl(H2O)5]Cl2绿色[CrcCl2(H2O)4]Cl3. 衣物上的铁锈渍,可先用高锰酸钾的酸性溶液润湿,再滴加草酸溶液,然后以水洗涤而除去。
试予以解释。
答:衣物上的铁锈渍,先用高锰酸钾的酸性溶液润湿,是使其氧化并以Fe3+存在,滴加草酸溶液,Fe3+与C2O42-形成易溶于水的络合物,用水冲洗即可除去。
4. [Fe(H2O)6]2+为顺磁性, 而[Fe(CN)6]4–为反磁性, 请分别用价键理论和晶体场理论解释该现象。
答:价键理论[Fe(H 2O)6]2+ 配离子中的Fe 3+离子在配位体H 2O 影响下,3d 轨道的五个成单电子占据五个轨道,外层的4s ,4p ,4d 轨道形成sp 3d 2杂化轨道而与6个H 2O 成键,形成八面体配合物。
[Fe(CN)6]4– 配离子中的Fe 3+离子在配位体CN -—影响下,3d 轨道的五个成单电子占据3个轨道,剩余2个空的3d 轨道同外层的4s ,4p 轨道形成d 2 sp 3杂化轨道而与6个CN —-成键,形成八面体配合物。
晶体场理论[Fe(H 2O)6]2+轨道分裂能△o=10400cm -1 ,P=17600cm -1,因P ﹥△o ,故为高自旋态,顺磁性。
大学基础化学考试试卷真题归纳总结(含答案)1、某同学在用半机械加码电光分析天平称量某物的质量时,打开升降枢纽后,此时,标尺的偏转比较慢,于是,将升降枢纽打开至最大,但最后发现显示屏上标线处在标尺的零刻度的左边,这时,该同学的正确操作是 AA.关好升降枢纽,将圈码减少10mg,重新称量B.关好升降枢纽,将圈码增大10mg,重新称量C.直接将圈码减少10mg,稳定后读数D.直接将圈码增大10mg,稳定后读数(实验题)2、滴定管清洗后,内壁应不挂有水珠。
一同学用内壁挂有水珠的酸式滴定管来测定硼砂含量,假定其它操作都无问题,包括用蒸馏水及酸标准液润洗过程,则最后结果,硼砂含量会 AA.偏高B.偏低C.无影响D.无法确定(实验题)3、半机械加码电光分析天平是一种精密的称量仪器。
天平玛瑙刀口锋利程度直接影响到天平的灵敏度,故使用中应特别注意保护刀口。
下列说法中,可以保护刀口的是 DA.旋转升降枢纽时,必须缓慢均匀,过快会使刀刃急触而损坏B.当天平处于工作状态时,决不允许在称盘上取放称物及砝码,一定要关上天平,将天平梁托起后取放称物及砝码C.天平读数时,应将两边边门关上,否则空气流动可能会使天平左右摇摆,从而影响到玛瑙刀口D.以上全都可以(实验题)4、H原子中3d、4s、4p能级之间的能量高低关系为BA.3d<4s<4pB.3d<4s=4pC.3d=4s=4pD.3d>4s=4p5、水具有反常的高沸点是由于存在着CA.共价键B.孤对电子C.氢键D.离子键6、在用可见分光光度法测量时,某有色溶液的浓度变为原来的一半时,其吸收光谱上最大吸收峰的位置和高度将会 DA.位置向短波方向移动,高度不变B.位置向长波方向移动,高度不变C.位置不变,峰的高度也不变D.位置不变,峰的高度变为原来的一半7、由n和l两个量子数可以确定 BA.原子轨道B.能级C.电子运动的状态D.电子云的形状和伸展方向8、以下分子中,偶极距不等于零的极性分子是 CA. BeCl2B. BF3C. H2SD. SiF49、有关配合物的下述说法中错误的是 DA. [Fe(CN)6]3-与[FeF6]3-虽然都是八面体配合物,但其分裂能⊿o不相等B. Cd的原子序数为48,CN-为强场配体,但[Cd(CN)6]4-不能称为低自旋配离子C. EDTA滴定法中控制溶液的pH值相当重要D.在血红色的[Fe(SCN)6]3-配合物中加足量EDTA也不能生成[FeY]-10、下列几组用半透膜隔开的溶液中,水由右向左渗透的是 CA. 5%C12H22O11(蔗糖)│5%C6H12O6(葡萄糖)B. 0.5 mol·L-1CO(NH2)2(尿素)│0.5 mol·L-1NaClC. 0.5 mol·L-1Na2CO3│0.5 mol·L-1 NaClD.0.5 mol·L-1Na2SO4│0.5 mol·L-1CaCl211、有关下列沉淀溶解说法正确的是 CA. CaC2O4既溶于HCl又溶于HAcB. Mg(OH)2溶于HCl不溶于NH4ClC. AgCl溶于NH3·H2OD. AgI溶于NH3·H2O和KCN12、影响缓冲容量的因素是 CA.缓冲溶液的pH值和缓冲比B.共轭酸的p K a和共轭碱的p K bC.缓冲溶液的共轭碱浓度与共轭酸浓度及二者之比D.缓冲溶液的总浓度和共轭酸的p K a13、某一可逆的元反应,在298.15K时,正反应速率常数k1是逆反应速率常数k-1的10倍。
课程答案网课刷课f ly in gj gh《大学化学基础》课程期中考试试卷(A 卷)考试方式闭卷 考试时间 120 分钟学院 专业 班级学号 姓名题号 一 二 三 四 五 总分 阅卷教师得分…………………………………………………………………………………………………………………………一、单项选择题(每小题1分,共20分,将你选择的答案填入下表中)得 题号 1 2 3 4 5 6 7 8 9 10答案题号 11 12 13 14 15 16 17 18 19 20 答案1. 同一原子中,可能存在下列量子数的两个电子是 ( )A .(1,1,0,+1/2)和(1,0,1,-1/2)B .(2,0,1,+1/2)和(2,0,0,-1/2)C .(3,2,0,-1/2)和(3,2,2,-1/2)D .(1,0,0,+1/2)和(1,0,0,-1/2) 2. 下列原子半径最小的是 ( )A .MgB .AlC .SD .F 3. 最外层电子排布为2s 22p 3的元素,其原子序数为( )A .5B .7C .13D .15 4. 同周期主族元素从左到右第一电离能变化规律是( )A .增大B .减小C .先增大后减D .不变 5. 元素周期表中第18列称为( )族分课程答案网课刷课flyingjghA.VIII B.VIIA C.VIIIB D.06. 下列化学键中极性最强的是( )A.H-H B.H-F C.H-O D.H-I7. 下列化合物中,是由极性键构成的非极性分子是( )A.Cl2B.H2S C.CO2 D.H-O-H8. 按离子极化理论,下面离子中变形性最大的是( )A.Cl-B.F-C.Br-D.Na+9. 下列物质沸点最高的是( )A.H2O B.CH4C.CH3OH D.CH3CH2OH10. 决定NH3-NH4Cl 缓冲溶液pH的最主要因素是( )A.弱碱的浓度B.弱碱盐的浓度C.弱碱的解离常数D.弱碱与弱碱盐的浓度比11. 在温度T下,若已知反应A→2B的反应热效应为Q1,反应2A→C的反应热效应为Q2,反应C→4B的反应热效应为Q3,则Q3=( )A. 2Q1 + Q2B.Q1 - 2Q2C.Q1 + Q2D. 2Q1 - Q212. 在可逆反应中加催化剂的目的是( )A.使平衡向正反应方向移动B.使原来不能发生的反应得以发生C.破坏化学平衡状态D.缩短反应达到平衡的时间13. 将基元反应2SO2(g)+O2(g) 2SO3(g)体系中,反应物的浓度增大到原来的2倍,则改变后的反应速度是原反应速度的( )倍。
基础化学考试题及答案一、选择题(每题2分,共20分)1. 元素周期表中,氧元素的原子序数是:A. 6B. 8C. 16D. 18答案:C2. 下列物质中,属于碱的是:A. 硫酸B. 氢氧化钠C. 碳酸钙D. 氯化钠答案:B3. 根据质量守恒定律,化学反应前后:A. 元素种类不变B. 物质的总质量不变C. 原子种类不变D. 所有选项都正确答案:D4. 化合物中,氢元素的化合价通常为:A. +1B. -1C. +2D. -2答案:A5. 根据酸碱中和反应的原理,下列物质中能够中和盐酸的是:A. 氢氧化钠B. 碳酸钠C. 硫酸D. 氯化钠答案:A6. 金属活动性顺序中,位于氢前面的金属能够:A. 与酸反应生成氢气B. 与碱反应生成氢气C. 与盐反应生成氢气D. 与水反应生成氢气答案:A7. 根据氧化还原反应的原理,下列物质中具有氧化性的是:A. 氧气B. 氢气C. 二氧化碳D. 氯化钠答案:A8. 根据化学平衡原理,下列条件中能够使化学平衡向正反应方向移动的是:A. 增加反应物浓度B. 减少生成物浓度C. 增加催化剂D. 降低温度答案:A9. 根据原子结构理论,原子核外电子的排布遵循:A. 泡利不相容原理B. 洪特规则C. 能量最低原理D. 所有选项都正确答案:D10. 根据化学键理论,下列物质中属于离子化合物的是:A. 氧气B. 氯化钠C. 甲烷D. 氮气答案:B二、填空题(每空1分,共20分)1. 碳原子的核外电子排布为______,其中最外层电子数为______。
答案:1s²2s²2p²,42. 根据酸碱中和反应的原理,酸和碱反应生成______和______。
答案:盐,水3. 根据化学平衡移动原理,当增大反应物浓度时,化学平衡会向______方向移动。
答案:正反应4. 根据氧化还原反应的原理,氧化剂在反应中被______,还原剂在反应中被______。
答案:还原,氧化5. 根据原子结构理论,原子核外电子排布遵循______、______和______。
大一基础化学试题及答案一、选择题(每题2分,共20分)1. 元素周期表中,元素的排列顺序是根据以下哪一项?A. 原子量B. 电子层数C. 最外层电子数D. 原子序数答案:D2. 下列物质中,哪一种是共价化合物?A. NaClB. NaOHC. H2OD. MgO答案:C3. 根据酸碱质子理论,下列物质中属于酸的是?A. H2OB. NH3C. NaOHD. HCl答案:D4. 以下哪种反应是氧化还原反应?A. HCl + NaOH → NaCl + H2OB. 2H2 + O2 → 2H2OC. CaCO3 → CaO + CO2D. 2Na + Cl2 → 2NaCl5. 摩尔质量的单位是?A. g/molB. mol/gC. kg/molD. mol/kg答案:A6. 根据勒夏特列原理,如果增加反应物的浓度,平衡将如何移动?A. 向左移动B. 向右移动C. 不移动D. 无法确定答案:B7. 以下哪种元素的原子序数是11?A. NaB. MgC. AlD. Si答案:A8. 根据波耳兹曼分布定律,气体分子的动能与其温度的关系是?A. 正比B. 反比C. 无关D. 先正比后反比答案:A9. 以下哪种物质是强电解质?B. H2OC. CH3COOHD. H2SO4答案:A10. 根据斯托克斯定律,颗粒在液体中沉降速度与其直径的关系是?A. 正比B. 反比C. 无关D. 先正比后反比答案:A二、填空题(每题2分,共20分)1. 元素周期表中,元素的电子层数等于其周期数。
2. 酸的定义是能够释放出H+的物质。
3. 氧化还原反应的特征是元素的氧化态发生变化。
4. 摩尔质量是指1摩尔物质的质量。
5. 勒夏特列原理指出,如果一个处于平衡状态的系统受到外部条件的改变,系统会自发地调整,以减少外部条件改变的影响。
6. 原子序数等于元素的核内质子数。
7. 波耳兹曼分布定律描述了气体分子动能与其温度的关系。
8. 强电解质是指在水溶液中能够完全电离的物质。
基础化学试题及答案大一一、选择题(每题2分,共20分)1. 化学元素周期表中,氧元素的原子序数是多少?A. 6B. 8C. 16D. 182. 以下哪个不是化学元素的符号?A. FeB. AuC. CuD. Ca3. 摩尔质量的单位是:A. gB. kgC. g/molD. mol/g4. 原子的核外电子排布遵循哪个原则?A. 泡利不相容原理B. 能量最低原理C. 洪特规则D. 所有以上5. 以下哪个是强酸?A. 醋酸B. 碳酸C. 氢氧化钠D. 氢氧化钾6. 根据酸碱质子理论,以下哪个是酸?A. 硫酸钠B. 氯化钠C. 碳酸氢钠D. 氢氧化钠7. 化学键中,离子键通常存在于:A. 金属与非金属之间B. 非金属与非金属之间C. 金属与金属之间D. 非金属与金属之间8. 氧化还原反应中,氧化剂和还原剂分别发生什么变化?A. 氧化剂被氧化,还原剂被还原B. 氧化剂被还原,还原剂被氧化C. 氧化剂被还原,还原剂被氧化D. 氧化剂被氧化,还原剂被氧化9. 以下哪个是化学平衡的表达式?A. K = [A][B]/[C][D]B. K = [A]/[B]C. K = [C][D]/[A][B]D. K = [A] + [B] - [C] - [D]10. 根据勒夏特列原理,增加反应物浓度,平衡会如何移动?A. 向左移动B. 向右移动C. 不移动D. 无法确定答案:1. B2. D3. C4. D5. A6. C7. A8. B9. C10. B二、填空题(每空2分,共20分)1. 原子的核外电子排布遵循的三大规则是:______、______、______。
答案:能量最低原理、泡利不相容原理、洪特规则2. 摩尔浓度(Molarity)的定义是:______。
答案:单位体积溶液中所含溶质的摩尔数3. 化学平衡常数(K)表达式为:K = [C][D]/[A][B],其中[A]、[B]、[C]、[D]分别代表______。