营养盐对小球藻生长及胞内蛋白质含量的影响
- 格式:pdf
- 大小:175.59 KB
- 文档页数:5

盐度对蛋白核小球藻生长、叶绿素荧光参数及代谢酶的影响佚名【摘要】以蛋白核小球藻820为实验材料,研究了3种盐度(15、30、45)对其生长、叶绿素荧光参数和两种代谢酶活性的影响,以了解该小球藻对盐度的适应能力.结果表明,蛋白核小球藻820的生长随盐度增加而变慢;而油脂含量随盐度增加而升高.叶绿素荧光参数中的PSII最大光能转化效率(Fv/Fm)、PSII实际光能转化效率(ΦPSII)、光化学淬灭系数(qP)随盐度升高下降,而非光化学淬灭系数(NPQ)随盐度升高而上升.超氧化物歧化酶(SOD)活性变化大致趋势是低盐和高盐下活性较高,碳酸酐酶(CA)活性则随盐度升高而降低,第5 d时45盐度是30盐度培养的0.43倍.因此,认为高盐一定程度地抑制了蛋白核小球藻的生长、叶绿素荧光参数和CA活性,但是促进了总脂含量和抗氧化酶SOD活性的提高.%Chlorella pyrenoidosa is a kind of important economic microalgae. In this paper, the effects of different salinity (15, 30 and 45) on the growth, total lipid content, chlorophyll fluorescence parameters and enzymic activities of C. pyrenoidosa 820 are investigated in order to understand how the alga responds to salinity. Results show that, with the increase of salinity, the growth speed of C. pyrenoidosa 820 decreases, but the lipid contents keep increasing. The chlorophyll fluorescence parameters of the maximal photochemical efficiency of PSII (Fv/Fm), actual photochemical efficiency of PSII (ΦPSII) and photochemical quenching (qP) declinee with the increasing salinity, whereas the non-photochemical quenching (NPQ) is enhanced with the increasing salinity. The superoxide dismutase (SOD) activities are higher under the 15 and 45 salinity than that of 30. Thecarbonic anhydrase (CA) activities are reversely propotional to the salinity increase, and CA activity of 45 is 43%of that of 30 salinity on the fifth day. These results suggest that the growth, chlorophyll fluorescence parameters and CA activity of C. pyrenoidosa are inhibited to a certain extent by the increased salinity, but the lipid content and SOD activity are enhanced to adapt the adverse salt environment.【期刊名称】《宁波大学学报(理工版)》【年(卷),期】2013(000)003【总页数】5页(P6-10)【关键词】蛋白核小球藻;盐度;叶绿素荧光;超氧化物歧化酶;碳酸酐酶【正文语种】中文【中图分类】Q513小球藻(Chlorella)为绿藻门普生性常见单细胞藻,是第一种被人工培养的微藻[1].在我国常见的种类主要有蛋白核小球藻(C.pyrenoidosa)、椭圆小球藻(C.ellipsoidea)、普通小球藻(C.vulgaris)、原始小球藻(C.protothecoides)等.小球藻含有丰富的蛋白质、多糖、不饱和脂肪酸、膳食纤维、维生素和微量元素等[2],具有很高的营养价值,是人类优良的保健食品和水产养殖饵料.小球藻生长因子(CGF)以及小球藻中高含量的EPA、DHA等不饱和脂肪酸使小球藻在医药、化工和食品等行业也有广泛应用.盐度是影响水生藻类生长繁殖的一个重要生态因子,盐胁迫会引起微藻生理生化和分子水平等一系列的变化.首先,盐胁迫可以干扰光合作用在内的一系列生理过程,从而抑制藻类生长和光合作用[3].盐度还可以影响藻类光合色素含量,如低盐有利于盐生杜氏藻(Dunaliella salina)叶绿素含量的提高,而高盐则增加了胡萝卜素含量[4]. 盐度胁迫主要是渗透胁迫和离子胁迫.渗透压力和钠离子毒性还可以引起活性氧(ROS)包括超氧自由基、过氧化氢、羟自由基等的形成,后者可以破坏线粒体和叶绿体的细胞结构.而超氧化物歧化酶(SOD)是生物体内第一个参与活性氧清除反应的重要保护酶[5],在抗氧化损伤中发挥着重要作用.在较低盐度范围内,随着 NaCl浓度的提高,盐藻SOD活性显著增强[6].但杜氏藻D.tertiolecta中的不同抗氧化酶和抗氧化底物对盐度的响应则不同[7].盐度逆境也影响了藻类碳氮代谢等基础代谢活动.碳酸酐酶(CA)是一种广泛存在于动植物体内的重要酶类,负责催化CO2与的转化,参与生物体诸多生理过程,如光合作用、呼吸作用、CO2和离子运输、钙化作用和酸碱平衡等[8-9].CA活性的高低可反映出藻细胞无机碳利用情况,不同盐度对藻类CA活性也有着直接影响[10]. 笔者使用盐度耐受范围比较广的蛋白核小球藻(Chlorella pyrenoidosa)820为实验材料,研究了不同盐度对藻生长和叶绿素荧光参数的影响,并结合不同盐度培养下藻细胞的SOD和CA活性变化,探讨适合小球藻生长和碳代谢的盐度,了解小球藻对盐度环境的适应能力,为增强小球藻抗逆性,提高其无机碳利用和生物量等提供基础资料.1.1 藻种与培养本实验所用藻种为蛋白核小球藻(C.pyrenoidosa)820,来自宁波大学海洋生物工程重点实验室藻种室.用分别添加不同NaCl浓度的3种盐度(15、30、45)人工海水培养基培养,每个浓度设置3个平行.培养温度为25℃,光照强度为3500klx,光暗周期为12L:12D.1.2 实验方法(1)生长曲线制作:从第1 d到第15 d,每天取样测定藻液的 OD440吸光值,再按照藻细胞数与OD440标准曲线公式0.996 0),计算出相应OD值对应的小球藻细胞数,制作藻细胞的生长曲线.(2)总脂含量测定:以5000r·min-1离心收集平台期小球藻,冷冻干燥后取10mg干藻粉,参照香草醛比色法测定其总脂含量[11].(3)叶绿素荧光参数的测定:用Water-PAM水样叶绿素荧光仪(Walz,Germany)进行叶绿素荧光参数的测定.测量前将微藻样品暗适应15min,再利用水样叶绿素荧光仪发出的强饱和光激发,测量不同盐度下的荧光参数:PSII最大光能转化效率(Fv/Fm)、PSII实际光能转化效率(ΦPSII)、光化学淬灭系数(qP)和非光化学淬灭系数(NPQ).(4)超氧化物歧化酶(SOD)活性测定:参考朱广廉等氮蓝四唑法[12]测定SOD活力,以抑制氮蓝四唑光还原的50%为1个酶活力单位.(5)碳酸酐酶(CA)活性测定:采用pH计法,参照Wilbur和Anderson方法[13],并稍做改进.(6)数据处理:数据均采用Excel软件作图.2.1 不同盐度对蛋白核小球藻生长的影响小球藻在不同盐度培养基中生长情况如图 1所示.图1显示,3种盐度培养蛋白核小球藻均可以正常生长,只是随着盐度的增加生长速度变慢.其中,低盐(15)培养藻生长最快,其次是正常盐度(30),最慢的是高盐(45)培养.初始接种量相同,生长到第15d,低盐和高盐的细胞数分别是正常盐度(30)培养的1.04倍和0.83倍.可见,在此盐度范围内,该小球藻均能较快生长,说明本实验用小球藻的盐度适应范围较广.2.2 不同盐度对蛋白核小球藻总脂含量的影响盐度不仅可影响藻类生长,还影响藻类的生化组成.蛋白核小球藻820在不同盐度培养中的总脂积累情况见表1.由表1可见,不同盐度影响了小球藻总脂的积累,随着盐度升高蛋白核小球藻820总脂含量增加.低盐(30)条件下小球藻总脂含量最低,为22.44%,是正常盐度下总脂含量的0.87 倍,而高盐培养的总脂含量是正常盐度条件下的1.36倍.可见高盐度促进了该小球藻的总脂积累.2.3 不同盐度对蛋白核小球藻叶绿素荧光参数的影响蛋白核小球藻820的PSII最大光能转化效率(Fv/Fm)、PSII实际光能转化效率(ΦPSII)、光化学淬灭系数(qP)和非光化学淬灭系数(NPQ)随培养时间的变化如图2所示.从图中可知,不同盐度对4个叶绿素荧光参数的影响不同,其中Fv/Fm、ΦPSII 和qP均随着培养时间的增加呈现出先升后降趋势,并且随盐度升高而降低.而 NPQ 则随着盐度的升高和盐胁迫时间的延长而增加.2.4 不同盐度对蛋白核小球藻SOD活性的影响不同盐度培养的蛋白核小球藻SOD活性变化如图3所示.从图中可见,SOD活性随时间增加大致表现出“降—升—降”的过程,即在培养的前2h,SOD活性先稍有降低,在2~20h阶段SOD活性不断上升,在20h时SOD活性最高,20~72h阶段SOD活性又降低.不同盐度对SOD活性的影响较复杂,但大致趋势是低盐和高盐培养 SOD活性要高于正常盐度培养,这可能与高低盐胁迫下藻体内产生较多的活性氧自由基,因此诱导了 SOD酶活性的增加,以抵御和适应盐度逆境条件有关.2.5 不同盐度对蛋白核小球藻CA活性的影响图4是不同盐度条件下蛋白核小球藻碳酸酐酶活性变化情况.从图4可见,CA活性随着培养时间的延长经历了先升再降的变化过程,即在培养的第5 d,蛋白核小球藻820 CA活性达到最高值(前2d由于培养初期藻密度低,酶活性低,所以未测出).盐度对蛋白核小球藻碳酸酐酶活性影响是随着盐度升高CA活性降低.其中在酶活性最高的第5d,低盐(15)是正常盐度培养的1.99倍;而高盐(45)则为30盐度培养的0.43倍.3.1 盐度对微藻生长和油脂积累的影响盐度是影响水生藻类生长繁殖的一个重要环境因素,过低或过高盐度都会影响微藻生长和生化组成.关于盐度对微藻总脂积累的影响,多数结果表明,适当增加盐分可促进微藻的脂类含量[14].如在淡水培养小球藻中,不同盐度对小球藻油脂积累有不同程度的促进作用[15-16].而在耐盐绿藻杜氏藻D.tertiolecta中,其总脂含量从0.5mol·L-1NaCl培养的60%增加到1.0mol·L-1NaCl的67%[17].本研究结果也表明高盐度促进了微藻脂类积累.3.2 盐度对微藻叶绿素荧光参数的影响叶绿素在光能的吸收、传递和转换过程中起着非常重要作用.叶绿素荧光分析技术就是一种以光合作用理论为基础、利用植物体内叶绿素作为天然探针,研究和探测植物光合生理状况及各种外界因子对其细微影响的新型植物活体测定和诊断技术[18],其中常用几个重要叶绿素荧光动力学参数有PSII最大光能转化效率(Fv/Fm)、PSII实际光能转化效率(ΦPSII)、光化学淬灭(qP)和非光化学淬灭(NPQ)等.这些叶绿素荧光参数与光合作用的各反应过程密切相关,任何逆境条件对光合作用的影响都可通过叶绿素荧光诱导动力学反映出来[19].文中结果与大多数藻类在盐胁迫逆境中的结果一致,如塔胞藻和小新月菱形藻中的相关研究结果表明在高盐度下藻细胞的荧光动力学参数Fv/Fm、ΦPSII、qP低于正常海水,而NPQ却随着盐度升高而上升[20-21].这与非光化学淬灭是一种自我保护机制,对光合结构具有一定的保护作用相关[22].3.3 盐度对微藻SOD活性的影响SOD作为生物体内第一个参与活性氧清除反应的重要保护酶[5],在抗氧化物酶类中处于重要地位.SOD的主要功能是将超氧化物阴离子自由基(2O−)快速歧化为过氧化氢(H2O2)和分子氧;H2O2再在过氧化氢酶(CAT)和其它过氧化物酶(如APX)等的作用下转变为水和分子氧.不同植物物种在盐胁迫中SOD活性变化并不完全相同.高等植物中多数研究表明,盐度可以增加SOD的活性,也可以不改变其酶活[7].在藻类中也是如此,笔者的结果是高盐一定程度地增加了SOD活性;而杜氏藻D.tertiolecta在0.05~3mol·L-1整个盐度范围内,其SOD活性没有变化[7].3.4 盐度对微藻碳酸酐酶活性的影响碳酸酐酶(CA)是二氧化碳浓缩机制(CCM)的重要组成成分,在微藻无机碳转运过程中发挥着重要作用.碳酸酐酶活性变化将影响微藻光合作用中可利用无机碳浓度.CA 属于诱导酶类,其活性高低受无机碳浓度、盐度、Zn2+等环境因子的影响.本研究结果表明,CA活性受高盐抑制,该结果与其它微藻中研究结果一致.如盐生杜氏藻在5~ 20盐度的低渗培养基中培养时,其胞外CA活性显著降低[10];而小新月菱形藻中胞外CA活性也是随盐度升高而逐渐降低[21].【相关文献】[1] 胡开辉,汪世华.小球藻的研究开发进展[J].武汉工业学院学报,2005,24(3):27-30.[2] 杨鹭生,李国平,陈林水.蛋白核小球藻粉的蛋白质、氨基酸含量及营养价值评价[J].亚热带植物科学,2003,32(1):36-38.[3] Xia J R,Li Y J,Zou D H.Effect of salinity stress on PSII inUlva lactucaas probed by chlorophyll fluorescence measurements[J].Aqua Bot,2004,80:129-137.[4] 王培磊,袁子懿.盐度对盐生杜氏藻生长及其色素积累的影响[J].水产科学,2009,28(2):71-74.[5] McCord J M,Fridovich I.Superoxide dismutase:An enzymic function for erythrocuprein (hemocuprein)[J].J Biol Chem,1969,224:6049-6055.[6] 郭金耀,杨晓玲.盐藻超氧化物歧化酶分子类型鉴定[J].水产科学,2011,30(5):298-300.[7] Jahnke L S,White A L.Long-term hyposaline and hypersaline stresses produce distinct antioxidant responses in the marine algaDunaliella tertiolecta[J].J PlantPhysiol,2003,160:1193-1202.[8] Henry R E.Multiple roles of carbonic anhydrase in cellular transport and metabolism[J].Annu Rev Physiol,1996,58:523-538.[9] Badger M R,Price G D.The role of carbonic anhydrasein photosynthesis[J].Annu Rev Plant Physiol Plant Mol Biol,1994,45:369-392[10] Liu W,Ming Y,Li P,et al.Inhibitory effects of hypoosmotic stress on extracellular carbonic anhydrase and photosynthetic efficiency of green algaDunaliella salinapossibly through reactive oxygen species formation[J].Plant Physiol Biochem,2012,54:43-48.[11] 丛峰,孙雪,徐年军.几种小球藻油脂含量检测方法的比较及优化[J].宁波大学学报:理工版,2012,25(1):20-23.[12] 朱广廉,钟海文,张爱琴.植物生理学试验[M].北京:北京大学出版社,1990:37-40.[13] Wilbur K M,Anderson N G.Electrometric and colorimetric determination of carbonic anhydrase[J].J Biol Chem,1948,176:147-154.[14] Harwati T U,Willke T,Vorlop K D.Characterization of the lipid accumulation in a tropical freshwater microalgaeChlorococcumsp.[J].Bioresource Technology,2012,121:54-60.[15] 黄冠华,陈锋.环境因子对异养小球藻脂肪酸组分含量和脂肪总酸产量的影响[J].可再生能源,2009,27(3):65-69.[16] 张桂艳,温小斌,梁芳,等.重要理化因子对小球藻生长和油脂产量的影响[J].生态学报,2011,31(8):2076-2085.[17] Takagi M,Karseno,Yoshida T.Effect of salt concentration on intracellular accumulation of lipids and triacylglyceride in marine microalgaeDunaliellacells[J].J BiosciBioeng,2006,101(3):223-226.[18] 赵会杰,邹奇,余振文.叶绿素荧光分析技术及其在植物光合机理研究中的应用[J].河南农业大学学报,2000,34(3):248-251.[19] 梁英,冯力霞,尹翠玲,等.叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景[J].海洋科学,2007,31(1):71-77.[20] 梁英,冯力霞,田传远,等.盐胁迫对塔胞藻生长及叶绿素荧光动力学的影响[J].中国海洋大学学报,2006,36(5):726-732.[21] 余锦兰,夏建荣,邹永东.小新月菱形藻碳酸酐酶活性和光合作用对高盐度胁迫的响应[J].水产学报,2011,35(4):515-523.[22] 张守仁.叶绿素荧光动力学参数的意义与讨论[J].植物学通报,1999,16(4):444-448.。

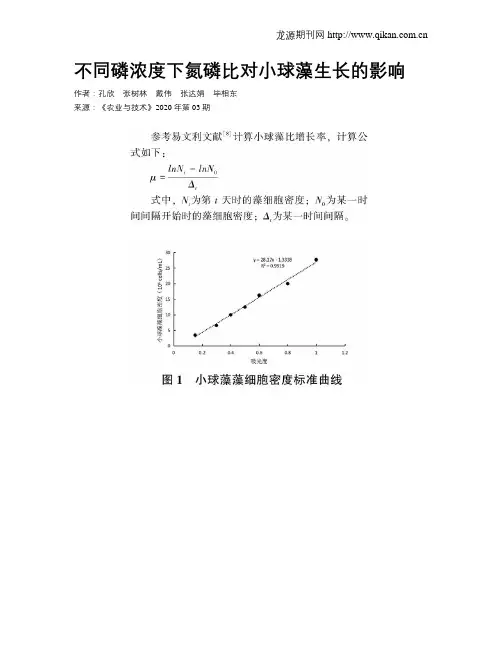
不同磷浓度下氮磷比对小球藻生长的影响作者:孔欣张树林戴伟张达娟毕相东来源:《农业与技术》2020年第03期摘要:通过室内试验研究不同磷浓度条件下氮磷比对小球藻(Chlorella vulgaris)生长的影响。
结果表明,在低磷浓度(0.05mg/L、0.1mg/L、0.2mg/L)和中磷浓度(0.4mg/L、0.6mg/L)下,随着氮磷比值增大,小球藻密度逐渐升高。
在高磷浓度(0.8mg/L、1mg/L)下,小球藻密度随着氮磷比增大呈先升高后下降趋势。
磷浓度为0.8mg/L条件下,N∶P=40∶1时,小球藻细胞密度达到最大值;磷浓度为1mg/L条件下,N∶P=30∶1时,小球藻细胞密度达到最大值。
以上研究结果表明,小球藻生长既受氮磷营养盐浓度水平影响又受氮磷比值影响。
关键词:小球藻;磷;氮磷比;生长中圖分类号:S-3文献标识码:ADOI:10.19754/j.nyyjs.20200215003收稿日期:2019-12-20基金项目:天津市自然科学基金重点项目(项目编号:18JCZDJC97800);天津市自然科学基金项目(项目编号:19JCYBJC30000);天津现代产业技术体系-水产-水质调控岗位(项目编号:ITTFR2017015);天津市高等学校创新团队“天津现代水产生态健康养殖创新团队” (项目编号:TD13-5089)作者简介:孔欣(1995-),女,硕士,研究方向:养殖水质调控;通讯作者张树林(1963-),男,教授,研究方向:养殖水质调控。
营养盐是水体中浮游生物赖以生存的主要营养来源,其组成和含量直接影响生物的代谢活动及藻类的生长情况[1]。
其中,氮、磷营养盐被认为是藻类生长过程中最关键的2个限制因素。
氮磷会直接影响藻类吸收和同化的效率,进而影响藻类的生长和胞内物质的积累[2]。
另外,氮和磷的作用需要相互配合,不同藻类对氮磷的需求量也不同。
一般在低氮磷浓度下,藻类生长缓慢,随着浓度增加,生长速率逐渐增高[3]。


盐度和无机碳对蛋白核小球藻生长、胞外碳酸酐酶活性及其基因表达的影响王玮蔚;孙雪;王冬梅;沈佳;徐年军【摘要】为探讨小球藻中碳酸酐酶对环境调控的响应规律,提高小球藻的生物量及对无机碳的利用,实验采用生化和荧光定量PCR方法研究了盐度和2种无机碳对蛋白核小球藻生长、胞外碳酸酐酶(CA)活性及3种亚型碳酸酐酶基因(ca)表达的影响.结果发现,培养至第9天时盐度15和30培养藻生长较快,盐度45藻细胞密度降为盐度15的0.83倍;CA活性随着盐度增加而降低,盐度45长时间处理酶活性降低更为明显,3种亚型ca基因表达量则随盐度升高而增加.2倍空气CO2浓度培养藻密度可达空气CO2浓度的1.23倍,但CA活性较低,第8天为空气CO2浓度组的0.41倍,α-ca和γ-ca基因表达量比空气CO2浓度组略有升高.在0 ~ 10 mmol/L HCO3-条件下,蛋白核小球藻随HCO3-含量升高生长加快,CA活性在5 mmol/L HCO3-最高,而3种亚型ca基因表达量在1 mmol/L HCO3-处理组最高.研究表明,蛋白核小球藻生长比较适合中低盐度、2倍空气CO2浓度和高HCO;处理,其CA活性可被低盐、空气CO2浓度和5 mmol/L HCO3-所诱导,而ca基因表达在高盐、2倍空气CO2浓度和低HCO3-条件下较高.【期刊名称】《水产学报》【年(卷),期】2014(038)007【总页数】9页(P920-928)【关键词】蛋白核小球藻;盐度;CO2;碳酸酐酶;ca基因【作者】王玮蔚;孙雪;王冬梅;沈佳;徐年军【作者单位】宁波大学海洋学院,浙江宁波315211;浙江省海洋生物工程重点实验室,浙江宁波315211;宁波大学海洋学院,浙江宁波315211;浙江省海洋生物工程重点实验室,浙江宁波315211;宁波大学海洋学院,浙江宁波315211;浙江省海洋生物工程重点实验室,浙江宁波315211;宁波大学海洋学院,浙江宁波315211;浙江省海洋生物工程重点实验室,浙江宁波315211;宁波大学海洋学院,浙江宁波315211;浙江省海洋生物工程重点实验室,浙江宁波315211【正文语种】中文【中图分类】S917.3海洋微藻的光合固碳量约占全球总光合固碳量的50%,是海洋碳循环系统中的重要组成部分[1]。

盐浓度对海藻N、P吸收的影响近年来,中国近海水域富营养化日趋严重,已对近海环境造成极大破坏。
究其来源,一方面由于城市及工业用水排放的逐年增多,另一方面来自于高速开展的近海养殖业产生的污染。
防治水体富营养化的根本措施在于控制和减少海水中氮(N)、磷(P)等营养物质的负荷【1】。
而国内外众多研究普遍说明,在大局部海区藻类生长以硝酸盐作为主要N源【2】,磷酸盐作为主要P源,因此大型海藻能够快速吸收环境中的营养盐,在满足自身生长需要的同时,也可以起到去除水体中过剩营养盐、减少水体污染的作用,此外还能实现养殖污染物的资源化利用。
Kraemer等【3】研究发现,紫菜(Porphyraamplissima)在体内N、P含量很高的情况下也能保持较高的N、P吸收速率,并快速生长,大大提高其去污能力;刘静雯等【4】利用多瓶法和干扰法相结合的技术研究了细基江蓠(Gracilariatenuistipitata)和孔石莼(UlvapertusaKjellman)对氨氮的吸收;徐姗楠等【5】利用网箱内栽培江蓠的混合生态养殖模式,对养殖区的富营养化海水进行修复,取得较好的效果。
目前有关大型海藻与海洋环境的相互关系研究,已引起国内外学者的广泛关注,对大型海藻的研究和开发利用,已经在国际上蓬勃开展起来。
真江蓠(Gracilariaasiatica)、脆江蓠(Gracilariachouae)和蜈蚣藻(Grateloupiafilicina)都属于红藻中具有较高经济价值的种类,具有生长快、分布广的特点,可以食用、药用,同时也是制造琼胶的重要原料。
本研究比较了在不同营养盐浓度下这3种海藻对N、P的吸收特点以及不同营养盐浓度对其生长的影响,以期为其作为生物修复种群的实际应用以及进一步的人工养殖提供理论依据。
1材料与方法1.1实验材料与预培养真江蓠和蜈蚣藻取自山东青岛小麦岛海域,脆江蓠取自福建宁德罗源湾海域人工栽培区。
选择健康藻体,用过滤海水清洗并仔细去除外表附着物,转入光照培养箱内进行预培养。

不同磷浓度下氮磷比对小球藻生长的影响1. 引言1.1 背景介绍小球藻是一种重要的微型藻类生物,广泛分布于淡水和海水中,是水生生态系统中的主要生产者之一。
磷是生物体生长和代谢不可或缺的重要元素之一,同时氮也是藻类生长所必需的关键营养元素。
氮磷比作为影响藻类生长的重要因素之一,对小球藻的生长具有重要影响。
不同磷浓度下氮磷比对小球藻生长的影响是一个备受关注的研究领域。
之前的研究表明,适宜的氮磷比有利于小球藻的生长,而过高或过低的氮磷比则会对其生长产生负面影响。
深入研究不同磷浓度下氮磷比对小球藻生长的影响,对于更好地了解藻类生长机制,优化水体养殖管理具有重要意义。
本研究旨在探究不同磷浓度条件下氮磷比对小球藻生长的影响,为水生生态系统的保护与管理提供科学依据,同时为藻类生长的调控提供理论支持。
通过实验设计和数据分析,我们将揭示不同磷浓度条件下氮磷比对小球藻生长的影响规律,为相关领域的研究提供重要参考。
1.2 研究目的研究目的是探究不同磷浓度下氮磷比对小球藻生长的影响,以期深入了解养分元素之间的相互作用对藻类生长的影响机制。
通过此研究,我们可以进一步探讨在实际水体中营养盐含量不同的情况下,小球藻的生长适应性和生态竞争力。
研究也旨在为水体水质管理和环境保护提供科学依据,为未来相关问题的解决提供参考。
通过深入研究小球藻在不同氮磷比条件下的生长情况,我们可以更好地理解水体中养分元素的平衡与生态系统的维持,为保护水生态系统提供可行的管理策略和措施。
本研究的最终目的是为了促进水体环境的平衡和保护,提高水质的可持续性,为人类创造更美好的生存环境。
1.3 研究意义通过研究不同磷浓度下氮磷比对小球藻生长的影响,可以为水体的环境管理和治理提供科学依据。
在水体污染治理中,通过调控磷浓度和氮磷比,可以有效控制小球藻的生长和繁殖,从而减少水中藻类的过度生长和水华的发生。
本研究对于提高水体质量、维护生态平衡、促进可持续发展具有重要意义。

盐度对微藻的生长、总脂肪含量以及脂肪酸组成的影响作者:华雪铭, 陈鹏, 周洪琪, 丁卓平, 张登沥作者单位:水产大学渔业学院1.学位论文刘孝竹凡纳滨对虾不同类型养殖池水质状况与浮游微藻群落结构的研究2009凡纳滨对虾(Litopenaeus vannamei)原产南美洲,1988年引进我国。
凡纳滨对虾、中国对虾和斑节对虾已成为我国三大高产养殖虾种之一。
此文对南方地区凡纳滨对虾两种主要养殖模式池塘的浮游微藻群落结构特征进行研究,内容包括浮游微藻种类组成、优势种和更替动态、数量和生物量的变化、多样性的基本特征和动态,结合理化因子和对虾的生长状况,对有关结果进行统计分析,得到如下结果。
1.凡纳滨对虾低盐度养殖土池塘水质状况与浮游微藻群落结构的研究2007年9月~2008年1月,在广东省珠海市斗门区对虾养殖区域选取4口凡纳滨对虾低盐度淡化养殖池塘,对养殖水体浮游微藻进行每14天一次连续采样,分析群落结构特征。
共检出浮游微藻113种,其中绿藻55种,蓝藻21种,硅藻和裸藻各15种,隐藻和甲藻各3种,金藻1种。
优势种有8种,主要为蓝藻门种类,有圆胞束球藻(Coelosphaerium naegelianum)、绿色颤藻(Oscillatoria chlorine)、假鱼腥藻(Pseudoanabaena sp.)、卷曲螺旋藻(Spirulina spirulinoides)、拟短形颤藻(Oscillatoriasubbrevis)和粘连色球藻(Chroococcus cohaerens),其次还有硅藻门的角毛藻(Chaetoceros sp.)和新月菱形藻(Nitzschia closteriu)。
养殖早期浮游微藻细胞数量介于7.9×105~6.2×107 ind/L之间,生物量0.05~2.9mg/L,多样性指数平均为2.02~2.68;养殖中后期浮游微藻细胞数量介于37.2×107~2.1×109ind/L之间,生物量11.6~502.9mg/L,多样性指数平均为2.39~3.36。

氮磷营养盐对海洋藻类生长的影响作者:樊娟来源:《科技创新导报》2012年第12期近年来随着近海海域污染的加剧,海域富营养化问题日益突出,有害藻类水华的发生频率、规模和危害程度有愈演愈烈的趋势。
氮磷营养盐作为藻类自然种群生长的主要限制因子,已有不少学者针对不同氮源及其浓度、氮磷比对藻类生长的影响做了大量研究。
本文在分析已有研究的基础上,从三个方面详细总结了氮磷营养盐对海洋藻类生长的影响,并提出了当前研究中存在的主要问题,旨在为相关研究者进一步开展海洋生态保护的工作提供参考。
1 无机氮磷营养盐对海洋藻类生长的影响海洋藻类增殖的成因较为复杂,但长期以来,研究者们普遍认为氮磷营养盐是海洋环境中藻类自然种群生长的主要限制因子。
尤其是海洋中溶解态的无机氮、磷。
概括起来主要表现在三个方面:一是营养盐浓度和形态,二是营养盐结构,三是营养盐的投加方式。
1.1 营养盐浓度和形态不同形态的氮对浮游植物的生理化特征、赤潮发生的种群及规模有着重要的影响,其中能被海洋浮游植物直接利用的是溶解性无机态。
如张传松等对大鹏湾水域的无机氮的研究表明,赤潮生物的繁殖与其密切相关,每当无机氮含量异常降低,再加上其它营养盐及其环境参数的异常变动,可能是赤潮发生的前奏[1]。
研究表明,实验培养的海洋原甲藻(Prorocentrum micans)在加入不同浓度的NO3--N的情况下,10天后海洋原甲藻明显增长,且与NO3--N浓度呈正相关[2]。
在各种形式的氮化合物中能被海洋浮游植物直接利用的是NH4+-N。
关于溶解无机氮的摄取,有研究指出[3],在高浓度的NO3--N和NH4+-N共存的近岸海域,浮游植物对NO3--N的摄取受NH4+-N含量的控制,它们将NH4+-N和尿素作为氮源进行选择性摄取,二者不足时才摄取NO3--N。
张诚等研究拟尖刺菱形藻(Pseudo-nitzschia pungens)对不同形态氮的吸收时发现[4],NH4-N的α值(最大吸收速率和半饱和常数的比值)为NO3--N的α值的2.57倍,表明在NH4+-N和NO3--N浓度相等的条件下,尖刺菱形藻能更有效的吸收利用NH4+-N。


影响微藻生长的主要因子作者:林源来源:《农家致富顾问·下半月》2015年第05期摘要:微藻是一类在海洋、陆地分布广泛,光合利用度高、营养丰富的自养植物,与其生活的环境有着十分密切的关系。
光、温度、盐度、营养盐、酸碱度、碳源、有机营养物质和生物因子等是影响微藻生长的主要因素。
关键词:微藻生长;主要因素1 光在温度和营养不限制微藻的生长情况下,光能自养微藻生长的限制因子即是光。
1.1 光源除了可利用人工光源,太阳光是微藻培养的主要光源。
在室外大规模培养和室内小型培养,都可以有效利用太阳光源,但极端易变是太阳光源的特点,这给在培养中控制最适光照强度带来了较大的困难。
室内小型培养可利用白炽灯或白色日光灯等人工光源。
白炽灯产生的温度很高,能使培养液水温上升,在夏天气温高时不宜使用。
使用人工光源,优点是较好控制光照强度和时间,但同时存在成本高问题,因此生产上二级培养很少使用。
1.2 光质光的颜色即是光质,是指不同波长的光线。
盐藻在300~700nm光谱区内,出现436nm和679nm两个吸收主峰和470nm一个肩。
三角褐指藻在红、黄、蓝、白和紫等五种不同的光质下的生长速度大小依次为蓝光、紫光、白光、红光和黄光,在蓝光下的生长常数约为0.44,而在黄光下仅为0.26;培养8d时其多糖含量在红光下最高。
在光照强度低于13.2μmol/(m2?s)时,螺旋藻的生物量在红光下是最高的。
1.3 光在细胞悬浮液中的穿透当光线进入藻液中,由于藻细胞的散射和吸收,随着深度的增加,光照强度迅速降低。
藻细胞的密度取决光投入深度的程度,密度愈低,光透入的深度愈深。
大部分细胞吸收到的光照强度往往是不足的,这是由于在高密度下,仅仅表层细胞能吸收到可进行光合作用的饱和光照强度,下层细胞实际甚至处于“黑暗”之中。
Emerson&Lewis测定蛋白核小球藻悬浮液中光吸收的情况,在1g/L(以DW计)浓度下,在第一个厘米范围内,有95%以上的红光和蓝光及60%的绿光被吸收;在浓度为10g/L(以DW计),大部分光在第一个毫米范围内被吸收。
小球藻的培养一、小球藻小球藻是单细胞植物,种类较多,多数生活在淡水中,少数生活在海洋里。
按植物学分类,小球藻属于小球藻纲绿藻目原球藻科生物,其体型小,直径一般为3~5μm,在显微镜下,需要放大400~600倍才能看到,我们肉眼看到的只不过是含有小球藻的绿色的水。
小球藻所含的营养成分很高,其蛋白质含量达到50%~60%(相当于花生米的2倍、鸡蛋的5倍),含脂肪10%~30%,还含有多种维生素。
小球藻的生物活性物质糖蛋白和多糖体的含量也相当高,这些生物活性物质具有增强人体免疫力、抗癌、降血压、抑制血糖上升、排除体内毒素和迅速恢复机体损伤等功能。
因此,小球藻的培养前景广阔。
作为培养原料的小球藻,可以到较清洁的池塘、水坑中采集绿色的水,在显微镜下鉴定,然后再用。
也可以向培养它的人索取。
1 容器的准备小规模的培养可用瓶、缸等,大规模的培养可用水泥池。
首先,要对所使用的容器进行消毒,一般用100mg/L的漂白粉水溶液浸泡,再用水冲刷数次。
(100mg/L的漂白粉水溶液的配制:①天平称量5g2%漂白粉澄清液;②定量转移至容量瓶中;③加水至1L;④混匀。
2%漂白粉上清液的配制法:取漂白粉2克,加少量水搅匀,再加水至100毫升,充分调匀后,待澄清后取上清液使用。
)2 培养液的准备(1)BG11液体培养基配方:Stock1 定容100mL 柠檬酸0.3g 柠檬酸铁胺0.3g EDTANa2 0.05gStock2 定容1000mL NaNO3 30g K2HPO4 0.78gMgSO4·7H2O 1.5gStock3 定容100mL CaCl2·2H2O 1.9gStock4 定容100mL Na2CO3 2gStock5 定容1000mL H3BO3 2.86g MnCl2·4H2O 1.81g ZnSO4·7H2O 0.222g Na2MnO4·2H2O 0.391g CuSO4·5H2O 0.079g Co(NO3)2·6H2O 0.049gStock1 取用2mL Stock2 取用20mL Stock3 取用2mL Stock4 取用1mL Stock5 取用1mL 总定容1000mL(2)购买2000元/套,九种原液各200ml(稀释1000倍),10瓶。
小球藻适宜培养营养盐以及添加单糖对生长的影响作者:刘秀花梁梁杜风光王有名梁峰来源:《河南科技》2019年第17期摘要:木糖为自然界中最丰富和经济的糖资源之一,但木糖很少被证明是野生型微藻的碳源。
本实验的目的是确定小球藻的最适培养基以及对糖的具体利用情况。
通过对小球藻干重和培养后的藻液中糖含量的测定发现,在HSM培养基中,小球藻生长较好,最适pH为6.5。
添加木糖对小球藻的生长存在一定的抑制作用,随着糖含量的增加,抑制越来越严重。
在木糖含量扩大培养中发现,木糖耐受在6g/L左右。
之后进行混合糖(木糖和葡萄糖)培养小球藻,确定混合糖培养效果明显好于单糖培养;经过薄层层析和DNS对培养后的藻液进行测定,结果发现,有葡萄糖存在时,小球藻优先利用葡萄糖。
关键词:小球藻;木糖;葡萄糖;薄层层析中图分类号:S963.213 文献标识码:A 文章编号:1003-5168(2019)17-0136-06Abstract: Xylose is one of the most abundant and economical sugar resources in nature, but xylose is rarely proven to be a carbon source for wild-type microalgae. The purpose of this experiment was to determine the optimum medium for Chlorella and the specific use of sugar. By measuring the dry weight of the Chlorella and the sugar content in the algae after the culture, it was found that the Chlorella grew well in the HSM medium, and the optimum pH was 6.5. The addition of xylose had a certain inhibition on the growth of Chlorella, and as the sugar content increases, the inhibition became more and more serious. In the expansion of xylose content, xylose tolerance was found to be around 6 g/L. After the cultivation of Chlorella with mixed sugar (xylose and glucose), it could be confirmed that the mixed sugar culture effect was significantly better than the monosaccharide culture, and the cultured algae liquid was measured by thin layer chromatography and DNS, and it was found that there was glucose present. Chlorella preferentially utilized glucose.Keywords: Chlorella;xylose;glucose;thin layer chromatography1 研究背景小球藻为绿藻门小球藻属(Chlorella sp)普生性单细胞绿藻,以光合自养生长繁殖,分布广泛,尤以淡水水域种类为最多,生物量大。
pH、盐度对小球藻生长量和溶氧量的影响作者:张奇曹英昆邢泽宇梁艳沈庆洲来源:《湖北农业科学》2018年第11期摘要:通过对小球藻(Chlorella vlgaris)在不同环境因素pH和盐度条件下,藻液溶氧量和生长量的测定,初步确定小球藻对盐度具有广适性,在0~45的盐度海水中都能生长,其中在盐度为25时溶氧量和生长量达最大,分别为7.65 mg/L和2.65×107个/mL,小球藻在pH为5.5~11.5的环境中可以生存,在pH为9.0时溶氧量和生长量达到最高,分别为8.04 mg/L和2.5×107个/mL,在pH大于11.0时小球藻生长明显减慢,甚至出现死亡现象。
关键词:小球藻(Chlorella vlgaris);pH;盐度;生长量;溶氧量中图分类号:Q948.8 文献标识码:A 文章编号:0439-8114(2018)11-0083-04DOI:10.14088/ki.issn0439-8114.2018.11.020Abstract: Based on the use of Chlorella vlgaris in different environmental factors pH and salinity conditions,determination of dissolved oxygen and liquid algae growth, preliminary determination of Chlorella vlgaris has wide adaptability to salinity, growth in 0 to 45 in the salinity of sea water can, in which salinity 25 of the dissolved oxygen and the largest amount of growth to the largest data,the highest value of dissolved oxygen content and growth were 7.65 mg/L and2.65×107/mL, Chlorella vlgaris at pH 5.5~11.5 environment can survive at pH 9 dissolved oxygen and growth of most high the highest the data here, the highest value of dissolved oxygen content and growth were 8.04 mg/L and 2.5×107/mL, the pH is greater than chlorella growth slowed significantly in 11, and even the phenomenon of death.Key words: Chlorella vlgaris;pH;salinity;growth;dissolved oxygen小球藻(Chlorella vlgaris)是一种单细胞藻类,分类学上属于绿藻门(Chlorophyta)、绿藻纲(Chlorophyce-ae)、绿球藻目(Chlorococcales)、小球藻科(Chlor-elaceae)、小球藻属(ChlorelaBeijerinck)[1]。