第七章 线粒体与过氧化物酶体分析
- 格式:ppt
- 大小:6.91 MB
- 文档页数:49

第七章线粒体与过氧化物酶体姓名:李淼学号:09352044 班级:生科一班日期:11.20线粒体是细胞内氧化磷酸化和形成ATP的组要场所。
线粒体由内、外两层彼此平行和高度特化的膜包围而成,内外膜都是典型的单位膜。
线粒体外膜起界膜作用,线粒体内膜向内皱褶成嵴,嵴上有颗粒朝向线粒体基质,成为F1颗粒。
线粒体的外膜和内膜将线粒体分成两个不同的区室:一个是膜间间隙;另一个是线粒体基质,是由内膜包裹的空间。
蛋白质占线粒体干重的65%-70%,脂类占干重的20%-30%。
含丰富的心磷脂和较少的胆固醇是线粒体在组成上与细胞其他膜结构的明显差别。
线粒体内蛋白和酶的分布有明显的差异性。
外膜构成中的脂类与蛋白的含量几乎相等。
外膜含有孔蛋白,通透性比较高。
外膜上含有单胺氧化酶,这是外膜的标志酶,这种酶能够终止胺神经递质的作用。
由于内膜要建立氢离子梯度,驱动A TP的合成,所以内膜的通透性较低,一般不允许离子和大多数带电的小分子通过。
内膜的蛋白含量比脂类多,并且含有大量的心磷脂。
内膜的酶类比较复杂,可以分为3类:运输酶类、合成酶类、电子传递和ATP合成酶类。
内膜的标志酶是细胞色素氧化酶。
内膜的标志酶是细胞色素氧化酶。
膜间间隙化学成分很多,几乎接近胞质溶胶,腺苷酸激酶是膜间间隙的标志酶,它的功能是催化ATP分子的末端磷酸基团转移到AMP,生成两分子ADP。
线粒体基质中的酶最多,标志酶是苹果酸脱氢酶。
翻译后转运是指在游离核糖体上合成的蛋白质等到完全合成以后释放到胞质溶胶中才被转运。
这也称为蛋白质寻靶。
共翻译转运是指膜结合核糖体合成的蛋白质,在进行翻译的同时就开始转运,通过定位信号,一边翻译一边进入内质网,然后进行进一步加工和转移。
在膜结合核糖体上合成的蛋白质通过信号肽,经过连续的膜系统转运分选才能到达最终的目的地,这一过程又称为蛋白质分选。
在游离核糖体上合成的蛋白质N端的信号统称为导向信号或导向序列。
由于这一段序列是氨基酸组成的肽,所以由称为转运肽或者前导肽。



线粒体和过氧化物酶体研究方法(study method)脉冲示踪研究(定位线粒体蛋白)、光谱分析(电子载体在内膜上的排序)、负染色技术(偶联因子1的发现)、线粒体膜重建实验(ATP酶功能的鉴定)、放线菌酮(抑制蛋白质的合成)、差速离心、等密度离心(过氧化物酶体的发现)、去垢剂的应用。
细胞的生存需要的两个基本要素是:构成细胞结构的化学元件和能量。
线粒体(mitochondrion)是细胞的动力工厂。
其直径一般为0.5—1.0um,最大可达40um。
具有两层膜结构,外膜起界膜作用,内膜向内皱褶成嵴(crista)。
具有膜间间隙和基质。
线粒体干重中蛋白质的含量为65%-70%,脂质占20%-30%。
内外膜的区别主要表现在蛋白质和脂质的含量比例不同。
内膜的酶类较复杂,包括运输酶类、合成酶类、电子传递和ATP合成酶类。
线粒体基质中酶类最多,与三羧酸循环、脂肪酸氧化、氨基酸降解相关的酶类大都存在于基质中。
单胺氧化酶是外膜的标志酶;细胞色素氧化酶是内膜的标志酶;腺苷酸激酶是膜间间隙酶的标志酶;苹果酸脱氢酶是基质的标志酶。
线粒体是Ca+贮存地,可以调节细胞质钙离子浓度。
蛋白质的转运方式有两种:翻译后转运(post-translational translocation)和共翻译转运(co-translational translocation)。
蛋白质的转运需要转运信号,这种信号一般位于肽链的N端,是优先翻译的方向,称为导向序列(targeting sequence)或导向信号(targeting signal)。
也称为转运肽(transit peptide)、前导肽(leading peptide)。
转运肽具有的一般特性:需要受体、从接触点进入、蛋白质要折叠、需要能量、需要转运肽酶、需要分子伴侣的协助。
线粒体基质蛋白的转运、外膜内膜蛋白的转运和膜间间隙蛋白的转运方式不同,膜间间隙蛋白的转运分为保守型寻靶(conservation targeting)和非保守性寻靶(nonconservative targeting)。

1. 线粒体(mi tochondri on)线粒体是1850年发现的,1898年命名。
线粒体由两层膜包被,外膜平滑,内膜向内折叠形成嵴,两层膜之间有腔,线粒体中央是基质。
基质内含有与三羧酸循环所需的全部酶类,内膜上具有呼吸链酶系及ATP酶复合体。
线粒体是细胞内氧化磷酸化和形成ATP的主要场所,有细胞"动力工厂"(power plant)之称。
另外,线粒体有自身的DNA和遗传体系, 但线粒体基因组的基因数量有限,因此,线粒体只是一种半自主性的细胞器。
线粒体的形状多种多样, 一般呈线状,也有粒状或短线状。
线粒体的直径一般在0.5~1.0 μm, 在长度上变化很大, 一般为1.5~3μm, 长的可达10μm ,人的成纤维细胞的线粒体则更长,可达40μm。
不同组织在不同条件下有时会出现体积异常膨大的线粒体, 称为巨型线粒体(megamitochondria)在多数细胞中,线粒体均匀分布在整个细胞质中,但在某些些细胞中,线粒体的分布是不均一的,有时线粒体聚集在细胞质的边缘。
在细胞质中,线粒体常常集中在代谢活跃的区域,因为这些区域需要较多的ATP,如肌细胞的肌纤维中有很多线粒体。
另外, 在精细胞、鞭毛、纤毛和肾小管细胞的基部都是线粒体分布较多的地方。
线粒体除了较多分布在需要ATP的区域外,也较为集中的分布在有较多氧化反应底物的区域,如脂肪滴,因为脂肪滴中有许多要被氧化的脂肪。
2. 外膜(o ute r membrane)包围在线粒体外面的一层单位膜结构。
厚6nm, 平整光滑, 上面有较大的孔蛋白, 可允许相对分子质量在5kDa左右的分子通过。
外膜上还有一些合成脂的酶以及将脂转变成可进一步在基质中代谢的酶。
外膜的标志酶是单胺氧化酶。
3. 内膜(inner memb rane)位于外膜内层的一层单位膜结构, 厚约6nm。
内膜对物质的通透性很低, 只有不带电的小分子物质才能通过。
内膜向内折褶形成许多嵴, 大大增加了内膜的表面积。
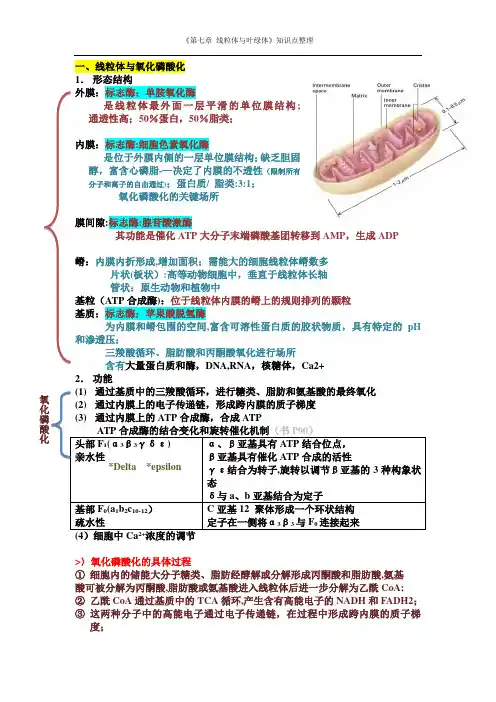
《第七章 线粒体与叶绿体》知识点整理一、线粒体与氧化磷酸化 1. 形态结构 外膜:标志酶:单胺氧化酶 是线粒体最外面一层平滑的单位膜结构; 通透性高;50%蛋白,50%脂类; 内膜:标志酶:细胞色素氧化酶 是位于外膜内侧的一层单位膜结构;缺乏胆固醇,富含心磷脂-—决定了内膜的不透性(限制所有分子和离子的自由通过);蛋白质/ 脂类:3:1; 氧化磷酸化的关键场所 膜间隙:标志酶:腺苷酸激酶 其功能是催化ATP 大分子末端磷酸基团转移到AMP ,生成ADP 嵴:内膜内折形成,增加面积;需能大的细胞线粒体嵴数多 片状(板状):高等动物细胞中,垂直于线粒体长轴 管状:原生动物和植物中 基粒(ATP 合成酶):位于线粒体内膜的嵴上的规则排列的颗粒 基质:标志酶:苹果酸脱氢酶 为内膜和嵴包围的空间,富含可溶性蛋白质的胶状物质,具有特定的pH 和渗透压; 三羧酸循环、脂肪酸和丙酮酸氧化进行场所 含有大量蛋白质和酶,DNA,RNA ,核糖体,Ca2+ 2. 功能 (1) 通过基质中的三羧酸循环,进行糖类、脂肪和氨基酸的最终氧化 (2) 通过内膜上的电子传递链,形成跨内膜的质子梯度 (3) 通过内膜上的ATP 合成酶,合成ATP ATP 合成酶的结合变化和旋转催化机制(书P90)头部F 1(α3β3γδε) 亲水性 α、β亚基具有ATP 结合位点,β亚基具有催化ATP 合成的活性 γε结合为转子,旋转以调节β亚基的3种构象状态δ与a 、b 亚基结合为定子基部F 0(a 1b 2c 10-12) 疏水性 C 亚基12 聚体形成一个环状结构定子在一侧将α3β3与F 0连接起来>〉氧化磷酸化的具体过程① 细胞内的储能大分子糖类、脂肪经酵解或分解形成丙酮酸和脂肪酸,氨基 酸可被分解为丙酮酸,脂肪酸或氨基酸进入线粒体后进一步分解为乙酰CoA;② 乙酰CoA 通过基质中的TCA 循环,产生含有高能电子的NADH 和FADH2; ③ 这两种分子中的高能电子通过电子传递链,在过程中形成跨内膜的质子梯度; 氧化磷酸化*Delta *epsilon《第七章 线粒体与叶绿体》知识点整理④ 质子梯度驱动ATP 合成酶将ADP 磷酸化成ATP,势能转变为化学能。

第七章线粒体与过氧化物酶体7.1线粒体7.1.1线粒体的结构、组成与特性(1)形态与分布棒杆状结构,可以有分支,而且有时多个线粒体可以形成网络结构。
两层膜,内膜内褶形成层状或管状,增大了膜面积。
线粒体在不同类型细胞内的数目不同,依其需能多少而定。
其具有自由移动的特性,能够移动到细胞需能的部位或附近。
(2)组成与特性两膜两空间。
线粒体的蛋白质的比重比较大,含有丰富的心磷脂和较少的胆固醇。
①外膜外膜脂类与蛋白的比例比内膜高,含有孔蛋白,具有较高的通透性。
同时外膜上有参与被氧化物质初步分解的酶。
标志酶为单胺氧化酶。
②内膜内膜脂类与蛋白的比例小,含有大量的心磷脂,其蛋白可以分为三类:转运蛋白;电子传递链复合体和ATP合酶;合成酶类。
其通透性非常低。
标志酶为细胞色素氧化酶③膜间间隙其成分由于外膜的通透性差的缘故,跟细胞胞质溶胶的成分相近。
标志酶为腺苷酸激酶。
④线粒体基质含有参与三羧酸循环、脂肪酸氧化、氨基酸降解的酶系,以及DNA,rRNA,tRNA 基因转录的酶系及核糖体。
标志酶为苹果酸脱氢酶。
7.1.2线粒体蛋白的定位7.1.2.1蛋白质定位的机制游离核糖体合成的蛋白质及膜结合核糖体合成的蛋白质的定位方式不同,定位到不同的细胞器。
(1)信号序列一般位于蛋白质N端的一段序列,蛋白质的标签,包括信号定位信号,死亡信号,修饰信号三种信号。
有时在其下游还有一段信号序列,或者有停止转运序列。
(2)蛋白质转运方式①翻译后转运蛋白质寻靶:游离核糖体上的蛋白质完全合成后再在转运肽的导向下定位。
转运肽的介导的蛋白质定位步骤为,在分子伴侣的协助下,蛋白质解折叠,伸出转运肽;转运肽与膜上受体作用,从内外膜形成接触点上穿过运输蛋白,这一过程需要ATP水解及膜电位的协助;进入基质的蛋白质首先在分子伴侣的协助下重新折叠,同时转运肽酶水解掉转运肽。
②共翻译转运蛋白质分选:膜结合核糖体上合成的蛋白质一边翻译,一边通过信号序列进入内质网。

第七章真核细胞内膜系统、蛋白质分选与膜泡运输1.细胞质基质:在真核细胞的细胞质中,除去可分辨的细胞器以外的胶状物质,也称胞质溶胶,内含水、无机离子、酶以及可溶性大分子和代谢产物。
21、许多中间代谢过程在细胞质基质中进行。
包括糖酵解过程、磷酸戊糖途径、糖醛酸途径、糖原合成与分解以及蛋白质与脂肪酸的合成等。
2、细胞质骨架是细胞质基质的主要结构成分,与维持细胞形态、细胞运动、物质运输及能量传递有关,而且也是细胞质基质结构体系的组织者,为细胞质基质中其他成分和细胞器提供锚定位点。
3、与蛋白质的修饰及选择性降解有关。
①蛋白质的修饰,在细胞质中发生的蛋白质修饰的类型主要有:辅酶或辅基与酶的共价结合;磷酸化与去磷酸化,用以调节很多蛋白质的生物活性;糖基化作用;对某些蛋白质的N端进行甲基化修饰;酰基化。
②控制蛋白质的寿命。
③降解变性和错误折叠的蛋白质。
④帮助变性或错误折叠的蛋白质重新折叠,形成正确的分子构象。
这一功能主要靠热休克蛋白来完成。
3①辅酶或辅基与酶的共价结合。
②磷酸化与去磷酸化,用以调节很多蛋白质的生物活性。
③糖基化作用:糖基化主要发生在内质网和高尔基体中,在细胞质基质中发现的糖基化是指在哺乳动物的细胞中把N-乙酰葡糖胺分子加到蛋白质的丝氨酸残基的羟基上。
④对某些蛋白质的N端进行甲基化修饰:这种修饰的蛋白质,如很多细胞支架蛋白和组蛋白等,不易被细胞内的蛋白质水解酶水解,从而使蛋白质在细胞中维持较长的寿命。
⑤酰基化:最常见的一类酰基化修饰是内质网上合成的跨膜蛋白在通过内质网和高尔基体的转运过程中发生的,它由不同的酶来催化,把软脂酸链共价地连接在某些跨膜蛋白的暴露在细胞质基质中的结构域;另一类酰基化修饰发生在诸如src基因和ras基因这类癌基因的产物上,催化这一反应的酶可识别蛋白中的信号序列,将脂肪酸链共价地结合到蛋白质特定的位点上。
如src基因编码的酪氨酸蛋白激酶与豆蔻酸的共价结合。
酰基化与否并不影响酪氨酸蛋白激酶的活性,但只有酰基化的激酶才能转移并靠豆蔻酸链结合到细胞质膜上。

细胞生物学第一章细胞概述1 举例说明细胞的形态与功能相适应。
细胞形态结构与功能的相关性与一致性是很多细胞的共同特点。
如红细胞呈扁圆形的结构,有利于O 2 和CO 2 的交换。
高等动物的卵细胞和精细胞不仅在形态、而且在大小方面都是截然不同的。
2 真核细胞的体积一般都是原核细胞的1000 倍,真核细胞如何解决细胞内重要分子的浓度问题?真核细胞为了解决细胞内重要分子的浓度问题,出现了特化的内膜系统,使一些反应局限于特定的膜结合的细胞器,这样,一些重要反应的分子浓度并没有被稀释。
3 组成蛋白质的基本构件只是20 种氨基酸,为什么蛋白质却具有如此广泛的功能?根本原因是蛋白质具有几乎无限的形态结构,因此蛋白质仅仅是一类分子的总称。
换句话说,蛋白质之所以有如此广泛的作用,是因为蛋白质具有各种不同的结构,特别是在蛋白质高级结构中具有不同的结构域,而这种不同的空间构型使得蛋白质能够有选择地同其他分子进行相互作用,这就是蛋白质结构决定功能放入特异性。
正是由于蛋白质具有如此广泛特异性才维持了生命的高度有序性和复杂性。
4 为什么解决生命科学的问题不能不仅靠分子生物学而要靠细胞生物学?第二章细胞生物学研究方法第三章细胞质膜和跨膜运输1 有人说红细胞是研究膜细胞结构的最好材料,你能说说理由吗?①首先是红细胞数量大,取材容易(体内的血库),极少有其他类型的细胞污染。
②其次,成熟的哺乳动物的红细胞中没有细胞核和线粒体等膜相细胞器,细胞质膜是它唯一的膜结构,所以在分离后不存在其他膜污染问题。
2 十二烷基磺酸钠(SDS)和TritonX-100 都是去垢剂,哪一种可用于分离分离有生物功能的膜蛋白?SDS 是离子型的去垢剂,不仅可使细胞膜崩溃,并与膜蛋白的疏水部分结合使其分离,而且还破坏膜蛋白内部的非共价键,使蛋白质变性,故不宜用于分离膜蛋白。
TritonX-100 是非离子型的去垢剂,它可以使膜脂溶解,又不会使蛋白质变性。
故用于分离膜蛋白。


高中生物chapter7线粒体和过氧化物酶体第七章线粒体和过氧化物酶体7.1 线粒体的形态结构1850年,德国生物学家Rudolph K?lliker第一系统的研究了线粒体。
(肌细胞) 1900年,Leonor Michaelis 氧化还原反应1943年,Arbert Claude采用盐法分离技术分离到线粒体1948年George Hogeboom等采用蔗糖介质分离有活性的线粒体,确定了能量转换的部位。
逐步证明了线粒体具有Krebs循环、电子传递、氧化磷酸化的作用,从而证明了线粒体是真核生物进行能量转换的主要部位。
7.2 线粒体结构与化学组成线粒体膜通透性实验将线粒体放在100 mM蔗糖溶液中,蔗糖穿过外膜进入线粒体的膜间间隙;然后将线粒体取出测定线粒体内部蔗糖的平均浓度,结果只有50 mM,比环境中蔗糖的浓度低。
据此推测:线粒体外膜对蔗糖是通透的,而内膜对蔗糖是不通透的。
线粒体组分的分离首先将线粒体置于低渗溶液中使外膜破裂,此时线粒体内膜和基质(线粒体质)仍结合在一起,通过离心可将线粒体质分离。
用去垢剂毛地黄皂苷处理线粒体质,破坏线粒体内膜,释放线粒体基质,破裂的内膜重新闭合形成小泡,其表面有F1颗粒。
1. 外膜(outer menbrane)标志酶:单胺氧化酶;外膜含有较大的通道蛋白:孔蛋白;2. 内膜(inner membrane)线粒体进行电子传递和氧化磷酸化的部位,通透性差;含有大量的心磷脂(cardiolipin),心磷脂与离子的不可渗透性有关;内膜的标志酶:细胞色素氧化酶;按作用分3类酶:运输酶类、合成酶类、电子传递合成和ATP合成的酶类。
3. 膜间隙(intermenbrane space)标志酶:腺苷酸激酶功能:建立电化学梯度4. 线粒体基质(matrix)标志酶:苹果酸脱氢酶功能:进行氧化反应,主要是三羧酸循环7.3 前导肽与线粒体蛋白定位线粒体各部分的蛋白质来自何方?定位机理如何?7.3.1 前导肽(leading peptide)蛋白质的两种运输方式:细胞质中的核糖体在合成蛋白质时有两种可能的存在状态:游离核糖体(free ribosome):在蛋白质合成的全过程一直保持游离状态膜结合核糖体(membranous ribosomes):核糖体在合成蛋白质的初始阶段处于自由状态,但是随着肽链的合成核糖体被引导到内质网上与内质网结合在一起1. 蛋白质的两种运输方式A翻译后转运:游离核糖体上合成的蛋白质释放到胞质溶胶后被运送到不同的部位,即先合成,后运输。
第一章:细胞概述1. 基本概念:主要分清细胞、原生质、细胞质、细胞学、细胞生物学等基本概念;2. 细胞的发现和细胞学说的创立:了解英国学者胡克发现细胞的起因, 以及发现细胞的基本条件。
对于细胞学说, 侧重于学说的基本内容和该学说对细胞科学发展的推动作用。
3. 细胞的基本功能和特性:重点掌握细胞生命的三个最基本的功能: 自我增殖和遗传、新陈代谢和运动性; 并对细胞结构上的同一性有基本的理解。
4. 细胞的分子基础:充分认识细胞是由化学物质构成的, 生命是物质的,是一种特殊形式的物质运动,它是物质、能量和信息诸变量在特定时空的“表演”,其运转有赖于生命系统有组织的守时和对空间环境的合拍。
5. 细胞的类型和结构体系:主要了解真核细胞与原核细胞的结构组成和体系,比较二者的异同。
同时注意动物细胞与植物细胞在结构上的差异。
本章的核心内容是细胞学说的创立和细胞的类型与结构体系。
一、名词解释1、细胞生物学cell biology2、显微结构microscopic structure二、填空题1、细胞生物学是研究细胞基本规律的科学,是在、和三个不同层次上,以研究细胞的、、、和等为主要内容的一门科学。
2、细胞生物学的发展历史大致可分为、、、和分子细胞生物学几个时期三、选择题1、第一个观察到活细胞有机体的是()。
a、Robert Hookeb、Leeuwen Hoekc、Grewd、Virchow2、细胞学说是由()提出来的。
a、Robert Hooke和Leeuwen Hoekb、Crick和Watsonc、Schleiden和Schwannd、Sichold和Virchow3、细胞学的经典时期是指()。
a、1665年以后的25年b、1838—1858细胞学说的建立c、19世纪的最后25年d、20世纪50年代电子显微镜的发明4、()技术为细胞生物学学科早期的形成奠定了良好的基础。
a、组织培养b、高速离心c、光学显微镜d、电子显微镜四、判断题1、细胞生物学是研究细胞基本结构的科学。