第十一章 电解及库仑分析法
- 格式:doc
- 大小:100.50 KB
- 文档页数:4


第十一章电解及库仑分析法1、什么叫做分解电压?为什么实际分解电压的数值比按电解产物所形成的原电池的反电动势要大?答:分解电压:在电解时,能够使被电解物质在两电极上产生迅速、连续的电极反应,所需的最低外加电压。
因为当电流通过电解池时,电极的实际电位常偏离平衡电位,即产生极化现象。
极化使阳极电位变得更正,阴极电位变得更负,即产生过电位(η=ηa-ηc),而分解电压是原电池电动势、电池过电位、电解池电压降iR之和,即:U = (E a +ηa) -(E c +ηc) + iR所以,实际分解电压比电池反电动势大。
2、控制电流电解分析和控制电位电解分析各有何优缺点?答:控制电流电解分析,由于电解电流大,并且基本恒定,因此电解效率高,分析速度快。
但由于阴极电位不断负移,其它离子也可能沉积下来,故选择性差。
而控制阴极电位能有效防止共存离子的干扰,选择性好,该法即可作定量测定,又可广泛作为分离技术,常用于多种金属离子共存情况下某一种离子的测定。
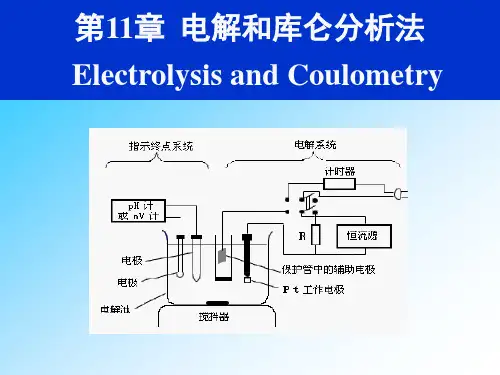
3、库仑分析与电解分析在原理、装置上有何异同点?答:电解分析与库仑分析在原理、装置上有许多共同之处,都需要通过控制分解电压或阴极电位来实现不同金属离子的分离,库仑分析也属于电解分析的范畴。
不同的是通常的电解分析是通过测量电解上析出的物质的质量来进行定量分析,而库仑分析是通过测量通过体系的电量(Q nFM m )来进行定量测定。
在测量装置上,二者也有共同之处,均需要有阴极电位控制装置,不同之处在于库仑分析中需要在电解回路中串联一个库仑计以测量通过体系的电量。
4、用库仑法在定量分析时,要取得准确的分析结果应注意些什么?答:要求电极反应单纯,电流效率100%,应注意消除各种影响电流效率的因素。
5、在恒电流库仑分析法和控制电位库仑分析法中,是如何测得电量的?答:在控制电位库仑分析法中,是用精密库仑计来测量电量的。
常用的有气体库仑计和电子积分库仑计等。
在恒电流库仑滴定中,由于电流是恒定的,因而通过精确测定电解进行的时间及电流强度,即可计算出电量。


第十一章 电解及库仑分析法习题解答1.以电解法分析金属离子时,为什么要控制阴极的电位解:由于各种金属离子具有不同的分解电位,在电解分析时,金属离子又大部分在阴极上析出,因此需要控制阴极的电位,以便不同金属离子分别在不同的电位析出,从而实现分离的目的。
2. 库仑分析法的基本依据是什么为什么说电流效率是库仑分析发关键问题在库仑分析中用什么方法保证电流效率达到100%解:根据法拉第电解定律,在电极上发生反应的物质的质量与通过该体系的电量成正比,因此可以通过测量电解时通过的电量来计算反应物质的质量,这即为库仑分析法的基本原理。
由于在库仑分析法中是根据通过体系的电量与反应物质之间的定量关系来计算反应物质的质量的,因此必须保证电流效率100%地用于反应物的单纯电极反应。
可以通过控制电位库仑分析和恒电流库仑滴定两种方式保证电流效率达到100%。
3. 电解分析和库仑分析在原理、装置上有何异同之处解:电解分析与库仑分析在原理、装置上有许多共同之处,都需要通过控制分解电压或阴极电位来实现不同金属离子的分离,库仑分析也属于电解分析的范畴。
不同的是通常的电解分析是通过测量电解上析出的物质的质量来进行定量分析,而库仑分析是通过测量通过体系的电量来进行定量测定。
在测量装置上,二者也有共同之处,均需要有阴极电位控制装置,不同之处在于库仑分析中需要在电解回路中串联一个库仑计以测量通过体系的 电量。
4. 试述库仑滴定的基本原理。
解: 库仑滴定是一种建立在控制电流电解基础之上的滴定分析方法。
在电解过程中,于试液中加入某种特定物质,以一定强度的恒定电流进行电解,使之在工作电极上(阳极或阴极)电解产生一种试剂,此试剂与被测物质发生定量反应,当被测物质反应完全后,用适当的方法指示终点并立即停止电解。
然后根据所消耗的电量按照法拉第定律计算出被测物质的质量:nitM m 96487= 5. 在控制电位库仑分析法和恒电流库仑滴定中,是如何测定电量的解:在控制电位库仑分析法中,是用精密库仑计来测定电量的.在恒电流库仑滴定中,由于电流是恒定的,因而通过精确测定电解进行的时间及电流强度,即可计算出电量.6.在库仑滴定中,相当于下列物质多少克 (1)OH-, (2) Sb(III 到V 价), (3) Cu(II 到0价), (4)As2O3(III 到V 价).解:根据法拉第电解定律,n itMm 96487=得: (1) mOH-=1×10-3 ×1 × (96487 ×2)= × ×10-9= ×10-8g(2)mSb= × × 10-9= × 10-7g(3)mCu= × × 10-9= × 10-7g(4)mAs2O3 = × ×10-9 /2 = ×10-7g7.在一硫酸铜溶液中,浸入两个铂片电极,接上电源,使之发生电解反应.这时在两铂片电极上各发生什么反应写出反应式.若通过电解池的电流强度为,通过电流时间为, 在阴极上应析出多少毫克铜解:阴极:Cu2+ + 2e = Cu↓阳极: 4OH- - 4e = 2H2O + O2↑故: m = it ×MCu/(2 ×96487) =8. 10.00mL浓度越为的 HCl溶液,以电解产生的OH-滴定此溶液,用pH计指示滴定时pH的变化,当到达终点时,通过电流的时间为,滴定时电流强度为20mA,计算此HCl溶液的浓度.解:根据题意:m/M = 20 ×10-3 ××60/96487 = ×10-5mol故: CHCl = ×9.以适当方法将0.854g铁矿试样溶解并使之转化为Fe2+后,将此试液在处,在铂阳极上定量地氧化为Fe3+,完成次氧化反应所需的电量以碘库仑计测定,此时析出的游离碘以标准溶液滴定时消耗. 计算试样中Fe2O3的质量分数.解: 1mol Fe2+ ~ 1mol e ~ 1/2mol I2 ~1mol S2O32-1mol Fe2O3 ~ 2mol Fe ~ 2mol S2O32-设试样中FeO3的摩尔数为x,则: 1: 2 = x : ×x = ×10-4molW% = ××10-4 × 100/ = %10.上述试液若改为以恒电流进行电解氧化,能否根据在反应时所消耗的电量来进行测定为什么解:不行,难以维持电流效率为100%(原因参见教材第189页)。


电解和库仑分析法一、填空题1. 在控制电位电解过程中,电极电位决定电极表面氧化态和还原态的________ 。
2. 能使电流持续稳定地通过电解质,并使之开始电解时施加于电解池两极的最低电压,称为________ 。
3. 使金属离子在阴极上不断电解而析出金属沉积物所需的最小阴极电位,称为______ 。
4. 在电解分析中,外加电压总是比理论电压大,这种差值一般用___________ 来表示。
5. 已知E Ag /Ag=0.800V,E CU2 ./cu = 0.345V。
在25C时,在含0.01 mol • L-1的Ag+和1mol • L-1的硫酸盐溶液中,首先在阴极上被还原的是__________ ,开始析出时的阴极电位为_________ 。
6. 由于电解一般是在水溶液中进行的,所以要控制适当的电极电位和溶液的pH 值,以防止水的分解。
当工作电极为阴极时,应避免有_______ 析出,当工作电极为阳极时,则要防止有_______ 产生。
7. 在各种不同的电解质溶液中,通过相同的电量时,每个电极上电极反应产物的量与它们的_____ 成正比。
8. 库仑分析法的基本依据是______ 。
9. 库仑分析法是通过对试液进行电解,测量电解反应所消耗的________ ,再根据______ ,计算待测物质量的一种方法。
10. 库仑滴定法和普通滴定法的主要区别在于 _______ 。
11. 1F =_____ C = _____ A h。
12. 用库仑法进行定量分析时,要取得准确分析结果的关键在于① _____ ;②_____ ;③_______ 。
13. 库仑分析的电流效率要求达到100%,以使电解时所消耗的电量全部用于的电极反应。
二、选择题1. 以测量沉积于电极表面的沉积物质量为基础的电化学分析法称为( )A. 电位分析法B.极谱分析法C.电解分析法D.库仑分析法2. 若在溶液中含有下列浓度的离子,以Pt为电极进行电解,首先在阴极上析出的是( )A. 0.01 mol L 4Ag+( = 0.799V )B.2.0mol L * Cu2+( = 0.337V )C.1.0mol L 」Pb + ( -0.128V )D.0.1mol L 」Zn 2+ ( - -0.128V ) 3. 在电重量分析中作为沉淀剂的是()o A.电压 B.电流 C.电量4. 法拉第电解定律的数学表达式中,各物理量的单位为: F/96485C , t/s ,贝U I 的单位为( )。



第十一章 电解及库仑分析法
1、什么叫做分解电压为什么实际分解电压的数值比按电解产物所形成的原电池的反电动势要大
答:分解电压:在电解时,能够使被电解物质在两电极上产生迅速、连续的电极反应,所需的最低外加电压。
因为当电流通过电解池时,电极的实际电位常偏离平衡电位,即产生极化现象。
极化使阳极电位变得更正,阴极电位变得更负,即产生过电位(η=ηa - ηc ),而分解电压是原电池电动势、电池过电位、电解池电压降iR 之和,即:
U = (E a +ηa ) - (E c +ηc ) + iR
所以,实际分解电压比电池反电动势大。
2、控制电流电解分析和控制电位电解分析各有何优缺点
答:控制电流电解分析,由于电解电流大,并且基本恒定,因此电解效率高,分析速度快。
但由于阴极电位不断负移,其它离子也可能沉积下来,故选择性差。
而控制阴极电位能有效防止共存离子的干扰,选择性好,该法即可作定量测定,又可广泛作为分离技术,常用于多种金属离子共存情况下某一种离子的测定。
)
3、库仑分析与电解分析在原理、装置上有何异同点
答:电解分析与库仑分析在原理、装置上有许多共同之处,都需要通过控制分解电压或阴极电位来实现不同金属离子的分离,库仑分析也属于电解分析的范畴。
不同的是通常的电解分析是通过测量电解上析出的物质的质量来进行定量分析,而库仑分析是通过测量通过体系的电量(Q nF
M m )来进行定量测定。
在测量装置上,二者也有共同之处,均需要有阴极电位控制装置,不同之处在于库仑分析中需要在电解回路中串联一个库仑计以测量通过体系的电量。
4、用库仑法在定量分析时,要取得准确的分析结果应注意些什么
答:要求电极反应单纯,电流效率100%,应注意消除各种影响电流效率的因素。
5、在恒电流库仑分析法和控制电位库仑分析法中,是如何测得电量的
答:在控制电位库仑分析法中,是用精密库仑计来测量电量的。
常用的有气体库仑计和电子积分库仑计等。
在恒电流库仑滴定中,由于电流是恒定的,因而通过精确测定电解进行的时间及电流强度,即可计算出电量。
^
6、为什么在库仑分析中要保证电流效率100%如何保证电流效率100%
答:因为库仑分析的理论依据是法拉第定律,根据这一定律,只有当电流效率为100%时,通过溶液或者电解时所消耗的电量才能完全应用于被测物质进行电极反应。
消除各种影响电流效率的因素。
7、某溶液含有2mol/L Cu 2+ 和 L Ag +,以Pt 为电极电解:
(1)在阴极上首先析出的是铜还是银
(2)能否使两种金属离子完全分离若可以,阴极电位控制在多少铜和银在Pt 电极上的过电
位可忽略不计。
(V E V E Ag
Ag Cu Cu 779.0337.0//2==++θθ,) 解:(1) V Cu E E Cu Cu Cu 346.02lg 2
059.0337.0]lg[2059.02/2=+=+=++θ V Ag E E Ag
Ag Ag 661.001.0lg 059.0779.0]lg[059.0/=+=+=++θ ~
因 E Ag > E Cu 所以 Ag 先析出。
(2)在电解过程中,随着Ag +的析出,其浓度逐渐降低。
当其浓度降为10-7mol/L 时,
可认为已析出完全。
此时,银的析出电位为:
V Ag E E Ag
Ag Ag 366.010lg 059.0779.0]lg[059.07/=+=+=-++θ 即当Ag +完全析出时的电位还未达到Cu 2+的析出电位,因此只要控制电位在~范围内就可实现两种离子完全分离。
解法二:要使某离子析出(电解)完全,其浓度应降低105倍,阴极电位负移V n
3.0,故Ag +要析出完全,阴极电位为: - = (V),此时还未达到Cu 2+的析出电位,故只要控制阴极电位在~范围内就可使Ag 和Cu 完全分离。
8、电解Cu 2+和Sn 2+的混合酸性溶液,Cu 2+和Sn 2+的浓度均为L ,以铂为电极进行电解。
(1)在阴极上何种离子先析出(2)若要使两种金属离子完全分开,阴极电位应控制多少(V E V E Sn Sn Cu Cu 136.0337.0//22-==++θθ,)
解:(1)V Cu E E Cu Cu Cu 307.01.0lg 2059.0337.0]lg[2059.02/2=+=+
=++θ V Sn E E Sn
Sn Sn 166.01.0lg 2059.0136.0]lg[2059.02/2-=+-=+=++θ 因 E Cu > E Sn 所以 Cu 先析出。
】
(2)Cu 析出完全时,阴极电位为:
V Cu E E Cu Cu Cu 160.010lg 2
059.0337.0]lg[2059.062/2=+=+=-++θ > - 所以 Cu 和Sn 可完全分开,只要控制阴极电位在-~之间即可。
9、某溶液中含有L Zn 2+和Cd 2+,用电解沉积的办法可以分离Zn 2+和Cd 2+,已知
V V V E V E Cd Zn
Zn Cd Cd 70.048.0763.0403.0Zn //22==-=-=++ηηθθ,,,,计算当锌开始电解沉积时,Cd 2+的剩余浓度为多少 解:V Cd E E Cd Cd Cd Cd 047.048.01.0lg 2059.0403.0]lg[2059.02/2=++-=++
=++ηθ V Zn E E Zn Zn n Zn 093.070.01.0lg 2
059.0763.0]lg[2059.02/Z 2-=++-=++=++ηθ 故 Cd 先析出。
当Zn 开始沉积时,
~
48.0]lg[2
059.0403.0093.02++
-==-=+Cd E E Cd Zn [Cd 2+] = ×10-6mol/L 10、用镀铂的铂电极,在25,电流密度为50A·m -2条件下电解1=+H a 的酸性溶液,已知氧
和氢的分压都是101325Pa ,V O H 487.0022==ηη,,忽略iR 降,外加电压应为多少
解:阴极 2H + + 2e = H 2
V p p H E E H H H H H H 00101325/1013251lg 2059.00/][lg 2059.022//2222=++=++=+++ηθ
θ 阳极 2H 2O - 4e = O 2 + 4H + V H p p E E O O O H O O H O 717.1487.0023.11][)/(lg 4059.02222224//=++=+⋅+=+ηθθ
V iR E E U H H O H O 717.100717.12
22//=+-=+-=+
11、用镀铜的铂网电极作阴极,电解L Zn 2+溶液,已知V E Zn Zn 763.0/2-=+θ,
{
V H Zn 40.002-==ηη,,试计算析出金属锌的最低。
解: Zn 的析出电位为:
V Zn E E Zn Zn n Zn n 822.0.0001.0lg 2
059.0763.0]lg[2059.02/Z /Z 22-=++-=++=+++ηθ 氢析出电位为:
40.0059.000.0/][lg 2059.022222//--=++=+++pH p p H E E H H H H H H ηθ
θ 若要使电极上只析出锌而不析出氢,则必须满足22//H H Zn Zn E E ++>
即 - > - -
pH >
故要使Zn 析出的最低值为
,
12、用控制阴极电位法电解某物质,初始电流为2.50A ,电解10min 以后,电流降至0.23A ,计算该物质浓度降至原浓度%时所需的时间
解: 因 i t = i 0 · 10-kt 即 = × 10-600k 得 k = × 10-3
又 c t = c 0 · 10-kt
所以
min 8.382330%01.0lg 10
717.11lg 130==⨯-=-=-s c c k t t
13、用铂电极电解CuCl 2试液,通过的电流为20A ,电解时间为15min ,计算阴极上析出的铜和阳极上析出的氯气各为多少g
解:
g it nF M Q nF M m Cu Cu Cu 93.560152096485
255.63=⨯⨯⨯⨯=⋅=⋅= g it nF M Q nF M m Cl Cl Cl 61.660152096485291.702
2
2=⨯⨯⨯⨯=⋅=⋅=。