第8章 卤代烃 有机化学
- 格式:doc
- 大小:870.50 KB
- 文档页数:40







有机化学第二版(高占先)(全14章答案完整版) _第8-14章其中包括各种判断题、推断题、思考题以及合成题的答案!!第8章 卤代烃8-2 完成下列各反应式。
(CH 3)3CBr C 2H 5OH(CH 3)2C=CH 2+CH 3CH=CH 2HBr+O OCH 3CH 2CH 2CH 3CH 2CH 2CNNaCN(1)(2)(CH 3)2CHCH=CH 2Br +500℃(CH 3)2CCH=CH 2BrH 2O (CH 3)2C=CHCH 2Br+(CH 3)2CCH=CH 2OH(CH 3)2C=CHCH 2OH+(3)NaCNKOH 25(4)(5)(6)ClCH=CHCH 2Cl CH 3+ClCH=CHCH 23OBrBrBrCNCH 2CHCH 3Br CH=CHCH 3CH 3Br2NH 3(l)CH 3NH 2CH 3NH 2+ClClNO 2NaOH-H 2OOHClNO 2ZnCl 2(HCHO + HCl)+CH 2ClMgCH 2MgClCH 2COOHClCH 2CHCH 2CH 2CH 3PhCH 2MgCl CH 3+PhCH 2CH 2CHCH 2CH 2CH 3CH3(7)(8)(9)(10)3RC CLi (11)RC CR'RC CCOOHRC CCH2CH2OH CHBr350%NaOH(aq)BrBr(12)8-3写出下列反应主要产物的构型式。
C2H5CH3NaI+C2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrBrCH2CH2CH3CCH2CH3H2Lindar催化剂C CCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化;S N2(2)增加溶剂的含水量反应明显加快;S N1(3)有重排反应产物;S N1(4)反应速率明显地与试剂的亲核性有关;S N2(5)反应速率与离去基的性质有关;S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
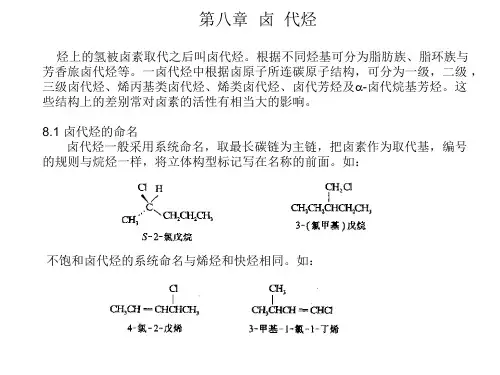
1、卤代烃的分类§8 -1 卤代烃的分类、异构现象和命名R X CHXR CH XCH 3XCHX 3 CX 4CH 2X 2 卤代烷(饱和卤代烃) 卤代烯烃(不饱和卤代烃)卤代芳烃(芳香族卤代烃)一卤代甲烷 二卤代甲烷 三卤代甲烷 四卤代甲烷X =F 、Cl 、Br 、I第8 章卤代烃南通大学张湛赋RCHR'XRCH 2XRC R'R'X(一级卤代甲烷) (二级卤代甲烷) (三级卤代甲烷)伯卤代烷 仲卤代烷 叔卤代烷2、卤代烷的同分异构现象CH 3CH 2CH 2CH 2CH 2Br CH 3CH 2CH 2CHCH 3CH 3CH 2CHCH 2CH 3BrBr CH 3CH 2CHCH 2BrCH 3CH 3CHCHCH 3Br CH 3CH 3CHCH 2CH 2BrCH 3CH 3CCH 2CH 3CH 3CCH 2BrCH 3CH 3BrCH 33、卤代烃的命名CH 3CH 2CH 2CH 2CH 2Br CH 3CH 2CH 2CHCH 3BrCH 3CH 2CHCH 2CH 3BrCH 3CH 2CHCH 2BrCH 31-溴戊烷2-溴戊烷3-溴戊烷2-甲基-溴丁烷1-CH 3CHCHCH 3BrCH 3CH 3CHCH 2CH 2BrCH 3CH 3CH 2CCH 3BrCH 3CH 3CCH 2BrCH 3CH 33-甲基-1-溴丁烷2-甲基-2-溴丁烷3-甲基-2-溴丁烷2,2-二甲基-1-溴丙烷CH 2C CHCH 3CH 3ClCHCH CH 2CH 2ClCHCH 3CH 3CHCH 2CH 2Cl CH 3CH 2ClCH 32-甲基-3-氯-1-丁烯4-甲基-6-氯-2-己烯3-苯基-1-氯丁烷对甲苯氯甲烷§8 -2 卤代烷的物理性质在常温常压下,氯甲烷、溴甲烷和氯乙烷是气体,其它常见的低级卤代烷都是液体,高级的是固体。
第8章 卤代烃8-2 完成下列各反应式。
(CH 3)3CBr C 2H 5OH(CH 3)2C=CH 2+CH 3CH=CH 2HBr+O OCH 3CH 2CH 2CH 3CH 2CH 2CNNaCN(1)(2)(CH 3)2CHCH=CH 2Br +500℃(CH 3)2CCH=CH 2BrH 2O (CH 3)2C=CHCH 2Br+(CH 3)2CCH=CH 2OH(CH 3)2C=CHCH 2OH+(3)NaCNC 2H 5OH, △(4)(5)(6)ClCH=CHCH 2Cl CH 3+ClCH=CHCH 2OCCH 3OBrBrBrCNCH 2CHCH 3Br CH=CHCH 3CH 3Br2NH 3(l)CH 3NH 2CH 3NH 2+ClClNO 22△OHClNO 2ZnCl 2+CH 2ClMgCH 2MgClCH 2COOHClCH 2CHCH 2CH 2CH 3PhCH 2MgCl CH 3+PhCH 2CH 2CHCH 2CH 2CH 3CH3(7)(8)(9)(10)3RC CLi(11)RCCR'RC CCOOHRC CCH 2CH 2OHCHBr350%NaOH(aq)BrBr(12)8-3写出下列反应主要产物的构型式。
CC2H5CH3NaI+CC2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrBrCH2CH2CH3CCH2CH3H2CHCCH2CH2CH3(1)(2)(3)(4)3KOH253H3t-BuOKH3CPh PhHC6H5H3C HC6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrHC2H5CH3H25Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B >A (亲核性C 2H 5O ->C 2H 5OH ) (2)A >B (烯丙型卤代烃活泼)(3)B >A (极性非质子溶剂有利于S N 2反应)(4)A >B (亲核性-SH >-OH ) (5)A >B (亲核性硫比氮强) (6)B >A (离去能力I ->Cl -)8-5 卤代烷与NaOH 在H 2O-C 2H 5OH 溶液中进行反应,指出哪些是S N 2机理的特点,哪些是S N 1机理的特点?(1)产物发生Walden 转化; S N 2 (2)增加溶剂的含水量反应明显加快; S N 1 (3)有重排反应产物; S N 1 (4)反应速率明显地与试剂的亲核性有关; S N 2 (5)反应速率与离去基的性质有关; S N 2和S N 1 (6)叔卤代烷反应速度大于仲卤代烷。
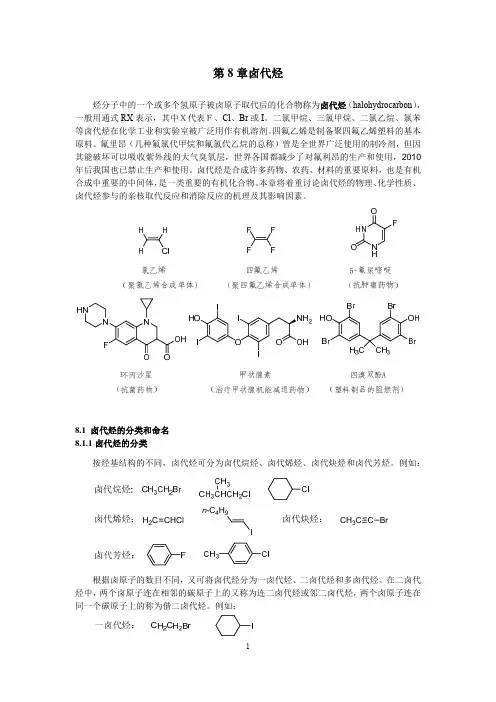
第8章 卤代烃烃分子中一个或几个氢原子被卤原子取代而得到的化合物,称为卤代烃(alkyl halides ),可用通式RX 表示。
卤代烃是一类重要的有机化合物,可作为溶剂和合成药物的原料等。
卤代烃中的卤原子可转变为多种其他官能团,在有机化学中占有重要地位。
一、卤代烃的分类根据分子的组成和结构特点,卤代烃可有不同的分类法。
1.按烃基结构的不同,分为饱和卤代烃、不饱和卤代烃、卤代芳烃。
BrCH 3CH 2CH 2I CH 3CH CHCH 2I饱和卤代烃 不饱和卤代烃 卤代芳烃 (卤代烷) (卤代烯)在卤代烯烃中有两种重要类型:烯丙型卤代烃和乙烯型卤代烃。
CH 2=CHCH 2—X CH 2=CH —X R CH 2=CHCH 2—X RCH=CH —X烯丙型卤代烃 乙烯型卤代烃 (卤原子连在α-碳上) (卤原子直接与双键碳相连)这两种卤代烃各有自己的特殊结构,它们在化学性质上有极大的差异。
2.根据与卤原子相连的碳原子的类型,将卤代烃分为伯(1°)卤代烃、仲(2°)卤代烃和叔(3°)卤代烃,例如:伯(1°)卤代烃 仲(2°)卤代烃 叔(3°)卤代烃伯、仲、叔卤代烃又称为一级、二级、三级卤代烃。
它们的化学活性不同,并呈现一定的规律。
所以在学习卤代烃的化学中,注意区分伯、仲、叔卤代烃也是很重要的。
3.按分子中所含卤原子数目多少,分为一卤代烃、二卤代烃和多卤代烃。
例如:CH 3Cl Br —CH 2—CH 2—Br CHCl 2—CHCl 2氯甲烷 1,2-二溴乙烷 1,1,2,2-四氯乙烷 chloromethane 1,2-dibromoethane 1,1,2,2-tetrachloroethane CH 3CH 2CH 2CH 2CH 3CH 2CHCH 3XC CH 3CH 3CH 3二、卤代烃的命名1.普通命名法普通命名法是按与卤原子相连的烃基名称来命名的,称为“某基卤(化物)”。
例如:CH 3CH 2CH 2Br CH 2CHCH 2Cl CH 2Cl正丙基溴 烯丙基氯 苄基氯(n -butyl bromide) (allyl chloride) (benzyl chloride)也可在母体烯名称前面加上“卤代”,称为“卤代某烃”,“代”字常省略。
例如:C BrCH 3CH 33CH 3CHCH 3CH 2CHClBr溴代叔丁烷 溴代异丙烷 氯乙烯 溴苯 (tert-butyl bromide) (iso-propanyl bromide) (chloro ethylene) (bromobenzene)2.系统命名法以相应的烃作母体,把卤原子作为取代基。
命名原则、方法与烃类相同,当烷基和卤素相同编号时,优先考虑烷基。
例如:4-甲基-2-氯己烷 2-甲基-4-氯戊烷(2-chloro-4-methylhexane) (4-chloro-2-methylpentane)CH 2CH 3HBrCH(CH 3)2Cl反-1-乙基-4-溴环己烷 3-氯-5-溴异丙苯(trans-4-bromo-1-ethylcyclohexane) (3-bromo-5-chloroisopropylbenzene)在命名卤代烯烃时,使双键编号尽可能小。
例如:3-氯-1-丙烯 4-乙基-6-氯-2-己烯 3-chloro-1-propene (6-chloro-4-ethyl-2-hexene)有些卤代烷有常用的俗名,如氯仿、碘仿等。
CH 3CHCH 2CHCH 2CH 33CH 3CH —CH 2—CH —CH 3CH 3CH 2CH —CH 2ClCH 3CHCHCHCH 2CH 2Cl CH 2CH 3CHCl3氯仿chloroform CHI3碘仿iodoform三、卤代烃的结构卤代烃的许多性质都是由于卤素原子的存在而引起的,由于卤原子的电负性比较大,使碳卤键(C—X)的极性比C—H和C—C键都大,见表8-1。
表8-1 若干共价键的偶极矩共价键偶极矩(10-30/c.m)C—C 0C—H 1.33C—F 4.70C—Cl 4.78C—Br 4.60C—I 3.97由于C—X键极性的增加,成键电子对偏向卤原子,〈-碳原子带有部分正电荷,卤原子带有部分负电荷。
C—X键不但极性大,同时极化度也大,因此,在化学反应中易发生共价键异裂。
像上述碳卤键那样,由于两键合原子的电负性不同,使成键电子对偏向某一原子而发生极化的现象称为诱导效应(inductive effect)。
诱导效应是有机化学中电性效应的一种,用I表示。
为了比较不同原子和基团诱导效应的大小及电子偏移方向,通常以碳氢键作比较标准:C C H CX吸电子 H比较标准 YX的电负性大于H,取代H后使C—X键的电子云偏向X,称X为吸电子基团;Y的电负性小于H,取代H后使C—X键的电子云偏向Y,称Y为斥电子基团。
有机化合物中常见的一些原子及基团的电负性大小次序如下:-F > -Cl > -Br > -I > -OCH3 > -NHCOCH3 > -C6H5 > -CH=CH2 >-CH3 > -C2H5 > -CH(CH3)2 > -C(CH3)3无论是吸电子基团还是斥电子基团,取代了C—H键的H以后,都使碳链上的电子云密度分布发生变化。
这种效应可沿着σ键传递到相邻的碳原子上,从而使碳链上其他共价键的电子云密度分布发生改变。
例如:—C4→C3→C2→C1→Cl因为氯原子的电负性大于碳,C—Cl键的电子云偏向氯原子,使氯原子带上部分负电荷(δ),C1带上部分正电荷(δ),从而使C1—C2共价键的电子云偏向C1,继而使C2带上比C1更少的正电荷,并依此传递下去,使C3带上比C2更少的正电荷。
吸电子基团引起的诱导效应称为吸电子诱导效应(-I效应),它使碳链的电子云密度下降;斥电子基团引起的诱导效应称为斥电子诱导效应(+I效应),它使碳链的电子云密度升高。
诱导效应沿分子链由近到远传递下去,渐远渐弱,通常传递到3个原子后就可忽略不计。
νC —FνC —Cl νC —Br νC —I四、物理性质由于卤原子的引入,C —X 键具有较强的极性,使卤代烃分子间的引力增大,从而使卤代烃的沸点升高,密度增加,卤代烃的沸点比同数碳的相应烷烃高。
在烃基相同的卤代烃中,碘代物的沸点最高,氟代烃的沸点最低。
在室温下,除氟甲烷、氟乙烷、氟丙烷、氯甲烷、溴甲烷是气 体外,常见的卤代烃均为液体。
一卤代烃的密度大于碳原子数相同的烷烃,随着碳原子数的增加,这种差异逐渐减小。
分子中卤原子增多,密度增大。
某些一卤代烃的沸点和密度见表8-2。
尽管卤代烃分子具有极性,但卤代烃不溶于水,因为它们不能和水分子形成氢键。
卤代烃可溶于醇、醚、烃类等有机溶剂。
某些卤代烃,例如,二氯甲烷、氯仿等是优良的有机溶剂,可把有机物从水层中提取出来。
卤代烃的光谱性质:红外光谱:C —X 键伸缩振动的吸收峰位置随着卤素原子量的增加而减小,分别为:1000cm -1~1 350 cm -1(强) 700cm -1~750 cm -1(中) 500cm -1~700 cm -1(中) 485cm -1~610 cm -1(中)图8-1为1,2-二氯乙烷的红外吸收光谱图。
由于C —X 键的吸收峰都在指纹区,因此要用红外光谱确定有机化合物中是否存在C —X 键是十分困难的。
图8-1 1,2-二氯乙烷的红外光谱图1H-NMR谱:由于卤素的电负性较强,使与卤原子相连的碳上的质子所受的屏蔽降低,质子的化学位移δ移向低场,与卤素直接相连的碳上质子的化学位移δ一般在2.16~4.4之间。
例如:CH3—F CH3—Cl CH3—Br CH3—I CH3—H 1H-NMR化学位移(δ) 4.3 3.2 2.2 2.2 0.23诱导效应是具有加和性的,随着碳上取代的卤原子增多,去屏蔽效应也越大:CHCl3 CH2Cl2CH3—Cl1H-NMR化学位移(δ)7.3 5.3 3.1诱导效应沿单键传递,其影响随距离的增加而减少,去屏蔽作用下降:γβα—CH2—CH2—CH2—X1H-NMR化学位移(δ)Cγ—H:1.03~1.08 Cβ—H:1.24~1.55 Cα—H:2.16~4.4 图8-2是1,2-二溴-2-甲基丙烷的1H-NMR谱图:图8-2 1,2-二溴-2-甲基丙烷的1H-NMR谱图不同卤代烷的稳定性不同。
单氟代烷不太稳定,蒸馏时会有烯烃形成并放出氟化氢。
氯代烷相当稳定,可用蒸馏方法来纯化。
较高分子量的叔烷基氯化物,加热时也会放出氯化氢,因而在处理时要小心。
叔丁基碘在常压下蒸馏时,会完全分解。
氯仿在光照下会发生缓慢的分解并生成光气。
溴代烷和碘代烷对光也敏感,在光的作用下会慢慢放出溴或碘而变成棕色或紫色,因而常存放于不透明或棕色的瓶中保存,在使用前重新进行蒸馏。
五、化学性质卤代烃所有化学性质都是由于C —X 键的极性引起的,都涉及到碳卤键的断裂。
(一)亲核取代反应1.亲核取代反应卤代烃可与许多亲核试剂(nucleophilic reagent )发生取代反应。
例如:NaOHROH + NaXNaOR ′ R —O —R ′+ NaX NaCN R —CN + NaX NH 3 R —NH 2 + HX NaSH R —SH + NaX NaONO 2 R —O —NO 2 + NaX NaC ≡CR ′ R —C ≡CR ′+ NaX AgONO 2 R —O —NO 2 + AgX ↓前四个反应可分别作为醇类、醚类、腈类和胺类的制备方法,而卤代烷与硝酸银作用生成卤化银沉淀,是鉴别卤代烃的简便方法。
上述反应的共同特点,都是试剂的负离子或具有未共用电子对的分子进攻卤代烃分子中电子云密度较低的与卤原子直接结合的碳原子而引起的。
反应中进攻试剂均提供了一对电子,象这种在反应中能提供一对电子的试剂称为亲核试剂。
由亲核试剂进攻而引起的取代反应,称为亲核取代反应(nucleophilicsubstitution ),以S N 表示之,其中S 代表取代(substitution ),N 代表亲核(nucleophilic ),反应通式如下:2—R —CH 2— Nu + X -+δ-Nu: + R —CH 2——CH 2—Nu + X -亲核试剂 卤代烷(底物) 产物 离去基团其中,:Nu 为亲核试剂;:X - 为反应中被取代而带着一对电子离去的基团,称为离去基团(leaving group )。
受亲核试剂进攻的对象卤代烷称为反应底物(substrate);卤代烷中与卤原子相连的碳原子为α-碳原子,它是反应的中心,又称为中心碳原子。