免疫定性项目性能验证报告---正本
- 格式:doc
- 大小:505.50 KB
- 文档页数:19

免疫定性项目性能验证报告单位名称:省儿童医院科室名称:检验科实验室:免疫实验室仪器名称:STAR-FAME全自动酶免分析系统型号规格:STAR LET8CH-FAME 24/30仪器编号:173000-7552 146003-3441验证人员:闫红雪超审核人员:郭映辉批准人:贵霞验证日期:2016年4月19日-2016年4月24日目录性能验证结果 (1)1、基本信息 (3)2、正确度验证 (4)3、精密度验证 (5)4、检出线验证 (9)5、阴阳性符合率 (15)1 基本信息1.1 仪器名称:STAR-FAME全自动酶免分析系统1.2试剂:1.3质控品:2 正确度验证以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。
附件:卫生部临检中心室间质量评价成绩表标本来源:卫生部临检中心批号:项目名称:HBsAg项目名称:HBsAb项目名称:抗-HCV3 精密度验3.1 批精密度:3.1.1 实验方案:选择低值、中值质控品,连续检测20次,记录并保存原始检测数据,计算SD、CV值。
3.1.2 检测要求:批精密度<15%。
3.1.3 结果HBsAg批精密度中值样本X= 0.798 s= 0.029 cv=3.6%HBsAb批精密度中值样本X= 1.278 s= 0.061 cv=4.8%HCV批精密度中值样本X= 0.794 s= 0.048 cv=6.1%3.2 批间精密度:3.2.1 实验方案:选择低值、中值质控品,每天重复测定5次,连续进行4 天,记录并保存原始检测数据,计算SD、CV值。
3.2.2 检测要求:批间精密度20%3.2.3 结果HBsAg批间精密度中值样本X=0.68 s=0.08 cv=11.16HBsAb批间精密度中值样本X=1.58 s=0.20 cv=12.55HCV批间精密度中值样本X=0.77 s=0.07 cv=8.804 检出限验证4.1实验方案:根据康彻斯坦定值标准物浓度(见下表)的实际情况进行1:1,1:4,1:8,1:16稀释检测,各浓度一次做3个孔,然后计算出预测临界点(C50),并重复检测20次进行验证C50;在此基础上,制备高于临界浓度20%和低于临界浓度20%的样本分别测定20次,记录阴性及阳性结果数。
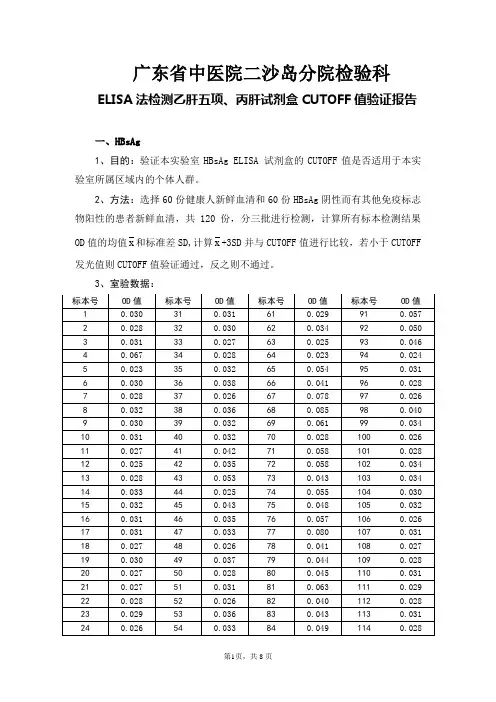
广东省中医院二沙岛分院检验科ELISA法检测乙肝五项、丙肝试剂盒CUTOFF值验证报告一、HBsAg1、目的:验证本实验室HBsAg ELISA 试剂盒的CUTOFF值是否适用于本实验室所属区域内的个体人群。
2、方法:选择60份健康人新鲜血清和60份HBsAg阴性而有其他免疫标志物阳性的患者新鲜血清,共120份,分三批进行检测,计算所有标本检测结果OD值的均值x和标准差SD,计算x+3SD并与CUTOFF值进行比较,若小于CUTOFF 发光值则CUTOFF值验证通过,反之则不通过。
3、室验数据:4、结果:x+3SD=0.037+0.014*3=0.079,试剂盒CUTOF值为0.105,故x+3SD 值小于CUTOFF值。
5、结论:本实验室HBsAg ELISA试剂盒所选择的CUTOFF值适用于本实验室所属区域内的99%正常人群。
二、HBsAb1、目的:验证本实验室HBsAb ELISA 试剂盒的CUTOFF值是否适用于本实验室所属区域内的个体人群。
2、方法:选择60份HBsAb阴性新鲜血清和60份HBsAb阴性而有其他免疫标志物阳性的患者新鲜血清,共120份,分三批进行检测,计算所有标本检测结果OD值的均值x和标准差SD,计算x+3SD并与CUTOFF值进行比较,若小于CUTOFF 发光值则CUTOFF值验证通过,反之则不通过。
3、室验数据:4、结果:x+3SD=0.031+0.024*3=0.103,试剂盒CUTOF值为0.105,故x+3SD 值小于CUTOFF值。
5、结论:本实验室HBsAb ELISA试剂盒所选择的CUTOFF值适用于本实验室所属区域内的99%正常人群。
三、HBeAg1、目的:验证本实验室HBeAg ELISA 试剂盒的CUTOFF值是否适用于本实验室所属区域内的个体人群。
2、方法:选择60份健康人新鲜血清和60份HBeAg阴性而有其他免疫标志物阳性的患者新鲜血清,共120份,分三批进行检测,计算所有标本检测结果OD值的均值x和标准差SD,计算x+3SD并与CUTOFF值进行比较,若小于CUTOFF 发光值则CUTOFF值验证通过,反之则不通过。


免疫定性项目性能验证报告单位名称:河北省儿童医院科室名称:检验科实验室:免疫实验室仪器名称:STAR-FAME全自动酶免分析系统型号规格:STAR LET8CH-FAME 24/30仪器编号:173000-7552 146003-3441验证人员:闫红刘雪超审核人员:郭映辉批准人:李贵霞验证日期:2016年4月19日-2016年4月24日目录性能验证结果 (1)1、基本信息 (3)2、正确度验证 (4)3、精密度验证 (5)4、检出线验证 (9)5、阴阳性符合率 (15)1 基本信息1.1 仪器名称:STAR-FAME全自动酶免分析系统1.2试剂:项目试剂产家试剂批文试剂批号失效期HBsAg 英科新创国药准字S1******* 2015125143 2016-12-09HBSAb 英科新创国食药监械(准)字2013第3401320号2016016202 2017-01-17抗-HCV 英科新创国药准字S1******* 2015125824 2016-11-301.3质控品:项目生产厂家批文浓度批号失效期HBsAg 北京康彻思坦生物国制标物号10000958号0.5IU/ml 201504002 20170407HBSAb 北京康彻思坦生物国制标物号10001001号30mIU/ml 201406001 20160602抗-HCV 北京康彻思坦生物国制标物号10001091号0.5NCU/ml 201511005 201711192 正确度验证以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。
附件:卫生部临检中心室间质量评价成绩表标本来源:卫生部临检中心批号:1521 1522 1523 1524 15251531 1532 1533 1534 15351611 1612 1613 1614 1615项目名称:HBsAg结果卫生部临检中心阳性阴性合计本室阳性 6 0 6 本室阴性0 9 9 合计 6 9 15 符合率:100% 100%项目名称:HBsAb结果卫生部临检中心阳性阴性合计本室阳性 4 0 4 本室阴性0 11 11 合计 4 11 15 符合率:100% 100%项目名称:抗-HCV结果卫生部临检中心阳性阴性合计本室阳性 5 0 5本室阴性0 10 10合计 5 10 15符合率:100% 100%3 精密度验3.1 批内精密度:3.1.1 实验方案:选择低值、中值质控品,连续检测20次,记录并保存原始检测数据,计算SD、CV值。

临床免疫学检验的定性项目性能验证方案检验程序性能验证是临床实验室质量管理的关键技术要求,是保证实验室检测结果准确的前提。
根据中国合格评定国家认可委员会(CNAS)发布的《CNAS-GL038:临床免疫学定性检验程序性能验证指南》,要求申请认可或已获认可的医学实验室对临床免疫学(定性)检验程序,在新检验程序常规应用前、检验程序分析性能受影响后(如仪器主部件故障、仪器搬迁、环境失控等)、检验程序的任一要素(仪器、试剂、校准品等)变更等,都要对检验程序的性能进行验证或重新验证,通过验证结果来分析评估该检验程序是否符合实验室的质量管理要求并满足临床的诊断需要。
性能验证指标的选择应满足该项目检测的预期用途,临床免疫学定性检验程序的分析性能参数一般包括:符合率、精密度(重复性)、检出限、临界值、抗干扰能力、血清与血浆结果一致性等。
下面将对临床免疫学定性检验程序的符合率、精密度(重复性)、检出限和临界值这4个性能指标的验证方案进行介绍解释。
1符合率验证符合率验证的目的是评估该检验程序所检测结果的正确度,有两种验证方案,一是诊断符合率,采用国家标准血清盘或临床明确诊断的阴阳性样品进行比对;二是方法符合率,即与其他分析方法进行比对,包括用候选方法评估已知能力验证或室间质评的样本以及不同方法学或/和相同方法学在不同实验室之间的比对。
1.1诊断符合率验证选取国家标准血清盘或临床明确诊断的阴性样本20份(包含至少10份其他标志物阳性的样本)、阳性样本20份(包含至少10份浓度在cut-off值和2-4倍cut-off值之间的弱阳性样本,1份极高值阳性样本),随机分组分批检测样本,以国家标准血清盘或临床明确诊断的样本结果为金标准,计算候选检验程序所检测结果的诊断符合率,如表1,表1诊断符合率验证金标准合计+-候选检验程序+a b a+b -c d c+d合计n1n2n 诊断符合率计算:诊断灵敏度=[a/n1]×100%诊断特异性=[d/n2]×100%诊断符合率=[(a+d)/n]×100%验证通过标准:要求计算得出的诊断灵敏度、诊断特异性和诊断符合率不低于厂商检验方法声明。

免疫定性项目性能验证报告单位名称:河北省儿童医院科室名称:检验科实验室:免疫实验室仪器名称:STAR-FAME全自动酶免分析系统型号规格:STAR LET8CH-FAME 24/30仪器编号:173000-7552 146003-3441验证人员:闫红刘雪超审核人员:郭映辉批准人:李贵霞验证日期:2016年4月19日-2016年4月24日目录性能验证结果 (1)1、基本信息 (3)2、正确度验证 (4)3、精密度验证 (5)4、检出线验证 (9)5、阴阳性符合率 (13)1 基本信息1.1 仪器名称:STAR-FAME全自动酶免分析系统1.2试剂:1.3质控品:2 正确度验证以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。
附件:卫生部临检中心室间质量评价成绩表标本来源:卫生部临检中心批号:项目名称:HBsAg项目名称:HBsAb项目名称:抗-HCV3 精密度验3.1 批内精密度:3.1.1 实验方案:选择低值、中值质控品,连续检测20次,记录并保存原始检测数据,计算SD、CV值。
3.1.2 检测要求:批内精密度<15%。
3.1.3 结果HBsAg批内精密度中值样本X= 0.798 s= 0.029 cv=3.6%HBsAb批内精密度中值样本X= 1.278 s= 0.061 cv=4.8%HCV批内精密度中值样本X= 0.794 s= 0.048 cv=6.1%3.2 批间精密度:3.2.1 实验方案:选择低值、中值质控品,每天重复测定5次,连续进行4 天,记录并保存原始检测数据,计算SD、CV值。
3.2.2 检测要求:批间精密度20%3.2.3 结果HBsAg批间精密度中值样本X=0.68 s=0.08 cv=11.16HBsAb批间精密度中值样本X=1.58 s=0.20 cv=12.55HCV批间精密度中值样本X=0.77 s=0.07 cv=8.804 检出限验证4.1实验方案:根据康彻斯坦定值标准物浓度(见下表)的实际情况进行1:1,1:4,1:8,1:16稀释检测,各浓度一次做3个孔,然后计算出预测临界点(C50),并重复检测20次进行验证C50;在此基础上,制备高于临界浓度20%和低于临界浓度20%的样本分别测定20次,记录阴性及阳性结果数。



定性项目性能验证报告目录1. 报告概述 (2)1.1 报告目的与意义 (2)1.2 报告范围与方法 (3)1.3 报告编制依据 (4)2. 项目概况 (5)2.1 项目背景介绍 (6)2.2 项目目标与任务 (8)2.3 项目团队组成 (8)3. 性能验证方案 (10)3.1 验证目标与指标确定 (11)3.2 验证方法与步骤 (12)3.3 验证环境与工具配置 (13)4. 性能测试结果 (14)4.1 功能测试结果分析 (15)4.2 性能指标测试结果分析 (17)4.3 稳定性测试结果分析 (17)5. 性能评估与对比 (19)5.1 与行业标准对比分析 (20)5.2 与竞品对比分析 (21)5.3 与历史数据对比分析 (23)6. 存在问题与改进建议 (25)6.1 存在的主要问题 (26)6.2 原因分析与定位 (27)6.3 改进建议与措施 (28)7. 结论与展望 (29)7.1 研究结论总结 (30)7.2 未来工作展望 (31)7.3 对项目的进一步建议 (31)1. 报告概述本定性项目性能验证报告旨在提供对项目进展、成果质量以及项目团队独立评估结果的概要反馈。
报告结构包括但不限于项目背景、关键绩效指标(KPIs)分析、团队反馈、以及其他项目性能影响因素的考察。
本报告旨在成为一个全面反映项目实际情况的工具,辅以定性分析深度搅匀多项定量视角,形成对项目全面而深入的视角。
通过提供定质的反馈,本报告旨在作为项目团队及利益相关者之间的沟通平台,进而促成项目的持续优化和成功实施。
1.1 报告目的与意义本报告旨在对项目的性能进行全面的定性分析,验证项目在预定目标、进度和质量方面的实现情况。
通过收集、整理和分析项目相关数据,评估项目是否达到预期效果,并识别潜在问题及改进方向。
明确项目绩效:系统地呈现项目在各个关键方面的实际表现,为项目管理者和利益相关者提供直观的性能依据。
问题诊断与改进:通过深入剖析项目过程中的问题和挑战,为项目团队提供针对性的解决方案和优化建议。

免疫定性项目性能验证报告单位名称:河北省儿童医院科室名称:检验科实验室:免疫实验室仪器名称:STAR-FAME全自动酶免分析系统型号规格:STAR LET8CH-FAME 24/30仪器编号:验证人员:闫红刘雪超审核人员:郭映辉批准人:李贵霞验证日期:2016年4月19日-2016年4月24日目录性能验证结果 (1)1、基本信息 (3)2、正确度验证.................................................................... 错误!未定义书签。
3、精密度验证 (5)4、检出线验证 (9)5、阴阳性符合率................................................................ 错误!未定义书签。
1 基本信息仪器名称:STAR-FAME全自动酶免分析系统试剂:质控品:2 正确度验证以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。
附件:卫生部临检中心室间质量评价成绩表标本来源:卫生部临检中心批号:项目名称:HBsAg项目名称:HBsAb项目名称:抗-HCV3 精密度验批内精密度:3.1.1 实验方案:选择低值、中值质控品,连续检测20次,记录并保存原始检测数据,计算SD、CV值。
3.1.2 检测要求:批内精密度<15%。
3.1.3 结果HBsAg批内精密度中值样本X= s= cv=%HBsAb批内精密度中值样本X= s= cv=%HCV批内精密度中值样本X= s= cv=%批间精密度:3.2.1 实验方案:选择低值、中值质控品,每天重复测定5次,连续进行4天,记录并保存原始检测数据,计算SD、CV值。
3.2.2 检测要求:批间精密度20%3.2.3 结果HBsAg批间精密度中值样本X= s= cv=HBsAb批间精密度中值样本X= s= cv=HCV批间精密度中值样本X= s= cv=4 检出限验证实验方案:根据康彻斯坦定值标准物浓度(见下表)的实际情况进行1:1,1:4,1:8,1:16稀释检测,各浓度一次做3个孔,然后计算出预测临界点(C50),并重复检测20次进行验证C50;在此基础上,制备高于临界浓度20%和低于临界浓度20%的样本分别测定20次,记录阴性及阳性结果数。

性能验证报告(定性类)单位名称:AAA医院科室名称:检验科实验室:临床化学与免疫学(免疫组)实验室验证人员:审核人:批准人:验证日期:2012年7月18日—2012年12月4日目录乙型肝炎病毒e抗原(HBeAg)性能验证报告 (3)乙型肝炎病毒表面抗原(HBsAg)性能验证报告 (9)乙型肝炎病毒核心抗体(抗HBc)性能验证报告 (13)乙型肝炎病毒e抗体(HBeAb)性能验证报告............................................ 错误!未定义书签。
乙型肝炎病毒表面抗体(抗HBs)性能验证报告 ....................................... 错误!未定义书签。
丙型肝炎病毒抗体(抗HCV)性能验证报告.............................................. 错误!未定义书签。
乙型肝炎病毒e抗原(HBeAg)性能验证报告1.检测系统基本信息A 精密度:CV<15%B 最低检出限:无3.验证内容3.1定性实验的符合率、特异性和灵敏度的验证:本实验室计算了2010-2011年间参加卫生部临检中心室间质评的对比结果,将两方结果输入表格中通过公式计算各项性能指标。
样本来源:PT材料求。
附件:室间质评复印件3.2人员比对选取20份标本(包括阳性、阴性和弱阳性),先由实验室经验丰富的操作人员进行实验,以其实验结果作为参照,再由从事该项目检测的人员对同标本进行操作,将各自结果与参照结果进行比对。
样本来源:患者标本附件:手工操作ELISA人员比对表3.2定性实验的检出限将定值样品进行倍比稀释(如稀释到原浓度的2、4、8、16倍…)后进行检测。
首次出现阴性的前一个稀释倍数为该实验的检出限。
测定时间:2012.8.15操作人员:定值质控品来源:康彻斯坦室内质控品(HBeAg:批号201202001)浓度:2NCL/mL3.3Cut-off值验证3.3.1方法1在临界值基础上,准备出-20%浓度样本和+20%浓度样本(即定值样品本身),对以上低、高浓度样本分别测定20次,记录阴性及阳性结果数,即为cut-off重复性验证。
免疫定性项目性能验证报告目录性能验证结果 (1)1、基本信息 (3)2、正确度验证 (4)1 基本信息1.1 仪器名称:STAR-FAME全自动酶免分析系统1.2试剂:2 正确度验证以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。
附件:卫生部临检中心室间质量评价成绩表标本来源:卫生部临检中心批号:项目名称:抗-HCV中值样本X=0.68 s=0.08 cv=11.16HBsAb批间精密度中值样本X=0.77 s=0.07 cv=8.804 检出限验证4.1实验方案:根据康彻斯坦定值标准物浓度(见下表)的实际情况进行1:1,1:4,1:8,1:16稀释检测,各浓度一次做3个孔,然后计算出预测临界点(C50),并重复检测20次进行验证C50;在此基础上,制备高于临界浓度20%和低于临界浓度20%的样本分别测定20次,记录阴性及阳性结果数。
4.2 实验要求:要求高于临界浓度20%的样本重复检测20次应至少有19次以上(≥95%)阳性反应,低于临界浓度20%的样本重复检测20次应至少有19次以上(≥95%)阴性反应,即为通过。
4.3 实验结果HBsAg检出限序号 1 2 3 4 5 稀释比例原倍1:2 1:4 1:8 1:16 终浓度0.5 0.25 0.125 0.0625 0.0312 (IU/ml)OD值0.531 0.252 0.115 0.047 0.017预测临界点(C50): 0.11IU/mlHBsAg检出限浓度20次重复检测判定0.11IU/ml为实验方法的临界点临界值+20%浓度,也就是0.14IU/ml即为该试验方法检出限HBsAb检出限终浓度30 15 7.5 3.75 1.88(mIU/ml)OD值0.386 0.179 0.079 0.034 0.013预测临界点(C50): 9.16mIU/mlHBsAb检出限浓度20次重复检测序号 1 2 3 4 5 6 7 8 9 10 OD值0.118 0.082 0.09 0.074 0.094 0.115 0.081 0.092 0.085 0.104 序号11 12 13 14 15 16 17 18 19 20 OD值0.106 0.107 0.118 0.103 0.111 0.097 0.104 0.113 0.106 0.109 X=9.16,经统计,阳性结果数:9,阴性结果数:11,阳性结果比45%,因此可以判定9.16IU/ml为实验方法的临界点HBsAb20次高低浓度样本测定(±20%样本浓度)+20%浓度-20%浓度样本号OD值样本号OD值样本号OD值样本号OD值1 0.194 11 0.197 1 0.078 11 0.0912 0.195 12 0.193 2 0.08 12 0.0753 0.199 13 0.19 3 0.09 13 0.0884 0.201 14 0.192 4 0.085 14 0.0655 0.176 15 0.193 5 0.082 15 0.0826 0.199 16 0.19 6 0.094 16 0.0747 0.177 17 0.177 7 0.083 17 0.0928 0.202 18 0.178 8 0.094 18 0.0949 0.191 19 0.2 9 0.089 19 0.08910 0.195 20 0.199 10 0.097 20 0.093 +20%浓度样本OD均值X=0.192,阳性数量20,阳性比例100%-20%浓度样本OD均值X=0.085, 阴性数量20,阴性比例100%临界值+20%浓度,也就是11mIU/ml即为该试验方法检出限HCV检出限序号 1 2 3 4 5 稀释比例原倍1:2 1:4 1:8 1:16 终浓度0.5 0.25 0.125 0.0625 0.0312(NCU/ml)OD值0.428 0.185 0.072 0.044 0.015预测临界点(C50): 0.184NCU/mlHCV检出限浓度20次重复检测以判定0.184NCU/ml为实验方法的临界点临界值+20%浓度,也就是0.22NCU/ml即为该试验方法检出5 阴阳性符合率5.1 实验方案:20份已确诊为阳性和20份已确诊为阴性的标本在同一批检测,计算阳性符合率和阴性符合率。
免疫检测系统/方法的分析性能验证评估报告检验中心依据CNAS-CL02:《医学实验室质量和能力认可准则》(ISO 15189:2007)对医学实验室检测系统性能评价的相关要求,对定性检测项目的灵敏度、特异性、符合率、检出限、CUT OFF值进行评价;雅培ARCHITECT i2000SR全自动化学发光分析检测系统性能主要从以下几个方面进行评价:精密度、正确度、线性范围、临床可报告范围、功能灵敏度等。
具体实施方案如下。
1 目的:对雅培ARCHITECT i2000SR全自动化学发光分析检测系统定量检测的肿瘤8项(AFP、CEA、Ferritin、Total PSA、Free PSA、CA125、CA19-9、CA15-3)和感染免疫项目(HBsAg、HBsAb、HBeAg、HBeAb、HBcAb、抗HCV、抗HIV、抗TP、TRUST)定性检测方法的分析性能进行评价,结果与生产厂家给出的性能指标进行比较,来验证生产厂家给出的性能指标是否能满足临床要求。
若无厂家性能指标则与CLIA’88规定的标准或卫生部室间质评计划表提供的标准比较,判断仪器的性能是否符合要求。
2 原理2.1 感染免疫定性检测项目2.1.1 检测系统灵敏度、特异性和符合率评价仪器测量结果与真值的一致程度。
采用参加卫生部临检中心的室间质评样品,本组参加室间质评的项目一律用回报结果作为评价标准。
检测系统灵敏度为真阳性/(真阳性+假阴性)的百分率。
诊断特异性为真阴性/(真阴性+假阳性)的百分率。
符合率指所有检验结果中正确结果百分率。
2.1.2 检出限检出某种分析物的最低浓度。
选择定值阳性质控品,按比例作系列稀释并检测,以确定其最低检出限。
以S/CO大于1且接近于1,比值稳定的最低浓度作为其检测限。
2.1.3 CUT OFF值判定某种分析物有或无的判断值。
收集1500例健康人群需验证项目的OD值,求其平均值和标准差(SD),以平均值+3SD作为本实验室的Cut off值。
免疫定性项目性能验证报告单位名称:河北省儿童医院科室名称:检验科实验室:免疫实验室仪器名称:STAR-FAME全自动酶免分析系统型号规格:STAR LET8CH-FAME 24/30仪器编号:173000-7552 146003-3441验证人员:闫红刘雪超审核人员:郭映辉批准人:李贵霞验证日期:2016年4月19日-2016年4月24日目录性能验证结果 (1)1、基本信息 (3)2、正确度验证 (4)3、精密度验证 (5)4、检出线验证 (9)5、阴阳性符合率 (15)河北省儿童医院检验科性能验证报告1 基本信息1.1 仪器名称:STAR-FAME全自动酶免分析系统1.2试剂:1.3质控品:2 正确度验证以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。
附件:卫生部临检中心室间质量评价成绩表标本来源:卫生部临检中心批号:项目名称:HBsAg项目名称:HBsAb项目名称:抗-HCV3 精密度验3.1 批内精密度:3.1.1 实验方案:选择低值、中值质控品,连续检测20次,记录并保存原始检测数据,计算SD、CV值。
3.1.2 检测要求:批内精密度<15%。
3.1.3 结果HBsAg批内精密度中值样本X= 0.798 s= 0.029 cv=3.6%HBsAb批内精密度中值样本X= 1.278 s= 0.061 cv=4.8%HCV批内精密度中值样本X= 0.794 s= 0.048 cv=6.1%3.2 批间精密度:3.2.1 实验方案:选择低值、中值质控品,每天重复测定5次,连续进行4 天,记录并保存原始检测数据,计算SD、CV值。
3.2.2 检测要求:批间精密度20%3.2.3 结果HBsAg批间精密度中值样本X=0.68 s=0.08 cv=11.16HBsAb批间精密度中值样本X=1.58 s=0.20 cv=12.55HCV批间精密度中值样本X=0.77 s=0.07 cv=8.804 检出限验证4.1实验方案:根据康彻斯坦定值标准物浓度(见下表)的实际情况进行1:1,1:4,1:8,1:16稀释检测,各浓度一次做3个孔,然后计算出预测临界点(C50),并重复检测20次进行验证C50;在此基础上,制备高于临界浓度20%和低于临界浓度20%的样本分别测定20次,记录阴性及阳性结果数。
免疫定性项目性能验证报告---正本————————————————————————————————作者:————————————————————————————————日期:1第 1 页 共 17 页免疫定性项目性能验证报告单位名称:河北省儿童医院 科室名称:检验科 实 验 室:免疫实验室仪器名称:STAR-FAME 全自动酶免分析系统 型号规格:STAR LET8CH-FAME 24/30 仪器编号:173000-7552 146003-3441 验证人员:闫红 刘雪超 审核人员:郭映辉 批 准 人:李贵霞验证日期:2016年4月19日-2016年4月24日第2页 共 17 页目 录性能验证结果...................................................... 1 1、 基本信息 ................................................... 3 2、 正确度验证 ................................................. 4 3、 精密度验证 ................................................. 5 4、 检出线验证 ................................................. 9 5、阴阳性符合率 (13)河北省儿童医院检验科 性能验证报告第 3 页 共 17 页1 基本信息1.1 仪器名称:STAR-FAME 全自动酶免分析系统 1.2试剂: 项目 试剂产家 试剂批文 试剂批号 失效期 HBsAg 英科新创 国药准字S1******* 2015125143 2016-12-09 HBSAb 英科新创 国食药监械(准)字2013第3401320号 2016016202 2017-01-17 抗-HCV 英科新创国药准字S1*******20151258242016-11-301.3质控品: 项目 生产厂家 批文浓度 批号 失效期 HBsAg北京康彻思坦生物 国制标物号10000958号0.5IU/ml20150400220170407HBSAb 北京康彻思坦生物 国制标物号10001001号 30mIU/ml 201406001 20160602抗-HCV 北京康彻思坦生物国制标物号10001091号 0.5NCU/ml 201511005 20171119第 16 页 共 17 页2 正确度验证以卫生部临床检验中心室间质评结果为准;成绩在80%者即为验证通过。
附件:卫生部临检中心室间质量评价成绩表 标本来源:卫生部临检中心 批号:1521 1522 1523 1524 1525 1531 1532 1533 1534 1535 1611 1612161316141615项目名称:HBsAg结果 卫生部临检中心 阳性 阴性 合计 本室阳性 6 0 6 本室阴性 0 9 9 合计 6 9 15 符合率: 100%100%项目名称:HBsAb结果 卫生部临检中心 阳性 阴性 合计 本室阳性 4 0 4 本室阴性 0 11 11 合计 4 11 15 符合率: 100%100%第 16 页 共 17 页项目名称:抗-HCV结果 卫生部临检中心 阳性 阴性 合计 本室阳性 5 0 5 本室阴性 0 10 10 合计 5 10 15 符合率: 100%100%3 精密度验 3.1 批内精密度:3.1.1 实验方案:选择低值、中值质控品,连续检测20次,记录并保存原始检测数据,计算SD 、CV 值。
3.1.2 检测要求:批内精密度<15%。
3.1.3 结果HBsAg 批内精密度样本号 低值OD 值 检测结果 样本号 中值OD 值 检测结果 1 0.378 阳性 21 0.819 阳性 2 0.345 阳性 22 0.775 阳性 3 0.347 阳性 23 0.769 阳性 4 0.328 阳性 24 0.78 阳性 5 0.327 阳性 25 0.856 阳性 6 0.337 阳性 26 0.754 阳性 7 0.335 阳性 27 0.803 阳性 8 0.331 阳性 28 0.845 阳性 9 0.334 阳性 29 0.832 阳性 100.352阳性300.783阳性第 16 页 共 17 页11 0.366 阳性 31 0.789 阳性 12 0.364 阳性 32 0.781 阳性 13 0.349 阳性 33 0.83 阳性 14 0.355 阳性 34 0.747 阳性 15 0.356 阳性 35 0.819 阳性 16 0.371 阳性 36 0.81 阳性 17 0.395 阳性 37 0.787 阳性 18 0.384 阳性 38 0.791 阳性 19 0.377 阳性 39 0.791 阳性 200.365阳性400.795阳性低值样本X= 0.355 s= 0.020 cv=5.6% 中值样本X= 0.798 s= 0.029 cv=3.6%HBsAb 批内精密度样本号 低值OD 值 检测结果 样本号 中值OD 值 检测结果 1 0.256 阳性 21 1.24 阳性 2 0.226 阳性 22 1.238 阳性 3 0.224 阳性 23 1.24 阳性 4 0.211 阳性 24 1.188 阳性 5 0.217 阳性 25 1.316 阳性 6 0.212 阳性 26 1.27 阳性 7 0.212 阳性 27 1.315 阳性 8 0.22 阳性 28 1.33 阳性 9 0.239 阳性 29 1.368 阳性 10 0.215 阳性 30 1.298 阳性 110.235阳性311.297阳性第 16 页 共 17 页13 0.227 阳性 33 1.441 阳性 14 0.229 阳性 34 1.296 阳性 15 0.215 阳性 35 1.307 阳性 16 0.197 阳性 36 1.177 阳性 17 0.229 阳性 37 1.258 阳性 18 0.227 阳性 38 1.242 阳性 19 0.221 阳性 39 1.233 阳性 200.227阳性401.276阳性低值样本X= 0.223 s= 0.012 cv=5.5% 中值样本X= 1.278 s= 0.061 cv=4.8%HCV 批内精密度样本号 低值OD 值 检测结果 样本号 中值OD 值 检测结果 1 0.507 阳性 21 0.894 阳性 2 0.456 阳性 22 0.77 阳性 3 0.466 阳性 23 0.796 阳性 4 0.461 阳性 24 0.81 阳性 5 0.395 阳性 25 0.83 阳性 6 0.447 阳性 26 0.805 阳性 7 0.434 阳性 27 0.772 阳性 8 0.457 阳性 28 0.845 阳性 9 0.381 阳性 29 0.723 阳性 10 0.408 阳性 30 0.739 阳性 11 0.402 阳性 31 0.744 阳性 120.428阳性320.771阳性第 16 页 共 17 页14 0.418 阳性 34 0.744 阳性 15 0.449 阳性 35 0.765 阳性 16 0.441 阳性 36 0.721 阳性 17 0.386 阳性 37 0.843 阳性 18 0.342 阳性 38 0.781 阳性 19 0.364 阳性 39 0.854 阳性 200.399阳性400.842阳性低值样本X= 0.423 s= 0.039 cv=9.3% 中值样本X= 0.794 s= 0.048 cv=6.1%3.2 批间精密度:3.2.1 实验方案:选择低值、中值质控品,每天重复测定5次,连续进行4 天,记录并保存原始检测数据,计算SD 、CV 值。
3.2.2 检测要求:批间精密度20% 3.2.3 结果HBsAg 批间精密度日期 低值OD 值 中值OD 值 日期 低值OD 值 中值OD 值 4月20日 0.395 0.787 4月22日 0.277 0.679 4月20日 0.384 0.791 4月22日 0.247 0.665 4月20日 0.377 0.791 4月23日 0.255 0.595 4月20日 0.365 0.795 4月23日 0.262 0.599 4月21日 0.321 0.75 4月23日 0.272 0.595 4月21日 0.319 0.779 4月23日 0.239 0.618 4月21日 0.315 0.726 4月24日 0.254 0.629 4月21日 0.32 0.696 4月24日 0.269 0.65 4月22日 0.261 0.611 4月24日 0.256 0.669 4月22日0.2790.5864月24日0.2630.639低值样本X=0.30 s=0.05 cv=16.79中值样本X=0.68 s=0.08 cv=11.16HBsAb批间精密度日期低值OD值中值OD值日期低值OD值中值OD值4月20日0.229 1.258 4月22日0.219 1.73 4月20日0.227 1.242 4月22日0.236 1.776 4月20日0.221 1.233 4月23日0.208 1.555 4月20日0.227 1.276 4月23日0.197 1.743 4月21日0.192 1.543 4月23日0.201 1.748 4月21日0.204 1.531 4月23日0.218 1.959 4月21日0.191 1.574 4月24日0.2 1.683 4月21日0.211 1.54 4月24日0.202 1.632 4月22日0.247 1.672 4月24日0.209 1.609 4月22日0.244 1.756 4月24日0.206 1.586低值样本X=0.21 s=0.02 cv=7.69中值样本X=1.58 s=0.20 cv=12.55HCV批间精密度日期低值OD值中值OD值日期低值OD值中值OD值4月20日0.386 0.843 4月22日0.383 0.783 4月20日0.342 0.781 4月22日0.254 0.745 4月20日0.364 0.854 4月23日0.385 0.742 4月20日0.399 0.842 4月23日0.444 0.765 4月21日0.339 0.709 4月23日0.383 0.638 4月21日0.409 0.775 4月23日0.352 0.61 4月21日0.379 0.708 4月24日0.452 0.822 4月21日0.398 0.75 4月24日0.418 0.838 4月22日0.381 0.781 4月24日0.461 0.824 4月22日0.478 0.778 4月24日0.429 0.854低值样本X=0.39 s=0.05 cv=12.85中值样本X=0.77 s=0.07 cv=8.804 检出限验证4.1实验方案:根据康彻斯坦定值标准物浓度(见下表)的实际情况进行1:1,1:4,1:8,1:16稀释检测,各浓度一次做3个孔,然后计算出预测临界点(C50),并重复检测20次进行验证C50;在此基础上,制备高于临界浓度20%和低于临界浓度20%的样本分别测定20次,记录阴性及阳性结果数。