药化构效关系
- 格式:doc
- 大小:110.00 KB
- 文档页数:2




第一章药物化学结构与构效关系药物化学结构与构效关系是研究药物分子结构与其生物活性之间关系的重要学科之一、了解药物分子的结构特征以及其与生物活性之间的相互作用对于新药的研发和优化具有重要意义。
本章将从药物分子的结构与活性关系的概念、分子结构对活性的影响、构象与构效关系等方面进行论述。
药物分子的结构与活性关系是以药物分子的结构特征为基础,通过对药物分子的结构与活性进行定性和定量的研究,从而提高药物的活性、选择性和毒性。
药物分子的结构特征包括分子量、电荷分布、功能团、立体构型等。
药物分子的活性受多种因素的影响,例如药物分子与靶点的相互作用方式、药物分子的生物转化、药物分子的分布与代谢等。
因此,通过研究药物分子的结构与活性关系,可以揭示药物分子与靶点之间的相互作用机制,为药物设计提供理论依据和指导。
药物分子的结构对活性的影响可以从药物内部结构、药物分子与靶点相互作用等角度进行分析。
药物内部结构中,有机化合物的骨架结构、取代基的位置和类型等对于药物分子的活性具有重要影响。
骨架结构的特定形状可以影响药物分子在靶点上的识别和结合,在保持药物分子与靶点相互作用的基础上,通过改变骨架结构来提高药物的活性和选择性。
取代基的位置和类型也可以影响药物分子的立体构型和电荷分布,从而影响药物与靶点之间的相互作用。
药物分子与靶点相互作用是药物发挥生物活性的基础,通过研究药物与靶点之间的相互作用方式,可以揭示药物分子活性的机制,并为药物的设计和优化提供指导。
药物分子的构象与构效关系是研究药物分子构象特征与其生物活性之间的关系。
药物分子的构象是指药物分子在空间中的排列方式,包括键角、键长、手性等方面的信息。
药物分子的构象特征对于药物的活性和选择性具有重要影响。
例如,药物分子的手性结构可以影响药物分子与靶点的亲和力和选择性,手性药物分子的活性常常和其对映异构体(对映体)的结构密切相关。
此外,药物分子的构象特征还可以通过分子模拟等方法进行预测和研究,为药物的设计和优化提供指导。

药物化学构效关系1.局部麻醉药的构效关系:①亲脂性部分:可变范围较大,可为芳环或芳杂环,但以苯环的作用较强,是局麻药物的必需部位。
当酯类药物苯环的邻位或对位引入给电子集团,如氨基、烷氧基时,局麻作用均较未取代得苯甲酸衍生物强;对氨基苯甲酸酯类苯环的邻位上若再有其他取代基如氯、氨基、烷氧基时,由于位阻作用而延长了酯的水解,因此活性增强,作用时间延长。
②中间连接部分:由羰基部分和烷基部分共同组成。
羰基部分与麻醉药持效时间及作用强度有关,作用持续时间为:酮﹥酰胺﹥硫代酯﹥酯;麻醉作用强度:硫代酯﹥酯﹥酮﹥酰胺。
烷基部分碳原子数以2~3个为好,当烷基部分为—CH2CH2CH2—时,麻醉作用最强。
③亲水性部分:大多数为叔胺,易形成可溶性的盐类。
氮原子上取代基的碳原子总和以3~5时作用最强,也可为酯环胺,其中以哌啶的作用最强。
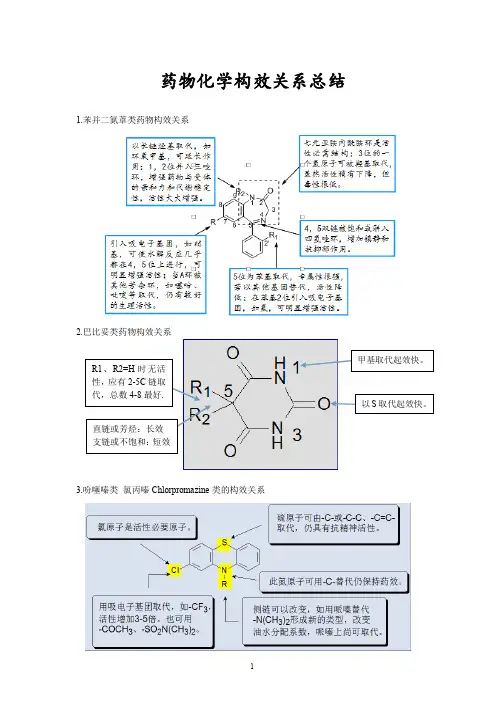
2. 苯二氮卓类药物的构效关系:① 1、2位拼入三氮唑环,使代谢稳定性增加,提高与受体的亲和力,活性显著增加;② 3位引入手性碳,分子构想更稳定,对受体亲和力增强;③ 4、5位引入恶唑环,增强稳定性;④7位有吸电子取代基时,药物活性明显增强,且吸电子性越强,活性增加越明显,NO2>Br>CF3>Cl;⑤ 5位苯环的2’位引入体积较小的吸电子基团如F、Cl,可使活性增强。
①镇静作用的强度和起效快慢,与药物的理化性质有关。
【酸性解离常数pKa】巴比妥酸和5位取代的巴比妥类有较强的酸性,在生理pH=7.4几乎全都电离成离子状态,不易透过血脑屏障,无镇静催眠作用;5,5-二取代的巴比妥类,酸性减弱,生理pH条件下不易电离,易进入脑中发挥作用,显效快,作用强。
【脂水分配系数】5位无取代基时,分子有一定极性,亲脂性强,不易透过血脑屏障,无镇静催眠作用;5位取代基碳原子总数在7~8之间作用最强,若亲脂性过强,作用下降甚至出现惊厥。
药物有最适当的的脂溶性,有利于药物透过细胞膜和血脑屏障,起效快,作用强。

局部麻醉药构sheng效关系1.分类芳酸酯类、酰胺类、氨基醚类、氨基酮类、其他类2.构效关系亲酯部分中间链亲水部分⑴亲脂部分:芳烃或芳杂环,这一部分修饰对理化性质变化大,但苯环作用较强。
苯环上引入给电子取代基,麻醉作用增强,而吸电子取代基则作用减弱。
⑵中间部分:此部分决定药物稳定性,和局麻作用持续时间有关⑶亲水部分:常为仲胺和叔胺,仲胺刺激性较大;烃基链3~4个碳原子作用最强,杂环以哌啶环作用最强巴比妥类药构效关系(1)、分子中5位上应有两个取代基。
(2)、5位上的两个取代基的总碳数以4—8为最好(3)、5位上的两个取代基的总碳数以4—8为最好. (4)、在酰亚胺氮原于上引入甲基,可降低酸性和增加脂溶性。
(5)、将C2上的氧原子以硫原子代替,则脂溶性增加,起效快,作用时间短。
苯二氮卓类药物的构效关系(1)1,3-二氢-5-苯基-2H-1,4-苯二氮卓-2-酮是此类药物基本结构;(2)环A7位引入吸电子取代基活性增加(3)环B为七元亚胺-内酰胺结构是产生药理作用的必要结构(4)5位苯环上的取代基时产生药效的重要结构之一,(5)1,2位的酰胺键和4,5位的亚胺键在酸性条件下易水解开环.吩噻嗪类药构效关系R1 部分必须由三个成直链的碳原子组成,若为支链,与多巴胺受体B 部分立体上不匹配,抗精神病活性明显下降,抗组胺作用增强。
顺式吩噻嗪类药物与多巴胺的优势构象能部分重叠,活性高(当侧链与氯取代的苯环同侧时,成为顺式构象)。
丁酰苯类药物的构效关系(1)丁酰苯基为必需的基本骨架(2)侧链末端连一碱性叔胺(3)苯环的对位一般具有氟取代(4)侧链湠基于碱基之间以三个碳原子最好镇痛药的一般特征(1)分子中具有一个平坦的芳香结构(2)有一个碱性中心能在生理PH条件下大部分电离为阳离子(3)含有哌啶或类似于哌啶的空间结构吗啡的构效关系(半合成类镇痛药)叔胺是镇痛活性的关键基团,氮原子引入不同的取代基可使μ 受体激动剂转变为拮抗剂。



药物的构效关系名词解释一、引言药物是人类提取自各种自然或合成物质的化合物,用于治疗、预防和诊断疾病。
药物的研发离不开对其构效关系的深入探索和解释。
构效关系研究的主要目的是揭示药物分子结构与其生物活性之间的关系,以便更好地设计和合成出具有特定疗效的药物分子。
本文将对药物的构效关系名词进行解释,并探讨其在药物研发中的重要性。
二、1.构效关系构效关系是指药物分子的结构特征与其生物活性之间的定量或定性关系。
这种关系可以包括药物分子的空间构型、功能基团的位置、取代基的类型和位置等。
通过研究药物分子结构与生物活性之间的关系,可以为合理设计和优化药物提供理论依据。
2.构效关系研究构效关系研究是指通过实验和计算方法,寻找药物分子结构与其生物活性之间的关系,并进行定量或定性分析。
在构效关系研究中,科学家通常会综合考虑药物分子的物理化学性质、分子对接研究、定量构效关系等方面的内容,以便更好地了解药物分子的结构与生物活性之间的关联。
3.药效团药效团是指药物分子中具有特定生物活性的结构或基团。
药效团可以是药物分子中的一个或多个功能基团,也可以是药物分子中的特定原子团。
通过研究药效团与生物活性之间的关系,可以揭示药物的药理机制,并为药物设计提供重要的指导。
4.定量构效关系定量构效关系是指通过定量方法,系统研究药物结构与生物活性之间的数量关系。
这种研究需要大量的实验数据和统计方法的支持,通过建立数学模型来描述药物分子结构与生物活性之间的关联,从而提供合理的理论指导。
5.取代基效应取代基效应是指在药物分子中,替换或添加不同的取代基会对其生物活性产生明显的影响。
取代基的类型和位置可能会导致药物的效果不同,因此在药物研发中需要充分考虑取代基效应,以优化药物的性能。
三、药物构效关系在药物研发中的重要性药物的构效关系研究在药物研发中具有重要的意义。
通过深入了解药物分子的结构特征与其生物活性之间的关系,可以实现以下几个方面的优化和改进:首先,药物的构效关系研究可以为药物分子的设计合成提供理论指导。
药物化学构效关系(第二版尤启冬主编)主要药物的构效关系应用抗肿瘤作用机理:1、药物在体内能形成缺电子活泼中间体(碳正离子)或其他具有活泼的亲电性基团的化合物,进而与肿瘤细胞的生物大分子(DNA,RNA,酶)中富电子基团(氨基,巯基,羟基等)发生共价结合,使其丧失活性,致肿瘤细胞死亡。
2、属细胞毒类药物,在抑制和毒害增生活跃的肿瘤细胞的同时,对其它增生较快的细胞产生抑制。
如骨髓细胞、肠上皮细胞、毛发细胞和生殖细胞等。
副作用大:影响造血功能和机体免疫功能,恶心、呕吐、骨髓抑制、脱发等。
氮芥类药物脂肪氮芥:氮原子的碱性比较强,在游离状态和生理PH(7.4)时,易和β位的氯原子作用生成高度活泼的亚乙基亚胺离子,为亲电性的强烷化剂,极易与细胞成分的,亲核中心发生烷基化反应。
脂肪族氮芥:烷化历程是双分子亲核取代反应(SN2),反应速率取决于烷化剂和亲核中心的浓度。
脂肪氮芥属强烷化剂,对肿瘤细胞的杀伤能力也较大,抗肿瘤谱较广;但选择性比较差,毒性也较大。
芳香族氮芥:氮原子与苯环共轭,减弱了碱性,碳正离子中间体,单分子的亲核取代反应。
氮芥类药物及大多数烷化剂主要是通过和,DNA上鸟嘌呤或胞嘧啶碱基发生烷基化,产生DNA链内、链间交联或DNA蛋白质交联而抑制,DNA的合成,阻止细胞分裂。
β-内酰胺类抗生素的化学结构特点:1分子内有一个四元的β-内酰胺环,除了单环β-内酰胺外,该四元环通过N原子和邻近的第三碳原子与另一个五元环或六元环相稠合。
2除单环β-内酰胺外,与β-内酰胺环稠合的环上都有一个羧基。
3所有β-内酰胺类抗生素的β-内酰胺环羰基α-碳都有一个酰胺基侧链。
4β-内酰胺环为一个平面结构,但两稠环不共平面β-内酰胺类药物可抑制粘肽转肽酶的活性和青霉素结合蛋白青霉素构效关系(1)6位的侧链酰胺基团决定其抗菌谱。
改变其极性,使之易于透过细胞膜可以扩大抗菌谱。
例如,在芳环乙酰氨基的α位上引入-NH2、-COOH、和-SO3H等亲水性基团,可以扩大抗菌谱,增强亲水性有利于对革兰阴性菌的抑制作用并能增强对青霉素结合蛋白的亲和力。
药学综合考研之药物化学构效关系总结一、概述药物化学构效关系,即药物化学结构与生物活性之间的关系,是药学领域的重要研究方向之一。
在药学综合考研中,药物化学构效关系的学习和理解对于理解药物作用机制、药物设计与优化、新药研发等方面具有至关重要的意义。
药物化学构效关系研究主要关注药物分子结构与其生物活性之间的相互影响和关联。
通过系统研究药物化学结构的变化如何影响其生物活性,我们可以更好地理解药物作用的本质,为新药的设计和研发提供理论基础和实践指导。
药物化学构效关系不仅涉及到化学结构的知识,还需要深入理解生物学、生理学、病理学等领域的知识,是一个多学科交叉的领域。
随着现代科学技术的发展,尤其是计算机技术和生物技术的不断进步,药物化学构效关系的研究方法也在不断发展和完善。
从传统的合成、提取、筛选等实验方法,到现代的计算机模拟、大数据分析等高科技手段,药物化学构效关系的研究正在逐步深入。
对药物化学构效关系的考研复习者来说,不仅需要掌握基础的理论知识,还需要具备跨学科的综合能力,以适应这个领域的研究和发展。
药物化学构效关系是药学研究的重要基础,对于指导新药设计、优化药物作用机制等方面具有重要意义。
本文旨在对药学综合考研中的药物化学构效关系进行总结,以期为考研学生提供系统的学习资料和复习指导。
1. 简述药物化学构效关系的重要性。
药物化学构效关系,作为药物设计与研发领域中的核心原理,具有极其重要的地位。
其重要性主要体现在以下几个方面:药物化学构效关系是药物研发的基础。
药物的疗效与其化学结构之间有着密切的联系,通过对药物分子结构的深入研究,可以预测和优化药物的生物活性,从而有针对性地设计合成新药物。
构效关系研究有助于提高药物研发的效率。
随着现代医药产业的飞速发展,药物研发已经进入了一个竞争激烈的时代,如何快速、高效地发现和优化具有优良药效的药物成为了一个重要的挑战。
而药物化学构效关系的研究,可以指导科研人员快速筛选出具有潜力的药物分子,从而大大提高药物研发的效率。
构效关系的名词解释
构效关系的名词解释是:药物或其他生理活性物质的化学结构与其生理活性之间的关系,是药物化学的主要研究内容之一。
狭义的构效关系研究的对象是药物,广义的构效关系研究的对象则是一切具有生理活性的化学物质,包括药物、农药、化学毒剂等。
最早期的构效关系研究以直观的方式定性推测生理活性物质结构与活性的关系,进而推测靶酶活性位点的结构和设计新的活性物质结构,随着信息技术的发展,以计算机为辅助工具的定量构效关系成为构效关系研究的主要方向,定量构效关系也成为合理药物设计的重要方法之一。
药物的构效关系:
例如拟胆碱药的化学结构与乙酰胆碱相似,都有季胺或叔胺基团,都能与胆碱受体结合,形成具有活性的复合物,因而表现出相似的作用。
又如,磺胺药与对氨基苯甲酸化学结构相似,因而能与对氨基苯甲酸竞争二氢叶酸合成酶而影响细菌叶酸的代谢。
在具有基本结构的任何一类药物中,药理作用的类型是由它们的基本结构决定的,而它们的药理作用的相对强度,是由基本结构上各个取代基团的性质决定的,如磺胺类药物。
但也有化学结构相似而作用相拮抗的情况,如磺胺与对氨基苯甲酸、氨丙啉与硫胺等。
同时,也有化学结构不同而药理作用相似的情况,如麻黄碱与茶碱。
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表本人。
本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。
如发现本站有涉嫌抄袭侵权/违法违规的内容请联系客服!。
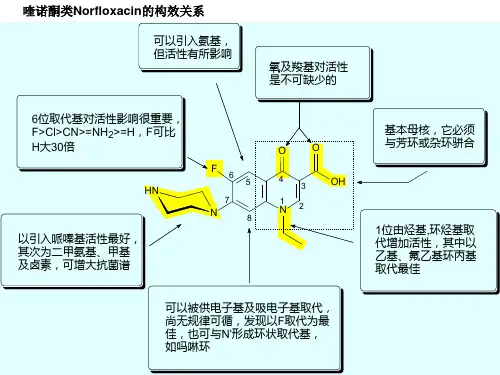
药物化学考研(构效关系总结)一、苯二氮卓类药物的构效关系 (2)二、ACE抑制剂的构效关系 (2)三、吩噻嗪类药物构效关系 (3)四、丁酰苯类药物的构效关系 (3)五、氯氮平的构效关系 (3)六、吗啡结构改造 (4)七、Morphine类似物的结构特征 (4)八、乙酰胆碱结构改造 (4)九、胆碱酯类M受体激动剂的构效关系 (5)十、合成M受体拮抗剂的构效关系 (5)十一、生物碱类N受体拮抗剂的优化 (6)十二、苯乙醇胺类肾上腺素受体激动剂的构效关系 (6)十三、局部麻醉药的结构与作用 (7)十四、局部麻醉药的构效关系 (7)十五、β受体阻滞剂的构效关系 (7)十六、二氢吡啶类钙拮抗剂构效关系 (8)十七、吲哚美辛的构效关系 (8)十八、芳基丙酸类药物的构效关系 (8)十九、塞利西布的构效关系 (9)二十、环磷酰胺的构效关系 (9)二十一、顺铂的构效关系 (10)二十二、青霉素V 的构效关系 (10)二十三、头孢菌素类药物构效关系 (10)二十四、喹诺酮类药物构效关系 (11)二十五、磺胺抗菌药的结构与其抗菌活性的关系。
(11)二十六、唑类药物结构与活性关系 (12)二十七、利巴韦林的构效关系 (12)二十八、齐多夫定的构效关系 (13)二十九、青蒿素的结构与活性关系 (13)三十、他莫昔芬的构效关系 (13)三十一、孕激素的构效关系 (14)三十二、米非司酮的构效关系 (14)三十三、糖皮质激素的构效关系 (14)三十四、Vitamin A的构效关系 (16)三十五、ACEI的结构特点及构效关系 (16)三十六、AII受体拮抗剂构效关系 (17)一、苯二氮卓类药物的构效关系二、ACE抑制剂的构效关系三、吩噻嗪类药物吩噻嗪类药物构效关系构效关系四、丁酰苯类药物的构效关系五、氯氮平的构效关系六、吗啡结构改造七、Morphine类似物的结构特征•①平坦的芳环•②碱性中心–碱性中心和平坦结构在同一平面上•③有哌啶类的空间结构–烃基突出于平面的前方八、乙酰胆碱结构改造①ACh对所有胆碱能受体部位无选择性,导致产生副作用。
构效关系
苯巴比妥类药物的构效关系
1.若R(R1)=H则无活性,5位需要两个亲脂性取代基,且总碳原子数量4-8最好
2.酰胺氮上R2为甲基时,增加脂溶性,降低酸性。
若两个N上均引入甲基则会产生惊厥作用
3.2位羰基氧以硫代替,脂溶性增加,起效快,持续作用时间短
苯二氮卓类药物的构效关系
A环:
*7位上引入吸电子取代基,活性增强,顺序为NO2>CF3>Br>Cl
*苯环被其他芳杂环如噻吩,吡啶等取代时。
仍有较好活性
B环(七元亚胺内酰胺)
*是活性必须结构
*1位N上长链烃基延长作用
*3位引入羟基使毒性下降
*4,5位双键饱和镇静作用强
*1,2位或4,5位拼合杂环可提高活性
C环
*苯环专属性较高,代以其他基团则活性降低
*2’位引入吸电子基,活性增强
拟肾上腺素类构效关系
*具有苯乙胺基本结构,碳链增长为3个碳原子,活性降低
*苯环上的3,4羟基显著增加活性,但不能口服。
3位羟基变为羟甲基,可口服,且对β2受体选择性较强
*氨基的β位通常有羟基,一般R型有较大活性
*氨基上烷基越大,对β选择性较大,但需保留一个氢未被取代
*a碳上引入甲基,拟肾上腺素作用减弱,但作用时间延长,中枢兴奋作用增强
局麻药的构效关系
亲脂性部分:
*芳基上氨基取代较好,氨基上有羟基,则活性与毒性都增加,其他取代基取代,稳定性上升,作用时间增加*苯环以其他电子等排体置换时,不及苯环强
*苯环与羰基间引入其他基团(除CH=CH外)作用消失
中间体
*X用不同电子等排体置换时的稳定性(作用时间)顺序为CH2>NH>S>O
*n=2-3时,作用最好
亲水性部分
*叔胺最常见,两个羰基常相同,也可为哌啶,吡咯烷,玛啉等
HMG-COA还原酶抑制剂的构效关系
*1位侧链内酯或羟基酸是活性中心
*5’羟基酰化后活性大大降低
*8位侧链上碳为手性碳,R和S活性相同,该碳上再引入一个甲基,活性增强
*六氢萘环被苯环,吡咯,喹啉等环替代时能保持活性
二氢吡啶类的构效关系
*1,4二氢吡啶环是必须结构,氧化为吡啶,作用消失,还原双键作用减弱
*二氢吡啶环上的NH不被取代可保持最佳活性
*4位主要影响作用强度,以取代苯基为宜,且苯环的邻,间位吸电子基取代增强活性,对位取代则活性降低或消失*3,5位羧酸脂基优于其他基团,且两个脂基不同者优于相同者
β受体拮抗剂的构效关系
取代芳基部分
*苯环4位取代对B1受体具有较好的选择性。
苯环上2,3位被取代对B1受体无选择性
*可用萘环和杂环取代,仍能维持较好活性
氧亚甲基部分
*氧亚甲基可明显提高B受体阻断作用
*氧用S或CH2取代,活性降低
异丙肾上腺素侧链(N-烷基略有差别)
*S型异构体活性强,R型活性降低或消失
*N上取代基以叔丁基和异丙基活性高,且保留一个氢未被取代
青霉素类药物的构效关系
*四元环骈五元环是活性必须,骨架上存在三个手性中心
*C2COOH是必须基团,可进行成脂修饰,醇失活
*3位两个甲基对活性影响不大
*6位侧链各种基团的引入可解决青霉素的抗菌谱,不耐酶等,不耐酸等问题
*。