2012年中考专题---溶液
- 格式:doc
- 大小:2.04 MB
- 文档页数:12

2007-2012年广东省中考试题(溶液)一、选择题1.(2007·广东)右图是A、B、C三种物质的溶解度曲线,下列说法不正确的是()A.A的溶解度大于C的溶解度B.t1℃时,100g水溶解了40gA就达到了饱和状态C.t2℃时,A和C的饱和溶液中溶质的质量分数相等D.A和B的饱和溶液从t2℃降到t1℃时,溶液的溶质质量分数都变小2.(2008·广东)20℃时,NaCl溶解于水的实验数据如下表,则下列叙述正确的是()A.②中所得溶液是饱和溶液B.20℃时10g水最多能溶解4g NaClC.③④溶液的溶质质量分数相等D.①所得溶液的溶质质量分数为20%3.(2010·广东)下列有关溶液的说法正确的是()A.将植物油与水混合,得到的是溶液B.配制溶液时,搅拌溶液可以增大溶质的溶解度C.将10%的KNO3,溶液倒出一半,剩余溶液中溶质的质量分数为20%D.将25 g KCl溶液蒸干得到5g KCl固体,则原溶液中溶质的质量分数为20%4.(2010·广东)右图是NaCl、MgSO4的溶解度曲线,下列说法正确的是()A.只有在t1℃时,NaCl和MgSO4的溶解度才相等B.t1℃~t3℃,MgSO4的溶解度随温度升高而增大C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出二、填空题1.(2009·广东)(4分)下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答()(1)60℃时,氯化钠的溶解度为g。
(2)在30℃时,100g水中加入50g硝酸钾,充分搅拌后得到的溶液质量为g。
(3)欲从海水中获得氯化钠晶体,应采取方法。
(4)由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则x的取值范围是g。
2.(2011·广东)(9分)下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题。

中考化学专题复习《溶液》测试卷-附带答案学校:___________班级:___________姓名:___________考号:___________一、选择题。
1、分别将下列物质加入到足量水中,能得到无色、澄清溶液的是()A.NaCl B.CuSO4 C.CaCO3D.FeCl32、在试管中加入少量碘粒,再加入适量的汽油,振荡,静置,观察到的现象为()3、日常生活中除去油污的方法很多,下列现象不属于乳化的是()A.修车工用汽油洗去手上的油污B.用洗发剂洗去头发上的油脂C.用洗面奶洗去皮肤上的油脂D.用洗洁精洗去餐具上的油污4、用下列物质清洗油污时,能产生乳化现象的是( )A.水B.洗洁精C.汽油D.酒精5、饱和溶液用水稀释变成不饱和溶液的过程中,保持不变的是()A.溶质的质量B.溶剂的质量C.溶液的质量D.溶质与溶剂的质量比6、20 ℃时,某物质在100 g水中最多能溶解5 g,则该物质的溶解性属于() A.易溶B.可溶C.微溶D.难溶7、有20℃等质量的两份饱和石灰水,一份冷却到10℃;另一份加入少量生石灰后,温度仍保持20℃.这两种情况下都不改变的量是()A. Ca(OH)2的溶解度B. 溶剂的质量C. 溶液的质量D. 溶液中溶质的质量分数8、将80 g质量分数为36%的浓盐酸稀释成6%的稀盐酸,需加水的质量为()A.480 g B.400 g C.320 g D.80 g9、某物质X完全溶于水,溶液中X与水的质量关系如图所示。
下列说法正确的是()A.X是溶剂B.X只能是固体C.该溶液一定是饱和溶液D.该溶液中溶质的质量分数是25%10、某溶液溶质的质量分数为20%,加入50g水后变为10%,稀释后溶液中溶质的质量是( )A.50gB.10gC.100gD.40g11、已知硫酸的浓度越大,密度越大,现将等体积质量分数为90%和10%的硫酸溶液混合,所得溶液的溶质质量分数为()A.>50% B.=50% C.<50% D.不能确定12、盐湖地区人们常采用“夏天晒盐,冬天捞碱”的方法来获取NaCl和Na2CO3。



溶液 2005-2012年山西省中考化学试卷一、选择题(每小题只有一个选项符合题意,每小题1分,共20分) 概念型:(05)6.A. 空气B. 碘酒C. (06)2.以下物质中属于纯净物的是( )A .生铁B .清洁的空气C .盐酸D (06)3 A .用汽油擦洗衣服上的油污 B C .室内放一盆水可以防止煤气中毒 D (12)7.下列说法正确的是(A )A.B.KNO 3和Ca 3(PO 4)2C.生石灰与烧碱与水都有热量放出,不能用加水的方法鉴别二者D.操作:(05)11.(09)7、下列说法不正确的是( )A 、食盐水的凝固点比较低BC 、可以在量筒中配制NaCl 溶液D (11)8. A. 用100ml 的量筒量取8.55ml 的水B. C. D. 用固体氯化钠配置100g 10%的氯化钠溶液的主要步骤是:计算、称量、溶解、装瓶贴标签 溶解度:(05)15.下图表示M 、N 描述正确的是( )A. 20℃时,M 的溶解度大于N 的溶解度B. M 、N 都不是易溶性物质C. P 点表示M 、N 的溶解度相等D. 阴影处M 、N 均为饱和溶液(08)8.木糖醇是一种理想的蔗糖替代品,它的溶解度曲线如图所示。
下列关于木糖醇的叙述,正确的是( ) A.30℃时,木糖醇的溶解度是70gB.木糖醇的溶解度随温度的升高而降低C.50℃时,100g 水中加入80g 木糖醇,搅拌,可得到饱和溶液D.70℃时木糖醇的饱和溶液降温到60℃不会析出木糖醇晶体Y 对应的试(碳酸其原理是 剂的水洗净,其原理是 。
山西省太原市2008年中考理科综合(化学试题)(08)16.(4分)我们的生活离不开溶液。
比如病了有时需要输液,渴了有时要喝饮料。
⑴医用葡萄糖溶液中,溶质的化学式是 。
(09)14(1)P (2)20方法有 (3 (4)3050℃ (选填A A (10)22.火的原理是________(10)23.(1(2小明观察到D (11)13. (1)P (2)t 2 (填“饱和”或“不饱和” (3)若将A (4)将t 2℃(12)22.溶液,现实验室只有含少量(1)查阅KNO 3和NaCl 的溶解度曲线,如图。
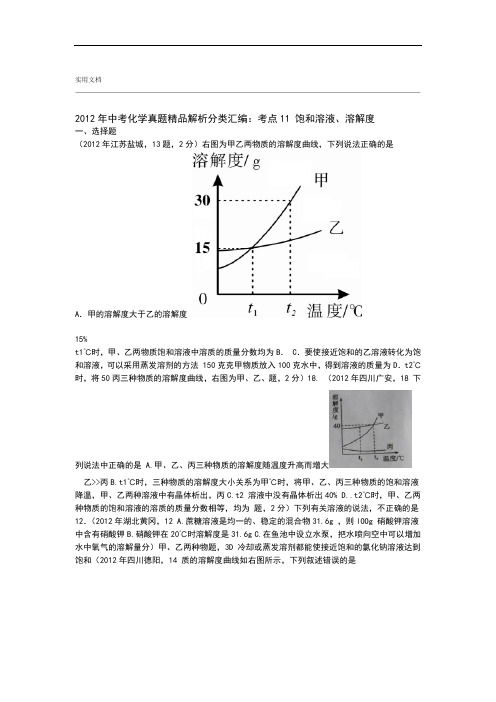
实用文档2012年中考化学真题精品解析分类汇编:考点11 饱和溶液、溶解度一、选择题(2012年江苏盐城,13题,2分)右图为甲乙两物质的溶解度曲线,下列说法正确的是A.甲的溶解度大于乙的溶解度15%t1℃时,甲、乙两物质饱和溶液中溶质的质量分数均为B. C.要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法 150克克甲物质放入100克水中,得到溶液的质量为D.t2℃时,将50丙三种物质的溶解度曲线,右图为甲、乙、题,2分)18. (2012年四川广安,18 下列说法中正确的是 A.甲、乙、丙三种物质的溶解度随温度升高而增大乙>>丙B.t1℃时,三种物质的溶解度大小关系为甲℃时,将甲、乙、丙三种物质的饱和溶液降温,甲、乙两种溶液中有晶体析出,丙C.t2 溶液中没有晶体析出40% D..t2℃时,甲、乙两种物质的饱和溶液的溶质的质量分数相等,均为题,2分)下列有关溶液的说法,不正确的是12.(2012年湖北黄冈,12 A.蔗糖溶液是均一的、稳定的混合物31.6g ,则lOOg 硝酸钾溶液中含有硝酸钾B.硝酸钾在20℃时溶解度是31.6g C.在鱼池中设立水泵,把水喷向空中可以增加水中氧气的溶解量分)甲、乙两种物题,3D 冷却或蒸发溶剂都能使接近饱和的氯化钠溶液达到饱和(2012年四川德阳,14 质的溶解度曲线如右图所示,下列叙述错误的是℃时,甲的溶解度小于乙的溶解度A、t1 ℃时,加入甲物质,可使不饱和的甲溶液变成饱和溶液B、t1100 :、t2℃时,甲或乙两种物质的饱和溶液中溶质与溶剂的质量比是WC t2、将甲、乙饱和溶液的温度从℃降到t1℃时,乙先析出晶体D 9题,2分)氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是(2012年广东, A、50℃时,氯化铵的溶解度大于硝酸钾a℃时,氯化铵与硝酸钾溶液的质量分数相等 B. 60℃的硝酸钾饱和溶液降温会变为不饱和溶液 C.将硝酸钾,充分搅拌,得到50g D.40℃时,水中加入50 g %的硝酸钾溶液质量分数约为39题、2012年甘肃兰州,152分)下列有关溶液的说法正确的是( A 均一、稳定的液体都是溶液B 在其他条件不变时,氮气的溶解度随着压强的升高而减小C 饱和溶液一定比不饱和溶液浓D 餐具上的油污可利用洗涤剂的乳化功能将其洗去固体的溶解、MgSO4KCl年江苏扬州,(201218题,2分)右图是NaCl、度曲线图,下列说法正确的是溶液A 60℃三种物质的饱和溶液中,溶质质量分数最大的是KCl ℃不饱和的MgSO4℃,一定能得到起饱和溶液降温至40将B 80 NaCl溶解度比小C 40℃时MgSO4 KCl饱和溶液降温至20晶体℃,可得到KCl的℃含有少量将D 80NaCl分)右图是甲、乙两物质的溶解度曲线图,题,年湖南株洲,(2012192 下列说法错误的是大全.实用文档t3 t2 t1 0℃温度/℃,根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量, t2分)(2012年贵州铜仁,9题,绘制成下图中斜线.下列说法正确是.该物质的溶解度随温度的升高而增大A40℃时该物质的溶解度为.tB %点表示溶液中溶质的质量分数为20C.Gw=z m<4个点表示的溶液中溶质质量分数的关系是:G<D.图中,℃的水溶解一定量的NaCl分)某同学用2521.(2012年四川眉山,12题,然后该同学又用酒精灯NaCl晶体没有溶解。
2012 届中考化学溶液知识点总结第九单元《溶液》知识点一、溶液的形成1、溶液(1)溶液的观点:一种或几种物质分别到另一种物质里形成的均一的、稳固的混淆物,叫做溶液(2)溶液的基本特点:均一性、稳固性的混淆物注意: a、溶液不必定无色,如 cuSo4 为蓝色 FeSo4为浅绿色 Fe2(So4)3 为黄色b、溶质能够是固体、液体或气体;水是最常用的溶剂c、溶液的质量 =溶质的质量 +溶剂的质量溶液的体积≠溶质的体积 +溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)固体、气体溶于液体,液体为溶剂2、溶质和溶剂的判断有水,水为溶剂,液体溶于液体无水,量多的为溶剂3、饱和溶液、不饱和溶液(1)观点:(2)判断方法:看有无不溶物或持续加入该溶质,看可否溶解(3)饱和溶液和不饱和溶液之间的转变注:① ca(oH)2随和体等除外,它的溶解度随温度高升而降低②最靠谱的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不必定是浓溶液②不饱和溶液不必定是稀溶液,如饱和的石灰水溶液就是稀溶液③在必定温度时,同一种溶质的饱和溶液必定要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如 NH4No3溶解溶解放热:如 NaoH溶解、浓 H2So4溶解溶解没有显然热现象:如 Nacl二、溶解度1、固体的溶解度( 1)溶解度定义:在必定温度下,某固态物质在 100g 溶剂里达到饱和状态时所溶解的质量四因素:①条件:必定温度②标准:100g 溶剂③状态:达到饱和④质量:单位:克( 2)溶解度的含义:20℃时 Nacl 的溶液度为 36g 含义:在 20℃时,在100 克水中最多能溶解36 克 Nacl或在 20℃时, Nacl 在 100 克水中达到饱和状态时所溶解的质量为 36 克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度大部分固体物的溶解度随温度高升而高升;如No3少量固体物质的溶解度受温度的影响很小;如Nacl很少量物质溶解度随温度高升而降低。
2012年中考化学真题精品解析分类汇编:考点12 溶质质量分数一、选择题1.(2012年江苏盐城,15题,2分)酒精(C2H5OH)的某种水溶液,溶质和溶剂中氢原子个数相等,则该溶液中溶质的质量分数为A.23% B.46% C.55% D.72%2.(2012年湖南衡阳,15题,2分)将80g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为A.80gB.100gC.200gD.280g3. (2012年广东肇庆,13题,2分)一种抗生素为粉末状固体,每瓶含0.5g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水()A.1.5mLB.2mLC.3mLD.4mL4.(2012年湖北恩施,17题,2分)下列选项为配制50g溶质质量分数为5%的氯化钠溶液的步骤,其先后顺序准确的是A.称量—计算—溶解—转液贴签B.计算—称量—溶解—转液贴签C.计算—称量—转液贴签—溶解D.计算—溶解—称量—转液贴签二、填空、简答题1.(2012年甘肃兰州,31题,4分)根据右图中a、b|、c三种物质的溶解度曲线,回答下列问题:(1)P点表示在t1℃两物质的溶解度关系为a c(填“>”或者“<”或者“=”)。
(2)t2℃时,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为。
(3)t2℃时,50gb物质加入到50g水中充分溶解后,所得溶液的质量为。
(4)b中含有少量的a,若要提纯b,可采用结晶的方法。
2.(2012年四川眉山,19题,4分)汽车、电动车一般使用铅酸蓄电池。
某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸。
请回答下列相关问题:(1)若用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为 ml(精确到0.1);(2)该实验的主要步骤有计算、量取、稀释配制、装瓶并贴标签。
请填写右侧的标签........;(3)用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数____ 20%(填“大于”、“小于”或“等于”)。
第九单元溶液一、主要知识点一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性的混合物注意:a、溶液不一定无色,如CuSO4为蓝色FeSO4为浅绿色Fe2(SO4)3为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量= 溶质的质量+ 溶剂的质量溶液的体积≠溶质的体积+ 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)2、溶质和溶剂的判断:(1)固体、气体溶于液体,液体为溶剂(2)有水,水为溶剂(3)液体溶于液体,看定义(4)无水,量多的为溶剂3、饱和溶液、不饱和溶液(1)概念:(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解(3)饱和溶液和不饱和溶液之间的转化注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl二、溶解度1、固体的溶解度(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克(2)溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。
中考复习----溶液专题1.根据你对溶液组成的认识,判断下列说法正确的是( ) A.溶液的质量等于溶质与溶剂的质量之和B.20 mL 浓硫酸与80 mL 水相混合后得到100 mL 稀硫酸C.20 g 氯化钠完全溶解于100 g 水中,所得溶液的质量分数为20%D.20 mL 酒精放入盛有80 mL 水的烧杯中,所得酒精溶液的质量分数为20%2.40 ℃时,200 g 硝酸钾饱和溶液,蒸发掉20 g 水后,仍然冷却到40 ℃,则蒸发前后保持不变的是( )①溶液的质量;②溶液中溶质的质量分数;③溶剂的质量;④溶质的质量;⑤硝酸钾的溶解度A.①②B.②③C.②⑤D.②④ 3.要配制质量分数为20%的硫酸溶液,需用质量分数分别为60%、10%的硫酸溶液的质量比为( )A.1∶3B.1∶5C.1∶6D.1∶4 4.在化学学习中,经常会遇到“1+1≠2”的有趣现象。
下列选项符合此现象的是( ) A.n 个N 2与n 个O 2混合后得到的分子总数 B.100 mL 酒精与100 mL 水混合后溶液的体积 C.1 g 饱和食盐水中加1 g 水后所得溶液的质量D.1 g 氢氧化钠稀溶液和1 g 稀硫酸溶液混合后所得溶液的质量 5.下列说法正确的是 ( ) A.碘酒中的溶剂是水B.把食用油放入水里,并用力振荡,食用油是溶质C.高锰酸钾放入水中,生成紫色溶液D.将少量氯化钠放入水中溶解,溶质是氯化钠6.将M 克食盐溶液蒸发掉全部水得食盐m 克,则M 克食盐溶液中溶质的质量分数为( )A.M m ×100%B.m M m-×100% C.m M m +×100% D.Mm 100×100%7.用密度为1.03 g·cm-3,质量分数为5%的食盐溶液配制成50 g质量分数为1%的食盐溶液,其操作顺序为( )A.量取→溶解→计算B.称量→溶解→计算C.计算→称量→溶解D.计算→量取→溶解8.在实验操作中如果不慎将浓硫酸沾到皮肤上,应立即用布擦拭并用大量的水冲洗,然后涂上4%左右的碳酸氢钠溶液。
配制200 g质量分数为4%的碳酸氢钠溶液,需要碳酸氢钠的质量为( )A.4 gB.8 gC.192 gD.200 g 9.家用漂白水的主要成分是次氯酸钠,其浓度大小直接影响漂白水杀灭病菌的效能。
已知将含5%次氯酸钠的漂白水和水以1∶99的比例稀释后,用于家居消毒效果最佳。
若某同学购买的漂白水中次氯酸钠含量为2.5%,则此漂白水的最佳稀释方案应为(由于漂白水的溶质质量分数很小,其密度可近似看成1g/cm3)( )A.0.5∶99 B.0.5∶99.5 C.1∶49 D.1∶49.510. 镁、锌、铁的混合物50g与足量的硫酸铜溶液反应得到混合溶液,蒸干后得到218g固体(不含结晶水),则反应产生的铜质量为A. 133gB. 112gC. 57.1gD. 49.2g11.烧杯中盛有溶质质量分数一定的NaCl溶液,溶液全部倒出后,用蒸馏水洗涤2次,每次用20 mL蒸馏水,若烧杯内每次残留0.5 mL溶液,经2次洗涤后烧杯内残留的NaCl 溶液中溶质的质量分数约为原NaCl溶液的(NaCl溶液的密度均按1 g/cm3计算)A.1/81 B.1/400 C.1/820 D.1/168112.甲、乙两种固体的溶解度曲线如右图所示。
下列说法中,正确的是A.20℃时,甲溶液中溶质的质量分数一定大于乙溶液B.40℃时,分别在100 g水中加入50 g 甲、乙,所得溶液溶质的质量分数相等C.40℃时,分别在100 g水中加入30 g 甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液D.20℃时,分别在100 g水中加入40 g 甲、乙,加热到40℃时,甲溶液为饱和溶液A.甲的溶解度随温度变化比乙小B.t2℃时甲的饱和溶液的溶质质量分数小于30%C.t1℃时,甲、乙饱和溶液的溶质质量分数不相等D.可采用降低温度的方法使乙的饱和溶液变为不饱和溶液14.根据右图的溶解度曲线判断,下列说法错误..的是A50℃时A物质的溶解度最大B升温可使C物质的不饱和溶液变饱和C50℃时把90gA物质放入100g水中能得到190g溶液D将50℃三种物质的饱和溶液分别降温到20℃时,B溶液最浓15.右图表示M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是A.30℃时M的溶解度小于N的溶解度B.P点表示t℃时M、N的溶解度相等C.M、N都是难溶物质D.阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液16.t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成下图中的斜线。
下列说法正确的是( )A.该物质的溶解度随温度的升高而增大B.t℃时该物质的溶解度为50C.图中4个点表示的溶液中溶质质量分数的关系是:n<m<W=ZD.n点表示溶液中溶质的质量分数为25%17.常温下,在两个各盛有100 mL水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如下图所示。
下列说法中正确的是( )A.甲溶液是不饱和溶液B.常温下,甲、乙两种物质的溶解度相同C.升高温度,剩余的甲固体一定能继续溶解D.乙溶液可能是饱和溶液,也可能是不饱和溶液A .T 1℃时,甲的溶解度小于乙B .T 2℃时,100 g 甲的饱和溶液中含有60 g 甲物质C .T 1℃时,取60 g 甲和60 g 乙分别加入50 g 水中,二者均可得到饱和溶液D .T 2℃时,将等质量甲、乙的饱和溶液降温至T 1℃,析出甲物质质量大于乙19.甲、乙两物质的溶解度曲线如右图所示。
下列叙述中,正确的是A.t 1℃时,甲和乙的溶解度均为40B. t 2℃时,甲和乙的饱和溶液中溶质质量分数相等C. 从0℃至t 1℃时,甲物质的溶解度大于乙物质的溶解度D. t 2℃时, 分别在100 g 水中各溶解20 g 甲、乙, 同时降低温度,甲先达到饱和20.t ℃时,向10 g 水中逐渐加入硝酸钾晶体至饱和,则此过程中该溶液满足下图a 、b 两个变量的变化关系的是 A.a-溶解度, b -溶质质量 B.a -溶质的质量分数,b -溶质质量C.a -溶质质量, b -溶剂质量D.a -溶解度, b -溶剂质量21.向100g 水中不断加入固体A 或改变温度,得到相应的溶液①~⑤。
下列说法正确的是①②③④⑤A .②中A 的质量分数最大B .③⑤中A 的质量分数相等C .②④⑤的溶液为饱和溶液D .①③④⑤中没有固体存在22.右图是a 、b 、c 三种物质的溶解度曲线,下列说法正确的是A .a 的溶解度一定小于b 的溶解度B .c 可能是熟石灰的溶解度曲线C .40℃时,a 、b 两种物质的饱和溶液中溶质的质量分数相同D .三种物质的饱和溶液分别从40℃降温到20℃,a 、b 析出的晶体质量相等甲乙溶解度 g0 t 1 t 2 温度/℃30 50 20 40 1023.若甲能与水反应,将少量甲加到饱和石灰水中,溶液变浑浊,则下列说法正确的是_____(填字母序号)。
A.甲一定是二氧化碳B.反应后溶质的质量一定减小C.反应前后溶剂的质量保持不变D.反应前后溶液中溶质的质量分数可能不变24.右图是某反应的微观示意图。
从微观粒子变化......的角度...分析该反应的实质是_____。
若两者恰好完全反应,所得溶液中溶质的质量分数为10%,则此溶液中钠离子与水分子的个数比为_____(结果用最简整数比表示)。
25.海水晒盐能够得到粗盐和卤水。
卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。
t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是。
将t1℃的MgCl2、KCl和MgSO4三种物质的饱和溶液加热到t2℃以上时,可能会析出晶体。
26.水是一种最常用的溶剂。
在A、B、C、D四个烧杯中分别装有等量的水,在t℃时,向A、B、C烧杯中分别加入25g、15g、5g甲物质,向D烧杯加入25g 乙物质,充分溶解后,静置,现象如下图1所示。
回答下列问题:①在图1四个烧杯的溶液中,(填“A”、“B”、“C”或“D”,下同)烧杯中的溶液一定是饱和溶液。
②图2分别为两种物质的溶解度曲线,其中可表示乙物质的是(填“a”或“b”);要使A烧杯中剩余固体继续溶解,可采用的方法是。
③室温下,将一瓶a溶液敞口放置一段时间,溶质质量分数由5%变了10%,放置前后溶液中所含水(溶剂)的质量比为。
27.下图为氯化铵和硫酸钠的溶解度曲线,当把相同质量的氯化铵和硫酸钠的饱和溶液从50℃降到20℃时,析出晶体最多的是。
(5)在40℃时取两份100 g水分别往加入50克氯化铵和50克硫酸钠,充分搅拌后,升温到60℃,下列说法正确的是。
A.40℃时,两溶液均为饱和溶液B.40℃时,两溶液质质量分数相等C.50℃时.两溶液仍为饱和溶液D.60℃时,硫酸钠溶液仍为饱和溶液,氯化铵溶液为不饱和溶液E.60℃时,两溶液溶质质量分数相等F.60℃时,两溶液中溶质质量分数不相等28.请根据图7中A、B两种固体物质的溶解度曲线,回答下列问题。
(l)在____℃时,A、B两种物质溶解度相同。
(2) t2℃时,100g水中溶解_ gA物质恰好达到饱和,该饱和溶液中溶质的质量分数为_ ___,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水g。
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是___ _。
29.(8分)溶液在生产和生活中具有重要意义。
(1)碘.酒溶液中的溶质是______,溶剂是______。
(2)用含有洗涤剂的水可以将餐具上的油滴清洗干净的原因是______(填序号)。
①油滴可以溶解于水②洗涤剂有乳化功能③洗涤剂有吸附作用(3)将10 g 98%的硫酸溶液(体积约为5 mL)加入到90 g水(体积为90 mL)中,则所得硫酸溶液的质量分数为______,按上述要求配制好溶液后,实际测得溶液的体积小于95 mL,配制前后溶液体积并不守恒,其原因是______。
(4)将甲、乙两固体溶解于水中,其溶解度曲线如图所示。
①t 2℃时,甲物质的溶解度为______g 。
②t 1℃时,甲物质饱和溶液的质量分数______(填“>”“<”或“=”)乙物质饱和溶液的质量分数。
③要从甲物质的溶液中提取甲,可采用______的方法。
30.(共4分)下列数据是四种固体物质在20℃时的溶解度。
(1)20℃时,分别向盛有100 g 水的四个烧杯中加入34.0 g 上述四种物质,充分溶解后,一定能得到饱和溶液的是 (填化学式)。
(2)质量分数为25%的氯化钠溶液,其溶质与溶剂的质量比为 。