突破键角大小的比较
- 格式:pdf
- 大小:343.02 KB
- 文档页数:2

分子(或离子)中键角大小的比较史永鑫(安徽师范大学附属中学ꎬ安徽芜湖241001)摘㊀要:从分子中电子对之间斥力角度分析ꎬ归纳总结了共价分子或离子中键角大小的比较方法.关键词:分子ꎻ键角大小ꎻ高中化学中图分类号:G632㊀㊀㊀文献标识码:A㊀㊀㊀文章编号:1008-0333(2023)10-0144-02收稿日期:2023-01-05作者简介:史永鑫ꎬ男ꎬ硕士ꎬ中学高级教师ꎬ从事高中化学教学研究.㊀㊀在多原子分子中ꎬ两个相邻共价键之间的夹角称为键角.多原子分子的键角一定ꎬ表明共价键具有方向性.键角是描述分子空间结构的重要参数ꎬ分子的许多性质都与键角有关.本文对分子或离子中键角大小的比较方法进行了归纳总结和整理.1直接通过分子结构判断键角:直线形分子>平面正三角形分子>正四面体形分子>三角锥形分子.如CO2直线形分子ꎬ键角180ʎꎻBF3平面正三角形分子ꎬ键角120ʎꎻCH4正四面体形分子ꎬ键角109ʎ28ᶄꎬNH3三角锥形ꎬ键角107ʎ18ᶄ.例1㊀(2022年湖南高考节选)铁和硒(Se)都是人体所必需的微量元素ꎬ且在医药㊁催化㊁材料等领域有广泛应用.比较键角大小:气态SeO3分子SeO2-3(填 > < 或 = )ꎬ原因是.解析㊀SeO3的空间构型为平面三角形ꎬ键角120ʎꎻSeO2-3的空间构型为三角锥形ꎬ键角小于109ʎ28ᶄ.答案:>㊀SeO3的空间构型为平面三角形ꎬSeO2-3的空间构型为三角锥形.例2㊀意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子ꎬ其分子结构如图1所示ꎬ则N4分子中键角为.图1解析㊀由图1可知N4分子为封闭的正四面体形分子ꎬ每个面均为正三角形ꎬ显然N4分子中键角为60ʎ.答案:60ʎ.2通过电子对之间斥力大小判断电子对之间斥力越大ꎬ相互之间形成的角度就越大.电子对之间斥力规律如下:(1)孤电子对 孤电子对>孤电子对 成键电子对>成键电子对 成键电子对ꎮ例3㊀(2021年全国乙卷节选)过渡金属元素铬(Cr)是不锈钢的重要成分ꎬ在工农业生产和国防建设中有着广泛应用.[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3㊁H2O以及分子PH3的空间结构和相441应的键角如图2所示.回答下列问题:图2H2O的键角小于NH3的ꎬ分析原因.解析㊀NH3含有一对孤电子对ꎬ而H2O含有两对孤电子对.由孤电子对 孤电子对>孤电子对 成键电子对>成键电子对 成键电子对可知ꎬH2O中的孤电子对对成键电子对的排斥作用较大ꎬ故H2O的键角小于NH3的.答案:略.例4㊀NH3与Zn2+可形成[Zn(NH3)6]2+ꎬ其部分结构如图3所示.图3已知NH3分子中H N H键角为107ʎꎬ判断[Zn(NH3)6]2+中H N H键角(填 > ㊁< 或 = )107ʎ.解析㊀NH3中氮原子含有一对孤电子对ꎬ而[Zn(NH3)6]2+中氮原子没有孤电子对ꎬ由孤电子对 成键电子对>成键电子对 成键电子对可知ꎬ[Zn(NH3)6]2+中H N H键角大于107ʎ.答案:>.(2)共价键:三键 三键>三键 双键>双键 双键>双键 单键>单键 单键.例5㊀已知亚硫酰溴分子结构如图4所示.图4请推测亚硫酰溴分子中键角大小:键角O S Br(填 > ㊁ < 或 = )键角Br S Br.解析㊀亚硫酰溴分子中硫氧键为双键(SO )ꎬ硫溴键为单键(S Br)ꎬ根据斥力大小:双键 单键>单键 单键可知ꎬ键角O S Br大于键角Br S Br.答案:>.(3)对于配位原子而言ꎬ弱电负性-弱电负性>弱电负性-强电负性>强电负性-强电负性.例6㊀根据VSEPR模型可知氯化硫酰(SO2Cl2)分子和氟化硫酰(SO2F2)分子均为畸变四面体结构.则SO2Cl2分子中键角Cl S Cl(填> ㊁ < 或 = )SO2F2分子中键角F S F.解析㊀对于四面体分子SO2Cl2和SO2F2ꎬ中心原子均为Sꎬ配位原子分别为O㊁Cl和O㊁Fꎬ由于电负性F>Clꎬ根据斥力大小:弱电负性-弱电负性>强电负性-强电负性可知ꎬSO2Cl2分子中键角Cl S Cl大于SO2F2分子中键角F S Fꎬ(实测值键角Cl S Cl为102ʎꎬ角F S F为98ʎ).答案:>.(4)对于中心原子而言ꎬ电负性大的成键电子对之间的斥力>电负性小的成键电子对之间的斥力.例7㊀(2020年山东高考节选)CdSnAs2是一种高迁移率的新型热电材料ꎬ回答问题:NH3㊁PH3㊁AsH3的键角由大到小的顺序为.解析㊀NH3㊁PH3㊁AsH3中心原子都是sp3杂化ꎬ都有1对孤电子对ꎬ中心原子的电负性越小ꎬ成键电子对之间的斥力越小ꎬ键角越小ꎬ所以这三种物质键角由大到小的顺序为NH3>PH3>AsH3.答案:NH3㊁PH3㊁AsH3.参考文献:[1]人民教育出版社ꎬ课程教材研究所.普通高中教科书 化学 选择性必修2[M].北京:人民教育出版社ꎬ2020.[2]北京师范大学ꎬ华中师范大学ꎬ南京师范大学.无机化学上册(第四版)[M].北京:高等教育出版社ꎬ2002.[责任编辑:季春阳]541。

研究高考题多了,你就会发现高考的题目虽年年换着新装但是其内在的姑娘却依然是以前的那个你熟悉的伊人。
从而要想在高考中获得高分,不在于研究高考题目的变化而在于掌握哪些永恒不变的知识点的本身,掌握好了知识点不管其外衣如何花枝招展最后我们都能准确的得到准确的答案。
今天我们就来解析高考中有关物质键角大小比较的题目,抓住其核心要点总结规律以准确拿全这一知识点的分。
如果时间紧急可直接拉到第三点答题规律部分。
一、考点考察方式物质键角大小比较的考察在高考化学中常常出现于在化学选做题的物质组成与结构即选三的选做题,分值在两分左右。
物质键角大小的比较考察方式大多是直接给你一个物质并告诉谁的键角比较大,让学生写出相关的原因;比较少的但是曾经考察过的是在选择题中判断物质键角的大小。
我们先来看看高考中物质键角大小比较的常见考题。
1、CH4的键角大于 NH3的原因为:【答】CH4中都是 C-H 单键,键与键之间的排斥力一样,所以是正四面体 109.5 。
,而 NH3有未成键的孤对电子,孤对电子间的排斥力>孤对电子对化学键的排斥力>化学键间的排斥力,所以NH3的键角要小于没有孤对电子排斥的 CH4的键角.而孤对电子越多,排斥力越大。
2、NF3的键角小于 NH3键角的原因为:【答】F的电负性比 H的大,NF3中N上的孤对电子更靠近原子核,从而使孤对电子对成键电子对的排斥力更大。
3、高温陶瓷材料 Si3N4晶体中键角N—Si—N >Si—N—Si(填“>”“<”“=”),原因是:【答】N原子上有孤电子对,由于孤电子对与成键电子对的排斥力更大,使得 Si—N—Si 键角较小。
4、两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为 93.6o和 107o,试分析 PH3的键角小于 NH3的原因:【答】电负性N 强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的斥力增大,键角变大。

比较键角大小的方法
好的,我将为您编写一篇关于比较键角大小的方法的文章。
键角是指在化学分子模型中两个原子键之间的夹角。
这个角度对于分子的性质有很大的影响,因此在化学研究中经常会用到。
如何比较键角的大小呢?我们可以使用以下方法之一来进行比较:
1.使用数学规则
我们可以使用数学规则来比较键角的大小。
例如,我们可以使用余弦定理来比较两个键角的大小。
我们还可以使用三角函数来比较键角的大小。
这种方法的优点在于,它可以提供精确的结果,并且易于计算。
2.使用经验法则
我们还可以使用经验法则来比较键角的大小。
例如,我们可以使用“规则60度”,即认为大多数分子中的键角都在60度左右。
我们还可以使用“规则109度”,即认为大多数分子中的三角形键角都在109度左右。
这种方法的优点在于,它简单易懂,但是结果可能不够精确。
3.使用计算机软件
我们还可以使用计算机软件来比较键角的大小。
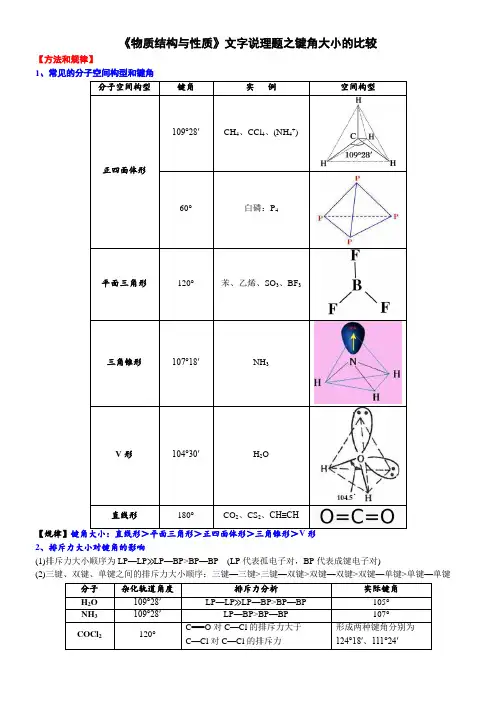
《物质结构与性质》文字说理题之键角大小的比较【方法和规律】1、常见的分子空间构型和键角分子空间构型键角实例空间构型正四面体形109°28′CH4、CCl4、(NH4+)60°白磷:P4平面三角形120°苯、乙烯、SO3、BF3三角锥形107°18′NH3V形104°30′H2O直线形180°CO2、CS2、CH≡CH【规律】2、排斥力大小对键角的影响(1)排斥力大小顺序为LP—LP≫LP—BP>BP—BP (LP代表孤电子对,BP代表成键电子对)(2)三键、双键、单键之间的排斥力大小顺序:三键—三键>三键—双键>双键—双键>双键—单键>单键—单键分子杂化轨道角度排斥力分析实际键角H2O 109°28′LP—LP≫LP—BP>BP—BP 105°NH3109°28′LP—BP>BP—BP 107°COCl2120°C===O对C—Cl的排斥力大于C—Cl对C—Cl的排斥力形成两种键角分别为124°18′、111°24′【例题精讲】电子对构型(或杂化方式)不相同,空间构型也不相同答题策略键角大小:直线形>平面三角形>正四面体形>三角锥形>V形答题模板×××中心原子采取×××杂化,键角为×××,而×××中心原子采取×××杂化,键角为×××1Si与C元素位于同一主族,SiO2键角小于CO2的原因是:SiO2中心Si原子采用SP3杂化,键角109°28';CO2中心C原子采用sp杂化,键角为180°电子对构型(或杂化方式)相同,但空间构型不相同(看排斥力) 答题策略①排斥力大小顺序为LP—LP≫LP—BP>BP—BP (LP代表孤电子对,BP代表成键电子对)②三键、双键、单键之间的排斥力大小顺序:三键—三键>三键—双键>双键—双键>双键—单键>单键—单键答题模板孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力,×××分子中无孤对电子,×××分子中含有1对孤对电子,×××分子中含有2对孤对电子,对成键电子对的排斥作用依次增大,故键角逐渐减小2已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是CH4>NH3>H2O,原因为:孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力,CH4分子中无孤对电子,NH3分子中含有1对孤对电子,H2O分子中含有2对孤对电子,对成键电子对的排斥作用依次增大,故键角逐渐减小空间构型相同,中心原子相同或配位原子相同答题策略看中心原子或配位原子的电负性答题模板中心原子不同,配位原子相同(AC3与BC3,且电负性A>B,键角:AC3>BC3):中心原子的电负性A强于B,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的斥力增大,键角变大中心原子相同,配位原子不同(AB3与AC3,且电负性B>A>C,键角:AB3<AC3):电负性B>A>C,在AB3中成键电子对离中心原子较远,成键电子对之间的排斥力较小,因而键角较小3NH3的键角>PH3的键角,原因是:中心原子的电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的斥力增大,键角变大4NF3的键角小于NH3的键角,理由是:F的电负性比H大,NF3中成键电子对离中心原子较远,成键电子对之间的排斥力较小,因而键角较小1、H3BO3分子中的O—B—O 的键角(填“大于”、“等于”或“小于”) BH4-中的H—B—H 的键角,判断依据是2、SeO42—中Se—O的键角比SeO3的键角____(填“大”或“小”),原因是__________________________________ _____________________________________________________________________________________________3、高温陶瓷材料Si3N4晶体中键角N—Si—N______Si—N—Si,原因是______________________________ _______________________________________________________________________________________________4、NH3分子在独立存在时H—N—H键角为107°。

比较不同物质间的键角大小影响键角大小的因素:一是中心原子的杂化类型;二是中心原子的孤对电子数;三是中心原子的电负性大小。
1.利用常见物质分子的空间构型,直接判断键角大小。
案例1:CO2为直线形(sp杂化)、BF3为平面三角形(sp2杂化)、CH4为正四面体形(sp3杂化)、NH3为三角锥形(sp3杂化)、H2O为V形(sp3杂化)、P4为正四面体形(sp3杂化)等,则键角依次为:180°、120°、109.5°、107.3°、104.5°、60°。
任取其中不同物质均可比较键角大小。
说明:CH4与P4都是sp3杂化,但CH4的正四面体中心有C原子,P4的正四面体的体内空心,故二者键角有别。
CH4、NH3、H2O均为sp3杂化,但中心原子的孤电子对依次0、1、2对,根据价层电子对互斥理论,斥力为孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,孤电子对数增多,对成键电子的斥力增大,故三者键角依次减小。
案例2:乙炔C2H2为直线形(sp杂化)、苯C6H6为正六边形(sp2杂化),则分子中的键角分别为:180°、120°。
乙烯C2H4为平面形(sp2杂化),由于分子中存在不同共价键,键角不是120°;根据价层电子对互斥理论,知斥力为叄键-叄键>叄键-双键>双键-双键>双键-单键>单键-单键,C=C双键对C-H键形成较大的斥力,故C=C-H键角(122°)大于H-C-H键角(116°)。
2.利用周期表位置类比推测分子的空间构型,直接判断键角大小。
案例3:①CS2、CSO等类比CO2,直线形,键角均为:180°。
②BCl3、BBr3等与BF3类比,平面三角形,键角均为:120°。
③CF4、SiH4、SiF4等与CH4类比,正四面体形,键角均为:109.5°。

如何比较物质中的键角大小?含有共价键的物质中相邻两键之间的夹角称为键角。
键角是决定物质分子空间构型的主要因素之一。
根据价层电子对互斥理论的分析,在高中阶段学习中,影响键角大小的因素主要有三:一是中心原子的杂化类型;二是中心原子的孤电子对数;三是中心原子的电负性大小等。
现通过例说如何比较物质中的键角大小。
一、比较不同物质间的键角大小1.利用常见物质分子的空间构型,直接判断键角大小。
案例1:CO2为直线形(sp杂化)、180°BF3为平面三角形(sp2杂化)、120°CH4为正四面体形(sp3杂化)、109.5°NH3为三角锥形(sp3杂化)、07.3°H2O为V形(sp3杂化)、104.5°P4为正四面体形(sp3杂化) 60°说明:CH4与P4都是sp3杂化,但CH4的正四面体中心有C原子,P4的正四面体的体内空心,故二者键角有别。
CH4、NH3、H2O均为sp3杂化,但中心原子的孤电子对依次0、1、2对,根据价层电子对互斥理论,斥力为孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,孤电子对数增多,对成键电子的斥力增大,故三者键角依次减小。
案例2:乙炔C2H2为直线形(sp杂化)、180°苯C6H6为正六边形(sp2杂化),120°乙烯C2H4为平面形(sp2杂化),由于分子中存在不同共价键,键角不是120°;根据价层电子对互斥理论,知斥力为叄键-叄键>叄键-双键>双键-双键>双键-单键>单键-单键,C=C双键对C-H键形成较大的斥力,故C=C-H键角(122°)大于H-C-H键角(116°)。
2.利用周期表位置类比推测分子的空间构型,直接判断键角大小。
案例3:①CS2、CSO等类比CO2,直线形,键角均为:180°。
②BCl3、BBr3等与BF3类比,平面三角形,键角均为:120°。

学生疑问:1、为什么NH3的键角是107°, NF3的键角是102.5°?答题思考方向-------配原子电负性对键角的影响,相邻的两个成键电子对远离中心原子时、相互间的斥力会变小。
2、为什么NH3的键角是107°, PH3的键角是93.6°?答题思考方向------中心原子电负性对键角的影响,成键电子对更靠近中心原子,成键电子对间的斥力要变大,老师归纳:影响分子中键角大小的因素键角为某原子与另两个原子所成共价键间的夹角。
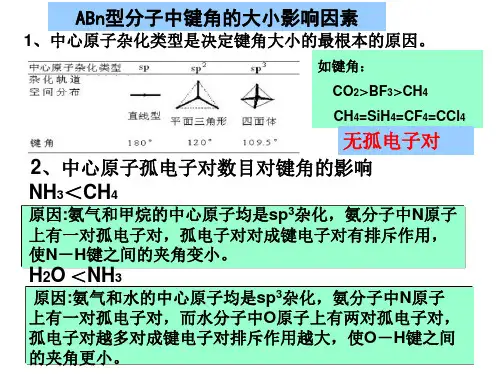
一、中心原子杂化类型对键角大小有决定性的影响中心原子杂化类式是决定键角大小的最根本的原因。
上表由前(左)到后(右)的顺序就基本是一个键角逐渐减小的顺序。
例1,对CH4、BF3、CO2这一分子序列,中心原子分别为sp3、sp2和sp杂化,它们对应的键角为109°28′、120°、180°,键角会依次增大。
二、中心原子孤电子对数目对键角的影响由于中心原子的孤对电子的电子云肥大,对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小。
且中心原子的孤电子对数越多,键角会变得越小[2]。
例2,对H2O、NH3、CH4分子系列。
这3个分子的中心原子采取的都是sp3角要受2个孤电子对的压缩,键角应该会最小。
这就导致出推断:该序列是一个键角逐渐增大的序列。
可查得它们的键角分别是104.5°、107.1°、109.5°。
三、配原子电负性对键角的影响当同一种原子中心原子种类相同、杂化类型也相同,而配原子种类不同时,由于配原子的电负性不同,会使键角有区别。
因为当相邻的两个成键电子对更靠近中心原子时、相互间的斥力会增大。
反之,当相邻的两个成键电子对远离近中心原子时、相互间的斥力会变小。
例3,将NF3与NH3比较,中心原子都是N原子、且都为sp3杂化,但因为F原子的电负性大于H原子,使成键电子离N原子更远,两个N-F键间的斥力减小、可以靠的更近,所以其键角更小。

化学键键角的大小判断依据
化学键键角的大小是由分子中的原子间的排斥和吸引力相互作
用决定的。
键角的大小直接影响着分子的几何构型和化学性质。
在
分子中,原子之间的键角可以通过实验和计算得到。
一般来说,键
角的大小受到以下几个因素的影响:
1. 杂化轨道,原子的杂化轨道决定了键角的大小。
sp3杂化的
原子通常形成109.5°的键角,而sp2杂化的原子通常形成120°的
键角,sp杂化的原子通常形成180°的键角。
2. 电子对排斥,孤对电子对原子之间的键角有排斥作用,使得
键角变大。
这是由于孤对电子的排斥力比化学键的吸引力要大。
3. 双键和三键,双键和三键中的π键会使得键角变小,因为
π键的存在会使得原子间的排斥力减小,从而减小键角。
4. 电负性差异,原子间的电负性差异也会影响键角的大小。
当
两个原子的电负性相近时,键角通常较大;而当电负性差异较大时,键角通常较小。
总的来说,化学键键角的大小是由原子之间的排斥和吸引力相互作用所决定的,这些因素共同影响着分子的结构和性质。
通过对键角的研究,我们可以更好地理解分子的构型和化学行为,为化学领域的研究和应用提供重要的依据。

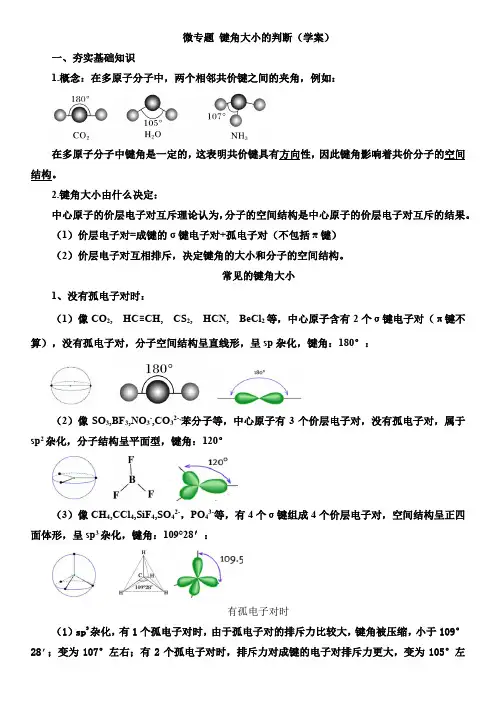
微专题键角大小的判断(学案)一、夯实基础知识1.概念:在多原子分子中,两个相邻共价键之间的夹角,例如:在多原子分子中键角是一定的,这表明共价键具有方向性,因此键角影响着共价分子的空间结构。
2.键角大小由什么决定:中心原子的价层电子对互斥理论认为,分子的空间结构是中心原子的价层电子对互斥的结果。
(1)价层电子对=成键的σ键电子对+孤电子对(不包括π键)(2)价层电子对互相排斥,决定键角的大小和分子的空间结构。
常见的键角大小1、没有孤电子对时:(1)像CO2, HC≡CH, CS2, HCN, BeCl2等,中心原子含有2个σ键电子对(π键不算),没有孤电子对,分子空间结构呈直线形,呈sp杂化,键角:180°:(2)像SO3,BF3,NO3-,CO32-,苯分子等,中心原子有3个价层电子对,没有孤电子对,属于sp2杂化,分子结构呈平面型,键角:120°(3)像CH4,CCl4,SiF4,SO42-,PO43-等,有4个σ键组成4个价层电子对,空间结构呈正四面体形,呈sp3杂化,键角:109°28′:有孤电子对时(1)sp3杂化,有1个孤电子对时,由于孤电子对的排斥力比较大,键角被压缩,小于109°28’;变为107°左右;有2个孤电子对时,排斥力对成键的电子对排斥力更大,变为105°左右CH 4:109°28′ NH 3:107° H 2O :105° (2)sp 2杂化,有1个孤电子对时,由于孤电子对的排斥力比较大,键角被压缩,小于120°,如:小结:常见典型的键角二、回眸经典案例【典例1】:白磷和甲烷均为正四面体结构它们的键角是否相同,为什么?【答】不同,白磷分子的键角是指P —P 之间的夹角,为60°;而甲烷分子的键角是指C —H 的夹角,为109°28′。
【典例2】:氨分子、水分子、甲烷分子中共价键的键角分别为a 、b 、c ,则a 、b 、c 的大小关系为( )A .a<b<cB .c<b<aC .b<c<aD .b<a<c【答案】 D【解析】 甲烷分子中含有4个成键电子对,NH 3分子中含有1个孤电子对,3个成键电子对;H 2O 分子中含有2个孤电子对,2个成键电子对。
共价化合物键角大小的比较
共价化合物是由不同原子通过共用电子对形成的化合物。
在共价化合物中,原子之间的键角大小会影响化合物的性质和结构。
本文将会比较一些常见的共价化合物的键角大小。
一般来说,共价化合物中的键角大小受到如下因素的影响:原子的电子云密度、原子的电负性和原子的杂化状态。
其中,电子云密度越大,原子之间的键角越小;电负性越大,原子之间的键角越大;杂化状态不同,原子间的键角也会有所不同。
例如,氨分子(NH3)中,氮原子的杂化状态为sp3,电子云密度较大,因此氮原子与三个氢原子的键角大小大约为107度。
而在水分子(H2O)中,氧原子的杂化状态为sp3,电子云密度也较大,但氧原子的电负性比氮原子大,因此水分子中氧原子与两个氢原子的键角大小约为104.5度。
另外,共价化合物中的键角大小也会受到分子的对称性影响。
例如,四氟化硅(SiF4)中硅原子的杂化状态为sp3,其四个氟原子的位置对称,因此四氟化硅的键角大小都相等,约为109.5度。
总之,共价化合物中的键角大小是由多种因素综合作用决定的。
对于化学研究和应用来说,了解不同化合物的键角大小对其性质和结构的影响具有重要意义。
- 1 -。
键角大小怎么比较? Document number:NOCG-YUNOO-BUYTT-UU986-1986UT影响分子中键角大小的因素键角为某原子与另两个原子所成共价键间的夹角。
一、中心原子杂化类型对键角大小有决定性的影响中心原子杂化类式是决定键角大小的最根本的原因。
上表由前(左)到后(右)的顺序就基本是一个键角逐渐减小的顺序。
例1,对CH4、BF3、CO2这一分子序列,中心原子分别为sp3、sp2和sp杂化,它们对应的键角为109°28′、120°、180°,键角会依次增大。
二、中心原子孤电子对数目对键角的影响由于中心原子的孤对电子的电子云肥大,对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小。
且中心原子的孤电子对数越多,键角会变得越小[2]。
例2,对H2O、NH3、CH4分子系列。
这3个分子的中心原子采取的都是sp3杂化,但孤电子对数不同。
其孤电子对数分别为2、1、0.。
在H2O分子中,键角要受2个孤电子对的压缩,键角应该会最小。
这就导致出推断:该序列是一个键角逐渐增大的序列。
可查得它们的键角分别是°、°、°。
三、配原子电负性对键角的影响当同一种原子中心原子种类相同、杂化类型也相同,而配原子种类不同时,由于配原子的电负性不同,会使键角有区别。
因为当相邻的两个成键电子对更靠近中心原子时、相互间的斥力会增大。
反之,当相邻的两个成键电子对远离近中心原子时、相互间的斥力会变小。
例3,将NF3与NH3比较,中心原子都是N原子、且都为sp3杂化,但因为F原子的电负性大于H原子,使成键电子离N原子更远,两个N-F键间的斥力减小、可以靠的更近,所以其键角更小。
实际上:NH3的键角是107°,NF3的键角是°.对常遇到的H2O与OF2分子的键角和极性比较,也可照上例来判断。
四、中心原子电负性对键角的影响当同主族中心原子种类不同,但杂化类型相同、且配原子种类相同时,中心原子的电负性大,成键电子对更靠近中心原子,成键电子对间的斥力要变大,键角要变大。
比较键角大小思维模型含有共价键的物质中相邻两键之间的夹角称为键角。
键角是决定物质分子空间构型的主要因素之一。
根据价层电子对互斥理论的分析,在高中阶段学习中,影响键角大小的因素主要有三:一是中心原子的杂化类型;二是中心原子的孤电子对数;三是中心原子的电负性大小等。
一、中心原子杂化类型对键角大小有决定性的影响【结论】杂化轨道类型不同:sp>sp2>sp3。
【练1】比较CH4、BF3、CO2键角大小:CH4<BF3<CO2说明理由:CH4、BF3、CO2分别为sp3、sp2、sp杂化,因此键角CH4<BF3<CO2【练2】比较CH4、P4键角大小:CH4>P4说明理由:CH4与P4都是sp3杂化,但CH4的正四面体中心有C原子,P4的正四面体的体内空心,P4键角为60O, CH4>P4【练3】①CS2、CSO、CO2键角大小为②BCl3、BBr3、BF3键角大小为③CF4、SiH4、SiF4、CH4键角大小为二、杂化类型相同时键角的影响因素(一)中心原子孤电子对数目对键角的影响由于中心原子的孤对电子的电子云肥大,对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小。
且中心原子的孤电子对数越多,键角会变得越小[2]。
【练4】,比较H2O、NH3、CH4键角大小:CH4>NH3>H2O理由:CH4、NH3、H2O均为sp3杂化,但中心原子的孤电子对依次0、1、2对,根据价层电子对互斥理论,斥力为孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,孤电子对数增多,对成键电子的斥力增大,故三者键角依次减小。
(二)配原子电负性对键角的影响当同一种原子中心原子种类相同、杂化类型也相同,而配原子种类不同时,由于配原子的电负性不同,会使键角有区别。
因为当相邻的两个成键电子对更靠近中心原子时、相互间的斥力会增大。
反之,当相邻的两个成键电子对远离近中心原子时、相互间的斥力会变小。
分子中键角大小比较的方法标题:分子中键角大小比较的方法及其应用摘要:本文将探讨分子中键角大小比较的方法,以帮助读者更深入地理解这一重要的概念。
我们将从基础知识开始,并逐渐深入到更高级的技术和应用。
通过总结和回顾性的内容,您将能够对这一主题有更全面、深刻和灵活的理解。
最后,本文将分享作者对这一概念的观点和理解。
引言:分子中的键角大小在化学领域中具有重要意义,它影响着分子的几何构型、化学反应和物理性质。
因此,准确比较分子中的键角大小对于理解和预测分子行为至关重要。
本文将介绍三种常用的方法来进行分子中键角大小的比较:几何角度、分子轨道理论和量化研究。
请随我一起进入这个有趣的领域。
一、几何角度方法几何角度方法是最简单直观的方法之一。
它通过测量分子中化学键的夹角来进行比较。
通过观察键的构型,我们可以估计键角的大小。
举个例子,对于单键和双键,一般情况下双键角度要小于单键角度。
虽然几何角度方法简单易用,但它并不能提供准确的定量数据,因此在分析复杂的分子结构时,其他方法更为可靠。
二、分子轨道理论方法分子轨道理论是一种基于量子力学的方法,用于描述分子中电子的行为。
通过计算分子轨道的能级和电子云的空间分布,我们可以推导出键角的大小。
在分子轨道理论中,主要有两种方法:LCAO(线性组合原子轨道)和MO(分子轨道)理论。
LCAO方法通过线性组合原子轨道来构建分子轨道,这种方法对于简单分子非常有效。
而MO理论则通过求解薛定谔方程得到分子轨道的波函数,更适用于复杂分子的计算。
分子轨道理论可以提供比几何角度更多的定量信息,因此在分子角度比较中被广泛使用。
三、量化研究方法量化研究方法是一种更为精确的方法,通过计算化学键的键能、键长和键振动频率等物理性质来比较键角大小。
这种方法可以利用量化计算软件,如密度泛函理论(DFT)等,来模拟和分析分子结构。
通过计算键角相关的物理性质,我们可以得到更精确的键角比较结果。
然而,值得注意的是,量化研究方法可能需要更高的计算能力和专业知识,并且在处理大型分子或复杂体系时可能会面临挑战。
键角大小的判断方法【方法与技巧】1.常见的分子(离子)空间构型和键角分子(离子)空间构型 键角 实例 空间构型正四面体形 109°28′ CH 4、CCl 4、NH 4+60° 白磷:P 4平面三角形 120° BF 3、SO 3、苯、乙烯三角锥形 107°18′ NH 3V 形 104.5° H 2O直线形 180° CO 2、CS 2、CH≡CH【规律】 键角大小:直线形>平面三角形>正四面体形>三角锥形>V 形2(1)排斥力大小顺序:LP -LP>LP -BP>BP -BP (LP 代表孤电子对,BP 代表成键电子对)(2)三键、双键、单键之间的排斥力大小顺序:三键-三键>三键-双键>双键-双键>双键-单键>单键-单键3.键角大小的判断方法(1)中心原子的杂化方式不同且中心原子无孤对电子——看中心原子杂化方式分子CO 2、CS 2 BF 3、SO 3 CH 4、NH 4+ 杂化方式sp(1800) sp 2(1200) sp 3(109028) 分子构型直线型 平面三角形 正四面体 键角 1800 1200 109028'(2)中心原子杂化方式相同且中心原子有孤对电子——看中心原子的孤电子对数排斥力大小顺序:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对,中心原子孤电子对数越多,对成键电子对的排斥力越大,键角越小分子CH4NH3H2O杂化方式sp3sp3sp3孤电子对数0 1 2键角109028'107018'104030'分子构型正四面体三角锥形V形(3)中心原子不同,配位原子及中心原子孤电子对数相同且结构相似——看中心原子的电负性:中心原子的电负性越大,成键电子对越靠近中心原子,成键电子对排斥力增大,键角增大键角:NH3>PH3>AsH3;H2O>H2S>H2Se(4)中心原子及孤电子对数相同,配位原子不同且结构相似——看配位原子的电负性:配位原子电负性越大,成键电子对越偏离中心原子,成键电子对排斥力减小,键角越小键角:NF3<NCl3<NBr3;NF3<NH3;OF2<H2O(5)单键、双键、三键的影响三键、双键、单键之间的排斥力大小顺序:三键-三键>三键-双键>双键-双键>双键-单键>单键-单键乙烯分子中键角①(121.3°)>键角②(117.4°)原因是斥力大小:双键—单键>单键—单键(6)配体体积对键角的影响:配体体积越大,电子云占据空间增大,对成键电子斥力增强,导致键角减小键角:NH3>NH2OH>NH2(CH3)【课时跟踪检测】1.Si与C元素位于同一主族,SiO2键角小于CO2的原因是______________________________________________ _______________________________________________________________________________________________ 2.比较键角大小:气态SeO3分子_______SeO2-3离子(填“>”“<”或“=”),原因是______________________________ _______________________________________________________________________________________________ 3.比较SO2-4和H2O分子中的键角大小并给出相应解释:______________________________________________ _______________________________________________________________________________________________ 4.H2O的键角小于NH3的,分析原因:_______________________________________________________________ ________________________________________________________________________________________________ 5.[PtCl4(NH3)2]中H—N—H之间的夹角________(填“>”“<”或“=”)NH3分子中H—N—H之间的夹角,原因是______________________________________________________________________________________________________________________________________________________________________________________ 6.乙酸分子()中键角1________(填“大于”“等于”或“小于”)键角2,原因是________________________________________________________________________________________________________________ 7.键角NH3_____PH3,原因是________________________________________________________________________ _______________________________________________________________________________________________ 8.NF3的键角_____NH3的键角,理由是_____________________________________________________________ 9.NH3分子在独立存在时H-N-H键角为107°。
分子中键角大小的比较
分子中键角大小的比较
分子中的键角大小是由分子中原子的排列方式决定的。
在分子中,原
子之间的键角大小对于分子的性质和反应具有重要的影响。
因此,了
解分子中键角大小的比较是化学研究中的一个重要方面。
在分子中,键角大小的比较可以通过分子的几何形状来确定。
分子的
几何形状受到原子间的相互作用力的影响。
分子中的原子可以通过单键、双键或三键相互连接。
单键的键角通常比双键和三键的键角大。
这是因为单键中的原子之间的相互作用力较弱,原子之间的距离较远,因此单键的键角较大。
在分子中,键角的大小还受到原子的电子云的影响。
原子的电子云可
以通过共价键的形成来相互连接。
共价键的形成是由原子之间的电子
云重叠而形成的。
当原子之间的电子云重叠较多时,原子之间的相互
作用力较强,键角较小。
当原子之间的电子云重叠较少时,原子之间
的相互作用力较弱,键角较大。
在分子中,键角的大小还受到原子的电子云的形状的影响。
原子的电
子云可以呈现出不同的形状,如线性、三角形、四面体等。
不同形状
的电子云会对键角的大小产生不同的影响。
例如,当原子的电子云呈现出线性形状时,键角通常较大。
当原子的电子云呈现出三角形或四面体形状时,键角通常较小。
总之,分子中键角大小的比较是由分子的几何形状、原子间的相互作用力、原子的电子云形状等多种因素共同决定的。
了解分子中键角大小的比较对于理解分子的性质和反应具有重要的意义。
突破键角大小的比较
中心原子杂化方式对键角大小的影响
即:杂化类型不同,sp(180°)>sp2(120°)>sp3(109°28’)
例1、BF3与BF4−中键角更大的是_________________
【解析】BF3分子中,B原子为sp2杂化,空间构型为平面正三角形,键角∠F−B−F=120°,而在BF4−离子中,B原子为sp3杂化,空间构型为正四面体形,键角∠F−B−F=109°28',因此BF3的键角比BF4−大的。
电子对之间的排斥力对键角大小的影响
孤电子对(lone pair,简写为LP)与成键电子对(bond pair,简写为BP)的电子云分布不同。
成键电子受到两个成键原子核的吸引,电子云比较集中在键轴的位置;孤电子对则只受到中心原子核的吸引,电子云在原子周围占据的体积比较“肥大”。
因此孤电子对对相邻电子对的排斥更强烈,从而导致成键电子对之间的夹角被压缩,即键角变小。
电子对的排斥力由大到小的顺序为:LP−LP≫LP−BP>BP−BP。
即:中心原子杂化类型相同时,孤电子对越多,键角越小。
NH3结构示意图
例2、H2O、NH3、CH4键角由大到小的顺序为______________________
【解析】H2O的键角为104.5°,NH3的键角是107°,CH4的键角为109°28',键角逐渐增大的原因是:3个分子的中心原子采取的都是sp3杂化,但孤电子对数分别为2、1、0。
孤电子对的排斥力比成键电子对的排斥力大,因此键角被压缩;
孤对电子数越多,排斥力越大,键角被压缩的越小,键角也越小。
例3、SO2分子中,键角∠O−S−O________120°(填“大于”、“等于”或“小于”)。
【解析】中心原子杂化类型为sp2的分子中,若中心原子无孤电子对,则键角为120°;但SO2分子中,中心原子S为sp2杂化,且含有1对孤电子对,孤电子对对成键电子对的排斥力更大,使键角变小,即∠O−S−O键角小于120°。
成键原子的电负性对键角大小的影响
当分子或离子的中心原子杂化类型相同、孤对电子数也相同时,成键原子的电负性强弱直接影响成键电子对的偏移方向和偏移程度。
若中心原子电负性强,则成键电子对偏向中心原子,中心原子的电子云密度增大,成键电子对之间的排斥作用力增大,键角变大;
若中心原子电负性弱,则成键电子对偏离中心原子,中心原子的电子云密度减小,成键电子对之间的排斥作用力减弱,键角变小。
例4、为什么NH3的键角是107°,NF3的键角是102.5°?
答:中心N原子均为sp3杂化,且都有1对孤电子对。
但F原子的电负性大于H原子,NF3分子中成键电子对更偏离中心原子,成键电子对间斥力减小,所以NF3键角更小。
即:中心原子相同,配原子不同,杂化类型相同,配原子电负性越强,键角越小。
例5、为什么NH3的键角是107°,PH3的键角是93.6°?
答:N和P原子均为sp3杂化,且都有1对孤电子对。
但N原子的电负性大于P原子,NH3分子中成键电子对更靠近中心原子,成键电子对间斥力变大,所以NH3键角更大。
即:中心原子不同,配原子相同,杂化类型相同,中心原子电负性越大,键角越大。
影响键角大小的其他因素
①重键对单键的斥力更大,重键键角变大,单键键角变小。
分子中存在重键(即双键或叁键)时,由于重键中包含的电子数比单键中的电子数多,电子云所占据的空间大于单键中的两个电子所占据的空间。
所以排斥力强,使分子中
含有重键的键角变大,而单键之间的键角变小。
重键电子对间排斥力:三键−三键>三键−双键>双键−双键>双键−单键>单键−单键
例6、HCHO分子中,键角∠H−C−O ________ 120°(填“大于”、“等于”或“小于”)。
【解析】C原子为sp2杂化,若为等性sp2杂化时键角等于120°。
但由于C与O原子间以双键C=O结合,双键对C−H键的排斥力更大。
所以,键角∠H−C−O增大,即∠H−C−O 大于120°,而键角∠H−C−H减小,∠H−C−H小于120°。
②配体体积越大,键角越小
当配体基团的体积较大时,配体基团的电子云占据的空间也会相应增大,对相邻电子对的电子云形成“挤压”,即对相邻键的排斥作用增强,键角则变小。
例6、NF3与NF2(CH3)中,后者的∠F−N−F键角更小。
原因是____________________。
【答案】NF2(CH3)分子中,CH3基团电子云占据的空间比F原子电子云的更大,对相邻键的排斥作用增强,使键角∠F−N−F变小。