《氯气和氢氧化钠反应》进阶练习(一)
- 格式:docx
- 大小:11.97 KB
- 文档页数:3
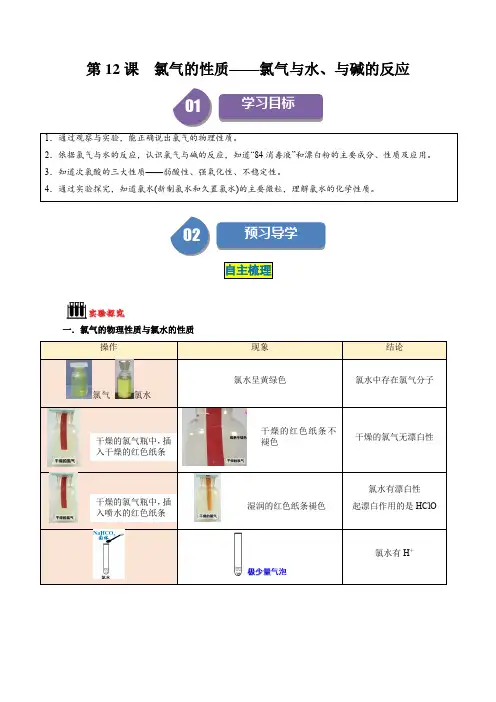

高中化学必修一人教版课时同步强化训练氯气与碱的反应氯离子的检验一、选择题1、1.下列检验Cl-的方法正确的是()A.向某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-B.向某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl -C.向某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有Cl-D.向某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明溶液中有Cl -答案 D2.在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断水溶液中含有()A.Cl-、SO2-4B.Cl-、NO-3C.Cl-、CO2-3D.Cl-、OH-答案 C3.自来水是用Cl2杀菌消毒的,不法商贩用自来水冒充蒸馏水出售,为辨真伪,可用下列哪一种试剂鉴别()A.酚酞溶液B.FeCl3溶液C.AgNO3溶液D.NaOH溶液答案 C4.氯仿(CHCl3)可用作麻醉剂,常因保存不慎而被空气氧化产生剧毒物质COCl2(光气)和氯化氢,为防止事故发生,使用前要检验氯仿是否变质,应选用的检验试剂是() A.水B.AgNO3溶液C.NaOH溶液D.KI溶液答案 B5.(2020·天津一中高一调研)将Cl2制成漂白粉的最主要目的是:①使它转变成较易溶于水的物质②转变成较稳定、便于贮存的物质③提高氯的质量分数④提高漂白能力()A.①②③B.②④C.②③D.②答案 D6.下列说法中正确的是()A.“84”消毒液是混合物,可以长期保存B.“84”消毒液中含有次氯酸,所以“84”消毒液能使有色布条褪色C.工业上将氯气通入澄清石灰水中制取漂白粉D.漂白粉在空气中容易失效的原因是Ca(ClO)2易与空气中的二氧化碳和水反应答案 D7.有关氯气的性质或用途的叙述中错误的是()A.工业上用氯气与消石灰反应来制漂白粉B.自来水常用氯气来消毒杀菌,其有效成分是HClOC.氯气有毒,制取氯气的尾气要用碱溶液来吸收D.氢气不能在氯气中燃烧答案 D8.(2019·山东齐河实验中学月考)下列物质不能使有色布条褪色的是() A.次氯酸钠溶液B.次氯酸钙溶液C.新制氯水D.氯化钙溶液答案 D9.(2019·牡丹江市一中期末)下列有关NaClO和NaCl混合溶液的叙述正确的是() A.该溶液中,H+、NH+4、Ag+可以大量共存B.向该溶液中通入CO2,不发生化学反应C.该溶液可作游泳池及环境的消毒剂,有效成分是NaClD.常温下,将氯气通入NaOH溶液中可以得到该溶液答案 D10.已知氯气和NaOH溶液在一定温度下能发生反应:Cl2+2NaOH===NaCl+NaClO +H2O,3Cl2+6NaOH===5NaCl+NaClO3+3H2O。

2021年人教版(2021版)必修第一册第二章氯气、氯气的实验室制法、氯离子的检验针对性训练一、氯气的性质1.(2020·湛江高一检测)氯气是一种化学性质很活泼的非金属单质,下列叙述中不正确的是( )A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟B.钠在氯气中燃烧,生成白色的烟C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾D.氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸答案 C2..(2020·天津一中高一调研)将Cl2制成漂白粉的最主要目的是:①使它转变成较易溶于水的物质②转变成较稳定、便于贮存的物质③提高氯的质量分数④提高漂白能力( )A.①②③ B.②④ C.②③ D.②答案 D3.下列关于氯气及含氯化合物的叙述不正确的是( )A.干燥的氯气和氯水均能使鲜花褪色B.因为氯气有毒,所以可用于杀菌、消毒、漂白C.漂白粉的有效成分是Ca(ClO)2D.氯气和氯化氢通入AgNO3溶液中均能产生白色沉淀答案 B4、下列与Cl2有关的说法正确的是( )A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂B.氯气作水的杀菌消毒剂时没有发生化学变化C.0.1 mol Cl2与足量NaOH溶液反应,转移0.2 mol电子D.Cl2能使湿润的淀粉碘化钾试纸变蓝,说明Cl2具有氧化性答案 D5、已知氯气和NaOH溶液在一定温度下能发生反应:Cl2+2NaOH===NaCl+NaClO+H2O,3Cl2+6NaOH===5NaCl+NaClO3+3H2O。
某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与ClO-3的个数比为1∶3,则氯气与氢氧化钠反应时,被还原的氯原子和被氧化的氯原子的个数比为( )A.21∶5 B.11∶3 C.3∶1 D.4∶1答案 D二、氯水的成分与性质6.(2020·贵州荔波中学调研)下列关于液氯和氯水的说法不正确的是( )A.常温常压下液氯是一种黄绿色的液体B.在加压条件下氯气转化为液氯,可用干燥的钢瓶储存液氯C.新制氯水在光照条件下放出气体的主要成分是氧气D.新制氯水可以使蓝色石蕊试纸先变红后褪色答案 A7.下列关于氯水的说法正确的是( )A.新制氯水含有 Cl2、HCl、HClO、H2O 分子B.紫色石蕊溶液滴入新制氯水中,溶液先变红后变无色C.氯水和液氯都能使干燥的有色布条褪色D.新制氯水的 pH要比久置氯水的 pH小答案 B8、(2020·贵州荔波中学期末)下列说法正确的是( )A.自来水中通入少量Cl2用于杀菌、消毒是利用了Cl2能杀菌、消毒B.漂白粉的主要成分是Ca(ClO)2,可用于杀菌、消毒C.漂白粉是由Cl2和NaOH浓溶液制得D.漂白粉与空气中的CO2和H2O反应而失效,因此要密封保存在干燥阴凉处答案 D9、已知NaClO溶液与CO2能发生如下反应:NaClO+H2O+CO2===NaHCO3+HClO,下列叙述错误的是( ) A.HClO比H2CO3的酸性弱B.加入少量盐酸可增强NaClO溶液的漂白性C.通入少量Cl2可增加NaClO溶液的漂白性D.“84”消毒液的有效成分是Ca(ClO)2,可用于消毒答案 D三、氯气制法及氯离子的检验10、下列制取Cl2、探究其漂白性、收集并进行尾气处理的原理和装置合理的是( )A.①制取Cl2B.②探究漂白性C.③收集Cl2D.④尾气处理答案 B11、某化学兴趣小组利用MnO2和浓盐酸及如图装置制备Cl2。

1、氯气通入氢氧化钠(氯气尾气的吸收)Cl2+2NaOH=NaCl+NaClO+H2O离子反应Cl2+2OH—= Cl—+ClO—+H2O2、实验室用石灰石制CO2CaCO3+2HCl= CO2↑+H2O+CaCl2离子反应CaCO3+2H+= CO2↑+Ca2++H2O3、硝酸见光分解贮棕色瓶4HNO 3 2H2O +4NO2↑+O2↑4、过氧化钠作供氧剂2H2O +2Na2O2 = 4NaOH+ O2↑2CO2 +2Na2O2 = 2Na2CO3+ O25、金属铝溶解在烧碱溶液中2Al+2NaOH+2H2O=2NaAlO2+3H2↑6、氯化铝与过量氨水反应AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl7、氯化铝与过量强碱AlCl3+4NaOH=NaAlO2+3NaCl+2H2O8、氯化铁使淀粉KI溶液变蓝2Fe3++2I-= 2Fe2++I29、氢氧化亚铁在空气中氧化为氢氧化铁(白色-灰绿-红褐色)4Fe(OH)2 +O2 +2H2O =4Fe(OH)310、铁丝在氯气中点燃产生红棕色的烟,加水得黄色溶液2Fe+3Cl 22FeCl311、氯气通入石灰乳乳制漂白粉2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O12、实验室用二氧化锰Cl2MnO2 +4HCl(浓)MnCl2+2H2O+Cl2↑离子反应:MnO2 +4H++2Cl-Mn2++2H2O+Cl2↑13、硫化钠与亚硫酸钠在酸性条件下归中2Na2S +Na2SO3+3H2SO4 =3H2O + 3S+ 3Na2SO4离子反应:14、偏铝酸钠溶液通CO2(少量、足量)足量NaAlO2 + 2H2O+CO2= Al(OH)3↓ + NaHCO3少量2NaAlO2 + 3H2O+CO2= 2Al(OH)3↓ + Na2CO3 15、碳与浓硫酸反应C+2H2SO4(浓)CO2↑+2SO2↑+2H2O16、铜与浓酸酸反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O17、镁条在CO2点燃CO2+2Mg 点燃2MgO+C18、次氯酸钠氧化碘化钠NaClO+2NaI+H2O=2NaOH+I2+NaCl19、硅与氢氧化钠溶液反应Si+2NaOH+H2O=Na2SiO3+2H2↑20、硝酸的工业制法:2NO+O2=2NO2(红棕)3NO2+H2O=2HNO3+NO(无色)21、偏铝酸盐与铝盐的完全水解AlCl3 + 3N aAlO2 +6H2O = 4Al(OH)3↓+3NaCl22、实验室制氨气2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O23、溴水吸收SO2(SO2表现还原性而非漂白性)Br2+2H2O+SO2=2HBr+H2SO4离子反应:24、碳酸钠溶液逐滴加稀盐酸(少量、足量)少量:Na2CO3+HCl(少量)=NaCl++NaHCO3足量:Na2CO3+2HCl=H2O+CO2↑+2NaCl25、NO与氧气溶于水总反应4NO+3O2+2H2O=4HNO326、NO2与氧气溶于水总反应4NO2+O2+2H2O=4HNO327、氧化铜除氯化铜中的氯化铁杂质2FeCl3+3CuO+3H2O=2Fe(OH)3↓+3CuCl228、钠与硫酸铜溶液反应2Na+CuSO4+2H2O=Cu(OH)2↓+ H2↑+Na2SO429、用硫酸铜吸收H2SH2S + CuSO4= CuS↓ +H2SO4离子反应:H2S+Cu2+=CuS↓+2H+30、硫酸的工业制法:煅烧硫铁矿4FeS2+11O2煅烧2Fe2O3+8SO2SO2的催化氧化为SO3 2SO2+O22SO3SO3吸水SO3+H2O=H2SO431、KI溶液在空气中变质4KI+2H2O+O2=4KOH+2I232、实验室用硝酸与铜反应应制NO、NO2气体制NO2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 制NO :3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 33、氟气与饱和食盐水:(实质是与水反应)2F2+2H2O=4HF+O234、氨水吸收SO2(少量、足量)少量2NH3·H2O+SO2(少量)=(NH4)2SO3+H2O足量NH3·H2O +SO2(足量)=NH4HSO335、偏铝酸钠溶液加足量盐酸NaAlO2 +4HCl= AlCl3 + NaCl+2H2O36、氯化铝与加足量烧碱反应AlCl3 +4 NaOH=NaAlO2 +3NaCl+2H2O4NH3+ 5O24NO + 6H2O催△重要无机反应一百例37、铁与高温水蒸气反应3Fe+4H2O Fe3O4 + 4H2↑38、候德榜制碱NH3+H2O+CO2+NaCl=NH4Cl+NaHCO339、亚硝酸铁与盐酸反应的离子方程式3Fe2+ +4H+ +NO3—=3Fe3+ + NO↑+2H2O40、工业用乙醛银镜反应制镜:AgNO3+ NH3·H2O=AgOH↓+NH4NO3AgOH+2NH3·H2O=[Ag(NH3)2]OH+2H2OCH3CHO+2[Ag(NH3)2]OH2Ag↓+CH3COONH4+3NH3 +H2O41、氢氧化铝降胃酸Al(OH)3+3HCl=AlCl3+3H2O离子反应:Al(OH)3+3H+=Al3++3H2O42、实验室用70%硫酸制SO2Na2SO3+H2SO4=H2O+SO2↑+Na2SO443、氮化镁溶于水Mg3N2 + 6H2O=3Mg(OH)2↓+ 2NH3↑44、硫酸氢钠与氢氧化钡,恰中和2H++SO42- +2OH- +Ba2+=BaSO4↓+2H2O恰沉淀H++SO42- +OH- +Ba2+=BaSO4↓+H2O45、硫酸氢钠与碳酸氢钠的离子反应H++HCO3-=H2O+CO2↑46、硫酸氢钠与亚硫酸氢钠的离子反应H++HSO3-=H2O+SO2↑47、明矾净水的离子反应Al3++3H2O⇋Al(OH)3+3H+48、用四氧化三铁发生铝热反应焊接钢轨8Al+3Fe3O44Al2O3+9Fe49、电解饱和食盐水2 NaCl +2H2O H2↑ + Cl2↑ +2 NaOH离子反应:2Cl- +2H2O H2↑ + Cl2↑ +2OH—50、海水-海贝制镁所涉及的反应①贝壳煅烧制取熟石灰:CaCO 3CaO+CO2↑ CaO+H2O=Ca(OH)2②产生氢氧化镁沉淀:Mg2++2OH-=Mg(OH)2↓③氢氧化镁转化为氯化镁:Mg(OH)2+2HCl=MgCl2+2H2O④电解熔融氯化镁:MgCl 2Mg+Cl2↑51、氢氧化铝溶于烧碱溶液Al(OH)3+NaOH=NaAlO2+2H2O52、钢铁腐蚀吸氧负极(Fe):Fe-2e-=Fe2+;正极(C):O2+2H2O+4e-=4OH-总反应:2Fe+O2+2H2O=2Fe(OH)2溶液反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3腐蚀:负极(Fe):Fe-2e-=Fe2+;正极(C):2H++2e-=H2↑总反应:Fe+2H+=Fe2++H2↑53、饱和碳酸钠溶液充CO2析出晶体Na2CO3+H2O+CO2=2NaHCO3↓54、碳酸氢钠与澄清石灰水(少量、足量)离子反应少量:Ca2+ +2OH—+2HCO3—=CaCO3↓+2H2O+CO32—足量:Ca2+ +OH—+HCO3—=CaCO3↓+H2O55、锌与浓硫酸反应Zn+2H2SO4(浓)=ZnSO4+So2↑+2H2O56、锌与稀硫酸反应Zn+H2SO4(稀)=ZnSO4+H2↑57、铁丝在纯氧中燃烧3Fe+2O 2Fe3O458、用氯化铁腐蚀铜制印刷电路板:2FeCl3+Cu=2FeCl2+CuCl259、碳与浓硝酸:C+4HNO3(浓)CO2↑ + 4NO2↑ + 2H2O60、工业制玻璃Na2CO3+SiO 2Na2SiO3+CO2↑CaCO3+SiO 2CaSiO3+CO2↑61、镁条在氮气中燃料3Mg + N2Mg3N262、实验室制用稀盐酸或用稀硫酸制H2SFeS + 2HCl = FeCl2 + H2S↑63、氯化铵溶液与金属镁2NH4Cl+2H2O+Mg=MgCl2+2NH3· H2O+H2↑64、漂白粉失效:Ca(ClO)2+H2O+CO2=CaCO3↓+2HclO2HClO2HCl + O2↑65、硫化氢气体与SO2气体反应2H2S + SO2 =2H2O + 3S66、氢硫酸与亚硫酸溶液反应2H2S + H2SO3 =3H2O + 3S↓67、碳酸钠水溶液去油污的离子反应CO32-+H2O⇋HCO3—+OH-68、用双氧水和稀硫酸溶解电子垃圾中铜Cu+H2SO4+H2O2=CuSO4+2H2O69、碳酸氢钙与澄清石灰水Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O离子反应Ca2+ +OH- +HCO3—=CaCO3↓+H2O—70、有关碳酸钠与碳酸氢钠除杂,注括符中为杂质固体碳酸钠(NaHCO3)2NaHCO 3Na2CO3+H2O+CO2↑碳酸钠溶液(NaHCO3)NaOH+NaHCO3=Na2CO3+H2O碳酸氢钠溶液(Na2CO3)Na2CO3+CO2+H2O=2NaHCO3 71、金属钠与水反应2Na+2H2O=2NaOH+H2↑72、酸性KMnO4吸收SO2的离子反应2MnO4—+2H2O +5SO2=5SO42—+2Mn2++4H+73、等物质的量氯气与SO2在水中反应Cl2+2H2O+SO2=2HCl+H2SO474、氯水久置Cl2 +H2O =HCl+HClO2HClO 2HCl + O2↑75、氯化碘与水反应ICl+H2O=HCl+HIO76、氯化碘与NaOH溶液ICl+2NaOH=NaCl+NaIO+H2O77、硅酸钠溶液通少量CO2Na2SiO3+H2O +CO2=Na2CO3+H2SiO3↓78、硫代硫酸钠与稀硫酸Na2S2O3+H2SO4=S↓+H2O+SO2↑+Na2SO479、亚硫酸钠与稀盐酸(少量、足量)少量: Na2SO3+HCl=NaCl++NaHSO3(足量: Na2SO3+2HCl=H2O+SO2↑+2NaCl80、有关二价铁与三价铁的转化,注样品(杂质)亚铁溶液含三价铁(加铁):2Fe3++Fe= 3Fe2+氯化铁中少量氯化亚铁2FeCl2+Cl2=2FeCl381、工业制石灰制石灰CaCO 3CaO+CO2↑82、硅与氢氟酸反应Si + 4HF=2H2↑+SiF4↑83、碳酸氢铵加热分解NH4HCO 3H2O + CO2↑+ NH3↑84、CO2与CO转化CO2(CO除杂):CuO+CO CO2+CuCO(CO2除杂):CO2+C2CO85、金属铁与硫加热化合Fe+S FeS86、金属铜与硫加热化合2Cu+S Cu2S 87、氢氟酸腐蚀雕刻玻璃SiO2+4HF =SiF4↑+2H2O88、钠在氧气中点燃2Na+O 2Na2O2(加热或点燃)89、澄清石灰水通CO2(少量、足量)少量:CO2+Ca(OH)2=CaCO3↓+H2O足量:CO2+CaCO3+H2O=Ca(HCO3)290、碳有关工业制法制粗硅SiO2+2C Si+2CO制水煤气C +H2O CO+H2制煤气C+CO 22CO制电石CaO+3C CaC2+CO91、氧气与臭氧相互转化3O22O392、H2O2不稳定可分解2H2O22H2O+O2↑93、氨气与盐酸反应NH3+HCl=NH4Cl94、镁与沸水反应Mg+2H2O Mg(OH)2 +2H2↑95、H2S不完全燃烧2H2S + O 22H2O +2 S96、H2S 完全燃烧2H2S + 3O 22H2O + 2SO297、硫氰化钠检验三价铁的离子反应Fe3+ + SCN- = [Fe(SCN)]2+血红色溶液98、酸性条件下用双氧水氧化亚铁离子4Fe2++H2O2+2H+= 2Fe3++2H2O99、氢氧化钠吸收SO2(少量、足量)少量2NaOH+SO2=Na2SO3+H2O足量NaOH+SO2=NaHSO3100、电解冶炼活泼金属铝的冶炼(冰晶石作助熔剂)2Al2O 34Al + 3O2↑电解熔化NaCl制钠:2NaCl 2Na+ Cl2↑重要的离子方程式2、钠与水反应:2Na+2H2O=2Na++2OH–+H2↑11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++2Fe2+53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–60、氯化铁溶液与硫氰化钾溶液:Fe3++3SCN–=Fe(SCN)3 66、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O76、碘化钾溶液中加入氯水:2I-+Cl2=I2+2Cl-101、电解饱和食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑52、氢硫酸中滴加溴水:H2S+Br2=2 H++S↓+2Br–(X2O2) 59、氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+65、氯化铁溶液加入碘化钾溶液:2Fe3++2I-=2Fe2++I2 82、氯气通入水中:Cl2+H2O=H++Cl-+HClO△86、二氧化硫通入溴水中:SO2+Br2+2H2O=4H++2Br-+SO42-(Cl2 I2 )△92、用氨水吸收少量SO2:SO2+2NH3+H2O=2NH4++SO32- +H2O 93、用氨水吸收过量的SO 2:SO2+NH3+H2O=NH4++HSO3-99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+△112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O△116、碳酸钠的第一步水解:CO32-+H2O HCO3-+OH-△125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、四氧化三铁溶于浓盐酸:Fe3O4+8H+=2Fe3++Fe2++4H2O70、氧化铁溶于氢碘酸溶液:Fe2O3+2I-+6H+=2Fe2++I2+3H2O附气休制取化学反应方程式气体反应原理注意点H2Zn+2HCl(稀)=ZnCl2+H2↑用稀盐酸和稀硫酸不可用硝酸用杂质锌(或加几滴CuSO4溶液)O22KClO3 2KCl+3O2↑2KMnO4K2MnO4+MnO2+O2↑用双氧水制O2既环保又快速多数过渡金属氧化物对双氧水分解有催化作用2H2O22H2O+O2CO2 CaCO3+2HCl(稀) =CaCl2+H2O+CO2↑不能用稀硫酸、可用稀硝酸NH3 2NH4Cl+Ca(OH)2CaCl2+2H2O+NH3↑反应物必是无水固体NH3·H2O+CaO=Ca(OH)2 + NH3↑浓氨水滴入碱石灰NH3·H2O H2O+ NH3↑浓氨水加热Cl2MnO2 + 4HCl(浓) MnCl2+2H2O+Cl2↑用浓盐酸、要加热2KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑KClO3 +6HCl(浓)= KCl+3H2O+3Cl2↑用浓盐酸、不用加热SO2Na2SO3+H2SO4=Na2SO4+H2O+SO2↑用70%硫酸或浓盐酸产物SO2易溶于水。

备战高考化学(氯及其化合物提高练习题)压轴题训练及详细答案(1)一、 高中化学氯及其化合物1.已知Cl 2在70℃的NaOH 水溶液中,能发生氧化还原反应后可生成NaClO 与NaClO 3现有63.9g Cl 2,将其通入到足量70℃的NaOH 水溶液中,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,并得到500mL 溶液。
(1)写出Cl 2在70℃的NaOH 水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO 、NaClO 3物质的量浓度____、______。
【答案】9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 0.8mol/L 0.2mol/L【解析】【分析】先通过氯元素化合价的对比判断NaClO 与NaClO 3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl 2与被还原的Cl 2的物质的量之比。
【详解】(1)该反应中NaClO 与NaClO 3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O ;(2)49.7g Cl 2的物质的量为63.9g 71g /mol=0.9mol ,根据反应9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 可知,生成NaClO 与NaClO 3的物质的量分别为0.9mol 40.4mol 9⨯=、0.9mol 10.1mol 9⨯=,完全反应后溶液中NaClO 、NaClO 3物质的量浓度分别为0.4mol 0.8/0.5mol L L =、0.1mol 0.2/0.5mol L L=。

氯气和氢氧化钠溶液的反应嘿,朋友们!今天咱们来聊聊氯气和氢氧化钠溶液那超级有趣的反应,就像一场化学界的奇妙派对。
你看啊,氯气就像一个调皮捣蛋的小恶魔,浑身绿油油的,充满了“坏点子”。
氢氧化钠溶液呢,就像是一个包容的大家庭,里面的钠离子和氢氧根离子和谐地生活在一起。
当氯气这个小恶魔一头扎进氢氧化钠溶液这个大家庭的时候,那场面,简直就像是一个捣蛋鬼闯进了温馨的家庭聚会。
氯气一进去,就开始张牙舞爪地搞事情。
它会先和氢氧化钠溶液里的氢氧化钠分子“握手”,不过这可不是友好的握手哦。
一个氯气分子(Cl₂)就像一个双手拿着武器的小怪兽,它会把自己分成两半,一半的氯原子(Cl)就像被招安了一样,和氢氧化钠里的钠(Na)说:“嘿,兄弟,咱们组个队吧。
”于是就形成了氯化钠(NaCl),这就像是两个性格迥异的家伙被迫凑成了一对,不过还挺和谐,就像土豆和牛肉搭配起来很美味一样。
而另一半的氯原子呢,它可没闲着,它就像一个不甘寂寞的小喽啰,跑去和氢氧根离子(OH⁻)纠缠。
这个氢氧根离子啊,本来好好地在溶液里过着自己的小日子,突然被这个氯原子搅和,然后它们就变成了次氯酸钠(NaClO)。
这就像是一场意外的组合,原本八竿子打不着的两个东西,硬是被这个反应给凑成了新的伙伴,感觉就像把香蕉和辣椒放在一起做成了奇特的菜肴。
整个反应过程啊,就像是一场激烈又有趣的大混战。
氯气在氢氧化钠溶液里横冲直撞,最后自己被分解得七零八落,而氢氧化钠溶液也发生了巨大的变化,从原本单纯的氢氧化钠溶液变成了有氯化钠和次氯酸钠的混合溶液。
这就好比一场魔法,原本的两种东西进去,出来就变成了全新的东西,就像把红色和蓝色颜料混在一起变成了紫色一样神奇。
从能量的角度看呢,这个反应就像是一场能量的交换舞会。
氯气带着它的化学能,在和氢氧化钠溶液接触的时候,把能量传递出去,就像一个热情的舞者把自己的活力传递给舞伴一样。
然后大家的化学结构就发生了改变,就像舞伴们换了新的舞蹈姿势一样。

高中化学第四章第二节第2课时氯气与碱反应氯气的制法及Cl的检验练习含解析新人教版必修1.下列说法正确的是()A.向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色B.纯净的氢气在氯气中安静地燃烧,发出苍白色火焰C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密闭保存D.在氯气泄漏时,可以用浸有NaOH水溶液的毛巾捂住口鼻,并向下风方向跑答案:B2.下列检验Cl-的方法正确的是()A.向某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-B.向某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-C.向某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有Cl-D.向某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-答案:D3.甲、乙、丙三种溶液中各含一种X-(X-为Cl-、Br-或I-)离子,向甲溶液中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化,则甲、乙、丙依次含有(已知溴水显橙色)()A.Br-、Cl-、I-B.Br-、I-、Cl-C.I-、Br-、Cl-D.Cl-、I-、Br-答案:B4.用下列两种方法制取氯气:①用含氯化氢146 g的浓盐酸与足量的二氧化锰反应;②用87 g二氧化锰与足量的浓盐酸反应。
则所得氯气()A.②比①多B.①比②多C.一样多D.无法比较答案:A5.实验室欲制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物:FeCl3+6H2O===FeCl3·6H2O。
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):①接,接 , 接 。
(2)烧瓶A 发生的反应中,氧化剂是 (填物质名称),B 中反应的化学方程式是___________________________________。
(3)容器D 的作用是__________________________________。

《氯气和氢氧化钠反应》进阶练习一、选择题1.实验室制取有毒的氯气时,常用烧碱溶液来吸收多余的氯气,反应后的生成物之一是次氯酸钠(NaClO).在次氯酸钠中,氯元素的化合价为()A.+5 B.+7 C.+1 D.+32.某实验室的尾气中含有较多的氯气,下列试剂用来吸收氯气最适合的是()A.澄清的石灰水B.饱和食盐水C.自来水D.NaOH溶液3.下列与氯气的氧化性无关的是()A.氯气被碱液吸收B.金属钠在氯气中燃烧C.氯气变为液氯D.氯气溶于水二、填空题4.实验室制氯气的尾气处理用溶液吸收,其化学反应方程式为5.青海省玉树县地震灾害之后,需用“84消毒液”12%次氯酸钠(NaClO)溶液稀释后对场地喷洒消毒.(1)消毒液工厂生产500kg溶质质量分数为12%次氯酸钠溶液,需取用溶质次氯酸钠 kg.(2)地震灾害现场要配制0.3%的次氯酸钠溶液800kg,需取用12%次氯酸钠溶液kg,在稀释过程中需加水 kg。
参考答案【答案】1.C2. D3. C4.NaOH(或KOH);Cl2+2NaOH═NaCl+NaClO+H2O (或Cl2+2KOH═KCl+KClO+H2O)5.(1)60;(2)20;780。
【解析】1.钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价。
故选C. 2.A.澄清的石灰水浓度较小,不能充分吸收氯气,故A不选;B.食盐水中氯离子浓度较大,抑制氯气的溶解,则吸收效果最不好,故B不选;C.氯气微溶于水,吸收效果不好,故C不选;D.因氯气能与烧碱反应,且相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,则烧碱溶液的吸收效果好,故D选。
故选D。
3.A.氯气被碱液吸收,生成氯化钠和次氯酸钠,氯气发生自身的氧化还原反应,氯气既是氧化剂也是还原剂,所以与氧化性有关,故A不选;B.金属钠在氯气中燃烧,生成氯化钠,体现氯气的氧化性,与氧化性有关,故B不选;C.氯气变为液氯,是分子间距离的改变,是物理变化,与氧化性无关,故C选;D.氯气溶于水,生成盐酸和次氯酸,发生自身的氧化还原反应,所以与氧化性有关,故D不选;故选C。

第2课时氯气与碱反应及Cl-的检验[学习目标定位] 1.根据氯气与水的反应能正确写出氯气与碱[NaOH、Ca(OH)2]反应的化学方程式。
2.知道漂白粉的成分和用途。
3.学会氯离子的检验方法。
一氯气与碱的反应1.Cl2与NaOH溶液反应的化学方程式为2NaOH+Cl2===NaCl+NaClO+H2O。
2.工业上制取漂白粉(Cl2和石灰乳)的原理与上述反应原理相似,则反应的化学方程式为2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O。
3.自来水常用氯气来杀菌消毒,但因氯气的溶解度不大,而且生成的HClO很不稳定,不便于保存,而次氯酸盐性质稳定,且遇酸或空气中的CO2和水蒸气又可再生成HClO。
因此常用氯气与碱反应制取漂白粉。
归纳总结漂白液(粉)的制取与保存(1)漂白液是NaClO溶液;漂白粉的成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2;漂粉精的主要成分是Ca(ClO)2。
(2)漂白粉的使用原理:利用复分解反应原理和较强酸能够制取较弱酸的原理使Ca(ClO)2转化为HClO进行漂白。
①Ca(ClO)2+2HCl===CaCl2+2HClO,离子方程式:ClO-+H+===HClO。
②Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO(酸性:HClO酸性比H2CO3弱)。
(3)漂白粉保存不当会变质的原因是Ca(ClO)2和空气中的CO2和水蒸气反应生成HClO,易分解。
因此漂白粉和漂粉精的保存方法是密封、避光并置于阴凉干燥处。
1.某化工厂生产的漂白粉,产品说明书如下:请你回答:(1)请你为漂白粉写一份保存、使用的注意事项(不超过30字)____________ _______________________________。
(2)用化学方程式表示:①漂白粉的生产原理:_______________________________。
②一般情况下,漂白粉失效的主要原因:________________________________________________________________________ ________________________________________________________________________。

高中化学《离子反应》练习题(附答案解析)学校:___________姓名:___________班级:_____________ 一单选题1.下列化学用语正确的是()A.质子数为17 中子数为20的氯原子:37Cl17B.硫离子的结构示意图:C.亚硫酸的电离方程式:H2SO3=2H++2SO32-D.明矾的化学式:KAlSO4·12H2O2.下列离子方程式中,错误的是()A.氯气与烧碱溶液反应:Cl2 +2OH- =Cl-+ ClO-+H2OB.氯气与KOH溶液反应:Cl2 +2OH- =Cl- +ClO-+H2OC.盐酸与AgNO 3溶液反应:HCl +Ag+ =H++AgCl↓D.NaCl溶液与AgNO 3溶液反应:Cl- +Ag+=AgCl↓3.下列电离方程式中,错误的是()HCO-A.NaHCO3= Na++3SO-B.H2SO4=2H++24C.NaHS=Na++H++S2-SO-D.NaHSO4=Na++H++244.某强酸性溶液中含有Fe3+ Mg2+,在此溶液中还能存在的离子组是()A.K+ Na+ HCO3- SO42-B.OH- K+ Cu2+ NO3-C.K+ SCN- I- Na+D.K+ SO42- Na+ NO3-5.过氧化物在纺织业工业里有重要的作用,关于Na2O2的说法正确的是()A.阴离子的电子数为10B.阴阳离子个数比1:1C.属于离子化合物D.属于非电解质6.下列说法正确的是()A.CO2溶于水能导电,所以CO2是电解质B.铜丝能导电,所以铜是电解质C.氯化氢水溶液能导电,所以盐酸是电解质D.氯化钠在熔融状态下能导电,所以氯化钠是电解质7.下列有关离子方程式书写错误的是()A.向Ca( HCO3)2溶液加少量氢氧化钠溶液:Ca2++2HCO-3+2OH- =CaCO3↓+CO2-3+2H2OB.氧化铁与足量 HI 溶液反应:Fe2O3+ 6H++ 2I-=I2+ 2Fe2++ 3H2OC.等物质的量的 Ba(OH)2 与明矾加入足量水中:3Ba2++6OH- +2Al3++3SO2-4=3BaSO4↓+2Al(OH)3↓D.Na2CO3溶液中通入少量CO2:CO2-3+CO2 +H2O = 2HCO-38.下列叙述正确的是()A.熔融NaCl能导电,因为其通电时发生了电离B.固体NaCl不能导电,因为其不由带电微粒直接构成C.43NH NO电离时不产生金属离子,因此其不是盐D.4NaHSO在水溶液中电离出三种离子,其中两种是阳离子,另一种是阴离子9.下列反应的离子方程式书写不正确...的是()A.铁与氯化铁溶液:Fe+Fe3+ =2Fe2+B.稀盐酸与氢氧化钙溶液:H+ +OH-=H2OC.铜与硝酸银溶液:Cu+2Ag+=Cu2++2AgD.氧化钠与稀盐酸:Na2O+2H+=2Na++H2O10.下列各组离子在溶液中能大量共存的是()A.H+ Na+ CO32— NO3—B.K+ Ba 2+ SO42— NO3—C.K+ Al3+ SO42— Cl—D.Fe3+ H+ Cl— SCN—11.在能使酚酞变红的无色溶液中,可大量存在的离子组是()A.Na+ Fe2+ Br- Cl-B .SO 2-3 K + NH +4 Na +C .K +Na +NO -3 HCO -3D .K + S 2- SO 2-4 OH -12.下列离子方程式的书写及评价均合理的是( )A .AB .BC .CD .D13.常温下,下列各组离子在指定溶液中能大量共存的是( ) A .中性溶液中:3+Al 3+Fe 2-4SO -4ClOB .加入铝粉生成2H 的溶液中:+Na -3HCO -3NO +4NHC .无色溶液中:+K 2-4SO 2-27Cr O +NaD .()131w 110mol L H K c --+=⨯⋅平24SO -的溶液中:+4NH 2+Ca -Cl -3NO 二 填空题14.已知磷酸钠(Na 3PO 4)是电解质,在水溶液中能完全电离。
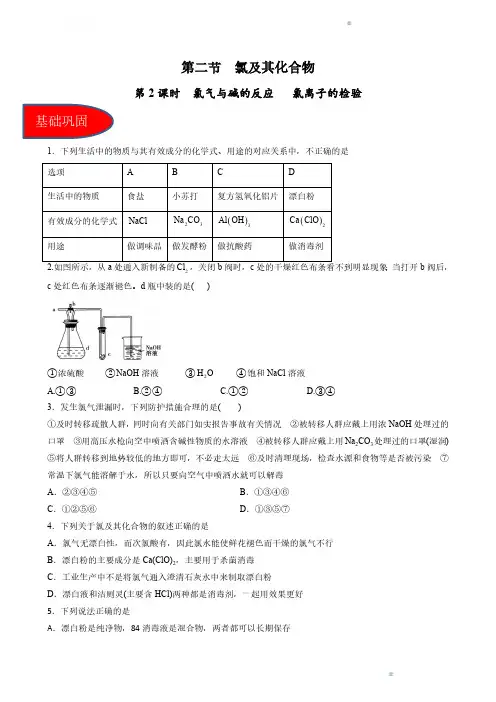
第二节 氯及其化合物第2课时 氯气与碱的反应 氯离子的检验1.下列生活中的物质与其有效成分的化学式、用途的对应关系中,不正确的是选项A B C D 生活中的物质食盐小苏打复方氢氧化铝片漂白粉有效成分的化学式NaCl 23Na CO ()3Al OH ()2Ca ClO 用途做调味品做发酵粉做抗酸药做消毒剂2.如图所示,从a 处通入新制备的2Cl ,关闭b 阀时,c 处的干燥红色布条看不到明显现象;当打开b 阀后,c 处红色布条逐渐褪色。
d 瓶中装的是( )①浓硫酸 ②NaOH 溶液 ③2H O ④饱和NaCl 溶液A.①③ B.②④ C.①②D.③④3.发生氯气泄漏时,下列防护措施合理的是( )①及时转移疏散人群,同时向有关部门如实报告事故有关情况 ②被转移人群应戴上用浓NaOH 处理过的口罩 ③用高压水枪向空中喷洒含碱性物质的水溶液 ④被转移人群应戴上用Na 2CO 3处理过的口罩(湿润)⑤将人群转移到地势较低的地方即可,不必走太远 ⑥及时清理现场,检查水源和食物等是否被污染 ⑦常温下氯气能溶解于水,所以只要向空气中喷洒水就可以解毒A .②③④⑤B .①③④⑥C .①②⑤⑥D .①③⑤⑦4.下列关于氯及其化合物的叙述正确的是A .氯气无漂白性,而次氯酸有,因此氯水能使鲜花褪色而干燥的氯气不行B .漂白粉的主要成分是Ca(ClO)2,主要用于杀菌消毒C .工业生产中不是将氯气通入澄清石灰水中来制取漂白粉D .漂白液和洁厕灵(主要含HCl)两种都是消毒剂,一起用效果更好5.下列说法正确的是A .漂白粉是纯净物,84消毒液是混合物,两者都可以长期保存B.漂白粉中含有次氯酸,所以漂白粉能使有机色质褪色C.工业上将氯气通入澄清石灰水中制取漂白粉D.漂白粉在空气中容易失效的原因是Ca(ClO)2与CO2、H2O反应生成的HClO不稳定6.下列关于含氯消毒剂的解释不正确的是A.“84”消毒液不能与洁厕灵混合使用:2H++Cl-+ClO-=Cl2↑+H2OB.工业上将氯气通入石灰乳制取漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OC.氯水应避光保存的原因是:2HClO 光照H2O+Cl2↑D.氯气意外发生泄漏,可用浸有一定浓度NaHCO3溶液的毛巾捂住鼻子,向高处转移7.(2021·洮南市第一中学高一月考)某溶液中含有较大量的Cl-、23CO 、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。
第2课时氯气与碱反应及Cl-的检验【基础篇】题组一氯气与碱反应的应用1.下列有关漂白粉的说法正确的是( )A.漂白粉的有效成分是CaCl2B.漂白粉和明矾处理自来水的原理是相同的C.漂白粉最好在弱酸性环境下使用D.漂白粉因易在空气中氧化而密封保存答案 C2.在空气中能稳定存在的物质是( )A.氢氧化钙溶液B.新制氯水C.次氯酸钠D.食盐水答案 D3.漂白粉在空气中放置易失效的主要原因是( )A.Ca(ClO)2不稳定,易分解B.Ca(ClO)2易吸收水分而潮解C.Ca(ClO)2跟空气中的水和CO2反应D.Ca(ClO)2跟空气中的CO2反应答案 C题组二Cl2的制法4.实验室用MnO2和浓盐酸来制取氯气,主要操作有:①将蒸馏烧瓶固定在铁架台上;②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定好铁圈,放好石棉网;③用药匙向蒸馏烧瓶中加入MnO 2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中;④检查气密性;⑤在蒸馏烧瓶上装好分液漏斗,连接好导管。
最好的实验操作顺序是( ) A .②⑤①④③ B .②①⑤④③ C .②①⑤③④D .⑤②①④③答案 B5.实验室用浓盐酸与足量的二氧化锰反应产生少量的氯气。
若反应过程中消耗了0.2 mol HCl ,理论上可收集到的氯气的质量( ) A .等于3.55 g B .小于3.55 g C .大于3.55 gD .约等于7.1 g 答案 A解析 理论上可收集到的氯气的质量,可直接根据化学方程式计算,设收集到氯气的质量为x ,则4HCl(浓)+MnO 2=====△MnCl 2+Cl 2↑+2H 2O 4 mol 71 g 0.2 mol xx =3.55 g 。
6.下列关于实验室制取Cl 2的说法正确的是( )A .将混有HCl 杂质的Cl 2通过盛有饱和NaHCO 3溶液的洗气瓶除去杂质B .实验室制取Cl 2,浓盐酸起到酸性和氧化剂作用C .实验室用如图装置除去Cl 2中的少量HClD .实验室制备Cl 2,可用排饱和食盐水集气法收集解析Cl2通入饱和NaHCO3溶液反应生成CO2,引入新的杂质,并且消耗Cl2,A项不正确;实验室制取Cl2,浓盐酸起到酸性和还原剂的作用,B项不正确;用饱和食盐水除去Cl2中的HCl 气体时,导气管应长进短出,C项不正确;实验室用排饱和食盐水法收集Cl2是因为Cl2难溶于饱和食盐水,而能溶于水,D项正确。
2020-2021备战高考化学(氯及其化合物提高练习题)压轴题训练附答案一、 高中化学氯及其化合物1.Cl 2通人70℃的NaOH 水溶液中,发生氧化—还原反应,反应完成后,测得溶液中NaClO 与NaClO 3的物质的量之比为4∶1,则:(1)配平溶液中所发生反应的化学方程式:____Cl 2+______NaOH=____NaCl+____NaClO 3+_____NaClO+____ ____(2)反应中的氧化产物为_________________。
(3)已知生成0.1mol NaClO ,反应中转移的电子总数是__________ mol ,若溶液的体积正好为100mL ,则溶液中NaCl 的物质的量浓度为________ mol /L 。
【答案】7 14 9 1 4 7 NaClO 3 NaClO 0.225 2.25【解析】【分析】【详解】(1)据题设条件,先定NaClO 、NaClO 3的化学计量数为4、1,再利用化合价升降法:升高总数为4×1+1×5=9,降低总数为1,配平得7Cl 2+14NaOH=9NaCl+NaClO 3+4NaClO+7H 2O ;(2)分析反应得氧化剂、还原剂均为Cl 2,Cl 元素被氧化生成NaClO 3与NaClO ,氧化产物为NaClO 3与NaClO ;(3)由反应知每转移9mol 电子,生成4molNaClO ,则生成0.1molNaClO ,反应中转移的电子总数是0.225mol ,同时生成NaCl 为0.225mol ,若溶液的体积正好为0.1L ,则溶液中NaCl的物质的量浓度为2.25mol·L -1。
2.(1)单质钠是一种______色的金属,密度比水______(大/小),钠在自然界中以______(化合/游离)态存在;金属钠与水反应的化学方程式:______,金属钠在空气中燃烧生成______色的______(化学式),其生成物与水反应的化学方程式:______。
第四章非金属及其化合物4.2.1氯气与碱反应及Cl-的检验1.下列关于漂白粉的叙述正确的是()A.漂白粉的有效成分是Ca(ClO)2和CaCl2B.漂白粉在空气中久置后会变质C.漂白粉的有效成分Ca(ClO)2不稳定,易分解D.漂白粉的主要成分是CaCl2【答案】B【解析】A.漂白粉的有效成分是Ca(ClO)2,选项A错误;B.空气中Ca(ClO)2与水、二氧化碳反应生成碳酸钙和HClO,HClO光照分解而变质,选项B正确;C.漂白粉的有效成分是Ca(ClO)2,易与氯气与水、二氧化碳反应生成碳酸钙和HClO,HClO光照分解而不是Ca(ClO)2易分解,选项C错误;D.漂白粉的主要成分是Ca(ClO)2和CaCl2,选项D错误;答案选B。
2.下列物质属于纯净物的是()A.漂白粉B.水玻璃C.液氯D.陶瓷【答案】C【解析】A.漂白粉是氯化钙和次氯酸钙的混合物,故A不符合题意;B.水玻璃是硅酸钠的水溶液,属于混合物,故B不符合题意;C.液氯是液态氯气,是一种物质组成的纯净物,故C符合题意;D.陶瓷是无机硅酸盐制品,是由多种物质组成的混合物,故D不符合题意;答案选C。
3.实验室用MnO2和浓盐酸来制取氯气,主要操作有:①将蒸馏烧瓶固定在铁架台上;②把酒精灯放在铁架台上,根据酒精灯确定铁圈的高度,固定好铁圈,放好石棉网;③用药匙向蒸馏烧瓶中加入MnO2,再向分液漏斗中加浓盐酸,并将导管放入集气瓶中;④检查气密性;⑤在蒸馏烧瓶上装好分液漏斗,连接好导管。
最好的实验操作顺序是()A.②⑤①④③B.②①⑤④③C.②①⑤③④D.⑤②①④③【答案】B【解析】制取氯气的正确操作步骤为:先连接装置(从下到上,从左到右)、检查气密性,然后装入药品:先向烧瓶中装入二氧化锰,再向分液漏斗中装入浓盐酸,下一步进行加热制取、吸收氯气,由于氯气有毒,最后需要进行尾气吸收,故正确的排序为:②①⑤④③。
4.(2020·安徽师范大学附属中学高一期末)下列物质中,漂白原理与其他三种物质不同的是()A.活性炭 B.次氯酸钠 C.氯水 D.过氧化氢【答案】A【解析】常见物质的漂白原理有1.强氧化性2.吸附性3.与有色物质结合生成不稳定无色物质,分析各物质的性质进行解答。
《氯气和氢氧化钠的奇妙反应》嘿,朋友!今天咱来聊聊氯气和氢氧化钠的反应。
这俩家伙凑到一起,那可真是有一番热闹呢。
先说说氯气吧,这家伙有点小脾气,不好惹。
它是黄绿色的,有点刺鼻的味道。
要是不小心碰到它,那可不得了,会让人不舒服呢。
不过呢,它也有自己的用处,在很多地方都能派上用场。
再看看氢氧化钠,这也是个厉害的角色。
它通常是白色的固体,遇水就会溶解,变成一种滑溜溜的液体。
它可以用来清洁东西,还能在一些工业生产中发挥作用。
那当氯气和氢氧化钠碰到一起的时候,会发生啥呢?嘿嘿,这就像一场奇妙的相遇。
氯气会和氢氧化钠发生化学反应,生成一些新的物质。
这个反应可有意思啦。
就好像是氯气和氢氧化钠在玩一场游戏,它们互相交换着一些东西,然后就变成了不一样的家伙。
在这个过程中,会产生氯化钠、次氯酸钠和水。
氯化钠咱都熟悉吧,就是咱们平时吃的盐。
没想到吧,氯气和氢氧化钠反应还能变出盐来呢。
次氯酸钠也有它的用处,可以用来消毒啥的。
这个反应可不是随便就能发生的哦,需要一定的条件。
比如说,要有合适的温度啦,浓度啦。
要是条件不合适,它们可能就不乐意反应了。
想象一下,氯气和氢氧化钠在一个容器里,它们开始了自己的冒险。
它们你看看我,我看看你,然后就开始动手啦。
它们把自己的原子重新组合,变成了新的物质。
这个过程就像变魔术一样,让人惊叹不已。
不过呢,在进行这个反应的时候,咱们也要小心哦。
氯气毕竟是有点危险的,不能随便乱玩。
要在专业的人指导下,在安全的环境里进行这个反应。
好啦,今天关于氯气和氢氧化钠的反应就聊到这里啦。
是不是觉得很有趣呢?下次再遇到这俩家伙的时候,你就可以想象一下它们之间的奇妙反应啦。
第二节氯及其化合物第1课时氯气的性质(分层练习)1.下列关于氯气性质的描述中,不正确的是A.无色气体B.有刺激性气味C.能溶于水D.常温常压下密度比空气的大【答案】A【解析】A项,氯气为黄绿色气体,错误;B项,氯气具有刺激性气味,正确;C项,氯气可以与水反应生成HCl和HClO,能溶于水,正确;D项,氯气的相对分子质量为71,空气的平均相对分子质量约为29,故相同条件下氯气的密度比空气的大,正确。
2.氯气可用于消灭田鼠,为此,可将氯气用软管通入田鼠洞中,这是利用了氯气下列性质中的①黄绿色①密度比空气大①有毒①易液化①溶于水A.①①B.①①C.①①①D.①①①【答案】B【解析】氯气密度比空气大,能接近地面进入田鼠洞,灭鼠利用氯气的毒性,故利用①、①,故选答案B。
3.铁丝在氯气中燃烧的实验说法正确的是A.瓶内有大量白烟生成B.Fe被还原C.瓶内液体变为浅绿色D.产物为FeCl3【答案】D【解析】A项,铁丝在氯气中燃烧,产生棕褐色的浓烟,错误;B项,铁丝在氯气中燃烧生成FeCl3,Fe元素化合价升高,被氧化,错误;C项,FeCl3溶液水,溶液呈黄色,则反应后瓶内液体变为黄色,错误;D 项,铁丝在氯气中燃烧生成FeCl3,正确。
4.下列有关氯气的说法正确的是A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂B.铁丝在氯气中燃烧,产生棕褐色的烟,加水溶解后,溶液呈浅绿色C.氯气通入水中形成的氯水能使有色布条褪色,说明氯气有漂白性D.Cl2虽然是一种有毒气体,但控制用量,可以用于自来水的消毒、杀菌【解析】A.Cl2具有很强的氧化性,Cl2在化学反应中不仅可以作氧化剂、也可以作还原剂,如Cl2与H2O的反应中,Cl2既是氧化剂、又是还原剂,A项错误;B.铁丝在氯气中燃烧生成FeCl3,FeCl3加水溶解所得溶液呈黄色,B项错误;C.氯气通入水中形成的氯水能使有色布条褪色,是因为氯水中含有的HClO具有漂白性,氯气没有漂白性,C项错误;D.Cl2是一种有毒气体,Cl2能与H2O反应生成具有强氧化性的HClO,HClO能杀死水中的病菌,起到消毒的作用,故控制Cl2的用量,Cl2可用于自来水的消毒、杀菌,D项正确。
备战高考化学氯及其化合物提高练习题压轴题训练及详细答案一、 高中化学氯及其化合物1.一定量氢气在氯气中燃烧,所得混合物用1100mL3.00mol L NaOH -⋅溶液恰好完全吸收,测得溶液中含有NaClO 的物质的量为0.0500 mol 。
(1)所得混合物与NaOH 溶液反应的离子方程式______(2)所得溶液中NaCl 的物质的量为________。
(3)所用氯气和参加反应的氢气的物质的量之比()()22n Cl :n H =________。
【答案】2H OH H O -++=、22Cl 2OH Cl ClO H O ---+=++ 0.250 3:2【解析】【分析】由溶液中含有0.0500 mol 次氯酸钠可知,氢气在氯气中燃烧时,氯气过量,反应得到氯化氢和氯气的混合气体。
【详解】(1)氯化氢和氯气的混合气体被氢氧化钠溶液吸收时,氯化氢与氢氧化钠溶液发生中和反应生成氯化钠和水,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为OH —+H += H 2O ,Cl 2+2OH —=Cl —+ClO —+H 2O ,故答案为:OH —+H += H 2O ,Cl 2+2OH —=Cl—+ClO —+H 2O ;(2)根据溶液电中性原则可知:n (Na +)=n (Cl -)+n (ClO -),n (Cl -)=n (Na +)-n (ClO -)=0.1L ×3.00mol/L-0.0500mol=0.250mol ,则所得溶液中NaCl 的物质的量为0.250mol ,故答案为:0.250;(3)根据Cl 原子守恒可知,n (Cl 2)=12×n (NaOH )=0.15mol ,由氯气与氢氧化钠溶液反应的化学方程式可知,生成0.0500 mol 次氯酸钠消耗过量氯气0.0500 mol ,则与氢气反应的氯气为0.15mol-0.05mol=0.1mol ,氢气在氯气中燃烧的化学方程式为H 2+Cl 22HCl ,由化学方程式可知氢气的物质的量为0.1mol ,故氯气和参加反应的氢气的物质的量之比n (Cl 2):n (H 2)=0.15mol :0.1mol=3:2,故答案为:3:2。
《氯气和氢氧化钠反应》进阶练习
一、选择题
1.实验室制取有毒的氯气时,常用烧碱溶液来吸收多余的氯气,反应后的生成物之一是次氯酸钠(NaClO).在次氯酸钠中,氯元素的化合价为()
A.+5 B.+7 C.+1 D.+3
2.某实验室的尾气中含有较多的氯气,下列试剂用来吸收氯气最适合的是()
A.澄清的石灰水B.饱和食盐水
C.自来水D.NaOH溶液
3.下列与氯气的氧化性无关的是()
A.氯气被碱液吸收B.金属钠在氯气中燃烧
C.氯气变为液氯D.氯气溶于水
二、填空题
4.实验室制氯气的尾气处理用溶液吸收,其化学反应方程式为
5.青海省玉树县地震灾害之后,需用“84消毒液”12%次氯酸钠(NaClO)溶液稀释后对场地喷洒消毒.
(1)消毒液工厂生产500kg溶质质量分数为12%次氯酸钠溶液,需取用溶质次氯酸钠 kg.(2)地震灾害现场要配制0.3%的次氯酸钠溶液800kg,需取用12%次氯酸钠溶液
kg,在稀释过程中需加水 kg。
参考答案
【答案】
1.C
2. D
3. C
4.NaOH(或KOH);Cl2+2NaOH═NaCl+NaClO+H2O (或Cl2+2KOH═KCl+KClO+H2O)
5.(1)60;(2)20;780。
【解析】
1.钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价。
故选C. 2.A.澄清的石灰水浓度较小,不能充分吸收氯气,故A不选;
B.食盐水中氯离子浓度较大,抑制氯气的溶解,则吸收效果最不好,故B不选;
C.氯气微溶于水,吸收效果不好,故C不选;
D.因氯气能与烧碱反应,且相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,则烧碱溶液的吸收效果好,故D选。
故选D。
3.A.氯气被碱液吸收,生成氯化钠和次氯酸钠,氯气发生自身的氧化还原反应,氯气既是氧化剂也是还原剂,所以与氧化性有关,故A不选;
B.金属钠在氯气中燃烧,生成氯化钠,体现氯气的氧化性,与氧化性有关,故B不选;
C.氯气变为液氯,是分子间距离的改变,是物理变化,与氧化性无关,故C选;
D.氯气溶于水,生成盐酸和次氯酸,发生自身的氧化还原反应,所以与氧化性有关,故D
不选;
故选C。
4.实验室制氯气的尾气处理用NaOH(或KOH)溶液吸收,其化学反应方程式为Cl2+2NaOH═NaCl+NaClO+H2O (或Cl2+2KOH═KCl+KClO+H2O),
故答案为:NaOH(或KOH);Cl2+2NaOH═NaCl+NaClO+H2O (或Cl2+2KOH═KCl+KClO+H2O).5.(1)消毒液工厂生产500kg溶质质量分数为12%次氯酸钠溶液,需取用溶质次氯酸钠的质量为500kg×12%=60kg。
(2)地震灾害现场要配制0.3%的次氯酸钠溶液800kg,设需要取用12%次氯酸钠溶液质量为x,溶液稀释前后,溶质的质量不变,则800kg×0.3%=12%x,x=20kg;在稀释过程中需加
水的质量为800kg-20kg=780kg。
故答案为:(1)60;(2)20;780。