实验四-酸碱解离平衡和沉淀-溶解平衡
- 格式:doc
- 大小:545.50 KB
- 文档页数:3



解离平衡和沉淀-溶解平衡一、实验目的1.加深对解离平衡、同离子效应及盐类水解原理的理解。
2.了解难溶电解质的多相离子平衡及溶度积规则。
3.学习快速测量溶液pH的方法和操作技术。
二、实验原理1.弱电解质的解离平衡及其移动弱电解质在水溶液中发生部分解离,在一定温度下,弱电解质(例如Hac)存在下列解离平衡:如果在平衡体系中,加入与弱电解质含有相同离子的强电解质,解离平衡向生成弱电解质的方向移动,使弱电解质的解离度降低,这种现象称为同离子效应。
2.缓冲溶液弱酸及其盐(如HAc和NaAc)或弱碱及其盐(如NH3·H20和NH4Cl)所组成的溶液,在一定程度上可以对外来少量酸或碱起缓冲作用。
即当加入少量的酸、碱或对其稀释时,溶液的pH基本不变,这种溶液叫做缓冲溶液。
3.盐类的水解强酸强碱盐在水溶液中不水解。
强碱弱酸盐、强酸弱碱盐和弱酸弱碱盐,在水溶液中都发生水解。
因为组成盐的离子和水电离出来的H+或0H-离子作用,生成弱酸或弱碱,往往使水溶液显酸性或碱性。
根据同离子效应,往溶液中加入H+或0H-可以抑制水解。
水解反应是吸热反应,因此,升高温度有利于盐类的水解。
4.难溶电解质的多相解离平衡及其移动在一定温度下,难溶电解质与其饱和溶液中的相应离子处于平衡状态。
根据溶度积规则可以判断沉淀的生成和溶解,利用溶度积规则,可以使沉淀溶解或转化。
降低饱和溶液中某种离子的浓度,使两种离子浓度的乘积小于其溶度积,沉淀便溶解。
对于相同类型的难溶电解质,可以根据其K sp的相对大小判断沉淀生成的先后顺序。
根据平衡移动原理,可以将一种难溶电解质转化为另一种难溶电解质,这种过程叫做沉淀的转化。
沉淀的转化一般是溶度积较大的难溶电解质可以转化为溶度积较小的难溶电解质。
三、试剂0.1mol·L-1的HCl,HAc,NaOH 和NH3·H2O;甲基橙;NH4Ac固体;酚酞;O.1mol·L-1NaAc;0.1mol·L-1的NaCl,NH4Cl,Na2C03,NH4Ac,NaAc,NaH2P04,Na2HP04,Na3P04溶液;固体Fe(N03)3·9H2O;6mol·L-1HNO3溶液;饱和Al2(SO4)3溶液;饱和Na2C03溶液;0.1mol·L-1AgNO3溶液; 0.1mol·L-1K2Cr04溶液;饱和(NH4)2C2O4溶液;0.1 mol·L-1CaCl2溶液;2 mol·L-1HCl溶液;2 mol·L-1HAc。




第四章酸碱平衡和沉淀溶解平衡根据酸碱质子理论,酸碱反应的实质是质子的传递。
根据酸碱质子理论,在水溶液中,弱酸及其共轭碱的关系:KΘa·KΘb=KΘw解离常数KΘa或KΘb:温度不变,解离常数不变。
已知弱酸的浓度和解离度,求弱酸的PH和解离常数?解:因为α=√KΘa·CΘ/C。
C(H+)=√Ka·C。
/CΘ 得出C(H+)=α·C。
/CΘ就可以求出PH,也可以求出解离常数。
酸碱平衡:已知酸的解离常数,求已知浓度C的含酸根的盐的PH?解:由酸的解离常数,根据Ka·Kb=Kw可得其共轭碱的解离常数Kb,代入得C(OH-)=√Kb·C/CΘ,所以C(H+)=Kw/C(OH-),PH=-lg(H+)缓冲溶液:配制缓冲溶液如何选择电解质及其对应的盐?解:解离常数K所对应的p H或POH尽可能地接近缓冲溶液的p H或POH缓冲方程PH=PKΘa(弱酸)-lgC弱酸/C共轭碱当缓冲比C弱酸/C共轭碱=1时,缓冲溶液的缓冲能力最大。
此时PH=PKΘa(弱酸)求缓冲溶液的PH值?解:由弱酸(碱)及其共轭碱(酸)组成。
以弱酸及其共轭碱构成的缓冲溶液(强酸与过量弱碱反应)为例:弱酸的(解离程度很小)浓度近似为强酸的浓度,共轭碱(没有考虑弱酸中所含有的碱根)的浓度=(弱碱的物质的量-强酸的物质的量)/混合后的总体积,则根据缓冲方程PH=PKΘa(弱酸)-lgC弱酸/C共轭碱即得。
如果再向混合液中加入酸或碱,再求弱酸和其共轭碱的浓度,代入缓冲方程即可。
溶度积与溶解度的关系:知溶解度求溶度积Ksp(生成的离子的乘积)?解:在不考虑离子水解的情况下,AB型Ksp=s²AB2或A2B型Ksp=4s³AB3型Ksp=27s4A2B3型Ksp=108s5 s是溶解度知溶度积kΘsp求溶解度s?⚠️AB型或AB2型方程不同。
例如:AgCl在0.1mol·L-1的NaCl溶液中溶解度为1.77×10-9mol·L-1。

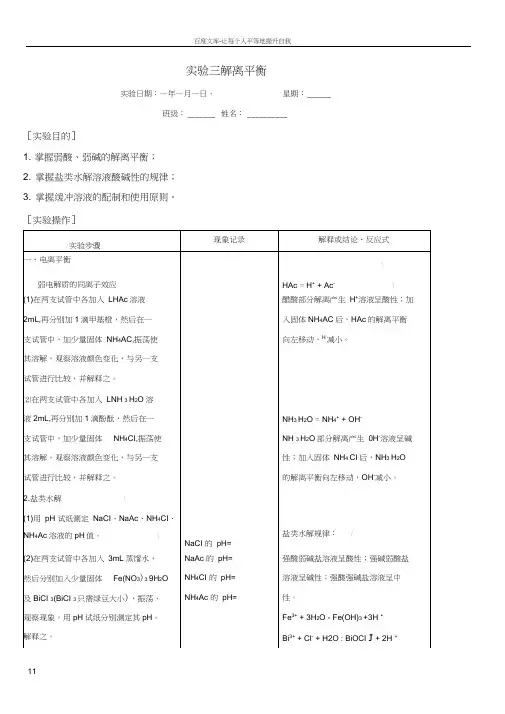
实验三解离平衡实验日期:—年—月—日、星期:______班级:_______ 姓名:__________[实验目的]1. 掌握弱酸、弱碱的解离平衡;2. 掌握盐类水解溶液酸碱性的规律;3. 掌握缓冲溶液的配制和使用原则。
[实验操作]支试管中的物质。
⑶取上面制得的NaAc溶液,加1滴酚酞指示剂,加热,观察溶液颜色变化,并解释之。
⑷将(3)制得的Fe(NO3)3溶液分成三份,第一份保留作比较用;第二份中加入2mol ・L-1HNO31〜2滴,观察溶液颜色变化;第三份用小火加热,观察颜色的变化,解释上述现象。
⑸在⑶制得的BiOCI白色混浊物的试管中逐滴加入6mol •L'1HCI,并剧烈振荡,至溶液澄清(HCI不要太过量),再加水稀释,有何现象?解释之,由此了解实验室应如何配制BiCI 3、SnCI2等易水解盐类的溶液。
⑹缓冲溶液的缓冲作用在100mL烧杯中加入LHAc和LNaAc 溶液各25mL,搅拌均匀,用pH试纸测定其pH 值。
加入去离子水50mL , 冲稀一倍,搅匀后再测定其pH值。
然后将此溶液分为两等份,一份加入LHCI溶液10滴,搅匀,用\ pH试纸测定其pH值,另一份中加入LNaOH溶液10滴,搅匀,再用pH试纸测定其pH值。
记录测定结果。
第二份现象:第三份现象:最初的pH=稀释后的pH=加酸后的pH=加碱后的pH=Ac- + H2O亠HAc + OH -Ac-的水解反应为吸热反应,温度升咼平衡向右移动,OH-浓度增大。
H+增大,Fe3+的水解反应向左移动,溶液颜色变浅。
Fe3+的水解反应为吸热反应,温度升咼平衡向右移动,Fe(OH) 3的量增大。
BiOCI+ HCI T Bi3+ + H2O + Cl-为了防止BiCI 3、SnCI2等盐类的水解,应加入适当的酸。
缓冲溶液能抵抗外加少量的酸、碱或水,溶液的pH不会发生太大变化。
实验四沉淀-溶解平衡实验日期:—年—月—日星期:______/ 班级:_______ 姓名:__________ \[实验目的]1•掌握沉淀溶解平衡的规律;2. 掌握溶度积规则的应用;3. 掌握沉淀生成和溶解的方法。


竭诚为您提供优质文档/双击可除解离平衡实验报告篇一:《水溶液中的解离平衡》实验报告二、实验步骤(一)同离子效应1、取两只小试管,0.1mol/LhAc溶液及1滴甲基橙,混合均匀,溶液呈红色。
在一试管中加入少量naAc(s),观察指示剂颜色变化指示剂变黄。
hAc=h++Ac-naAc=na++Ac—2、取两只小试管,各加入5滴0.1mol/Lmgcl2溶液,在其中以支试管中再加入5滴饱和nh4cl溶液,然后分别在这两支试管中加入5滴2mol/Lnh3·h2o,观察两试管发生的现象有何不同?何故?mgcl2=mg2++2cl-mg2++2oh—=mg(oh)2↓nh4cl解离出的cl-使mgcl2解离平衡向左移动减小了溶液中mg2+的浓度,因而在入5滴饱和nh4cl溶液,然后(二)在这支试管中加入5滴2mol/Lnh3·h2o无白色沉淀生成。
缓冲溶液的配制1、用1mol/LhAc溶液和1mol/LnaAc溶液配置ph=4.0的缓冲溶液10mL.应该如何配制?配好后,用ph试纸测定其ph值,检验其是否符合要求.ph=pKa+lgcAc-/chAc4=4.75+lgcAc-/chAclgcAc-/chAc=-0. 75cAc-/chAc=0.178VAc-/10-VhAc=0.178VAc-=1.51mLVhAc= 8.59mL2、将上述缓冲溶液分成两等份,在一分中加入1mol/Lhcl溶液1滴,在另一分中加入1mol/Lnaoh溶液,分别测定其ph值。
3、取两只试管,各加入5毫升蒸馏水,用ph试纸测定其ph值。
然后分别加入1mol/Lhcl1滴和1mol/Lnaoh1滴,再用ph试纸测定其ph值。
与“2”进行比较。
(三)盐的水解1、在三只小试管中分别加入1毫升0.1mol/Lna2co3,nacl,及Al2(so4)3溶液,用ph试纸测定它们的酸碱性。
解释其原因,并写出有关反应程式。
山东大学西校区实验报告姓名危诚年级班级公共卫生1班实验四酸碱解离平衡和沉淀-溶解平衡实验目的:了解弱酸与弱碱的解离平衡及其平衡移动原理;掌握缓冲溶液恶性质及缓冲溶液的配置方法;掌握难溶点解释的沉淀—溶解平衡及溶度积规则的运用;学习液体及固体的分离以及pH试纸的使用等基本操作。
实验原理:一元弱酸中的浓度:一元弱碱中的浓度:缓冲溶液的pH值:;难溶强电解质的标准溶度积常数:实验器材:离心机,离心试管,试管,烧杯,玻璃棒,量筒,试管架,滴管,药匙实验药品:甲基橙,酚酞,广泛pH试纸,精密pH试纸(pH=3.8~5。
4;pH=5。
5~9。
0)实验过程:(一)测定溶液pH用广泛pH试纸测量0.1mol/L的溶液,0。
1mol/L的溶液和的0.1mol/L溶液的pH。
测得分别为pH=1。
0; pH=13;pH=8.0。
通过计算,易知理论值分别为pH=1。
0;pH=13。
0;pH=8。
2552。
(二)同离子效应(1)取两支试管A、B,各加入等量0。
1mol/L的溶液和1滴甲基橙溶液,摇匀后观察溶液颜色为橙红色。
然后向A管中加入少量固体,摇匀后观察,与B管溶液颜色比较,发现A管中液体颜色变黄。
解释:在A管原溶液中达到解离平衡显酸性使甲基橙为橙红色,加入固体后,溶液中增多,发生同离子效应,反应逆向移动,使水中氢离子浓度减小,pH上升,甲基橙显黄色.(2)取两支试管A、B,各加入等量0。
1mol/L的溶液和1滴酚酞指示剂,摇匀观察溶液颜色为红色.向A管中加入少量固体,摇匀观察颜色,A管中红色褪去。
解释:在A管原溶液中达到解离平衡显碱性使酚酞为红色,加入固体后,溶液中增多,发生同离子效应,反应逆向移动,使水中氢氧根离子浓度减小,pH下降,酚酞红色褪去。
(3)取两支试管A、B,各加入等量0。
1mol/L的溶液,再向A管中加入适量饱和溶液,再向两支试管中各加入适量2mol/L的溶液,摇匀观察,A管无明显变化,B管中出现白色浑浊.解释:在两管原溶液中达到解离平衡,A管加入饱和溶液后,溶液中较多,再加入溶液则发生同离子效应,溶液解离逆向移动,使水中氢氧根离子浓度减小,使得因此不产生沉淀,没有明显变化;反之,B管中溶液解离后氢氧根离子浓度上升,使得,产生沉淀,显现白色浑浊。
一、实验目的1. 理解并掌握解离平衡和沉淀平衡的基本概念。
2. 通过实验观察和数据分析,验证沉淀溶解平衡的存在。
3. 学习并运用溶度积规则进行沉淀反应的预测。
二、实验原理1. 解离平衡:弱电解质在水溶液中存在电离平衡,其离子浓度与未电离分子浓度之间存在一定的平衡关系。
2. 沉淀平衡:难溶电解质在水中存在沉淀溶解平衡,当离子浓度乘积超过其溶度积时,会形成沉淀。
3. 溶度积规则:在一定温度下,难溶电解质的溶解度积(Ksp)为常数,可用于预测沉淀的生成和溶解。
三、实验仪器与药品1. 仪器:试管、烧杯、电子天平、滴定管、移液管、玻璃棒、漏斗、滤纸等。
2. 药品:硫酸铜(CuSO4)、氢氧化钠(NaOH)、氯化银(AgNO3)、硝酸钠(NaNO3)、氯化钠(NaCl)等。
四、实验步骤1. 沉淀反应:取两只试管,分别加入2 mL 0.1 mol/L CuSO4溶液和2 mL 0.1 mol/L AgNO3溶液,观察溶液颜色变化。
向其中一只试管中加入2滴0.1 mol/L NaOH溶液,观察沉淀生成情况。
2. 溶解平衡:取两只试管,分别加入2 mL 0.1 mol/L AgNO3溶液和2 mL 0.1 mol/L NaCl溶液,观察溶液颜色变化。
向其中一只试管中加入2滴0.1 mol/L NaNO3溶液,观察沉淀溶解情况。
3. 溶度积计算:根据实验数据,计算沉淀反应和溶解平衡的溶度积,并与已知溶度积数据进行比较。
五、实验数据与结果1. 沉淀反应:向CuSO4溶液中加入NaOH溶液后,观察到蓝色沉淀生成。
2. 溶解平衡:向AgNO3溶液中加入NaCl溶液后,观察到白色沉淀生成。
加入NaNO3溶液后,沉淀逐渐溶解。
3. 溶度积计算:(1)沉淀反应:Ksp(Cu(OH)2) = [Cu2+][OH-]^2 = 0.01 mol/L × (0.01mol/L)^2 = 1×10^-8(2)溶解平衡:Ksp(AgCl) = [Ag+][Cl-] = 0.01 mol/L × 0.01 mol/L =1×10^-4六、实验讨论1. 通过实验观察,验证了沉淀溶解平衡的存在,并了解了沉淀反应和溶解平衡的规律。
文档收集于互联网,已重新整理排版.word 版本可编辑.欢迎下载支持.
山东大学西校区实验报告
姓名 危诚
年级班级 公共卫生 1 班
实验四 酸碱解离平衡和沉淀-溶解平衡
实验目的: 了解弱酸与弱碱的解离平衡及其平衡移动原理;掌握缓冲溶液恶性质及缓冲溶
液的配置方法;掌握难溶点解释的沉淀-溶解平衡及溶度积规则的运用;学习液体及固体的
分离以及 pH 试纸的使用等基本操作。
实验原理:
一元弱酸中
的浓度:
一元弱碱中 的浓度:
缓冲溶液
的 pH 值:
;
难溶强电解质
的标准溶度积常数:
实验器材:离心机,离心试管,试管,烧杯,玻璃棒,量筒,试管架,滴管,药匙
实验药品:
(pH=3.8~5.4;pH=5.5~9.0) 实验过程: (一) 测定溶液 pH
甲基橙,酚酞,广泛 pH 试纸,精密 pH 试纸
用广泛 pH 试纸测量 0.1mol/L 的 溶液,0.1mol/L 的
溶液和的 0.1mol/L
溶液的
pH。
测得分别为 pH=1.0; pH=13; pH=8.0。
通过计算,易知理论值分别为 pH=1.0; pH=13.0; pH=8.2552。
(二) 同离子效应
(1)取两支试管 A、B,各加入等量 0.1mol/L 的 溶液和 1 滴甲基橙溶液,摇匀后观察溶 液颜色为橙红色。
然后向 A 管中加入少量 固体,摇匀后观察,与 B 管溶液颜色比较, 发现 A 管中液体颜色变黄。
解释:在 A 管原溶液中达到解离平衡显酸性使甲基橙为橙红色,加入 固体后,溶
液中 增多,发生同离子效应,反应逆向移动,使水中氢离子浓度减小,pH 上升,甲基 橙显黄色。
(2)取两支试管 A、B,各加入等量 0.1mol/L 的 溶液和 1 滴酚酞指示剂,摇匀观察溶液
颜色为红色。
向 A 管中加入少量
固体,摇匀观察颜色,A 管中红色褪去。
解释:在 A 管原溶液中达到解离平衡显碱性使酚酞为红色,加入
固体后,溶液
中
增多,发生同离子效应,反应逆向移动,使水中氢氧根离子浓度减小,pH 下降,
1 文档来源为:从网络收集整理.word 版本可编辑.
文档收集于互联网,已重新整理排版.word 版本可编辑.欢迎下载支持.
酚酞红色褪去。
(3)取两支试管 A、B,各加入等量 0.1mol/L 的
溶液,再向 A 管中加入适量
饱
和溶液,再向两支试管中各加入适量 2mol/L 的 中出现白色浑浊。
溶液,摇匀观察,A 管无明显变化,B 管
解释:在两管原溶液中达到解离平衡,A 管加入
饱和溶液后,溶液中
较多,
再加入 溶液则发生同离子效应, 溶液解离逆向移动,使水中氢氧根离子浓度减小,
使得
因此不产生
沉淀,没有明显变化;反之,B 管中
溶液解离后氢氧根离子浓度上升,使得
,产生
沉淀,显现
白色浑浊。
(三) 缓冲溶液的配置与性质
(1) 计算得需要 0.1mol/L 的 溶液 8.40ml,需要 0.1mol/L 的 溶液 11.60ml。
用 10ml
量筒量取 8.40ml 溶液,用 100ml 量筒量取 11.60ml 溶液,加入烧杯中混合
搅拌均匀。
取精密 pH 试纸(pH=3.8~5.4),用洁净的玻璃棒蘸取溶液涂在试纸上,
与比色卡对照,并用 2mol/L 的
溶液和 2mol/L 的 溶液调节溶液 pH 值到
pH=4.60。
(2) 计算得需要 0.2mol/L 的
溶液 77.62ml,需要 0.2mol/L 的
溶液
22.38ml。
用 100ml 量筒量取 77.62ml
溶液和 22.38ml
溶液,加入烧
杯中混合搅拌均匀。
取精密 pH 试纸(pH=5.5~9.0),用洁净的玻璃棒蘸取溶液涂在
试纸上,与比色卡对照,并用 2mol/L 的
溶液和 2mol/L 的
溶液调节溶
液 pH 值到 pH=7.40
(3) 以下各缓冲溶液用量皆为 20ml
缓冲溶液
pH(前)
加入物质
7.40
2ml 0.1mol/L HCl
7.40
2ml 0.1mol/L NaOH
7.40
20ml 纯水
0.1mol/L NaCl
7.00
2ml 0.1mol/L HCl
0.1mol/L NaCl
7.00
2ml 0.1mol/L NaOH
说明:缓冲溶液能有效地阻碍溶液 pH 值的变化。
(四) 沉淀的生成
pH(后) -0.20 +0.12 0.00
3.2 2.0
(1) 取试管 A,加 1ml 0.1mol/L 的 到生成黄色沉淀。
溶液和 1ml 0.1mol/L 的 溶液,混合后观察
解释:有
,而溶液中有
1 文档来源为:从网络收集整理.word 版本可编辑.
文档收集于互联网,已重新整理排版.word 版本可编辑.欢迎下载支持.
= (2) 取试管 B,加 1ml 0.001mol/L 的
观察,无明显现象。
解释:有
,所以形成沉淀。
溶液和 1ml 0.001mol/L 的 溶液,混合后
,而溶液中有
= (五) 沉淀的溶解
,所以不形成沉淀。
(1) 生成弱电解质:取离心试管,加入 5 滴 0.1mol/L 的
溶液和 3 滴
饱
和溶液,摇匀观察,生成白色沉淀。
离心分离,弃去溶液,在沉淀上滴加 6mol/L 的 溶液,沉淀溶解。
(2) 生成配离子:取离心试管,加入 10 滴 0.1mol/L
溶液,再加 10 滴 0.10mol/L
的 溶液,摇匀观察,生成白色沉淀。
离心分离,弃去溶液,在沉淀上滴加 2mol/L
的 溶液,沉淀溶解。
(3) 发生氧化还原反应:取离心试管,加 5 滴 0.1mol/L 的
溶液和 3 滴 0.1mol/L 的
溶液,摇匀观察,生成黑色沉淀。
离心分离,弃去溶液,在沉淀上滴加 6mol/L
的
溶液,60 水浴加热,有气体产生,大部分沉淀溶解,溶液显蓝色,小部分
带有黄色的沉淀没有溶解。
实验结论: 见实验过程。
1 文档来源为:从网络收集整理.word 版本可编辑.
。