二氧化氯实验报告
- 格式:doc
- 大小:60.50 KB
- 文档页数:4

二氧化氯消毒液的社区实践活动调查研究报告二氧化氯分子结构由一个氯原子和两个氧分子构成,共融合着19个电子器件,表层键域上存有一个未果对的特异性自由电荷,具备较强的化学作用。
另外,因为造成新绿色生态氧,可使微生物菌种内构成蛋白的碳水化合物断线,毁坏微生物菌种的辅因子,这类功效是一般有效氯的消毒液或次氯酸钠溶液不可以比较的(其他消毒液只使蛋白质水解)。
二氧化氯的广谱性抑菌作用,对高等动物细胞膜的结构基本上没什么危害,其溶解物质为水、氧化钠、少量二氧化碳。
北京市疾病防治监测中心的毒理实验結果为:1、亚急性毒理实验,属无毒性。
2、致基因突变试验,无。
3、ames试验,呈阴性。
运用二氧化氯的优点:可溶强电解质,但不水解反应,溶解性是氢气的5倍除菌力好能快速地杀死病毒、病菌、原生生物、藻类植物和细菌能合理地杀掉贾弟虫胞子、隐胞子和胞子产生菌ph融入覆盖面广,能在很宽的ph范畴内维持很高的除菌高效率不容易造成有机化学氟化物,不容易产生三卤甲烷气体不容易与氨反映能迅速除去水里铁及锰能毁坏酚、硫酸盐、氰化氢和其他很多有机化合物具备漂白剂褪色功效腐蚀低二氧化氯(clo2)是一种水溶的氧化剂,在常温常压下是浅绿色的汽体,但在更低的溫度下则呈液体,其含量为67.45,熔点11°c,溶点——59°c,汽体clo2相对密度为3.09(11°c),液态clo2的相对密度为1.64,0℃的饱和蒸气压为500torr。
二氧化氯在水中以二氧化氯单个存有,不汇聚转化成clo2汽体,在20°c和4kpa工作压力下,溶解性为2.9g/l。
在水中不与有机化合物融合,不转化成三氯甲烷致癌物质,因而被称作不致癌物质的消毒液。
clo2构造中有一个含有孤电子对的氯——氧烃基构造,极不稳定,光反应会造成自由基,具备强的还原性。
下表列出了二氧化氯与其他空气氧化类消毒液的空气氧化工作能力,亦即除菌工作能力的较为(用次氯酸钠溶液表明)。

碘量法测定二氧化氯1.1测定原理稳定性二氧化氯(ClO2)在酸性条件下可氧化碘化钾,使其释放出碘。
以标准硫代硫酸钠溶液滴定反应析出得碘,根据硫代硫酸钠得用量,计算出溶液中ClO2的含量。
2 ClO2+10KI+8HCl →10K Cl+5I2+4H2O5 I2+10Na2S2O3→10NaI+5NaS4O61.2主要试剂及器材1.2.1试剂:0.1mol/L硫代硫酸钠标准溶液6%碘化钾溶液0.5mol/L盐酸溶液0.5%淀粉指示液1.2.2器材:250毫升碘量瓶50毫升量筒2毫升移液管50毫升滴定管1.3测定方法以2ml移液管准确移取样品2ml,置于250ml碘量瓶中,加50ml的0.5mol/L HCl溶液和50ml的6%碘化钾溶液,塞紧瓶盖,振摇均匀后,于暗处避光静置5分钟使反应完全,此时溶液呈黄色,然后打开瓶塞,用少量蒸馏水冲洗瓶塞及瓶壁,立即用0.1 mol/L硫代硫酸钠标准溶液滴定,至溶液呈浅黄色时,加0.5%淀粉指示液10滴,继续滴定至蓝色消失即为终点。
将滴定结果用空白实验校正。
每1ml硫代硫酸钠标准溶液(0.1mol/L)相当于13.49mg的ClO2。
1.4计算公式ClO2(w/v)=[m(V1-V2)*0.01349/V]*1000000式中:M——硫代硫酸钠克分子浓度V1——样品消耗的硫代硫酸钠的毫升数V2——空白实验消耗的硫代硫酸钠的毫升数V——取样量(ml)资料源自:/forum.php?mod=misc&action=attachcredit&aid=122075&formhash=d91b572d/thread-173748-1-1.html End。

二氧化氯消毒剂的社会实践调查报告1、急性毒理实验,属无毒。
2、致突变实验,无。
3、Ames实验,阴性。
应用二氧化氯的优势:易溶于水,但不水解,溶解度是氯气的5倍杀菌力强能迅速地杀死病毒、细菌、原生生物、藻类和真菌能有效地杀死贾弟虫孢子、隐孢子和孢子产生菌PH适应范围广,能在很宽的PH范围内保持不低的杀菌效率不会产生有机氯化物,不会形成三卤二氧化碳不会与氨反应能快速去除水中铁及锰能破坏酚、硫化物、氰化物和其它许多有机物具有漂白脱色作用腐蚀性低ClO2结构中有一个带有孤对电子的氯氧双键结构,极不稳定,光反应会产生氧自由基,具有强的氧化性。
下表列出了二氧化氯与其它氧化类消毒剂的氧化能力,亦即杀菌控制能力的比较(用有效氯表示)。
氧化剂ClO2H2O2NaClO2KMnO4Cl2NaClO氧化能力263%209%157%111%100%93%国外大量的实验报告研究显示,二氧化氯是安全、无毒的消毒剂,更无三致效应(致癌、致畸、致突变),同时在三致原核细胞中也不与有机物发生氯代反应生成可产生消毒作用的生物农药氯化物或其他有毒类物质。
由于二氧化氯生存能力具有极强的氧化能力,在高浓度时(500mg/l)需要对健康产生不利影响。
当使用浓度低于500mg/l时,其影响可以忽略,在100mg/l以下时不会对人体诱发产生任何的影响,包括生理生化方面的影响,对皮肤亦无任何致敏作用。
事实上,二氧化氯的常规使用浓度要远远底于500mg/l,一般仅在几十mg/l左右。
因此,二氧化氯被国际上认作说成为安全、无毒的绿色漂白剂。
稳定性二氧化氯通过活化释放出游离态二氧化氯,游离态二氧化氯释放不稳定充分释放出新生态氧原子;新生态氧原子兼具强烈的氧化作用,其通过氧化有机物、细菌细胞中可溶性部分(包括酶系统)而达到快速压制微生物蛋白质的合成,杀灭细菌、病毒的目的。
国内外学术研究许多的研究结果表明,二氧化氯在极低浓度(0.1mg/l)下,即可杀灭许多种诸如大肠杆菌、金黄色链球菌等致病菌。

关于二氧化氯这篇干货很耐读至理名言是智慧的积淀常言道细节决定成败往往生活中的一言一行也折射出了成功的秘诀不信?您往下看☟师徒四人的聊天看似平常但细思极恐我们对二氧化氯有足够了解吗?......二氧化氯的鉴别指标第一部分:理化特征一、实验原理通过二氧化氯溶解时间长短判断其作用时间二、实验材料250ml烧杯、二氧化氯、标签、笔、纯净水三、实验方法1、量取100ml纯净水至烧杯。
2、称取1g二氧化氯置入纯净水中。
3、观察二氧化氯的溶解时间与溶解状态。
四、实验结果1、1g二氧化氯溶解需要4-5min左右。
2、溶解时在水面形成白色膜状物,是二氧化氯的包膜。
3、二氧化氯的溶解是立体的(即沉水到着陆塘底一直溶解)。
▲ 二氧化氯立体溶解扩散图五、结果分析1、溶解时间在3min左右刚好达到立体消毒的时间要求。
2、二氧化氯不稳定,而包膜恰恰克服了此类弊端,进而保证了产品的质量与使用安全。
3、柱状立体式溶解可以更大程度地发挥二氧化氯的氧化消毒功效。
一元二氧化氯片是一种固体二氧化氯发生剂,各组分只有溶于水里,产品的配方、形状、剂型以及选用的原材料、生产工艺参数等都会影响二氧化氯片的溶解性能,所以一个二氧化氯片的溶解性能也可以在一定程度上反映产品的质量。
二氧化氯片入水后,各组分应该基本溶解完全,没有过多残渣和不溶物。
如果残渣和不溶物过多,说明配方设计不合理,没有选用合适的包膜剂、粘合剂、脱模剂等。
二氧化氯片的崩解时限就是我们常说片剂的溶解时间,是指在一定温度一定体积的水中,规定数量的片全部崩解溶散所需时间的限度。
(1)崩解时限并不等同于反应生成二氧化氯需要的时间。
(2)崩解速度快也并不等同于亚氯酸盐(氯酸盐)转化成二氧化氯的反应速度快。
(3)二氧化氯片在水中崩解完全时并不能说明反应体系中生成的二氧化氯浓度达到峰值。
第二部分:强氧化性一、实验原理利用二氧化氯的强氧化性与Vc的强还原性(Vc的验证详看上期内容),通过氧化还原反应中颜色变化来判断产品质量。

改进五步碘量法测定二氧化氯含量的研究陈路瑶林立旺黄育红(福建省产生预防控制中心,福州 350001)提要: 在实验室用“五步碘量法”测定两种二氧化氯产品含量,来了解影响该方法测定准确性的因素并进行改进。
结果,按规范所示方法(方法1)进行测定,消毒剂A中二氧化氯含量为L,消毒剂B中二氧化氯含量为L。
对方法1的反应液的pH值进行适当调节控制(方法2)后再测定,则消毒剂A中二氧化氯含量为L,消毒剂B中二氧化氯含量为L。
显示方法1与方法2测定结果差异较大。
说明五步法测定过程中根据不同产品pH值作适当调节,使pH值均能接近7,才能保持二氧化氯最佳反应状态,所测得的二氧化氯含量比较接近实际。
关键词: 二氧化氯;含量测定;五步碘量法;中图分类号:文献标识码:B现用的化学法和电解法工艺生产的二氧化氯产品中均含有二氧化氯(ClO2)、亚氯酸根(ClO2—)、氯(Cl2)和氯酸根(ClO3—)等成分。
过去,二氧化氯含量测定方法一直采用第三版《消毒技术规范》规定的丙二酸碘量法[1],由于其特异性方面的原因,对上述成分区分测定比较困难。
因此,2002年版《消毒技术规范》规定用五步碘量法测定二氧化氯含量。
根据这种方法原理,应可以分别测定出二氧化氯消毒剂中所含的ClO2、ClO2—、Cl2、ClO3—的含量,但经实际应用发现该五步法尚有不完善之处,使得测定结果不稳定。
为此,我们对“五步碘量法”某些操作环节进行改进,并在实验室对两种二氧化氯产品进行了测定比较。
现将结果报告如下。
1 方法试验以两种品牌二氧化氯消毒剂为对象,二氧化氯消毒剂A以盐酸为激活剂,溶液pH 值为;二氧化氯消毒剂B以柠檬酸为激活剂,溶液pH值为。
五步碘量法[2](方法1)1.2.1 测定步骤::①在500ml碘量瓶中加200ml蒸馏水、1ml磷酸盐缓冲溶液,加入二氧化氯溶液,再加入10ml碘化钾溶液混匀。
用L硫代硫酸钠标准液滴定,记录读数为A。
②在上述滴定出A值的溶液中再加入L盐酸,并放置暗处5min。

饮用水中二氧化氯的测定方法确认实验报告一、项目概述依据:本方法依据 GB/T 5750.11-2006 生活饮用水标准检验方法消毒剂指标甲酚红分光光度法。
二、方法原理:在pH=3时,二氧化氯与甲酚红发生氧化还原反应,剩余的甲酚红在碱性条件下显紫红色,于573 nm波长下比色定量。
三、仪器试剂3.1试剂:3.1.1本法配制试剂及稀释标准溶液所用纯水均为无二氧化氯的蒸馏水。
即取蒸馏水每升加入2 mg二氧化氯(或含5 mg游离氯的氯水)放置1天,用二乙基对苯二胺法检查尚有余氯反应。
将此蒸馏水让日光照射或煮沸,检查无余氯后使用。
3.1.2 硫代硫酸钠标准溶液:c=0. 100 0 mol/L.3.1.3碘标准溶液c =0. 100 0 mol/L。
3.1.4淀粉溶液5 g/L。
3.1.5甲基橙指示剂溶液。
3.1.6盐酸溶液(1+23)。
3.1.7 柠檬酸盐缓冲液(pH=3):取16.5ml. 19.2 g,'I.柠檬酸溶液与3.5 mIJ 29.4 g/L柠檬酸钠溶液混合后用纯水稀释至100 ml,。
在pH计上用柠檬酸溶液调pH为3。
3.1.8 甲酚红溶液:称取0.1 g甲酚红,用20 mL 99%乙醇溶解后加水至100 ml.成储备液。
取1mL用纯水稀释为50 mL后使用。
3.1.9氢氧化钠溶液(50 g/l,)。
3.1.10 二氧化氯标准储备溶液:取250 ml.暴气瓶4个串联,于第一及第二两个瓶中依次加入50 ml及100 ml亚氯酸钠饱和溶液,第三及第四个瓶中各加入100 mL纯水,联接好后向第一个瓶中加入硫醛(1+1)至呈酸性(产生黄橙色气体),用500 ml√min的流量抽气,将二氧化氯吸收于纯水中。
当第四个瓶纯水吸收液中黄色较深时停止抽气,取第四个瓶中的标准溶液贮于棕色瓶内,冰箱内保存。
按下法准确测定二氧化氯标准储备溶液的浓度。
A 向250 mL碘量瓶内加入100 mL无需氯量纯水、lg碘化钾及5 mL冰乙酸,摇动碘量瓶,让碘化钾溶完。
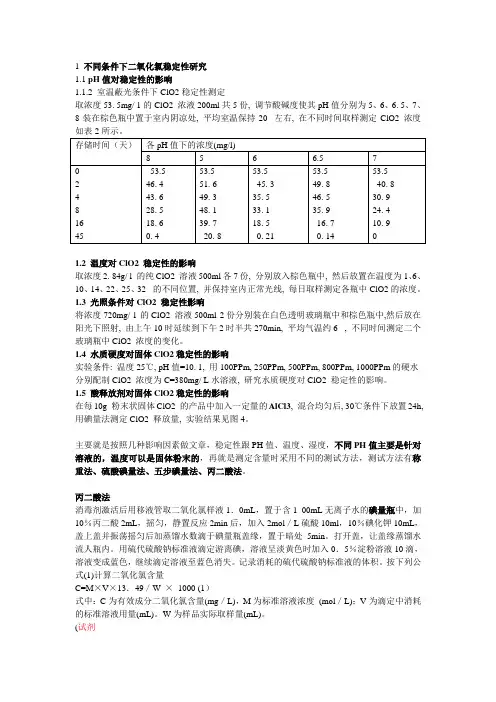
1 不同条件下二氧化氯稳定性研究1.1 pH值对稳定性的影响1.1.2 室温蔽光条件下ClO2稳定性测定取浓度53. 5mg/ 1的ClO2 浓液200ml共5份, 调节酸碱度使其pH值分别为5、6、6. 5、7、8装在棕色瓶中置于室内阴凉处, 平均室温保持20 左右, 在不同时间取样测定ClO2 浓度如表2所示。
存储时间(天)各pH值下的浓度(mg/l)8 5 6 6.5 70 2 4 8 16 4553.546. 443. 628. 518. 60. 453.551. 649. 348. 139. 720. 853.545. 335. 533. 118. 50. 2153.549. 846. 535. 916. 70. 1453.540. 830. 924. 410. 91.2 温度对ClO2 稳定性的影响取浓度2. 84g/ l 的纯ClO2 溶液500ml各7份, 分别放入棕色瓶中, 然后放置在温度为1、6、10、14、22、25、32 的不同位置, 并保持室内正常光线, 每日取样测定各瓶中ClO2的浓度。
1.3 光照条件对ClO2 稳定性影响将浓度720mg/ l 的ClO2 溶液500ml 2份分别装在白色透明玻璃瓶中和棕色瓶中,然后放在阳光下照射, 由上午10时延续到下午2时半共270min, 平均气温约6 , 不同时间测定二个玻璃瓶中ClO2 浓度的变化。
1.4 水质硬度对固体ClO2稳定性的影响实验条件: 温度25℃, pH值=10. 1, 用100PPm, 250PPm, 500PPm, 800PPm, 1000PPm的硬水分别配制ClO2 浓度为C=380mg/ L水溶液, 研究水质硬度对ClO2 稳定性的影响。
1.5 酸释放剂对固体ClO2稳定性的影响在每10g 粉末状固体ClO2 的产品中加入一定量的AlCl3, 混合均匀后, 30℃条件下放置24h,用碘量法测定ClO2 释放量, 实验结果见图4。
美国环保署关于二氧化氯的实验总结二氧化氯专题4.3 二氧化氯的主要用法二氧化氯的CT计算和其他消毒剂相似,。
主要消毒效果是通过残差浓度和有效接触时间来实现的。
实践中发现,由于二氧化氯气体的挥发性,它在管道之类的流反应器中表现非常好。
通过在高速混合容器中充气或者在再碳酸化盆中换气可以轻易地将它从稀释溶液方案中清除。
我们不能指望在过滤器中看到CT效果,因为在过滤水中有可能不存在残差(DeMers and Renner, 1992)。
为了加速CT杀菌效果,可以事先把二氧化氯加到水井或管道中。
要密切观察残差浓度,就要选取大量采样点。
众所周知,二氧化氯暴露在阳光或者荧光下时通常会被UV破坏。
因此,为了避免这种情况,应当有一些保护性的设计。
4.3.1 消毒在选用二氧化氯作为主要消毒剂之前,要进行氧化剂需求实验。
理想情况下,要考虑到水的质量、温度和采样点随季节变化而不同。
表4-2是用一种地表水进行试验得出的结果。
每个D/DBP rule中,二氧化氯的MRDL是0.8mg/L,亚氯酸盐的MCL是1.0mg/L。
这意味着如果氧化剂需求大于1.4mg/L,二氧化氯就不能作为消毒剂,因为副产品亚氯酸盐离子超过最大限制,除非亚氯酸盐之类的无机副产品同时去除。
有无数种方法去除过量的亚氯酸盐。
二氧化氯作为消毒剂在饮用水中的剂量一般是0.07到2.0mg/L。
工厂用的二氧化氯中,亚氯酸盐和氯酸盐的中位数是0.24和0.20mg/L。
而在一项EPA调查中,这一数值是1.0mg/L。
4.3.2 口味和气味控制在美国的饮用水中,二氧化氯普遍应用于控制藻类和腐烂植物的气味。
二氧化氯在消除酚类化合物的味道方面也很有效。
做此用途的二氧化氯,应用地点的选择取决于生水水质和工厂类型。
一般来说,二氧化氯在沉淀池接近尾声时添加。
但是如果生水浑浊度低(比如说低于10NTU),则应该在一开始就添加。
一些机构采取这种做法的原因是二氧化氯能够有效控制暴露在阳光下的沉淀池中的藻类的生长(DeMers and Renner,1992)。

二氧化氯高效广谱消毒杀生作用于1944年美国尼加拉大瀑布水厂对原水脱色除嗅中获得成功后,对二氧化氯开始进行应用研究。
随着人们对氯消毒过程产生的副产物有害研究深入,发现氯代产物氯仿、四氯化碳、氯乙烯、三氯乙烯、氯酚类后致癌作用,国际癌症研究中心认为致癌物质或潜在致癌物质,氯消毒工艺对人体健康有不可忽视的危害性。
二氧化氯的不致癌性,对有害有毒物质的有效分解功能,应用二氧化氯取代氯消毒工艺,受到应有的重视。
美国有300-400家大水厂应用二氧化氯取代氯的消毒工艺,欧洲国家更是在供水系统中广泛应用,并和臭氧、活性碳复合应用于供水系统全过程处理。
二氧化氯发生器是二氧化氯广泛应用的主要方式,评价二氧化氯发生器的好坏,主要看发生器的二氧化氯转化率及有害副产物氯气发生量的多少。
只有高转化率、发生气体中二氧化氯含量高、不发生或很少发生氯气不形成有害有机物、无需SO42-/HSO4-处理的发生器才是当前二氧化氯研究开发的方向。
目前发达国家的小型化学法二氧化氯发生器均采用亚氯酸钠为原料发生,这类发生器的二氧化氯转化率高、纯度高、很少发生有害副产物氯气及其他有害物质。
1.亚氯酸钠发生二氧化氯实验1.1 实验材料亚氯酸钠溶液:取亚氯酸钠结晶(江苏响水县科斯达化工有限公司产,有效含量82%)400克加水至1000毫升,用ZBG12015—89中规定方法测NaClO2浓度(mol/L)。
24%盐酸溶液:取36%盐酸溶液(分析纯)稀释至24%浓度。
实验用水:非离子纯净水。
0.1mg电子分析天平负压真空反应装量微量滴定管:分度值为0.02ml1.3 实验操作:用100 ml移液管精确吸取亚氯酸钠溶液100 ml,吸取24%盐酸溶液100 ml,分别通过加液器加入三颈反应瓶内,常温下反应时间4分钟,反应压力-0.02Mpa,反应结束后立即加凉水定容至1250ml,按碘量法测定残留液亚氯酸钠含量。
反高原料反应液反应时间(min)残留液转化率(%)浓度(mol/L)投加量(ml)M浓度(mol/L)加水定容量(ml)M,NaClO2 3.65 100 0.365 4 0.05144 1250 0.0643 82.3824%盐酸溶液等量投加ClO2产量为16.01克 Cl2产量为0.69克 ClO2有效转化率为63.32% Cl2/ClO2为4.31% ClO2转化率=(M -M')/M×100%1) 实验结果表示,氯酸钠发生二氧化氯实际有效转化率不高,于55°C实验室模拟实验转化率为36.99%,HT908—300发生器实际运行中于运行20分钟、40分钟、60分钟三时段取样检测结果平均值0.9339克/分,平均转化率为35.57%。
8%二氧化氯防治水稻稻瘟病田间试验报告二氧化氯为国际公认的第4代高效、广谱、安全消毒剂,它在作物病害的防治方面具有一定的应用前景。
有关文献也报道它在防治水稻稻瘟病上与井冈霉素的防治效果相当。
为了验证二氧化氯对水稻稻瘟病的防治效果,试图寻找对水体安全的作物病害杀菌剂,我们进行了该试验,试验结果仅供参考。
1 实验材料和方法1.1 实验材料和供试药剂水稻供试品种:Ⅱ优725。
8%二氧化氯粉剂:由张家口绿洁环保化工技术开发有限公司提供。
25%施保克乳油:江苏辉丰农化股份有限公司生产。
1.2 试验场地四川省双流县华阳镇。
试验田为淹育型水稻土壤性灰潮油砂石土,耕层DH 值为5.71,有机质含量为4.2%,含有效氮238mg/kg,速效磷12.70mg/kg,速效钾42.10mg/kg。
1.3 试验方法试验设二氧化氯粉剂100mg/kg,200mg/kg,400mg/kg,清水对照,25%施保克乳油3000倍浸种48小时5个处理,4次重复,小区面积为12m2,采用随机区组排列。
药剂处理方式为播种前浸种,直播,按30kg/hm2的播种量均匀撒播。
2 试验调查2.1 调查项目2.2.1 发芽率测定。
不同处理同时浸种24h,经过培养箱催芽后于4月25日播种。
播种前每处理分4次测定发芽率,每次100粒种子。
2.2.2 抗病性测定。
6月10日调查各处理苗期稻瘟病的发病情况。
3 结果与分析3.1 不同种衣剂包衣种子发芽率试验表明(表1),二氧化氯对水稻种子发芽率基本没有影响,3种浓度处理均略高于清水对照,与药剂对照基本相当。
3.2 不同处理苗期稻瘟病发病情况试验表明(表3),从病指防效看,二氧化氯400mg/kg的病指防效达77.85%,200mg/kg病指防效为73.15%,100mg/kg的病指防效为42.95%,而25%施保克乳油3000倍的病指防效为46.31%,二氧化氯200mg/kg和400mg/kg的防效较好,二氧化氯100mg/kg防效不理想。

二氧化氯消毒液的腐蚀性实验结论(摘自工业水处理网论文)1、10%(100000mg/l)二氧化氯对常用的304(Ocr18Ni9)316(Cr18ni12Mo2-3),不锈钢的腐蚀速率为0.05-0.5mm/a,属良好等级。
500mg/l二氧化氯对不锈钢浸泡72小时,腐蚀速率为0.174mg/h,属中度腐蚀。
一般使用200-250mg/l的二氧化氯对304、316不锈钢不会造成腐蚀。
但由于有些厂家的设备或管道使用了劣质或以次充好的304或316不锈钢,再加上焊接工艺和材料不符合要求,有可能出现局部腐蚀。
2、二氧化氯对普通的不锈钢、碳钢、铝和铜等有中等腐蚀。
3、二氧化氯对聚丙烯纤维类的过滤材料具有腐蚀作用。
4、二氧化氯对PVC塑料基本无腐蚀。
5、二氧化氯对普通橡胶具有中度腐蚀,因此管道的密封垫应采用硅橡胶或含氟塑料。
6、200-250mg/l二氧化氯短时间对人皮肤不会造成刺激但长时间接触最好戴耐酸手套。
二、个性:虽然说二氧化氯的腐蚀有以上科学实验的结论,但实际应用中我们却发现情况很不相同:有的客户使用了多年此产品,设备管道没出过问题,挺好的;有的客户刚刚用没几天,却就出现了设备表面发乌、发黄、出现锈蚀斑点等现象。
似乎在科学的共性之外,还有“个性问题”。
大家知道,金属设备、管道的腐蚀,其实是一种对金属材料有害的电化学反应。
影响这种反应的条件有:空气、湿度、温度、物理影响等。
我们要记住的减低腐蚀的条件大致如下:1、设备所处的环境越干燥越不容易被腐蚀。
2、设备、管道等越与空气隔绝越不容易被腐蚀。
3、越少擦、洗,越不容易被腐蚀。
当然,不是说擦洗、做卫生会让设备被腐蚀,而是经常的机械性擦洗会给设备表面造成肉眼看不到的“伤口”,“伤口”当然容易被侵害、腐蚀了。
4、擦、洗用水越纯净,越不容易被腐蚀。
毋庸讳言,加了任何消毒剂的水肯定都比纯净水更有可能损伤设备;而低浓度的消毒液肯定比高浓度的消毒液对设备的腐蚀性低!不锈钢对CL离子很敏感,容易发生应力腐蚀,各不锈钢耐CL离子浓度如下:SS304--20ppm左右SS316L--50ppm左右其它特种钢可以耐800ppm以上,但是价钱很贵!。
水中二氧化氯的测定1. 引言1.1 背景介绍二氧化氯是一种常用的消毒剂,在水处理过程中起着重要作用。
水中二氧化氯的浓度对水质安全至关重要,因此准确测定水中二氧化氯的浓度是非常重要的。
水中二氧化氯主要来源于消毒过程中使用的二氧化氯消毒剂,以及来自自然界的二氧化氯释放。
二氧化氯虽然能有效杀灭细菌,但过高的浓度却对人体和环境造成危害。
及时准确地测定水中二氧化氯的浓度对水质管理至关重要。
目前常见的水中二氧化氯测定方法包括色度法、电化学法和紫外-可见分光光度法等。
这些方法各有优缺点,需要根据具体情况选择合适的方法进行测定。
测定水中二氧化氯的步骤包括取样、预处理样品、选择合适的测定方法以及数据分析等。
通过测定结果分析,可以评估水中二氧化氯的浓度是否符合标准要求,及时采取措施改善水质。
针对水中二氧化氯的测定方法总结和未来研究方向,可以进一步提高测定准确性和效率。
对于水质安全的影响也需要更深入的研究,以保障公众健康及环境安全。
1.2 研究目的研究目的是为了探究水中二氧化氯的浓度及其影响因素,为保障水质安全提供科学依据。
水中二氧化氯是一种广泛应用于水处理领域的消毒剂,但其过量使用或残留可能会对水体和生物环境造成危害。
了解水中二氧化氯的浓度及其来源十分重要,有助于监测水质安全并及时采取有效措施。
本研究的目的是通过综合分析水中二氧化氯的来源、危害和测定方法,探讨如何准确、快速地测定水中二氧化氯的浓度,并对测定结果进行分析,为未来进一步研究提供参考。
通过本研究,希望能够总结水中二氧化氯的测定方法,探讨未来的研究方向,并评估对水质安全的影响,为水质监测和管理提供科学依据。
2. 正文2.1 水中二氧化氯的来源水中二氧化氯是一种常见的水处理剂,通常用于消毒和净化水源。
它的主要来源可以分为两类:一是工业生产过程中产生的二氧化氯废水,二是水处理过程中添加的二氧化氯消毒剂。
工业生产过程中产生的二氧化氯废水是指在化工生产中使用氯气和氧气合成二氧化氯的过程中产生的废水。
二氧化氯稳定性研究实验方法-丙二酸法,五步碘量法1 不同条件下二氧化氯稳定性研究1.1 pH值对稳定性的影响1.1.2 室温蔽光条件下ClO2稳定性测定取浓度53. 5mg/ 1的ClO2 浓液200ml共5份, 调节酸碱度使其pH值分别为5、6、6. 5、7、8装在棕色瓶中置于室内阴凉处, 平均室温保持20??左右, 在不同时间取样测定ClO2 浓度如表2所示。
1.2 温度对ClO2 稳定性的影响取浓度2. 84g/ l 的纯ClO2 溶液500ml各7份, 分别放入棕色瓶中, 然后放置在温度为1、6、10、14、22、25、32??的不同位置, 并保持室内正常光线, 每日取样测定各瓶中ClO2的浓度。
1.3 光照条件对ClO2 稳定性影响将浓度720mg/ l 的ClO2 溶液500ml 2份分别装在白色透明玻璃瓶中和棕色瓶中,然后放在阳光下照射, 由上午10时延续到下午2时半共270min, 平均气温约6??, 不同时间测定二个玻璃瓶中ClO2 浓度的变化。
1.4 水质硬度对固体ClO2稳定性的影响实验条件: 温度25℃, pH值=10. 1, 用100PPm, 250PPm, 500PPm,800PPm, 1000PPm的硬水分别配制ClO2 浓度为C=380mg/ L水溶液, 研究水质硬度对ClO2 稳定性的影响。
1.5 酸释放剂对固体ClO2稳定性的影响在每10g 粉末状固体ClO2 的产品中加入一定量的AlCl3, 混合均匀后, 30℃条件下放置24h,用碘量法测定ClO2 释放量, 实验结果见图4。
主要就是按照几种影响因素做文章,稳定性跟PH值、温度、湿度,不同PH值主要是针对溶液的,温度可以是固体粉末的,再就是测定含量时采用不同的测试方法,测试方法有称重法、硫酸碘量法、五步碘量法、丙二酸法。
丙二酸法消毒剂激活后用移液管取二氧化氯样液1.0mL,置于含1 00mL无离子水的碘量瓶中,加10%丙二酸2mL,摇匀,静置反应2min后,加入2mol /L硫酸10ml,10%碘化钾10mL,盖上盖并振荡摇匀后加蒸馏水数滴于碘量瓶盖缘,置于暗处5min。
二氧化氯实验报告一预实验实验最初采用亚氯酸钠和柠檬酸反应产生二氧化氯。
根据同济大学周荣丰等发表的论文《直接光度法测定高浓度二氧化氯消毒液》,选定455nm处测定二氧化氯浓度。
论文中说明用分光光度法测定时线性范围为50mg/l-2500mg/l;欧研消毒剂的二氧化氯浓度为10%,将其稀释40-2000倍后测得的吸光度均在线性范围内。
由于条件限制,实验没有配制标准二氧化氯溶液,而参照欧研消毒剂进行实验。
当两者吸光度一致时认为两者二氧化氯含量相同。
亚氯酸钠和柠檬酸的实验结果见下表(以下不特别说明时水均为纯净水):按实验序号1重复实验,测不同时间二氧化氯浓度,结果见下表:从以上结果可看出,亚氯酸钠与柠檬酸反应产生的二氧化氯浓度可以达到与欧研消毒剂一样的效果,但亚氯酸钠与柠檬酸反应速度较慢,影响生产节奏。
因此又采用了亚氯酸钠与盐酸反应产生二氧化氯的实验,亚氯酸钠和盐酸比例根据反应方程式中两者物质的量的比例确定(摩尔比为5:4),结果见下表:从以上结果看,亚氯酸钠与盐酸反应速度明显加快。
二亚氯酸钠与盐酸反应实验在进行此实验前,又查阅了卫生部《消毒技术规范》,其中对二氧化氯含量测定规定了两种方法:碘量法和分光光度法,分光光度法中采用的测定波长是430nm,因此以后实验也采用430nm,430 nm 处虽无最大吸收,但氯气、亚氯酸根离子、氯酸根离子、氯离子在此无吸收,不对二氧化氯检测造成干扰。
改变波长并不影响预实验的结论,但测定的吸光度值比455nm测定时偏高。
1 活化时间2.5g亚氯酸钠溶于50ml水,加4ml浓盐酸,不同反应时间下稀释30倍测吸光度,结果见下表:0.5g欧研消毒剂加100ml水,不同活化时间下直接测吸光度,结果见下表:从上表中可见亚氯酸钠与盐酸反应的活化时间至少需10min,在50min内依然可以用,但活化时间还是比欧研消毒剂长约5min。
2 稀释倍数2.5g亚氯酸钠溶于50ml水,加4ml浓盐酸,活化时间20min,稀释不同倍数测吸光度,结果见下表:从表中可见稀释40倍时二氧化氯浓度与0.5g欧研消毒剂加100ml水后得到的溶液中二氧化氯浓度基本一致(略高一点)。
二氧化氯消毒剂的社会实践调查报告二氧化氯分子由1个氯原子和2个氧原子组成,共结合着19个电子,外层键域上存在一个未成对的活性自由电子,具有很强的氧化作用。
同时,由于产生新生态氧,可使微生物内组成蛋白质的氨基酸断链,破坏微生物的酶系统,这种作用是一般含氯的消毒剂或过氧乙酸不能比拟的(其它消毒剂只使蛋白质变性)。
二氧化氯的广谱杀菌作用,对高等动物细胞结构几乎毫无影响,其分解产物为水、氯化钠、微量二氧化碳。
北京疾病预防控制中心的毒理实验结果为:1、急性毒理实验,属无毒。
2、致突变实验,无。
3、ames实验,阴性。
应用二氧化氯的优势:易溶于水,但不水解,溶解度是氯气的5倍杀菌力强能迅速地杀死病毒、细菌、原生生物、藻类和真菌能有效地杀死贾弟虫孢子、隐孢子和孢子形成菌ph适应范围广,能在很宽的ph范围内保持很高的杀菌效率不会产生有机氯化物,不会形成三卤甲烷不会与氨反应能快速去除水中铁及锰能破坏酚、硫化物、氰化物和其它许多有机物具有漂白脱色作用腐蚀性低二氧化氯(clo2)是一种水溶性的强氧化剂,在常温常压下是黄绿色的气体,但在更低的温度下则呈液态,其分子量为67.45,沸点11c,熔点59c,气体clo2密度为3.09(11c),液体clo2的密度为1.64,0℃的饱和蒸汽压为500torr。
二氧化氯在水中以二氧化氯单体存在,不聚合生成clo2气体,在20c和4kpa压力下,溶解度为2.9g/l。
在水中不与有机物结合,不生成三氯甲烷致癌物,因此被称为不致癌的消毒剂。
clo2结构中有一个带有孤对电子的氯氧双键结构,极不稳定,光反应会产生氧自由基,具有强的氧化性。
下表列出了二氧化氯与其它氧化类消毒剂的氧化能力,亦即杀菌能力的比较(用有效氯表示)。
氧化剂clo2h2o2naclo2kmno4cl2naclo氧化能力263%209%157%111%100%93%如果以氯气的氧化能力为100%的话,二氧化氯的理论氧化能力是氯气的2.6倍,次氯酸钠的2.8倍,双氧水的1.3倍。
二氧化氯检验报告1. 引言本报告是针对样本中二氧化氯含量进行测试和分析的检验报告。
二氧化氯是一种广泛应用于消毒和杀菌的化学物质,因其高效、稳定和无毒性而被广泛使用。
在本次检验中,我们将通过测量样本中的二氧化氯含量,评估其符合相关标准和指南的程度。
2. 方法2.1 样本收集我们从供应商处获得了一批二氧化氯样本,并按照标准操作程序进行了标识和储存,以确保样本的完整性和代表性。
2.2 仪器设备在本次检验中,我们使用了以下设备和仪器:•二氧化氯测量仪:用于测量样本中的二氧化氯含量。
•称量器:用于准确称量样本。
•实验室洗涤设备:用于清洗实验器具和容器。
2.3 检测步骤以下是我们进行二氧化氯检验的步骤:1.准备样本:从供应商处取得的样本瓶中取出适量样本。
2.稀释样本:根据需要,将样本稀释至适当的测量范围。
3.清洗仪器:使用实验室洗涤设备清洗测量仪器和容器,以确保准确的测量结果。
4.测量样本:使用二氧化氯测量仪对样本进行测量,并记录测量值。
5.重复测量:对同一样本进行多次测量,以确保结果的准确性和可重复性。
6.计算平均值:将多次测量的结果取平均值,作为最终的二氧化氯含量。
3. 结果分析根据我们的检测结果,样本中的二氧化氯含量为X mg/L。
根据相关标准和指南,该含量是符合要求的,并且可以满足消毒和杀菌的目的。
4. 结论本次二氧化氯检验结果表明,样本中的二氧化氯含量符合消毒和杀菌的要求。
这意味着样本可以被安全地使用,目的达到消毒和杀菌的效果。
5. 建议在未来的检验中,建议继续监测和测试样本中的二氧化氯含量,以确保其始终符合相关标准和指南的要求。
定期进行检验是确定样本质量和安全性的重要措施,可以有效预防病菌传播和保护人们的健康。
6. 参考文献[参考文献 1][参考文献 2]。
LABORATORY METHODFOR THE PRODUCTION OF ClO2 FREE FROM HCl AND Cl2The experimental equipment is shown in the attached Figure 1. The reaction vessel is a 3 liter round bottomed flask. All glassware shown is Pyres, except for the ClO2solution receiving bottle. Standard taper interchangeable ground glass joints are used throughout, with the exception of the joint between the trap flask and the tubing leading the receiving bottle. This joint may be made with a short piece of Tygon tubing, to be renewed each time the apparatus is used. The equipment should be shielded by a steel or safety glass screen, and should not be exposed to direct sunlight.To operate, weigh out 139 grams of NaClO3(or 160grams of KClO3) and 133 grams of crystalline oxalic acid ((COOH)2·2H2O), and place in the proportions 120 ml of concentrated H2SO4(98%) to 400 ml of distilled H2O. Add 333ml of this H2SO4 solution to the reaction flask, and assemble the equipment, taking care to moisten the ground glass joints with distilled water.The trap flask must contain sufficient distilled water to cover the end of the downcoming tube, but not so much as to suck back into the reaction flask in case of a heating failure. The distilled water in the ClO2 receiver should be precooled with ice water. The trap may be kept at room temperature.With the equipment all connected and an ice water bath surrounding the receiving bottle, the reaction is starred by immersing the reaction flask in a water bath at 60℃. At this temperature the bulk of the reaction will take place in form 1/2 to 1 hour. (Caution: the liquid reaction mixture will explode if the temperature is allowed to rise to the vicinity of 100℃). The CO2 produced by the decomposition of the oxalic acid dilutes the ClO2so that noexplosion occurs in the gas phase in the absence of direct sunlight. The gases pass through the trap flask, where traces of H2SO4, HCl, and Cl2are removed, and the rest into the receiving bottle, where the ClO2 is dissolved.At the conclusion of a run, the heat is removed from the reaction flask by removing the water bath. The receiving bottle may contain liquid chlorine dioxide octahydrate, in case the temperature was too low. This may be dissolved by applying warm water to the outside of the flask.The bottle containing ClO2 solution is closed with a tight –fitting glass stopper and stored in cold water in the dark, to minimize both the loss of ClO2 to the air, and the decomposition to Cl2 and O2.E.B.MarumAlkall Research Division2006.03.24 整理2006.03.23 晚22:30制备约2.3升二氧化氯水溶液图1中的Reaction Flask 采用了2升的24磨口圆底烧瓶,Trap Flask gas washing bottle 采用了250毫升24磨口的锥形瓶,Tygon tubing connection采用硅胶管,Pyrex tubing 采用直形冷凝管但不通冷凝水,Receiving bottle 采用2.5升棕色磨口瓶。
二氧化氯实验报告
一预实验
实验最初采用亚氯酸钠和柠檬酸反应产生二氧化氯。
根据同济大学周荣丰等发表的论文《直接光度法测定高浓度二氧化氯消毒液》,选定455nm处测定二氧化氯浓度。
论文中说明用分光光度法测定时线性范围为50mg/l-2500mg/l;欧研消毒剂的二氧化氯浓度为10%,将其稀释40-2000倍后测得的吸光度均在线性范围内。
由于条件限制,实验没有配制标准二氧化氯溶液,而参照欧研消毒剂进行实验。
当两者吸光度一致时认为两者二氧化氯含量相同。
亚氯酸钠和柠檬酸的实验结果见下表(以下不特别说明时水均为纯净水):
按实验序号1重复实验,测不同时间二氧化氯浓度,结果见下表:
从以上结果可看出,亚氯酸钠与柠檬酸反应产生的二氧化氯浓度可以达到与欧研消毒剂一样的效果,但亚氯酸钠与柠檬酸反应速度较慢,影响生产节奏。
因此又采用了亚氯酸钠与盐酸反应产生二氧化氯的实验,亚氯酸钠和盐酸比例根据反应方程式中两者物质的量的比例确定(摩尔比为5:4),结果见下表:
从以上结果看,亚氯酸钠与盐酸反应速度明显加快。
二亚氯酸钠与盐酸反应实验
在进行此实验前,又查阅了卫生部《消毒技术规范》,其中对二氧化氯含量测定规定了两种方法:碘量法和分光光度法,分光光度法中采用的测定波长是430nm,因此以后实验也采用430nm,430 nm 处虽无最大吸收,但氯气、亚氯酸根离子、氯酸根离子、氯离子在此无吸收,不对二氧化氯检测造成干扰。
改变波长并不影响预实验的结论,但测定的吸光度值比455nm测定时偏高。
1 活化时间
2.5g亚氯酸钠溶于50ml水,加4ml浓盐酸,不同反应时间下稀释30倍测吸光度,结果见下表:
0.5g欧研消毒剂加100ml水,不同活化时间下直接测吸光度,结果见下表:
从上表中可见亚氯酸钠与盐酸反应的活化时间至少需10min,在50min内依然可以用,但活化时间还是比欧研消毒剂长约5min。
2 稀释倍数
2.5g亚氯酸钠溶于50ml水,加4ml浓盐酸,活化时间20min,稀释不同倍数测吸光度,结果见下表:
从表中可见稀释40倍时二氧化氯浓度与0.5g欧研消毒剂加100ml水后得到的溶液中二氧化氯浓度基本一致(略高一点)。
3 用自来水实验
考虑到车间使用自来水方便,用自来水进行了实验,结果见下表:
以上结果可见用自来水无影响。
4 验证实验
用自来水进行验证实验,结果见下表:
从以上结果可见,实验结果重现性可以接受。
由于开始活化时反应速度很快,反应曲线波动很大,测定时间难以准确一致,所以结果有差异。
三生产具体操作
生产上是将3袋(100g)欧研消毒剂加入至一槽子(约2000kg)中消毒,从上面实验数据中可以看出,将2.5g亚氯酸钠溶于50ml水,加4ml浓盐酸后反应10min 再稀释40倍所得溶液二氧化氯浓度与0.5g欧研消毒剂加100ml水后得到的溶液中二氧化氯浓度基本一致。
因此实际操作中,可取75g亚氯酸钠溶于1500ml自来水中,加浓盐酸120ml 活化10min后,可直接供一槽水消毒使用。
若生产较快,可一次多配些,用时一槽水取1500ml加入即可,但放置时间不能超过50min。
四经济分析
从实验数据可知,将0.25g亚氯酸钠溶于5ml水,加0.4ml浓盐酸活化10min 后再稀释40倍,得溶液200ml,吸光度为0.518;另将1.0g欧研消毒剂加200ml 水,活化10min吸光度为0.470,以此数据进行费用分析。
目前市场价(按优质品等级计):亚氯酸钠 13元/kg,浓盐酸 1元/kg,欧研消毒剂 80元/kg。
用亚氯酸钠和盐酸得200ml吸光度为0.518 的溶液需费用为0.00365元;
用欧研消毒剂得200ml吸光度为0.470的溶液需费用为0.08元。
本年生产欧研消毒剂费用:9000袋×8元/袋=72000元,达到同样消毒效果时所需亚氯酸钠、盐酸费用:0.00365×100×9000=3285元。
五说明
盐酸销售程序国家控制较严,采购程序为先与厂方签定合同,再拿合同和执照到注册所在地公安局开证明后再进行采购。
每次采购都要到公安局开证明。
此致
敬礼
2007.12.4。