无机化学应知应会练习
- 格式:doc
- 大小:1.70 MB
- 文档页数:71


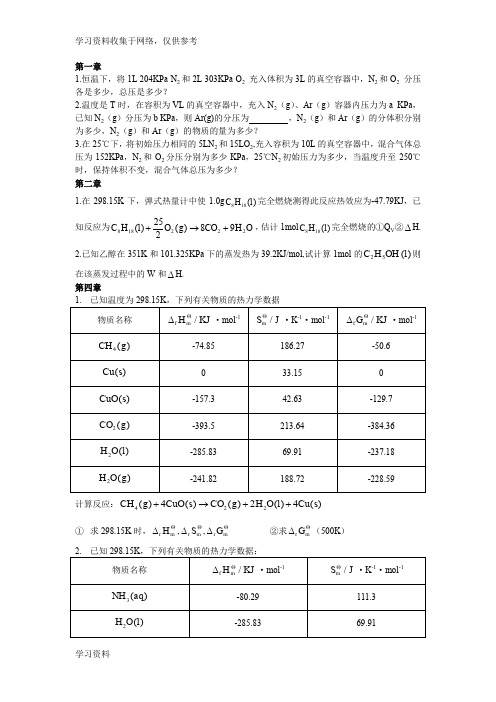
第一章1.恒温下,将1L 204KPa N 2和2L 303KPa O 2 充入体积为3L 的真空容器中,N 2和O 2 分压各是多少,总压是多少?2.温度是T 时,在容积为VL 的真空容器中,充入N 2(g )、Ar (g )容器内压力为a KPa ,已知N 2(g )分压为b KPa ,则Ar(g)的分压为 ,N 2(g )和Ar (g )的分体积分别为多少,N 2(g )和Ar (g )的物质的量为多少?3.在25℃下,将初始压力相同的5LN 2和15LO 2,充入容积为10L 的真空容器中,混合气体总压为152KPa ,N 2和O 2分压分别为多少KPa ,25℃N 2初始压力为多少,当温度升至250℃时,保持体积不变,混合气体总压为多少? 第二章1.在298.15K 下,弹式热量计中使1.0g )(188l H C 完全燃烧测得此反应热效应为-47.79KJ ,已知反应为O H CO g O l H C 22218898)(225)(+→+,估计1mol )(188l H C 完全燃烧的①Q V ②∆H. 2.已知乙醇在351K 和101.325KPa 下的蒸发热为39.2KJ/mol,试计算1mol 的)(52l OH H C 则在该蒸发过程中的W 和∆H. 第四章1. 已知温度为298.15K ,下列有关物质的热力学数据物质名称f /m H KJ Θ∆·mol -1/m S J Θ·K -1·mol -1f /m G KJ Θ∆·mol -14()CH g-74.85 186.27 -50.6 u()C s0 33.15 0 ()CuO s -157.3 42.63 -129.7 2()CO g-393.5 213.64 -384.36 2()H O l -285.83 69.91 -237.18 2()H O g-241.82188.72-228.59计算反应:422()4()()2()4u()CH g CuO s CO g H O l C s +→++ ① 求298.15K 时,r m H Θ∆,r m S Θ∆,r m G Θ∆ ②求r m G Θ∆(500K ) 2. 已知298.15K ,下列有关物质的热力学数据:物质名称f /m H KJ Θ∆·mol -1/m S J Θ·K -1·mol -13()NH aq -80.29 111.3 2H ()O l-285.8369.914NH ()aq +-132.51 113.4 OH ()aq --229.99-10.75用热力学原理计算反应324()H ()NH ()OH ()NH aq O l aq aq +-+→+在298.15K 和373.15K时的K Θ。

无机化学应知应会班级___________姓名___________ _第一章化学反应中的质量关系和能量关系基本要求:1.化学计量数和反应进度的概念2.状态函数及其特征3.状态函数焓(H)及焓变(ΔH)4.标准摩尔反应焓变(ΔrH°m,298)和标准摩尔生成焓(ΔfH°m,298);5.标准摩尔反应焓变(ΔrH°m,298)的计算。
重点:状态函数焓、标准摩尔生成焓的概念和标准摩尔反应焓变的计算。
难点: 标准摩尔生成焓和标准摩尔反应焓变的区别。
标准摩尔反应焓变(ΔrH°m,298)及计算:(1).标准摩尔生成焓ΔfH°m,298每种物质i有标准摩尔生成焓,其定义为:在标准态(P°=101325pa)和298K,由稳定单质生成单位物质的量某物质时的焓变(即恒压热),称为该物质的标准摩尔生成焓,H°m,298,i,单位为kJ²mol-1.表示为Δf稳定单质的标准摩尔生成焓为0.(2).标准摩尔反应焓变ΔrH°m,298的计算根据各反应物和生成物的标准摩尔生成焓ΔfH°m,298求反应的标准摩尔焓变ΔrH°m,298ΔrH°m,298=Σ(νΔf H°m298,i)生成物+Σ(νΔf H o,m298,i)反应物练习题判断练习:1、系统的焓变等于恒压反应热。
.....................(+)2、在恒温恒压下,某化学反应的热效应Q p=△H=H2-H1,因为H是状态函数,故Q p也是状态函数。
答:(--)3、系统的焓等于系统的热量。
答:(--)4、在一玻璃球内装有气体(可视作理想气体),连接着另一真空的玻璃球,打开两球之间的活塞使之相通,则系统(取两玻璃球为系统)的熵值增大。
答:(+)5、∆r H大,并不预示其反应速率快。
答:(+)6、同一聚集状态的物质B的标准熵值与所处温度有关,其规律为S(B,高温)>S(B,低温)。

⽆机化学第⼗六章氧族元素知识题第16章氧族元素16-1 写出下列物质的化学式。
(1)⽅铅矿;(2)朱砂;(3)闪锌矿;(4)黄铜矿;(5)黄铁矿;(6)芒硝;(7)海波;(8)保险粉解:(1)PbS (2)HgS (3)ZnS (4)CuFeS2 (5)FeS2 (6)Na2SO4·10H2O (7)Na2S2O3·5H2O(8)Na2S2O4·2H2O16-2 命名下列硫的含氧酸及盐。
(1)K2S2O7;(2)H2SO5;(3)K2S2O8;(4)Na2S2O3·5H2O;(5)Na2S2O4;(6)Na2SO3;(7)Na2S4O6;(8)Na2SO4·10H2O 解:(1)焦硫酸钾(2)过⼀硫酸(3)过⼆硫酸钾(4)五⽔合硫代硫酸钠(俗称海波)(5)连⼆亚硫酸钠(6)亚硫酸钠(7)连四硫酸钠(8)⼗⽔合硫酸钠(俗称芒硝)16-3 完成并配平下列反应⽅程式。
(1)H2S+ClO3-+H+ ------(2)Na2S2O4+O2+NaOH------(3)PbO2+H2O2 ------(4)PbS+H2O2 -------(5)S+NaOH(浓)------(6)Cu+H2SO4(浓)------(7)H+H2SO4(浓)------(8)H2S+H2SO4(浓)------(9)SO2Cl2+H2O------(10)HSO3Cl+H2O------解:(1)5H2S + 8ClO3- === 5SO42- + 2H+ + 4Cl2 +4H2O (2)Na2S2O4 + O2 +2NaOH === Na2SO3 + Na2SO4 + H2O (3)PbO2+H2O2 === PbO + H2O + O2↑(4)PbS+4H2O2 === PbSO4 + 4H2O(5)3S + 6NaOH(浓) === 2 Na2S + Na2SO3 + 3H2O (6)Cu +2H2SO4(浓) === CuSO4 + SO2↑+ 2H2O(7)S + 2H2SO4(浓) === 3SO2↑+2 H2O(8)H2S + H2SO4(浓) === S↓+ SO2+ 2H2O(9)SO2Cl2+2H2O === H2SO4+2HCl(10)HSO3Cl+H2O === H2SO4+HCl16-4 完成下列各反应的化学⽅程式。

一、选择题1、稀溶液依数性的本质是(D、蒸气压下降)2、血红细胞置于下列哪种溶液中将会引起皱缩现象?(A、15g·L-1NaCl溶液)3、利用凝固点降低法测定葡萄糖的分子量时,如果葡萄糖样品中含有不溶性杂质,则测得的分子量(B、偏高)4、人的血浆在-0.56℃凝固,则37℃血浆的渗透浓度为(已知Kf =1.86)(B、301 mmol.L-1)5、37℃时血液的渗透压为775 kPa,与血液具有相同渗透压的葡萄糖静脉注射液的浓度为(D、0.301mol·L-1)6、质量浓度为50.0g·L-1的葡萄糖溶液(M=180)的渗透浓度为B、278m mol·L-17、欲使被半透膜隔开的两种溶液间不发生渗透,应使两溶液的B、c os相同8、下列溶液中,凝固点降低最多的是(D、0.015 mol/L BaCl2)。
9、有三份溶液:a、0.1mol·L-1 C6H12O6;b 、0.1 mol·L-1 NaCl;c、0.1 mol·L-1 CaCl2。
在相同温度下,三份溶液蒸汽压由大到小的顺序正确的是:A、a>b>c10、测定高分子化合物血红素相对分子质量的最适宜方法是D、渗透压力法11、下列水溶液凝固点最高的是:(C、0.1 mol·L-1C6H12O6)12、下列各物质均配成0.10mol/L的溶液,相同温度下,它们的渗透压由高到低的顺序是(C、Al(NO3),MgCl2,KNO3)13、医药上关于等渗、低渗、高渗溶液概念正确的是(C、蒸3气压范围在719.4—820kPa的溶液称等渗液如0.9%生理盐水)。
14、测定葡萄糖溶液的凝固点时,如果葡萄糖样品中含有不溶性杂质,根据ΔT f≈K f m判断测得的ΔT f值比不含杂质时为(B、小)。
15、在讨论稀溶液蒸气压降低的规律时,溶质必须是(C、非挥发性物质)16、质量浓度为84g/L的NaHCO3(M=84g/mol)溶液产生的渗透压相当于哪种溶液产生的渗透压?(C 、1 mol/L NaCl 溶液)17、在稀溶液的凝固点降低公式△T f =K f ·m 中m 所代表的是溶液中(A 、溶质的质量摩尔浓度)。
无机化学练习题一、选择题1.Na2S2O7中S的氧化数是()(A) +2 (B) +4 (C) +6 (D) +82.相同浓度的下列几种酸中,酸性最弱的是()(A) HCl (B) HBr (C) HI (D) H2Se3.CaF2 的K sp = 3.95×10-11 ,在氟离子浓度为3.0 mol·dm-3 的溶液中Ca2+离子可能的最高浓度是( ) (A)4.39×10-11 mol·dm-3 (B) 1.09×10-12 mol·dm-3(C) 1.09×10-13 mol·dm-3 (D) 4.39×10-12 mol·dm-34.由下列反应设计的电池,不需要惰性电极的是( )(A) H2(g) + Cl2 (g) = 2HCl(aq) (B) Ce4++ Fe2+= Ce3++ Fe3+(C) Zn + Ni2+= Zn2++ Ni (D) Cu + Br2 = Cu2++ 2Br-5.向原电池Zn│Zn2+(1 mol.dm-3 )‖Cu2+(1 mol.dm-3 )│Cu的负极中通入H2S气体,生成白色沉淀,则电池的电动势将( ) (A) 增大(B) 减小(C) 不变(D) 无法判断6.由铬在酸性溶液中的元素电势图,可确定能自发进行的反应是( )Cr3+ - 0.41VCr2+- 0.91VCr(A) 3Cr2+→ 2Cr3++ Cr (B) Cr + Cr2+→ 2Cr3+(C) 2Cr → Cr2++ Cr3+(D) 2Cr3++ Cr → 3Cr2+7.已知:Fe3++ e-= Fe2+θE= 0.77 VCu2++ 2e-= Cu θE= 0.34 VAg++ e-= Ag θE= 0.80 VAl3++ 3e-= Al θE= -1.66 V则最强的氧化剂是( ) (A) Al3+(B) Fe3+(C) Cu2+(D) Ag+8.下列新制备出的氢氧化物沉淀在空气中放置,颜色不发生变化的是( )(A) Fe(OH)2(B) Mn(OH)2(C) Co(OH)2(D) Ni(OH)29.Fe3+具有d5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能P 所要满足的条件是( ) (A) △和P越大越好(B) △> P (C) △< P (D) △= P10.不具有空间异构体的是( )(A) [PtCl2(NH3)4]2+(B) [PtCl3(NH3)3]+(C) [PtCl(NO2)(NH3)4]2+(D) [PtCl(NH3)5]3+11.下列反应中配离子作为氧化剂的反应是( )(A) [Ag(NH3)2]Cl + KI = AgI↓+ KCl + 2NH3(B) 2[Ag(NH3)2]OH + CH3CHO = CH3COOH + 2Ag↓+ 4NH3 + H2O(C) [Cu(NH3)4]2+ + S2-= CuS↓+ 4NH3(D) 3[Fe(CN)6]4-+ 4Fe3+ = Fe4[Fe(CN)6]312. [Ni(CN)4]2-是平面四方形构型,中心离子的杂化轨道类型和d电子数分别是( )(A) sp2,d7(B) sp3,d8 (C) d2sp3,d6(D) dsp2,d813.下列原子中半径最大的是( )(A) Ba (B) Ca (C) As (D) At14.IA族的金属(除锂外)与过量水反应的产物,最好的表示是( )(A) MOH和H2(B) M+(aq),OH-(aq)和H2(C) MOH和H2O (D) M2O和H215.下列各组化合物热稳定性关系正确的是( )(A) Na2CO3 > Na2SO4(B) K2CO3 > Ag2CO3(C) NaHCO3 > Na2CO3(D) (NH4)2CO3 > ZnCO316.常温下和N2能直接起反应的金属是( )(A) Na (B) K (C) Be (D) Li17.ICl2-离子的几何形状为直线型,其中心原子I 的杂化态为( )(A) sp (B) sp2(C) sp3(D) sp3d18.向含I-的溶液中通入Cl2,其产物可能是( )(A) I2和Cl-(B) IO3-和Cl-(C) ICl2-(D) 以上产物均可能19.干燥H2S气体,通常选用的干燥剂是( )(A) 浓H2SO4(B) NaOH (C) P2O5(D) NaNO320.下列化合物中同时具有离子键和共价键的是( )(A) ClF (B) NaCl (C) NaCN (D) H2SO421.ⅣA族元素从Ge到Pb,下列性质随原子序数的增大而增加的是( )(A) +2氧化态的稳定性(B) 二氧化物的酸性(C) 单质的熔点(D) 氢化物的稳定性22.能共存于酸性溶液中的一组离子是( )(A) K+,I-,SO42-,MnO4-(B) Na+,Zn2+,SO42-,NO3-(C) Ag+,AsO43-,S2-,SO32-(D) K+,S2-,SO42-,Cr2O72-23. 当0.075 mol·dm-3的FeCl2溶液通H2S气体至饱和(浓度为0.10 mol·dm-3),若控制FeS 不沉淀析出,溶液的pH值应是()(K sp(FeS) = 1.1 ⨯ 10-19,H2S:K a1 = 9.1 ⨯ 10-8,K a2 = 1.1 ⨯ 10-12)(A) pH≤0.10 (B) pH≥0.10 (C) pH≤8.7 ⨯ 10-2(D) pH≤1.06二、填空题1.在含有AgCl固体的饱和溶液中加入盐酸,则AgCl的溶解度;如加入氨水,则其溶解度;若加入KNO3,则其溶解度。
化学奥赛⾃学资料—⽆机化学全部知识要点及配套练习奥赛⾃学资料—⽆机化学全部知识要点及配套练习⼀.⽆机化学(理论部分)知识点应⽤归纳1、⽆机物(分⼦或离⼦)构型:(1)简单分⼦(或离⼦):(2)配合物:2、物质的熔、沸点(包括硬度):(1)晶体类型:原⼦晶体,离⼦晶体,⾦属晶体,分⼦晶体(2)离⼦晶体:(3)分⼦晶体(4)⾦属晶体:⾦属键(与价电⼦、价轨道有关)3、物质的稳定性:(1)⽆机⼩分⼦:(2)配合物:4、物质的磁性:(1)⽆机⼩分⼦:MO (掌握双原⼦分⼦轨道能级图)(共价双原⼦分⼦)(2)配合物:5、物质的颜⾊:(1)⽆机⼩分⼦:极化理论(2)配合物:6、⽆机物溶解度:(1)离⼦晶体:(2)共价化合物:7、物质的氧化还原性:影响因素(1)溶液酸、碱度(2)物质的聚集状态8、化学反应⽅向:(1)热⼒学数据:(2)软硬酸碱理论9、分⼦极性、键的极性、键⾓、键长等:10、推导元素在周期表中的位置:能级组取值,选择—组合理量⼦数:四个量⼦数取值规则11、溶液中有关质点浓度计算:化学平衡,电离平衡,沉淀—溶解平衡,氧化—还原平衡,配合解离平衡:利⽤多重平衡规则,K是关键12、常见的基本概念:对⾓线规则;惰性电⼦对效应;Lewis酸、碱;质⼦酸、碱;缓冲溶液;屏蔽效应;钻穿效应;同离⼦效应;盐效应;镧系收缩;电负性;电离势;电⼦亲合势;晶格能;键能;有效核电荷及求法等。
⼆.⽆机化学(元素部分)(1)结构(2)性质:重点是化学性质第⼀讲分⼦结构(molecular structure)1-1 离⼦键理论⼀、基本要点活泼⾦属和活泼⾮⾦属的原⼦反应时,⽣成的化合物如NaCl等都是离⼦型化合物,它们具有⼀些固有的特征,如它们都以晶体的形式存在,具有较⾼的熔、沸点,在熔融态或⽔溶液中可导电等。
这种由于原⼦间发⽣电⼦转移,⽣成正负离⼦,并通过静电库仑作⽤⽽形成的化学键称为离⼦键。
通常,⽣成离⼦键的条件是两原⼦的电负性差⼤于1.7以上,由离⼦键形成的化合物叫做离⼦键化合物。
无机及分析化学第一章1、理想气体状态方程式:pV nRT = mp V R T M=p M R T ρ=(注意单位的一致) 2、道尔顿分压定律:123p p p p =+++…… i i p x p =(注意分压的定义)3、两个浓度表示法: 物质的量浓度 B B n c V = (-1mol L ⋅) 质量摩尔浓度 BB An b m = (1mol kg -⋅) 4、溶液的依数性:定性:蒸气压下降(根本原因);沸点升高;凝固点下降;产生渗透压 变化程度:A 2B(或AB 2)型>AB 型>弱电解质溶液>非电解质溶液 定量:少量难挥发非电解质的稀溶液*A (B)(B)p p K b p M b =⋅=⋅⋅ΔT b = K b · b ΔT f = K f · bc RTbRT π=5、胶体:性质:布朗运动;丁达尔效应;电泳;电渗溶胶粒子带电原因:胶体粒子对溶液中的离子产生选择性吸附 AgNO 3 + KI (过量)→ [(AgI)m ·nI - · (n-x )K +]x - · x K +AgNO 3(过量)+ KI → [(AgI)m ·nAg + · (n-x ) NO 3-]x + · x NO 3- 电位离子和反离子吸附层和扩散层:加入电解质,使得吸附层里的反离子增多,ζ电势下降,胶体聚沉。
聚沉值和聚沉能力:与胶粒带相反电荷的离子的价数影响最大,价数越高,聚沉能力越强练 习1. 5.8% NaCl 溶液产生的渗透压接近于( )。
(a )5.8%蔗糖溶液 (b )5.8%的HAc 溶液 (c )2.0 mol·kg -1 蔗糖溶液 (d )1.0 mol·kg -1葡萄糖溶液2. 在 0℃ 的 100 g KCl 溶液中,加入重量为 100 g 的冰,一段时间后,混合液中冰的质量为( )。
无机化学复习一(本大题分30小题,每小题1分,共30分)1、因为△r G(T)=-RT ln K,所以温度升高,K减小。
.......................................()2、当可逆反应达到平衡时,各反应物和生成物的浓度一定相等。
.............()3、反应2A(g)+B(g)C(g)的△r H>0,达到平衡后,升高温度,由于正、逆反应速率均加快,所以上述平衡不发生移动。
......................................................................................()4、难溶电解质的K是温度和离子浓度的函数。
................................................... ()5、弱酸及其盐组成的缓冲溶液的pH值必定小于7。
.............................................()6、密闭容器中,A、B、C三种气体建立了如下平衡:A(g)+B(g)C(g),若保持温度不变,系统体积缩小至原体积的2时,则反应商Q与平衡常数的关系是:Q=1.5K。
........()37、已知298K时,K(BaSO4)=1.1⨯10-10,其相对分子质量为233.3。
若将1.0⨯10-3molBaSO4溶于10L水中形成饱和溶液,则未溶解的BaSO4的质量为0.21g。
................................................ ()8、E(Cr2O72-/Cr3+)<E(Cl2/Cl-),但是,K2Cr2O7与浓度较大的HCl(aq)可以反应生成Cl2。
这是由于c(HCl)增大,使E(Cr2O72-/Cr3+)增大,同时又使E(Cl2/Cl-)减小,从而使E(Cr2O72-/Cr3+)>(Cl2/Cl-)。
无机化学复习一一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画 )(本大题分30小题,每小题1分,共30分)1、因为△r G(T)=-RT ln K,所以温度升高,K减小。
.......................................()2、当可逆反应达到平衡时,各反应物和生成物的浓度一定相等。
.............()3、反应2A(g)+B(g)C(g)的△r H>0,达到平衡后,升高温度,由于正、逆反应速率均加快,所以上述平衡不发生移动。
......................................................................................()4、难溶电解质的K是温度和离子浓度的函数。
................................................... ()5、弱酸及其盐组成的缓冲溶液的pH值必定小于7。
.............................................()6、密闭容器中,A、B、C三种气体建立了如下平衡:A(g)+B(g)C(g),若保持温度不变,系统体积缩小至原时,则反应商Q与平衡常数的关系是:Q=1.5K。
........()体积的237、已知298K时,K(BaSO4)=1.1⨯10-10,其相对分子质量为233.3。
若将1.0⨯10-3molBaSO4溶于10L水中形成饱和溶液,则未溶解的BaSO4的质量为0.21g。
................................................ ()8、E(Cr2O72-/Cr3+)<E(Cl2/Cl-),但是,K2Cr2O7与浓度较大的HCl(aq)可以反应生成Cl2。
这是由于c(HCl)增大,使E(Cr2O72-/Cr3+)增大,同时又使E(Cl2/Cl-)减小,从而使E(Cr2O72-/Cr3+)>(Cl2/Cl-)。
...........................................................................................................( )9、E(Cl2/Cl-)<E(Cl2/AgCl)。
........................................................................................()10、(1)Zn+Cu2+Zn2++Cu E(2)Fe2++Zn Fe+Zn2+E(3)Fe+Cu2+Fe2++Cu E则E=E-E。
......................................................................................................... ()11、金属离子A3+、B2+可分别形成[A(NH3)6]3+和[B(NH3)6]2+,它们的稳定常数依次为4⨯105和2⨯1010,则相同浓度的[A(NH3)6]3+和[B(NH3)6]2+溶液中,A3+和B2+的浓度关系是c(A3+)>c(B2+)。
()12、f区元素原子主要在(n-2)f亚层中电子数目不同,外层及次外层则相差不多,所以同一周期的f区元素之间表现出相似的化学性质。
...............................................................()13、SnCl2分子和H2O分子的空间构型均为V型,表明它们的中心原子采取相同方式的杂化轨道成键。
.........................................................................................................................................()14、能形成共价分子的主族元素,其原子的内层d轨道均被电子占满,所以不可能用内层d轨道参与形成杂化轨道。
.......................................................................................................()15、H2O的熔点比HF高,所以O-H…O氢键的键能比F-H…F氢键的键能大。
.....()16、CsCl晶体是由Cs+和Cl-的简单立方交错(重叠1/8)排列而成。
.................()17、自然界存在的晶体或人工制备的晶体中,所有粒子都是按照一定规律有序排列的,没有任何缺陷。
.............................................................................................................................()18、金属晶体可以看作由金属原子以等径圆球相互紧密堆积而成,通常有面心立方最紧密堆积、六方最紧密堆积和体心立方紧密堆积三种排列方式。
...........................()19、在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。
因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。
.........................................................................................................................()20、已知K2[Ni(CN)4]与Ni(CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。
................................................................................................()21、碱金属氧化物的稳定性次序为:Li2O>Na2O>K2O>Rb2O>Cs2O。
..............()22、H-在水溶液中不能存在。
................................................................................................()23、碱土金属氯化物的熔点高低次序为:BeCl2<MgCl2<CaCl2<SrCl2<BaCl2。
...()24、H[Sb(OH)6]是难溶于水的弱酸。
..................................................................................()25、试剂瓶中存放的SnCl2·6H2O,长时间后,会生成不溶于水的失去还原性的物质。
()26、热的NaOH溶液与过量的硫粉反应可生成Na2S2O3。
..........................................()27、卤素单质水解反应进行的程度由Cl2到I2依次减弱。
.......................................()28、硫酸和硝酸分子中均含有 46键。
.............................................................................()29、Al3+与edta(乙二胺四乙酸的二钠盐)溶液反应生成配离子,可使溶液的pH值变小。
()30、高碘酸有强氧化性,必须在碱性条件下,氯气才能将碘酸盐氧化为高碘酸盐。
.()二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(本大题分26小题,每小题1.5分,共39分)1、1.0×10-10mol·L-1HCl和1.0×10-10mol·L-1HAc两溶液中c(H+)相比,其结果是()。
(A)HCl的远大于HAc的;(B)两者相近;(C)HCl的远小于HAc的;(D)无法估计。
2、对于E A(MnO4-/Mn2+)来说,下列叙述中正确的是 .......................................... ()。
(A)Mn2+浓度增大则E值增大;(B)H+浓度的变化对E的影响比Mn2+浓度变化的影响大;(C)溶液稀释,c(MnO4-)/c(Mn2+)值不变,E值也不改变;(D)MnO4-浓度减小,E值增大。
3、下列反应,其标准平衡常数可作为[Zn(NH3)4]2+的不稳定常数的是 .............. ()。
(A)Zn2++4NH 3[Zn(NH3)4]2+;(B)[Zn(NH3)4]2++H2O[Zn(NH3)3(H2O)]2++NH3;(C)[Zn(H 2O)4]2++4NH3[Zn(NH3)4]+4H2O;(D)[Zn(NH3)4]2++4H2O[Zn(H2O)4]2++4NH3。
4、在标准状况下,1.00m3CO2通过炽热的碳层后,完全转化为CO,这时的温度为1173K,压力为102kPa,则CO的体积为...............................................................................................()。
(A)4.26m3;(B)4.26×103m3;(C)8.54m3;(D)8.54×103m3。
5、某煤气柜内的压力为104kPa,温度为298K、体积为1.6×103m3,298K时水的饱和蒸气压为3.17kPa,则气柜中煤气的物质的量和水蒸气的质量分别为.............................()。
(A)6.5×104mol和37kg;(B)6.5×107mol和3.7×103kg;(C)6.5×106mol和0.13kg;(D)6.5×104mol和1.3×102kg。
6、已知298K时,Sn(s)+Cl2(g)→SnCl2(s)的△r H(1)=-349.8kJ·mol-1,SnCl2(s)+Cl2(g)→SnCl4(l)的△r H(2)=-195.4kJ·mol-1,则12Sn(s)+Cl2(g)→12SnCl4(g)的△r H为..................................................................()。