铝的基本性质和主要用途
- 格式:doc
- 大小:13.50 KB
- 文档页数:1

高一化学必修一铝知识点归纳总结化学是一门探索物质组成、性质以及变化规律的科学,而铝作为重要的金属元素之一,在化学中扮演着重要的角色。
本文将对高一化学必修一中关于铝的知识点进行归纳总结。
一、铝的基本性质1. 原子结构:铝的原子序数为13,原子结构为2, 8, 3。
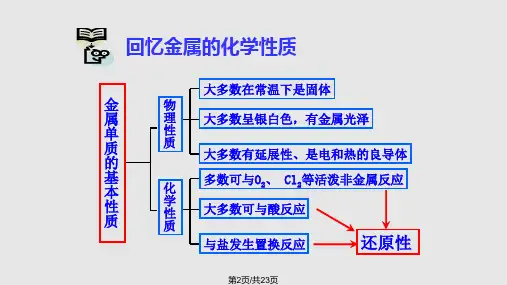
2. 物理性质:铝是一种银白色的轻金属,在常温下具有良好的延展性和导电性。
3. 化学性质:铝与氧气反应生成三氧化二铝,与非金属元素如硫、碳等反应生成相应的硫化物和碳化物等。
二、铝的制备与加工1. 制备方法:铝的主要制备方法有金属铝的电解法、熔融法和气相还原法等。
2. 加工工艺:铝可通过挤压、拉伸、锻造等加工工艺进行成型,可制备成各种形状的铝材。
三、铝的化合物1. 氧化物:铝的氧化物为三氧化二铝(Al2O3),是一种无机化合物,常见的矿石为矾土。
2. 盐类:铝与酸反应可生成相应的铝盐类化合物,如硫酸铝(Al2(SO4)3)等。
3. 氢氧化物:铝的氢氧化物为氢氧化铝(Al(OH)3),常见的形式为白色胶状物。
四、铝的应用1. 金属铝:铝是一种重要的金属材料,广泛应用于航空航天、汽车制造、建筑等领域,具有轻质、强度高、耐腐蚀等优点。
2. 铝合金:铝合金是将铝与其他金属元素进行合金化制备而成,具有较高的强度和热性能,常用于制造飞机、火箭等。
3. 铝的化合物:铝的氧化物与硅、氧化镁等化合可制备陶瓷材料,氢氧化铝则常用于药物制剂和消化剂等领域。
综上所述,铝作为一种重要的金属元素,在化学中扮演着重要的角色。
它的基本性质、制备与加工方法、化合物以及应用领域等知识点对于高一化学学习至关重要。
我们应该深入学习铝的相关知识,加深对其性质和应用的理解,为今后的学习打下坚实的基础。

高中化学课件铝高中化学课件:铝一、引言铝(Al)是一种具有广泛应用的金属元素,位于元素周期表的第三周期,原子序数为13。
在我国,铝资源丰富,开发利用历史悠久。
本课件旨在介绍铝的基本性质、制备方法、应用领域及环境保护等方面的内容,帮助学生全面了解铝的相关知识。
二、铝的基本性质1. 物理性质铝是一种银白色金属,具有良好的导电性、导热性和延展性。
密度约为2.7g/cm³,熔点约为660℃。
在常温下,铝与空气中的氧气发生化学反应,一层致密的氧化铝薄膜,从而具有良好的耐腐蚀性。
2. 化学性质铝的化学性质较为活泼,位于金属活动性顺序表的中等位置。
在化学反应中,铝容易失去电子,表现出还原性。
铝能与许多非金属元素发生反应,如与氧气、氯气、硫等形成相应的化合物。
此外,铝还能与强酸、强碱发生反应,相应的盐和氢气。
三、铝的制备方法1. 铝土矿的提取铝土矿是铝的主要原料,其主要成分是氧化铝(Al₂O₃)。
提取铝土矿的方法有露天开采和地下开采两种。
露天开采适用于铝土矿埋藏较浅的地区,地下开采适用于铝土矿埋藏较深的地区。
2. 氧化铝的制备将铝土矿经过破碎、研磨、浮选等工序,得到精矿。
然后,采用拜耳法或烧结法等方法,将精矿中的氧化铝提取出来。
拜耳法是将精矿与氢氧化钠溶液反应,偏铝酸钠,再通过酸化、沉淀、过滤、洗涤、干燥等工序,得到氧化铝。
烧结法是将精矿与石灰石、煤炭等原料混合,经高温烧结,得到氧化铝。
3. 铝的冶炼铝的冶炼采用霍尔-埃鲁法,即在熔融的氧化铝中通入氯气,使其中的氧化铝还原成铝。
反应方程式为:2Al₂O₃ + 3C → 4Al + 3CO₂。
通过电解槽,将熔融的氧化铝和冰晶石(Na₃AlF₆)混合物作为电解质,通入直流电,使铝离子在阴极上还原成铝。
电解过程中,产生的氧气在阳极上与氯气反应,氯气。
四、铝的应用领域1. 建筑行业铝在建筑行业中的应用十分广泛,如铝合金门窗、幕墙、铝塑板等。
铝合金具有质轻、强度高、耐腐蚀等优点,越来越受到建筑行业的青睐。

《铝金属材料》知识清单一、铝的基本性质1、物理性质铝是一种银白色的轻金属,具有良好的延展性、导电性和导热性。
它的密度较小,约为 270 g/cm³,这使得铝在航空航天、汽车制造等领域有广泛的应用。
铝的熔点为 66037℃,沸点为 2467℃。
2、化学性质(1)铝在空气中容易与氧气反应,形成一层致密的氧化铝保护膜,阻止内部的铝进一步被氧化。
化学方程式为:4Al + 3O₂= 2Al₂O₃。
(2)铝能与酸反应,生成铝盐和氢气。
例如,与盐酸反应的化学方程式为:2Al + 6HCl = 2AlCl₃+ 3H₂↑ 。
(3)铝也能与碱溶液反应,生成偏铝酸盐和氢气。
例如,与氢氧化钠溶液反应的化学方程式为:2Al + 2NaOH + 2H₂O = 2NaAlO₂+ 3H₂↑ 。
二、铝的制备1、电解法工业上通过电解熔融的氧化铝来制取铝。
氧化铝在电解槽中,在高温和直流电的作用下分解为铝和氧气。
化学反应方程式为:2Al₂O₃(熔融)通电 4Al + 3O₂↑ 。
三、铝合金1、定义铝合金是以铝为基添加一定量其他合金化元素的合金,是轻金属材料之一。
2、性能特点(1)强度高:铝合金的强度比纯铝高,能够满足许多结构件的强度要求。
(2)耐腐蚀:通过添加一些合金元素和进行适当的表面处理,铝合金具有较好的耐腐蚀性能。
(3)加工性能好:易于进行各种加工,如铸造、锻造、挤压、轧制等。
3、常见的铝合金种类(1)防锈铝合金:主要合金元素是锰和镁,具有良好的耐蚀性和塑性。
(2)硬铝合金:合金元素包括铜、镁、锰等,强度较高。
(3)超硬铝合金:含有较多的锌、铜、镁等元素,强度和硬度很高。
(4)锻铝合金:具有良好的热塑性、锻造性能和较高的力学性能。
四、铝在生活中的应用1、航空航天领域由于铝的密度小、强度高,在飞机制造中大量使用,如机身、机翼等部件。
2、汽车工业用于制造汽车的车身、发动机部件等,减轻车辆重量,提高燃油效率。
3、建筑行业铝合金门窗具有美观、耐腐蚀、质量轻等优点。

一、铝及铝合金的基本性质纯铝呈银白色,因其在潮湿的空气中能形成一层防止金属腐蚀的氧化膜,能阻止其进一步氧化从而具有一定抗蚀性。
铝相对密度2.7g/cm3,熔点660℃,沸点2327℃;面心立方体结构,故而有很高的塑性,易于加工,可制作成各种型材、板材。
但纯铝强度比较低,难以满足使用要求。
工业上铝都是采用电解法生产的,通常会以铝为基体,加入少量金属或非金属元素,采用合金化方式制作成铝合金并运用热处理等方法,使其在保持质轻等优点的同时还具有较高的强度。
铝及其合金主要有以下优点:(1)质轻,约为钢的1/3,比强度和比刚度高;(2)塑性好,易于加工及适用于各种表面处理:(3)导热、导电性好,导热、导电率仅次于铜,约为钢铁的3~4倍;(4)良好的耐腐蚀性和低温性能。
二、铝合金分类(1)铝按其纯度分为高纯铝和工业纯铝。
纯铝的牌号用“铝”字拼音首字母“L”和其后面的编号表示。
高纯铝的牌号有L01、L02、L03、L04、L05,后面的数字越大,纯度越高,含铝量在99.85%-99.99%之间。
工业纯铝的牌号有L1、L2、L3、L4、L4-1、L5、L5-1、L6,后面的数字表示纯度,数字越大,纯度越低。
(2)铝合金一般通过其成分、组织和工艺等特点,可以将其分为铸造铝合金与变形铝合金两大类。
变形铝合金:将铝合金铸锭通过压力加工(轧制、挤压、模锻等)制成半成品或模锻件,要求有良好的塑性形变能力铸造铝合金:将熔融的铝合金直接浇铸成形状复杂的甚至是薄壁的成型件,要求合金有良好的铸造流动性。
工程上常用铝合金相图大都与上图类似,D点成分以左的合金在加热至高温时能形成单相固溶体组织,其塑性较高成为变形铝合金;于D点成分以右的合金,因含有共晶组织,液态流动性较高适用于铸造,称为铸造铝合金。
对于变形铝合金而言位于F点以左成分的合金不能进行热处理强化,称为热处理不可强化的铝合金;成分在F和D之间的铝合金,由于合金元素在铝中有溶解度的变化会析出第二相,可以通过热处理使合金强度提高,称为热处理强化铝合金。

al5052化学成分摘要:一、铝的概述1.铝的基本概念2.铝的性质与用途二、AL5052 化学成分介绍1.AL5052 的定义2.AL5052 的主要成分3.AL5052 的性能特点三、AL5052 的应用领域1.交通工具制造2.建筑行业3.电子设备制造4.其他领域四、AL5052 的优缺点分析1.优点2.缺点五、AL5052 的发展趋势1.新技术的发展2.环保要求的提高3.市场需求的转变正文:铝是一种轻质、耐腐蚀的金属元素,具有很高的导电、导热性能。
由于铝的这些优良特性,使其在各个领域都有广泛的应用。
本文将重点介绍铝的一种重要类别——AL5052,并对其化学成分、性能特点以及应用领域进行详细阐述。
AL5052 是一种以铝为主,并加入适量镁、锰、铬、铜等元素的合金。
这种合金在我国通常被称为“5052 铝合金”,具有较高的强度、良好的耐腐蚀性和焊接性能。
其主要成分如下:- 铝(Al):余量- 镁(Mg):0.8%~1.2%- 锰(Mn):0.1%~0.5%- 铬(Cr):0.1%~0.35%- 铜(Cu):0.1%~0.5%此外,AL5052 还可能含有少量的锌、镍、铁等元素。
AL5052 的性能特点包括:密度低、强度高、耐腐蚀性强、可塑性好、易于加工等。
AL5052 广泛应用于各个领域,如交通工具制造、建筑行业、电子设备制造等。
在交通工具制造领域,AL5052 可用于制造汽车、火车、船舶等交通工具的零部件,以减轻整体重量、提高燃油效率。
在建筑行业,AL5052 可用于生产建筑铝型材、幕墙、门窗等,既美观又实用。
在电子设备制造领域,AL5052 的导电性能使其成为制造电缆、散热器等电子零部件的理想材料。
虽然AL5052 具有很多优点,如强度高、耐腐蚀性强等,但同时也存在一些缺点,如塑性较差、容易产生裂纹等。
针对这些问题,相关领域的研究人员正在努力研究新型铝合金,以满足不同应用场景的需求。
总之,AL5052 作为一种性能优良的铝合金,在各个领域都具有广泛的应用前景。

铝的化学方程式铝是一种化学元素,化学符号为Al,原子序数为13,相对原子质量为26.98。
它的化学性质非常活泼,在空气中易被氧化,产生一层氧化铝膜。
铝具有重量轻,导热性好,耐腐蚀等优点,因此被广泛应用于航空、汽车、建筑、电子等领域。
本文将从铝的基本化学性质、化学式、反应类型等方面介绍铝的化学方程式。
一、铝的基本化学性质铝是一种典型的金属元素,具有许多重要化学性质,如易被氧化、反应活泼等。
下面我们来了解一下铝的基本化学性质。
(一)化学符号铝的化学符号为Al,来自于拉丁语alumen,意思是明火,这是因为古代人们用明火来提取铝。
铝的元素周期表原子序数为13,位于第三周期,3s23p1。
(二)物理性质铝为银白色,光泽金属,质地柔软,有良好的延展性、导热性和电导性,但韧性较差,易脆断。
铝的密度为2.70g/cm3,熔点为660.37℃,沸点2327℃。
(三)化学性质1.与气体反应:铝具有高度的反应性,在空气中易受氧化作用,产生一层氧化铝膜。
当铝与氧气反应时,会产生大量的热,发生燃烧反应,生成氧化铝。
2.与水反应:铝与水反应时,也会发生剧烈反应,生成氢气和亚铝酸钠。
3.与酸反应:铝与浓硝酸反应时会产生铝硝酸。
铝还能够与硫酸、盐酸等酸类反应,生成相应的盐和氢气。
4.与金属卤化物反应:在硝酸存在下,铝与氯化钠反应时,会生成氯气和氧化铝。
铝还能与氯气或溴气反应生成铝卤化物。
二、铝的化学式铝的常见化学式包括:(一)氢氧化铝氢氧化铝化学式为Al(OH)3,是一种白色固体粉末,有良好的吸水性。
氢氧化铝是铝的主要产物之一,可以通过铝与水或氢氧化物反应得到。
Al+3H2O→Al(OH)3+H2↑(二)氧化铝氧化铝的化学式为Al2O3,是一种无色或白色固体粉末,具有较好的耐高温性、耐腐蚀性和绝缘性。
氧化铝是铝的主要产物之一,可以通过铝与氧气或空气反应得到。
4Al+3O2→2Al2O32Al+1.5O2→Al2O3(三)三氯化铝三氯化铝的化学式为AlCl3,是一种无色晶体固体,具有强大的催化作用和腐蚀性。

铝及其化合物知识点总结铝是一种轻巧、耐腐蚀、可回收的金属,具有广泛的应用。
本文将总结关于铝及其化合物的一些基本知识点。
1.铝的性质和用途:铝是一种银白色的轻金属,具有良好的导热性和导电性。
它的密度相对较低,比重约为2.7g/cm³。
铝在空气中不易被氧化,因为铝表面会生成一层致密的氧化铝膜,能够有效地防止进一步的氧化。
这使得铝具有优异的耐腐蚀性。
铝广泛应用于航空航天、运输、建筑、包装等领域,如飞机、汽车、建筑材料、饮料罐等。
2.铝和氧化铝:铝能与氧反应生成氧化铝(Al2O3)。
氧化铝是一种重要的陶瓷材料,具有高硬度、高熔点和良好的绝缘性能。
氧化铝常用于制作耐火材料、研磨材料、电子元件等。
3.铝的产出:铝是地壳中丰富的金属之一,其含量约为8%。
然而,铝在自然界中主要以氧化铝的形式存在,因此需要经过冶炼过程提取铝金属。
常用的铝冶炼方法包括电解法(Hall-Héroult法)和金属热还原法。
电解法是目前主要的铝生产方法,它利用电解质熔体(如氟化铝)将氧化铝还原成铝金属。
4.铝的合金:铝可以与其他金属形成合金,以提高其性能。
最常见的铝合金是铝和铜、锌、镁、硅等元素的合金。
铝合金具有较高的强度、硬度和耐腐蚀性,并且在制造飞机、汽车、船舶等领域广泛应用。
5.铝化合物:除了氧化铝,铝还可以形成多种化合物。
一些常见的铝化合物包括氯化铝(AlCl3)、硫酸铝(Al2(SO4)3)和碳酸铝(Al2(CO3)3)。
氯化铝是一种重要的催化剂,广泛应用于有机合成反应中。
硫酸铝广泛用于水处理、纸浆和皮革工业中的凝结剂。
碳酸铝是一种重要的无机盐,常用于制备其他铝化合物或作为中和剂和酸性土壤改良剂。
总之,铝是一种重要的金属材料,具有许多优良的性能和广泛的用途。
铝及其化合物在工业和日常生活中扮演着重要的角色。

高中化学铝及其化合物知识点
高中化学铝及其化合物知识点
一、铝的基本性质
铝是一种具有典型金属性的轻金属,具有许多良好的物理化学性质,例如具有较高的导热性和电导率,低密度和良好的可塑性等。
二、铝的制备方法
1. 金刚砂法
2. 电解法
三、铝的氧化物——氧化铝
氧化铝是一种常见的氧化物,也是铝的重要产物。
它具有很高的熔点和硬度,在高温环境下能保持极好的稳定性。
四、铝的氢氧化物——氢氧化铝
氢氧化铝是一种白色无定形粉末,容易吸收水分,也是很常见的铝的化合物。
它常用于制备其他铝化合物,如氧化铝等。
五、铝与酸、碱的反应
铝在一定的条件下与酸发生反应,会产生氢气和相应的铝盐。
与碱的反应则会生成相应的铝盐和氢氧化铝。
六、铝的应用领域
1. 金属材料——铝合金
2. 化工领域——氢氧化铝生产
3. 医疗领域——生物医学器械制造
4. 轻工业——食品包装、建筑材料
七、铝在环境中的影响
铝的大量排放对环境和生态系统造成了很大的负担,铝在水体中的存在会导致生态系统的异常变化和动植物死亡。
同时,铝的废弃物也会污染土地和空气,对人类健康造成不良影响。
八、铝及其化合物的安全问题
铝及其化合物存在一定的安全问题,长期接触铝化合物会对人体神经系统产生影响,增加患上老年痴呆症等疾病的概率。
总之,对于高中化学学生而言,学习铝及其化合物的知识点是非常重要的,理解这些知识将有助于他们更好地掌握化学基础理论,从而为未来更深入地研究化学打下坚实的基础。

高考化学铝知识点总结高考是每个学生学习生涯中的重要节点,考试科目的复习备考相当关键。
对于化学来说,铝是一个非常重要的元素,掌握铝的知识点对于高考化学的复习备考至关重要。
本文将系统总结高考化学中与铝相关的知识点,帮助学生更好地备考。
第一节:铝的基本性质1. 物理性质:铝是一种银白色的轻金属,具有良好的导电性和导热性。
它的密度相对较低,比强度较高,是一种重要的结构材料。
2. 化学性质:铝是活泼的金属,容易与氧气、氯气等发生反应。
在常温下,表面会形成一层氧化铝膜,保护铝不被进一步氧化。
3. 合金应用:铝可以与其他金属形成多种合金,如铝镁合金、铝铜合金等。
这些合金具有较高的强度和耐腐蚀性,广泛应用于航空航天、汽车制造等领域。
第二节:铝的制取与冶炼1. 制取方法:铝主要通过电解法制取,即利用电解质溶液中的氧化铝进行电解,使铝离子还原为铝金属。
2. 冶炼过程:铝冶炼主要包括压碎、浸出、纯化和电解等步骤。
其中,浸出是将铝矿经酸浸出,得到氧化铝的过程;纯化是通过氧确保铝产物的纯度;电解是最关键的步骤,通过电解氧化铝融液,得到纯度较高的铝金属。
第三节:铝的反应性1. 与非金属元素的反应:铝可以与氧气反应生成氧化铝,与硫反应生成硫化铝,与氯反应生成氯化铝等。
2. 与酸的反应:铝可以与稀酸反应生成对应的盐和氢气。
3. 与碱的反应:铝可以与碱反应生成相应的盐和氢气。
第四节:铝的应用1. 结构材料:铝具有良好的强度和轻质特性,广泛应用于航空航天、汽车制造等领域,例如飞机、汽车车身等。
2. 包装材料:铝具有良好的抗腐蚀性和隔热性,广泛应用于食品、药品等包装材料,例如铝箔。
3. 耐高温材料:铝可以作为喷气发动机等高温设备的结构材料,因为它具有较高的熔点和抗热膨胀性。
4. 防腐蚀涂层:由于铝本身会在表面形成氧化铝膜,因此可以作为其他金属的防腐蚀涂层材料,例如镀铝。
总结:通过对高考化学铝知识点的总结,我们可以清晰地了解到铝的基本性质、制取与冶炼方法、反应性以及广泛的应用领域。

铝的性质和主要用途一、铝的主要性质纯度为99.99%的金属铝的主要物理性质是:密度(20℃)2.7g/cm3熔点660.1℃沸点2520℃平均比热(0-100℃)917J/(kg·K)熔化热10.47kJ/mol汽化热291.4(估算值)kJ/mol热导率(O~100℃)238W/(m·K)电阻率(20℃)2.67μΩ·cm铝的密度小,仅为水的2.7倍;铝的比强度(强度与重量之比)高,某些高强度铝合金的机械强度超过了结构钢;铝没有磁性,铝在低温下(-198℃)也不变脆,仍具有较好的机械性能;铝可以轧成薄板和箔,拉成细丝,挤压成各种复杂形状的型材,其延展性能很好;铝在空气中能与氧迅速化合,生成一层致密而坚硬的氧化铝薄膜,厚度为0.005~0.02微米,成为铝的天然保护层,阻止铝继续被氧化,因而具有好的抗蚀性能,还可以用阳极氧化或电镀的方法,在铝材和铝制品的表面生成彩色鲜艳的氧化膜;铝的导电、导热性好,导电率相当于国际标准退火铜的64.94%,铝的导电能力超过这两如果就相同的重量而言,约为银的一半,种金属;铝的导热性几乎比铁的导热率大3倍;铝的反光性能很强,反射紫外线比银还强,铝在碰击时不产生火花。
铝对氧的亲和力大,铝可以用作炼钢的脱氧剂和一些高熔点金属氧化物(如MnO2、Cr2O3)的还原剂。
铝与氮、硫和卤族元素在高温下发生反应生成如AIN、Al2S3、AlCl3之类的化合物,这些化合物(除AIN外)和铝在真空中加热到1000℃以上时,生成相应的低价铝化合物,这些低价化合物在低温下发生歧化反应,分解为金属铝及其化合物。
铝是两性元素,它与大多数稀酸可缓慢地反应,能迅速溶解于浓盐酸中。
但浓硝酸使铝钝化,铝与苛性碱溶液发生强烈反应,迅速溶解生成铝酸根离子。
二、铝的主要用途铝由于具有优良的物理性能,所以铝在国民经济各部门和国防工业中得到了广泛的应用。
铝作为轻型结构材料,重量轻,强度大,陆、海、空各种运载工具,特别是飞机、导弹、火箭、人造卫星等,均使用大量的铝,一架超音速飞机的用铝量占其自身重量的70%,一枚导弹用铝量占其总重量的10%以上。
高一化学知识点铝必修一铝,化学元素周期表中的第13号元素,原子序数为13,符号为Al。
它是一种轻质、抗腐蚀、具有良好导电性的金属,被广泛应用于各个领域。
而在高一化学学习中,了解铝的性质和应用,对我们理解化学世界有着重要的意义。
第一部分:铝的基本性质铝是一种典型的金属元素,具有良好的导电性和导热性。
它的外层电子结构为2-8-3,其中最外层的3个电子能够轻松地释放出来形成阳离子Al3+,使铝具有较大的活性。
这也是铝被广泛应用的原因之一。
铝的化学性质也十分活泼。
它可以与氧、硫、氯等非金属反应生成相应的氧化物、硫化物、氯化物等化合物。
在空气中,铝会与氧发生反应生成一层氧化铝膜,这一层氧化物膜可以防止铝继续氧化,保护铝的内部免受腐蚀。
第二部分:铝的制备和提炼铝的制备主要有两种方法:电解法和热还原法。
其中,电解法是目前最常用的一种方法。
电解法首先需要将铝矾石(Al2(SO4)3)与纯碳粉混合,然后放入电解槽中进行电解。
在电流的作用下,铝矾石中的铝离子(Al3+)被还原成纯铝金属,并在阴极上析出。
而在电解过程中,阳极则发生氧化反应,产生氧气和二氧化硫。
热还原法则是利用铝矾石的高温热分解性质。
首先,将铝矾石放入电炉或回转窑中加热至高温,使其分解成氧化铝和硫酸铁。
接着,将生成的氧化铝与石油焦一同放入电炉中,通过高温还原反应,最终得到纯铝金属。
第三部分:铝的应用领域铝具有重量轻、导电性好、耐腐蚀等优良性能,因此在各个领域都有广泛应用。
在交通运输领域,铝合金被广泛应用于汽车、火车和飞机的制造中。
它们不仅能减轻车身和飞机的重量,提高燃油效率,还能提供较好的机械性能和耐腐蚀性能。
在建筑领域,铝合金门窗、幕墙和钢结构中,被广泛用作材料。
铝合金的轻质和可塑性,使得它成为了设计现代建筑外观的理想选择。
在电子领域,铝是导电性能良好的金属之一,被用于制造电线、电缆和电子元件。
在计算机、手机等电子产品中,铝也扮演了重要的角色。
此外,铝还可以用于制造罐装饮料的铝罐、食品包装材料以及各类铝制品等。
高一化学必修一铝知识点归纳总结铝是我们日常生活中常见的金属元素之一,具有广泛的应用领域。
在学习化学的过程中,了解铝的性质和应用是必不可少的。
下面对高一化学必修一中与铝相关的知识点进行归纳总结。
1. 铝的基本性质铝是一种轻质、无机金属,密度小,具有良好的导电性和导热性。
它的熔点较低,约为660℃,比较易于加工成不同形状的制品。
铝具有良好的耐腐蚀性,可以在空气中形成致密的氧化铝膜,保护铝本身不被进一步氧化。
此外,铝还具有反射光线、抗紫外线等特性。
2. 铝的制取方法铝的主要制取方法有电解法和热还原法。
电解法将铝矾土经过浸出、纯化、电积等步骤得到铝金属。
热还原法主要是利用铝矾土与焦碳反应,将铝矾土中的铝氧化物还原为铝金属。
3. 铝的氧化性与还原性铝是一种较活泼的金属,在化学反应中具有较强的氧化性。
铝可以与氧气发生反应生成氧化铝,并释放出大量的热量。
例如,铝粉与火焰中的氧气反应会发生剧烈的燃烧,产生明亮的火花。
4. 铝的应用领域铝具有广泛的应用领域,以下是其主要的应用方面:- 化工:用于制造硫酸铝、铝化学药品等;- 建筑:用于制造轻质、耐腐蚀的铝合金门窗、铝合金框架等;- 交通:用于制造汽车、飞机等交通工具的零部件;- 包装:用于制造易拉罐、食品包装等;- 电子:用于制造电子产品的外壳、散热器等;- 航空航天:用于制造火箭、航天器等。
5. 铝与环境问题铝在大自然界中广泛存在,但过度释放铝离子会对生态环境产生一定的影响。
铝离子对水生生物具有一定的毒性,过度排放铝离子可能导致水体富营养化,损害水生生物的生存和繁殖。
因此,在铝的生产和应用过程中需要注意环保问题,减少对环境的污染。
以上就是高一化学必修一中与铝相关的知识点的归纳总结。
通过对这些知识点的掌握,可以更加深入地了解铝的性质和应用,为我们日常生活和学习提供更多的参考和指导。
101a铝锭成分1. 介绍101a铝锭是一种常用的工业原材料,主要用于制造铝合金和其他铝制品。
了解101a铝锭的成分对于生产过程和产品质量控制非常重要。
本文将详细介绍101a铝锭的成分及其对其性能的影响。
2. 铝的基本性质铝是一种轻便、耐腐蚀、导电良好的金属,具有广泛的应用领域。
它在工业中常以纯度较高的形式使用,其中包括101a铝锭。
3. 101a铝锭成分及含量3.1 主要元素101a铝锭主要由以下元素组成: - 铁(Fe):0.5%以下 - 硅(Si):0.6%以下- 锰(Mn):0.15%以下 - 镁(Mg):0.15%以下 - 铜(Cu):0.1%以下 - 锌(Zn):0.1%以下3.2 其他杂质元素除了上述主要元素外,101a铝锭中可能还含有少量的其他杂质元素,如镍(Ni)、钛(Ti)等。
这些杂质元素的含量通常在0.05%以下。
3.3 纯度要求101a铝锭的纯度要求较高,通常要求其纯度达到99.5%以上。
这是因为较高的纯度能够提供更好的机械性能和耐腐蚀性,同时也有利于铝合金的生产和加工过程。
4. 成分对101a铝锭性能的影响101a铝锭中各元素的含量及其相互作用对其性能具有重要影响。
- 铁(Fe):高含量的铁会降低铝锭的塑性和延展性,降低产品的强度和韧性。
- 硅(Si):适量的硅可以提高铝锭的强度和刚性,但过多的硅会使产品易碎。
- 锰(Mn):适量的锰可以提高铝锭在高温下的强度和耐蚀性。
- 镁(Mg):适量的镁可以提高铝锭的塑性、强度和硬度,但过多会导致产品变脆。
- 铜(Cu):铜可提高铝锭的机械强度,但过多会降低铝锭的可塑性。
- 锌(Zn):适量的锌可以提高铝锭的强度和耐腐蚀性。
5. 成分控制为了确保101a铝锭的质量和性能,生产过程中需要严格控制各元素的含量。
常用的控制方法包括: - 原料选择:选择纯度较高的铝及其他合金元素原料,以减少杂质元素的含量。
- 冶炼工艺:采用合适的冶炼工艺,如电解法、熔炼法等,以确保成分均匀。
高中铝知识点一、铝的基本介绍铝(Aluminum)是一种银白色的金属元素,化学符号为Al,原子序数为13。
它是地壳中最丰富的金属元素,占地壳总质量的约8%。
铝具有低密度、良好的导电性和导热性、以及优异的可塑性和耐腐蚀性等特点。
二、铝的物理性质1. 密度:铝的密度约为2.70 g/cm³,较轻。
2. 熔点:铝的熔点为660.3°C(1220.54°F)。
3. 沸点:铝的沸点为2,467°C(4551.06°F)。
4. 硬度:铝的硬度较低,约为1.5-3.0(摩氏硬度)。
5. 延展性:铝具有良好的延展性,可制成铝箔等。
三、铝的化学性质1. 反应活性:铝在室温下与空气中的氧气反应,形成一层致密的氧化铝膜,这层膜可以保护铝不被进一步氧化。
2. 酸碱性:铝可以与酸和强碱反应,生成相应的铝盐和氢气。
3. 电化学性质:铝是活泼的金属,在电化学系列中位于较前的位置,可作为电池的阳极材料。
四、铝的提取和精炼1. 矿石:铝主要从铝土矿(Bauxite)中提取,铝土矿主要由氧化铝组成。
2. 霍尔-埃鲁法:这是商业上最常用的铝提取方法,通过电解熔融的氧化铝来生产铝。
3. 环境影响:铝的生产过程能耗较高,但铝可无限次回收,对环境的影响相对较小。
五、铝的应用1. 航空航天:由于其轻质和高强度的特性,铝被广泛应用于飞机、火箭等制造。
2. 包装材料:铝箔和铝制罐头广泛应用于食品和药品的包装。
3. 建筑材料:铝材和铝合金用于建筑装饰、门窗框架等。
4. 电子设备:铝因其良好的导电性和散热性,被用于电线和散热器件。
六、铝的化合物1. 氧化铝(Al2O3):常用作磨料、耐火材料和陶瓷。
2. 硫酸铝(Al2(SO4)3):用于造纸、水处理和染料。
3. 氯化铝(AlCl3):用于化工生产和有机合成。
七、铝的安全性和健康1. 铝与健康:虽然铝是人体非必需的微量元素,但过量摄入可能对健康造成影响。
高中化学复习知识点铝的钝化一、综述铝的钝化是我们高中化学中一个非常有趣且重要的知识点,说起铝大家可能都很熟悉,毕竟日常生活中铝制品无处不在。
而铝的钝化,更是让铝制品在生活中有了更广泛的应用。
什么是铝的钝化呢?简单来说就是铝在遇到某些物质时,表面会形成一种保护层,就像给铝穿上一层“防护衣”,让它变得更“坚强”。
这种变化让铝制品更耐磨损、耐腐蚀。
今天我们就一起来复习一下关于铝的钝化的知识点,探索这一神奇现象的奥秘。
1. 铝的重要性和应用概述铝作为一种金属元素,在我们的生活中无处不在,可以说是现代工业的重要支柱之一。
它的身影出现在我们日常生活的方方面面,比如食品包装、交通工具、建筑物等等。
甚至在我们身体内,铝也发挥着一定的作用。
首先铝的轻盈和耐用的特性让它成为了制造交通工具的理想材料。
汽车、火车、飞机,甚至是自行车,都有铝的参与。
它让交通工具变得更轻,更节能更环保。
其次铝在建筑业中也有广泛的应用,无论是高楼大厦、桥梁、还是雕塑,都能看到铝的身影。
它的抗腐蚀性能让它成为室外建筑的首选材料。
此外铝还在电力、通信、航空航天等领域发挥着巨大的作用。
比如说电线电缆的主要材料就有铝的存在,它在电力传输中扮演着重要的角色。
而在通信领域,铝的导电性使得它在通信设备的制造中不可或缺。
在航空航天领域,铝的轻盈和坚固让它成为了制造飞机和航天器的重要材料。
不仅如此铝还在我们的日常生活中扮演着重要的角色,比如食品包装、厨具、炊具等等都有铝的存在。
甚至在我们烹饪的过程中,铝也能帮助我们更好地保存食物,让食物更加美味。
可以说铝是我们生活中不可或缺的一部分,但是尽管铝在我们生活中有着广泛的应用,但在某些特定条件下,它也可能带来一些问题和挑战,比如钝化现象。
接下来我们就来详细了解一下铝的钝化是怎么回事。
2. 钝化的概念及其在工程领域的重要性接下来我们详细说说钝化这个概念,以及它在工程领域的重要性。
说起钝化简单来说,就是铝在遇到某些物质时,表面能够形成一层保护层,就像是给铝穿上一层“防护衣”。
有关铝化学方程式铝化学方程式是描述铝在化学反应中所经历的化学变化和化学反应所涉及的化学元素、化学物质和化学物质组成的数学表示。
铝作为一种常见的轻质、强度高、化学性质稳定的金属,在化学反应中表现出了极为丰富的化学特性,被广泛应用于各种领域,如飞机制造、汽车工业、电子工业等。
本文为读者介绍铝化学方程式的相关知识。
1. 铝的基本化学性质铝是一种化学元素,其原子序数为13,原子量为26.98。
铝在常温下为银白色的金属,具有良好的延展性、导电性和热导性。
铝的化学性质非常稳定,在空气中不会被氧化,但在强酸和强碱中则会发生反应。
2. 铝和氧的化学反应铝和氧是一种非常常见的化学反应对,其化学方程式为2Al + 3O2 → 2Al2O3。
铝和氧在高温下反应,生成铝氧化物(Al2O3),同时放出大量的热量。
这种反应可以用来产生高温,如利用铝和氧反应产生的高温来焊接、切割金属等。
3. 铝和酸的化学反应铝和酸的化学反应中,铝可以和各种弱酸反应,但基本不和强酸反应,这是因为铝的氧化物形成了一层稳定的氧化膜来保护自身。
其中,铝和盐酸反应的化学方程式为2Al +6HCl → 2AlCl3 + 3H2↑。
在该反应中,铝与氢离子(H+)结合,生成铝离子(Al3+),同时放出氢气(H2),生成了氯化铝(AlCl3)。
4. 铝和碱的化学反应铝和碱的化学反应中,铝会和氢氧化物(OH^-)形成铝氧化物(Al2O3)和水,生成的化学方程式为2Al + 2OH^- +6H2O → 2Al(OH)3 + 3H2↑。
在该反应中,铝和氢氧化物反应产生的铝氧化物是一种重要的固体氧化物,可以用于制备陶瓷、耐火材料和催化剂等。
5. 铝和卤素的化学反应铝和卤素的化学反应中,铝可以和氟、氯、溴和碘等卤素发生反应,生成相应的卤化铝。
其中,铝和氯的化学方程式为2Al + 3Cl2 → 2AlCl3。
在该反应中,铝与氯反应生成氯化铝(AlCl3),是一种重要的无机化学品,在某些有机合成反应中具有重要的催化作用。
铝的性质和主要用途
一、铝的主要性质
纯度为99.99%的金属铝的主要物理性质是:
密度(20℃) 2.7 g/cm3
熔点660.1 ℃
沸点2520 ℃
平均比热(0-100℃) 917 J/(kg·K)
熔化热10.47 kJ/mol
汽化热291.4(估算值) kJ/mol
热导率(O~100℃) 238 W/(m·K)
电阻率(20℃) 2.67 μΩ·cm
铝的密度小,仅为水的2.7倍;铝的比强度(强度与重量之比)高,某些高强度铝合金的机械强度超过了结构钢;铝没有磁性,铝在低温下(-198℃)也不变脆,仍具有较好的机械性能;铝可以轧成薄板和箔,拉成细丝,挤压成各种复杂形状的型材,其延展性能很好;铝在空气中能与氧迅速化合,生成一层致密而坚硬的氧化铝薄膜,厚度为0.005~0.02微米,成为铝的天然保护层,阻止铝继续被氧化,因而具有好的抗蚀性能,还可以用阳极氧化或电镀的方法,在铝材和铝制品的表面生成彩色鲜艳的氧化膜;铝的导电、导热性好,导电率相当于国际标准退火铜的64.94%,约为银的一半,如果就相同的重量而言,铝的导电能力超过这两种金属;铝的导热性几乎比铁的导热率大3倍;铝的反光性能很强,反射紫外线比银还强,铝在碰击时不产生火花。
铝对氧的亲和力大,铝可以用作炼钢的脱氧剂和一些高熔点金属氧化物(如MnO2、Cr2O3)的还原剂。
铝与氮、硫和卤族元素在高温下发生反应生成如AIN、Al2S3、AlCl3之类的化合物,这些化合物(除AIN外)和铝在真空中加热到1000℃以上时,生成相应的低价铝化合物,这些低价化合物在低温下发生歧化反应,分解为金属铝及其化合物。
铝是两性元素,它与大多数稀酸可缓慢地反应,能迅速溶解于浓盐酸中。
但浓硝酸使铝钝化,铝与苛性碱溶液发生强烈反应,迅速溶解生成铝酸根离子。
二、铝的主要用途
铝由于具有优良的物理性能,所以铝在国民经济各部门和国防工业中得到了广泛的应用。
铝作为轻型结构材料,重量轻,强度大,陆、海、空各种运载工具,特别是飞机、导弹、火箭、人造卫星等,均使用大量的铝,一架超音速飞机的用铝量占其自身重量的70%,一枚导弹用铝量占其总重量的10%以上。
用铝和铝合金制造的各种车辆,由于重量轻,可以减少能耗,所节省的能量远远超过炼铝时所消耗的能量。
在建筑工业中用铝合金作房屋的门窗及结构材料,用铝制作太阳能收集器,可以节省能源。
在电力输送方面,铝的用量居首位,90%的高压电导线是用铝制作的。
在食品工业上,从仓库储槽到罐头盒,以至饮料容器大多用铝制成。
在其他方面,用铝粉作难熔金属(如钼等)的还原剂和作炼钢过程中的脱氧剂,以及日常生活中的锅、盆、匙等。