高考化学 铁及其化合物 培优 易错 难题练习(含答案)附详细答案
- 格式:doc
- 大小:559.00 KB
- 文档页数:13

高考化学铁及其化合物(大题培优易错试卷)含答案一、高中化学铁及其化合物1.下图为一些常见物质的转化关系图(部分反应物与生成物未标出)。
A、C、E、G为单质,其中A、C、G为金属,E为气体。
B为常见无色液体,L为红褐色固体,I的焰色反应呈紫色。
常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质。
⑴A在元素周期表中的位置为_______,H的电子式为________。
⑵写出有关反应的离子方程式:反应①的离子方程式为__________。
反应②的离子方程式为__________。
⑶反应③中每生成1 mol E,转移电子的物质的量为__________。
【答案】第四周期Ⅷ族 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ 1 mol【解析】【分析】A、C、E、G为单质,其中A、C、G为金属,L为红褐色固体,L为Fe(OH)3,B为常见无色液体,B为H2O,由元素守恒及转化可知,D为Fe3O4,G为Al,A为Fe,E为H2,I的焰色反应呈紫色,I中含K元素,由元素守恒及转化可知,C为K,F为KOH,I为KAlO2,K与氢气化合生成KH,所以H为KH,常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质,J为硝酸,K为硝酸铁,然后结合单质及化合物的性质来解答。
【详解】A、C、E、G为单质,其中A、C、G为金属,L为红褐色固体,L为Fe(OH)3,B为常见无色液体,B为H2O,由元素守恒及转化可知,D为Fe3O4,G为Al,A为Fe,E为H2,I的焰色反应呈紫色,I中含K元素,由元素守恒及转化可知,C为K,F为KOH,I为KAlO2,K与氢气化合生成KH,所以H为KH,常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质,J为硝酸,K为硝酸铁,(1)由上述分析可知,A为Fe,位于元素周期表中第四周期Ⅷ族,H为KH,其电子式为;(2)反应①的离子方程式为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,反应②的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)反应③为KH+H2O=KOH+H2↑,H元素的化合价由-1升高为0,则每生成1molE(KOH),转移电子的物质的量为1mol×(1-0)=1mol。

高考化学培优 易错 难题(含解析)之铁及其化合物推断题附详细答案一、铁及其化合物1.下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C 常温下为一种液体,B 、D 分别为黑色粉末和黑色晶体,G 为淡黄色固体,J 为生活中常见的调味品,I 为红褐色固体,F 为棕黄色溶液。
①是实验室制取丁的反应之一。
各物质间的转化如下图所示,回答下列问题(部分生成物未列出):(1)物质I 的化学式为________;F 中阴离子是______________;(2)反应①的化学方程式为为____________;(3)B 与K 的反应是实验室制取丙的反应,其离子方程式为____________;(4)反应②的化学方程式为_____________;(5)若E 与G 以物质的量比为1:1投入足量水中,反应的化学方程式为_________;生成1mol 气体转移电子的个数为__________。
【答案】Fe(OH)3 Cl - 2H 2O 22MnO 2H 2O+O 2 MnO 2+4H ++2Cl -ΔMn 2++Cl 2↑+2H 2O 3Fe + 4H 2O(g)高温Fe 3O 4 +4H 2 4FeCl 2+4Na 2O 2 + 6H 2O = 4Fe(OH)3↓+8NaCl + O 2↑ 6N A【解析】【分析】丙为黄绿色单质气体,所以丙为Cl 2,B 与K 的反应是实验室制取丙的反应,且B 为黑色粉末,则B 为MnO 2,K 为HCl ;①是实验室制取丁的反应之一,则该反应为双氧水在二氧化锰的催化作用下制取氧气的反应,所以C 为H 2O ,丁为氧气;G 为淡黄色固体,且可以生成氧气,则G 应为Na 2O 2,则J 为生活中常见的调味品,应为NaCl ,I 为红褐色固体应为Fe(OH)3;F 为棕黄色溶液,应含Fe 3+,E 与氯气反应可生成F ,则F 为FeCl 3,E 为FeCl 2;氯化铁可以与单质铁反应生成氯化亚铁,所以甲为铁单质,Fe 可以在高温条件下与水反应生成氢气和四氧化三铁,所以乙为氢气,D 为Fe 3O 4。

备战高考化学铁及其化合物推断题培优易错难题练习(含答案)及答案一、铁及其化合物1.某强酸性溶液 X 中可能含有 Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。
实验过程中有一种气体为红棕色。
根据以上信息,回答下列问题:(1)由强酸性条件即可判断 X 溶液中肯定不存在的离子有_____。
(2)溶液 X 中关于硝酸根离子的判断,正确的是_____(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有(3)气体 F 的电子式为_____,化合物 I 中含有的化学键类型有_____。
(4)转化①的离子方程式为_____。
转化⑦的离子方程式为_________。
(5)对不能确定是否存在的离子,可以另取 X 溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是_____。
①NaOH 溶液②KSCN 溶液③氯水和 KSCN 的混合溶液④pH 试纸⑤KMnO4溶液【答案】CO32-、SiO32- b 共价键和离子键 3Fe2+ +4H+ +NO3-= 3Fe3++NO↑ +2H2O AlO2-+2H2O+CO2===HCO3-+Al(OH) 3↓②【解析】【分析】某强酸性溶液X中一定含有氢离子,一定不含CO32-、SiO32-,加过量的硝酸钡溶液,产生白色沉淀C是硫酸钡,一定含有SO42-,一定不含Ba2+,产生气体A一定是亚铁离子和硝酸根离子、氢离子发生氧化还原反应得到的NO,所以一定含有Fe2+,一定不含NO3-,NO 遇到氧气转化为气体D为二氧化氮,二氧化氮与水、氧气反应生成溶液E为硝酸溶液,溶液B中加入过量氢氧化钠生成气体F,F为氨气,则原溶液中一定含有NH4+,氨气和硝酸溶液反应生成I为硝酸铵,溶液H中通入过量二氧化碳产生沉淀K和溶液L,沉淀K一定为氢氧化铝,原溶液中一定含有Al3+,L是NaHCO3,溶液B中生成的有铁离子,所以沉淀G是Fe(OH)3,溶于盐酸得到J为氯化铁溶液,但原溶液中不一定含有Fe3+。

高考化学培优易错试卷(含解析)之铁及其化合物推断题含详细答案一、铁及其化合物1.某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
【答案】Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液,据此分析。
【详解】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液。
(1)依据推断可知A为Fe(OH)3;(2)反应②是盐酸和氧化铁发生的复分解反应,反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;(3)反应④是氢氧化亚铁和氧气水发生反应生成氢氧化铁的也还原反应,反应的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
2.A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出)。
已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是___。
(2)反应①的化学方程式为___。
(3)反应③的离子方程式为___。
(4)反应⑧的化学方程式为___。
(5)反应⑥过程中的现象是____。
(6)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占___L。

高考化学培优易错试卷(含解析)之铁及其化合物推断题及详细答案一、铁及其化合物1.钛(Ti )被称为继铁、铝之后的第三金属,钛白(2TiO )是目前使用最广泛的白色颜料。
制备2TiO 和Ti 的原料是钛铁矿,用含23Fe O 的钛铁矿(主要成分为3FeTiO )制备2TiO 的流程如下:(1)步骤①加Fe 的目的是________________________;步骤②冷却的目的是__________________。
(2)考虑成本和废物的综合利用等因素,水浸后的废液中应加入_______处理。
(3)由金红石(2TiO )制取单质钛(Ti )的过程为,其中反应42800C TiCl 2Mg2MgCl Ti ︒++在氩气气氛中进行的理由是______________________________。
【答案】将3+Fe 还原为2+Fe 析出绿矾(42FeSO 7H O ⋅) 生石灰(或碳酸钙、碱) 高温下镁或钛与2O 、2N 等反应【解析】【分析】根据钛铁矿中23Fe O 、3FeTiO 与浓硫酸反应的溶液中加入铁粉、过滤后,滤液冷却得到硫酸亚铁晶体推知,铁粉与铁离子发生反应得到亚铁离子。
水浸后的溶液成酸性。
【详解】(1)分析题图可知,钛铁矿中的铁最终转化成副产品绿矾,所以要将+3价Fe 转化为+2价Fe ;降低温度,减小了42FeSO 7H O ⋅的溶解度,有利于绿矶结晶析出。
(2)水浸过程发生的离子反应为2223TiO 2H O H TiO 2H +++=↓+,废液呈酸性,所以处理水浸后的废液应加入CaO 、3CaCO 或碱。
(3)由于Ti 和Mg 易与空气中的2O 、2N 等反应,故该反应应在氩气气氛中进行。
2.某铁的化合物A 存在如下转化关系:已知B为黄绿色气体单质。
请完成下列问题:(1)A的化学式________。
(2)向C的溶液中滴加适量KSCN溶液,无明显现象,再滴加几滴B的水溶液,溶液呈血红色。

高考化学培优易错试卷(含解析)之铁及其化合物推断题附答案解析一、铁及其化合物1.某强酸性溶液 X 中可能含有 Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。
实验过程中有一种气体为红棕色。
根据以上信息,回答下列问题:(1)由强酸性条件即可判断 X 溶液中肯定不存在的离子有_____。
(2)溶液 X 中关于硝酸根离子的判断,正确的是_____(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有(3)气体 F 的电子式为_____,化合物 I 中含有的化学键类型有_____。
(4)转化①的离子方程式为_____。
转化⑦的离子方程式为_________。
(5)对不能确定是否存在的离子,可以另取 X 溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是_____。
①NaOH 溶液②KSCN 溶液③氯水和 KSCN 的混合溶液④pH 试纸⑤KMnO4溶液【答案】CO32-、SiO32- b 共价键和离子键 3Fe2+ +4H+ +NO3-= 3Fe3++NO↑ +2H2O AlO2-+2H2O+CO2===HCO3-+Al(OH) 3↓②【解析】【分析】某强酸性溶液X中一定含有氢离子,一定不含CO32-、SiO32-,加过量的硝酸钡溶液,产生白色沉淀C是硫酸钡,一定含有SO42-,一定不含Ba2+,产生气体A一定是亚铁离子和硝酸根离子、氢离子发生氧化还原反应得到的NO,所以一定含有Fe2+,一定不含NO3-,NO 遇到氧气转化为气体D为二氧化氮,二氧化氮与水、氧气反应生成溶液E为硝酸溶液,溶液B中加入过量氢氧化钠生成气体F,F为氨气,则原溶液中一定含有NH4+,氨气和硝酸溶液反应生成I为硝酸铵,溶液H中通入过量二氧化碳产生沉淀K和溶液L,沉淀K一定为氢氧化铝,原溶液中一定含有Al3+,L是NaHCO3,溶液B中生成的有铁离子,所以沉淀G是Fe(OH)3,溶于盐酸得到J为氯化铁溶液,但原溶液中不一定含有Fe3+。

高考化学铁及其化合物(大题培优易错难题)及答案解析一、高中化学铁及其化合物1.下图所涉及的物质均为中学化学中的常见物质,其中C为气体单质一种主要成分、D在常温下是黄绿色气体、E为Fe单质,其余为化合物。
它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的化学式F______________,G_______________,H_________________。
(2)指出MnO2在相关反应中的作用,反应①中是___________剂,反应②中是____________剂。
(3)若反应①是在加热条件下进行,则A是___________;若反应①是在常温条件下进行,则A的电子式为______________。
(4)写出B与MnO2共热获得D的离子方程式________________。
(5)写出B与F反应的化学方程式___________________________。
【答案】Fe3O4 FeCl2 FeCl3催化剂氧化剂 KClO3 4H++2Cl-+MnO2Mn2++Cl2↑+2H2O Fe3O4+8HCl=FeCl2+2FeCl3+4H2O【解析】【分析】中学阶段与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用氯酸钾在加热条件分解制氧气,用浓盐酸和MnO2制备Cl2,则A 为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,是目前人类应用最广泛的金属,则F为Fe3O4,G为FeCl2,H为FeCl3,结合物质的性质解答该题。
【详解】与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用浓盐酸和MnO2制备Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,是目前人类应用最广泛的金属,则F为Fe3O4,G为FeCl2,H为FeCl3,则:(1)由以上分析可知,F为Fe3O4,G为FeCl2,H为FeCl3;(2)在不加热条件下,用H2O2和MnO2制备O2,H2O2起到催化剂的作用,在加热条件下用浓盐酸和MnO2制备Cl2,发生:4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,MnO2起到氧化剂的作用;(3)反应①是在加热条件下进行,判断为实验室制氧气的反应,加热分解氯酸钾,2KClO32KCl+3O2↑,若常温下反应是二氧化锰催化剂分解过氧化氢,2H2O22H2O+O2↑,H2O2是共价化合物,其电子式为;(4)B(HCl)与MnO2共热获得D(Cl2)的离子方程式为4H++2Cl-+MnO2Mn2++Cl2↑+2H2O;(5)B(HCl)与F(Fe3O4)反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O。
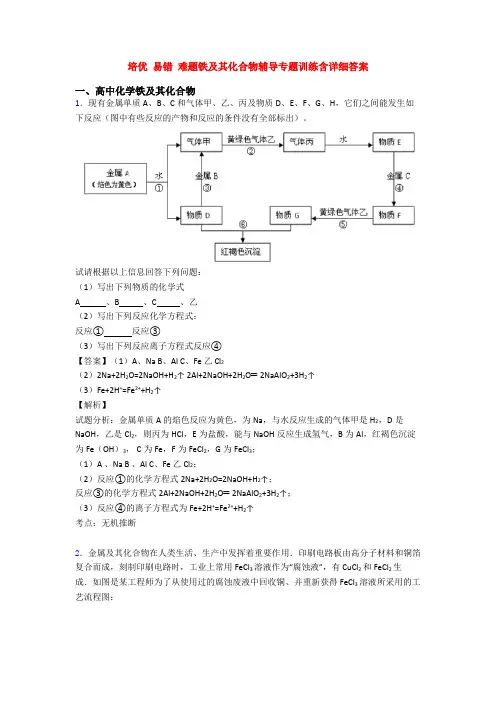
培优易错难题铁及其化合物辅导专题训练含详细答案一、高中化学铁及其化合物1.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
试请根据以上信息回答下列问题:(1)写出下列物质的化学式A 、B 、C 、乙(2)写出下列反应化学方程式:反应①反应③(3)写出下列反应离子方程式反应④【答案】(1)A、Na B、Al C、Fe 乙 Cl2(2)2Na+2H2O=2NaOH+H2↑ 2Al+2NaOH+2H2O═2NaAlO2+3H2↑(3)Fe+2H+=Fe2++H2↑【解析】试题分析:金属单质A的焰色反应为黄色,为Na,与水反应生成的气体甲是H2,D是NaOH,乙是Cl2,则丙为HCl,E为盐酸,能与NaOH反应生成氢气,B为Al,红褐色沉淀为Fe(OH)3, C为Fe,F为FeCl2,G为FeCl3;(1)A 、Na B 、Al C、Fe 乙 Cl2;(2)反应①的化学方程式2Na+2H2O=2NaOH+H2↑;反应③的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑;(3)反应④的离子方程式为Fe+2H+=Fe2++H2↑考点:无机推断2.金属及其化合物在人类生活、生产中发挥着重要作用.印刷电路板由高分子材料和铜箔复合而成,刻制印刷电路时,工业上常用FeCl3溶液作为“腐蚀液”,有CuCl2和FeCl2生成.如图是某工程师为了从使用过的腐蚀废液中回收铜、并重新获得FeCl3溶液所采用的工艺流程图:请回答下列问题:(1)实验室中检验溶液中存在Fe3+的试剂是________,证明Fe3+存在的现象是_________;(2)写出FeCl3溶液与金属铜发生反应的离子方程式:__________;(3)写出上述流程图中加入或生成的有关物质的化学式:①_________,②________,④_________;(4)含有②的滤液与⑤反应的化学方程式为__________;(5)如向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是_________。

高考化学铁及其化合物培优易错难题练习(含答案)及答案一、高中化学铁及其化合物1.某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
【答案】Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液,据此分析。
【详解】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液。
(1)依据推断可知A为Fe(OH)3;(2)反应②是盐酸和氧化铁发生的复分解反应,反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;(3)反应④是氢氧化亚铁和氧气水发生反应生成氢氧化铁的也还原反应,反应的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
2.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:已知①A、B、C、D、G含有同种元素。
②纯A(单质)B溶液D固体G溶液颜色银白色黄色红棕色浅绿色③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:(1)写出D的化学式:___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。

高考化学铁及其化合物推断题(大题培优易错难题)及详细答案一、铁及其化合物1.利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子并得到副产物ZnO。
制备流程如图所示:(已知ZnO能溶于强碱)已知:Zn及其化合物的性质与Al及其化合物的性质相似。
请回答下列问题:(1)用NaOH溶液处理废旧镀锌铁皮的目的是________(填字母)。
A 去除油污B 溶解镀锌层C 去除铁锈D 钝化铁皮(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是抽滤______。
(3)加适量H2O2 目的是________ 溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_____。
(4)副产物ZnO常用于制备锌单质。
我国早有炼锌技术的记载,明代宋应星著的《天工开物》中有“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红冷定毁罐取出…即倭铅也。
”该炼锌工艺过程涉及主要反应的化学方程式为_________,(注:炉甘石的主要成分为碳酸锌,“倭铅”是指金属锌)。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。
若需配制浓度为0.01 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7[保留4位有效数字,已知M r(K2Cr2O7)=294]。
配制该标准溶液时,下列仪器中用不到的有________(填编号)。
①电子天平②烧杯③量筒④玻璃棒⑤250 mL容量瓶⑥胶头滴管⑦移液管(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
【答案】AB 洗涤、灼烧将部分亚铁离子氧化成铁离子防止Fe2+被氧化 ZnCO3+2C 高温Zn+3CO↑ 0.7350 ③⑦偏大【解析】【分析】【详解】(1)A.氢氧化钠溶液与油污反应生成高级脂肪酸盐,具有去除油污作用,A符合题意;B.根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层,B符合题意;C.氢氧化钠和铁不反应,C不符合题意;D.氢氧化钠不能钝化铁皮,故D不符合题意;答案为:AB;(2)调节溶液A的pH可产生Zn(OH)2沉淀,抽滤就可以得到氢氧化锌沉淀,洗涤除去附着的离子,高温灼烧氢氧化锌分解得到ZnO;(3)Fe3O4中有+3价铁,因此加适量H2O2目的是将部分亚铁离子氧化成铁离子,将亚铁离子和铁离子达到Fe3O4中+2价铁与+3价铁的比例关系,持续通入N2,主要防止Fe2+被氧化;故答案为:将部分亚铁离子氧化成铁离子;防止Fe2+被氧化;(4)该炼锌工艺参加反应的物质是煤炭饼和炉甘石(碳酸锌),得到的物质是倭铅(金属锌)和CO,联想初中所学高炉炼铁原理,则炼锌过程涉及主要反应的化学方程式为ZnCO3+2C 高温Zn+3CO↑;(5)m(K2Cr2O7)=0.01 mol·L-1×0.250 L×294 g·mol-1=0.7350 g,电子天平用于准确称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流,容量瓶用于配制溶液,胶头滴管用于加水定容。

高考化学培优易错难题(含解析)之铁及其化合物附详细答案一、高中化学铁及其化合物1.化学反应多姿多彩,其中的颜色多种多样,试根据图中框图,按要求填写下列问题(1)A的名称是______________,B的化学式是_________。
(2)反应①的化学方程式________________________;反应②的离子方程式_____________________________;B和氯气的化学方程式____________________________。
【答案】(1)氧化铁;Fe(2)Fe2O3+3CO 2Fe+3CO2;Fe+Cu2+=Cu+ Fe2+;2Fe+3Cl22FeCl3【解析】【分析】【详解】试题分析:红棕色粉末A为氧化铁,在高温下被一氧化碳还原,生成黑色粉末B为铁,与蓝色溶液反应生成红色固体C为铜,铁与盐酸反应生成浅绿色溶液为氯化亚铁。
(1)根据上述分析,A是氧化铁,B是铁,故答案为氧化铁;Fe;(2)反应①的化学方程式为Fe2O3+3CO 2Fe+3CO2,故答案为Fe2O3+3CO2Fe+3CO2;反应②的离子方程式为Fe+Cu2+=Cu+ Fe2+,故答案为Fe+Cu2+=Cu+ Fe2+;B和氯气的化学方程式为2Fe+3Cl22FeCl3,故答案为2Fe+3Cl22FeCl3。
考点:考查了无机推断的相关知识。
2.D、E为中学化学常见的单质,在一定条件下C、D间能发生反应。
各物质转化关系如下图:(1)B的同素异形体的名称为:_____________;H的化学式为:_____________。
(2)已知E的燃烧热为QkJ/mol,试写出表示E燃烧热的热化学方程式_____________。
(3)用惰性电极电解A 溶液的阳极反应式为:_____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________。
a.氯水和KSCN溶液b.氢氧化钠溶液c.酸性KMnO4溶液(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH。
【化学】培优易错难题铁及其化合物辅导专题训练含答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:(1)A在B中燃烧的现象是__________________________________________。
(2)D+E→B的反应中,被氧化与被还原的物质的物质的量比是_________________________。
(3)G+J→M的离子方程式是____________________________________。
(4)Y受热分解的化学方程式是______________________________________。
(5)检验硫酸铁溶液中是否存在Fe2+的试剂是 ____________________。
【答案】放出大量的热,产生苍白色火焰 2:1 3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(O H)3↓4Fe(NO3)3Δ2Fe2O3+12NO2↑+3O2↑酸性高锰酸钾溶液【解析】【分析】F是地壳中含量最多的金属元素的单质,则F为Al,转化关系中X电解得到三种物质,为电解电解质与水型,A、B为气态单质,二者为氢气和氯气,二者反应生成D,D为HCl,E 为黑色固体,为氧化物,和HCl反应又生成B气体,A为H2,B为Cl2,E为MnO2,电解X 是电解氯化钠溶液,C为NaOH,与Al反应生成G,G为NaAlO2;M为红褐色沉淀为Fe(OH)3,所以J是含三价铁离子的物质,是H和D反应生成,证明J为FeCl3,H、I为氧化物判断H为Fe2O3,I为红棕色气体为NO2,结合转化关系可知,N为HNO3,Y为Fe(NO3)3,结合物质的性质来解答。
化学铁及其化合物的专项培优易错难题练习题(含答案)含详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.利用如图可以从不同角度研究含铁物质的性质及其转化关系。
图中甲~己均含铁元素。
回答下列问题:(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析是因其具有____性;下列关于乙的说法正确的是______(填标号)。
a.属于酸性氧化物,能与碱反应b.属于碱性氧化物,能与酸反应c.属于两性氧化物,既能与酸反应,又能与碱反应(2)已知甲与稀硝酸反应的化学方程式为甲+HNO3―→戊+己+NO↑+H2O(方程式未配平)。
若产物中戊和己的物质的量之比为3∶1,则甲与HNO3的物质的量之比为____。
(3)戊与烧碱溶液反应生成丙,放置一段时间后丙转化为丁,丙转化为丁的化学方程式为______,现象为______。
【答案】氧化 b 1∶3 4Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀迅速变为灰绿色,最后变为红褐色【解析】【分析】根据图像可知,甲为铁;乙为氧化物且为+2价,为FeO;丙、丁为氢氧化物,分别为+2、+3价,分别为氢氧化亚铁、氢氧化铁。
【详解】(1)K2FeO4中铁元素的化合价是+6价,在反应中Fe元素能得电子表现强氧化性,常用作杀菌消毒剂。
根据图可知,铁元素的+2价氧化物是FeO,属于碱性氧化物,能与酸反应生成盐和水。
(2)根据图可知,戊和己分别是铁元素的+2价和+3价盐,铁与硝酸反应生成的戊和己分别是Fe(NO3)2和Fe(NO3)3,HNO3在反应中被还原为NO,氮元素的化合价由+5价降为+2价;设反应生成Fe(NO3)3的物质的量为1 mol,则生成Fe(NO3)2的物质的量为3mol,则参加反应的Fe(甲)的物质的量为4mol,根据电子守恒可得3mol+3mol×2=n(NO)×3,n(NO)=3mol;根据N原子守恒可知参加反应的n(HNO3)=n(NO)+n[Fe(NO3)2]×2+n[Fe(NO3)3]×3=12mol,则铁与HNO3的物质的量之比为4∶12=1∶3。
化学铁及其化合物的专项培优易错难题练习题(含答案)及答案解析一、高中化学铁及其化合物1.物质X是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。
在密闭容器中加热X使之完全分解,发生如下转化:请回答下列问题:(1)X的化学式为__。
(2)将E混合晶体溶于水配成溶液,向溶液中加入过量稀NaOH溶液时发生的总反应的离子方程式为__。
(3)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,请设计实验方案验证之_。
【答案】AlCl3·2FeSO4 Al3++2H++6OH-=AlO2-+4H2O 将气体通入足量NaOH溶液中,收集余气,把一条带火星的木条伸入其中,若复燃,则说明是O2【解析】【分析】固体氧化物B溶于稀盐酸后得到的溶液C中滴加KSCN溶液,混合液变血红色,说明B中含有Fe3+,则B为Fe2O3,C为FeCl3溶液,无色D气体能使品红褪色,则D为SO2,由元素守恒可知A中含有Fe、S、O元素,A加热分解能生成氧化铁和二氧化硫,则盐A为FeSO4,氧化铁的物质的量为3.2g160g/mol=0.02mol,生成二氧化硫为0.448L22.4L/mol=0.02mol,由Fe、S原子为1:1可知生成SO3为0.02mol,4.27g混合晶体E为AlCl3和SO3,AlCl3的物质的量为4.27g-0.02mol80g/mol133.5g/mol=0.02mol,X的组成为AlCl3∙2FeSO4,以此解答该题。
【详解】(1)根据上述分析,X的化学式为AlCl∙2FeSO4;(2)将E混合晶体溶于水配成溶液,三氧化硫反应生成硫酸,则硫酸与氯化铝的物质的量相等,逐滴加入过量稀NaOH溶液,该过程的总反应的离子方程式为:Al3++2H++6OH-=AlO2-+4H2O;(3)若在高温下长时间煅烧X,生成的三氧化硫再分解生成二氧化硫和氧气,另一种气体分子式是O2,检验氧气的方法为:将气体通入足量NaOH溶液中,收集余气,把一条带火星的本条伸入其中,若复燃,则说明是O2。
高考化学铁及其化合物培优易错难题练习(含答案)及答案一、高中化学铁及其化合物练习题(含详细答案解析)1.在一定条件下,A、B、C、D、E物质相互转化关系如图所示(反应条件和部分产物略),其中A、B、C为单质。
(1)若A为金属,B、C常温下均为气体,D为黑色晶体,E为一种生活中必不可少的物质,则这五种物质的化学式为:A为__,B为__,C为__,D为__,E为__。
(2)A和E在一定条件下反应生成D的化学方程式为__。
【答案】Fe O2 H2 Fe3O4 H2O 3Fe+4H2O(g)Fe3O4+4H2【解析】【分析】A、B、C为单质,若A为金属,B、C常温下均为气体,D为黑色晶体,Fe和H2O反应生成黑色的Fe3O4,Fe和O2反应生成黑色的Fe3O4,氢气和氧气反应生成H2O,符合转化关系,则A是Fe、B是O2、C是H2、E是H2O、D是Fe3O4,据此分析解答。
【详解】A、B、C为单质,若A为金属,B、C常温下均为气体,D为黑色晶体,Fe和H2O反应生成黑色的Fe3O4,Fe和O2反应生成黑色的Fe3O4,氢气和氧气反应生成H2O,符合转化关系,则A是Fe、B是O2、C是H2、E是H2O、D是Fe3O4;(1)通过以上分析知,这五种物质的化学式为:A为Fe,B为O2,C为H2,D为Fe3O4,E为H2O;(2)在高温条件下,Fe和水蒸气反应生成四氧化三铁和氢气,所以A和E在一定条件下反应生成D的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。
2.下列物质之间有如下反应关系:已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:(1)写出下列物质的化学式:A______,B______,D________,甲_______,乙_______,丙__________。
(2)写出E →C 反应的化学方程式:_____________________。
【答案】Fe 2O 3 FeCl 3 FeCl 2 Cl 2 NaOH KSCN 4Fe (OH )2 +O 2 + 2H 2O =4Fe (OH )3【解析】【分析】E 转化成C 的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E 为Fe (OH )2,C 为Fe (OH )3,A 为红棕色粉末,则A 为Fe 2O 3,B 为FeCl 3,D 为FeCl 2,乙为NaOH ,由D →B 的转化可知,甲为氯气或氯水等,由血红色溶液可知,丙为KSCN ,据此解答。
化学铁及其化合物的专项培优易错难题练习题附详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:请回答:(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。
检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3高温2Fe+Al2O3还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN(或NH4SCN)溶液变红(或呈现血红色)【解析】【分析】氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
【详解】(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3高温2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。
检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。
2.已知有以下物质相互转化:请回答下列问题:(1)写出B的化学式___________,D的化学式为____________;(2)写出由E转变成F的化学方程式________。
(3)写出D转化成H的离子方程式_________。
高考化学铁及其化合物培优易错试卷练习(含答案)附详细答案一、高中化学铁及其化合物1.已知有以下物质相互转化。
试回答:(1)写出B的化学式__________,D的化学式__________。
(2)写出由E转变成F的化学方程式_______________________。
(3)写出用KSCN鉴别G现象___________;向G溶液加入A的有关离子反应方程式___________。
【答案】(1)FeCl2;KCl(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3(3)溶液变血红色;Fe+2Fe3+=3Fe2+。
【解析】试题分析:白色沉淀E在空气中转化为红褐色沉淀F,可推知E为Fe(OH)2、F为Fe(OH)3,F与盐酸反应得到G溶液,则G为FeCl3,G与A反应得到B、B与C反应得到E与,可推知B为FeCl2,A为Fe,C为碱,反应得到D为氯化物,D溶液与硝酸银、硝酸混合得到白色沉淀H为AgCl,反应得到的溶液进行焰色反应呈紫色,可以K元素,故D为KCl、C为KOH。
(1)由上述分析可知,B为FeCl2,D为KCl,故答案为FeCl2;KCl;(2)E转变成F的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)用KSCN鉴别FeCl3溶液的现象为:溶液呈血红色,向FeCl3溶液加入Fe的离子方程式为:Fe+2Fe3+=3Fe2+故答案为血红色;Fe+2Fe3+=3Fe2+。
考点:考查了无机物推断、Fe、Cl、K元素化合物的性质的相关知识。
2.某金属X,为了确定其成分,进行一系列实验,实验过程和发生的现象如下图所示:⑴写出金属X的化学式_________。
⑵写出溶液B中溶质的化学式_________。
⑶写出白色沉淀C转变为红褐色沉淀D的化学方程式_________。
【答案】Fe FeCl24Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】金属与盐酸反应生成无色可燃性气体为氢气,白色沉淀与氧气反应生成红褐色沉淀,则金属为Fe;【详解】(1)分析可知,金属X为Fe;(2)溶液B为氯化亚铁;(3)白色沉淀为氢氧化亚铁,在空气中与氧气反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;3.下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质。