2——氧化铝-详解
- 格式:ppt
- 大小:1.55 MB
- 文档页数:40

编辑词条氧化铝概要氧化铝通常称为“铝氧”,是一种白色粉状物,属共价化合物,熔点为2050℃,沸点为3000℃,真密度为3.6g/cm3。
它的流动性好,不溶于水,能溶解在熔融的冰晶石中。
它是铝电解生产的中的主要原料。
名称氧化铝;刚玉;白玉;红宝石;蓝宝石;刚玉粉;corundum化学式Al2O3外观白色晶状粉末或固体物理属性式量101.96 amu熔点2303 K沸点3250 K密度 3.97 kg/m..晶体结构三方晶系(hex)热化学属性ΔfH0liquid −1620.57 kJ/molΔfH0solid −1675.69 kJ/molS0liquid, 1 bar 67.24 J/mol•KS0solid 50.9 J/mol•K安全性食入低危险吸入可能造成刺激或肺部伤害皮肤低危险眼睛低危险在没有特别注明的情况下,使用SI单位和标准气温和气压。
氧化铝是铝和氧的化合物,分子式为Al2O3。
在矿业、制陶业和材料科学上又被称为矾土。
应急处理隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
避免扬尘,小心扫起,置于袋中转移至安全场所。
若大量泄漏,用塑料布、帆布覆盖。
收集回收或运至废物处理场所处置。
制备强热氢氧化铝,可得无定形之白色氧化铝粉末。
2Al(OH) 3 → Al 2 O 3 +3H 2 O 用途1. 红宝石、蓝宝石的主成份皆为氧化铝,因为其它杂质而呈现不同的色泽。
红宝石含有氧化铬而呈红色,蓝宝石则含有氧化铁及氧化钛而呈蓝色。
2. 在铝矿的主成份铁铝氧石中,氧化铝的含量最高。
工业上,铁铝氧石经由Bayer process纯化为氧化铝,再由Hall-Heroult process转变为铝金属。
3. 氧化铝是金属铝在空气中不易被腐蚀的原因。
纯净的金属铝极易与空气中的氧气反应,生成一层薄的氧化铝薄膜覆盖在暴露于空气中铝表面。
这层氧化铝薄膜能防止铝被继续氧化。
这层氧化物薄膜的厚度和性质都能通过一种称为阳极处理(阳极防腐)的处理过程得到加强。

高中化学离子反应试题(有答案和解析)一、高中化学离子反应1.下列离子方程式中正确的是A.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH +OH - A CH 2BrCOO-+H2OB.用氢氧化钠溶液除去铝片表面的氧化膜:A13++4OH-- A1O2-+2H2OC.次氯酸钠溶液中通入少量的CO2气体:CQ+CO2+H2O-HC1O+HCQ-D.等体积、等浓度的Ca (HCO) 2溶液和NaOH溶液混合:_ 2+ 2- - 2- _ _Ca +2HCO3 +2OH CaCO3 +CO3 +2H2O【答案】C【解析】【分析】【详解】A.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热,竣基和氢氧化钠发生中和反应,澳原子在碱中发生水解反应,反应的化学方程式为:CH2BrCOOH+2OH 4 * CH2(OH)COO+H2O, A选项错误;B.用氢氧化钠溶液除去铝片表面的氧化膜,氧化膜的成分为氧化铝,反应的离子方程式为:Al2O3+2OH-===2AlO2-+H2O, B 选项错误;C.次氯酸钠溶液中通入少量的CO2气体,次氯酸的酸性大于碳酸氢根,则次氯酸钠与二氧化碳反应生成碳酸氢根,反应的方程式为:C1O-+CQ+H2O—HClO+HCOi, C选项正确;D.等体积、等浓度的Ca(HCO2溶液和NaOH溶液反应,Ca2+和OH-为1:1 ,正确的离子反应方程式为Ca2++HCC3-+OH===CaCO J +H2O, D 选项错误;答案选Co【点睛】判断离子反应方程式的正误,关键在于抓住离子反应方程式是否符合客观事实、化学式的拆分是否准确、是否遵循质量守恒和电荷守恒、氧化还原反应中得失电子是否守恒等。
2 .某溶液中含有SQ2-、SC32-、SiO32-、BL、CC32-、Na+,向该溶液中通入过量的Cb,下列判断正确的是①反应前后,溶液中离子浓度基本保持不变的有SQ2-、Na+;②有胶状物质生成;③有气体产生;④溶液颜色发生变化;⑤共发生了2个氧化还原反应。

氧化铝简介氧化铝,⼜称三氧化⼆铝,分⼦量102,通常称为“铝氧”,是⼀种难溶于⽔的⽩⾊固体。
⽆臭。
⽆味。
质极硬。
易吸潮⽽不潮解。
两性氧化物,能溶于⽆机酸和碱性溶液中,⼏乎不溶于⽔及⾮极性有机溶剂。
相对密度(d204)4.0。
熔点约2000℃,俗称矾⼟。
英⽂别名:Aluminum oxide式量 101.96 amu导电性常温状态下不导电1.加热⽤氢氧化钠溶解矿⽯。
氧化铁不溶,⼆氧化硅溶解为硅酸根(Si(OH)62?),氧化铝溶解为铝酸根(Al(OH)4?)。
1.过滤,加酸处理,氢氧化铝沉淀出来,再过滤。
再由Hall-Heroult法转变为铝⾦属。
再由Hall-Heroult法转变为铝⾦属。
α型氧化铝在α型氧化铝的晶格中,氧离⼦为六⽅紧密堆积,Al3+对称地分布在氧离⼦围成的⼋⾯体配位中⼼,晶格能很⼤,故熔点、沸点很⾼.α型氧化铝不溶于⽔和酸,⼯业上也称铝氧,是制⾦属铝的基本原料;也⽤于制各种耐⽕砖、耐⽕坩埚、耐⽕管、耐⾼温实验仪器;还可作研磨剂、阻燃剂、填充料等;⾼纯的α型氧化铝还是⽣产⼈造刚⽟、⼈造红宝⽯和蓝宝⽯的原料;还⽤于⽣产现代⼤规模集成电路的板基.γ型氧化铝γ型氧化铝是氢氧化铝在140-150℃的低温环境下脱⽔制得,⼯业上也叫活性氧化铝、铝胶.其结构中氧离⼦近似为⽴⽅⾯⼼紧密堆积,Al3+不规则地分布在由氧离⼦围成的⼋⾯体和四⾯体空隙之中.γ型氧化铝不溶于⽔,能溶于强酸或强碱溶液,将它加热⾄1200℃就全部转化为α型氧化铝.γ型氧化铝是⼀种多孔性物质,每克的内表⾯积⾼达数百平⽅⽶,活性⾼吸附能⼒强.⼯业品常为⽆⾊或微带粉红的圆柱型颗粒,耐压性好.在⽯油炼制和⽯油化⼯中是常⽤的吸附剂、催化剂和催化剂载体;在⼯业上是变压器油、透平油的脱酸剂,还⽤于⾊层分析;在实验室是中性强⼲燥剂,其⼲燥能⼒不亚于五氧化⼆磷,使⽤后在175℃以下加热6-8h还能再⽣重复使⽤.⽬前世界上⽤拜⽿法⽣产的氧化铝要占到总产量的90%以上,氧化铝⼤部分⽤于制⾦属铝,⽤作其它⽤途的不到10%.电解氧化铝⼯业化⼤规模⽣产电解铝的主要⼯艺过程是⼀个熔盐电化学过程,⽤简单的化学式可表⽰如下:熔盐电解主反应:Al2O3+2C ——————→ 2Al+CO2↑+CO↑(1)阳极960~990℃阴极副反应:AlF3+C→Al+CF3 (2)Na3AlF3+C →Al+NaF+CF4+F2 (3)NaF+C → Na+CF4 (4)β型氧化铝还有⼀种β-Al2O3,它有离⼦传导能⼒(允许Na通过),以β-铝矾⼟为电解质制成钠-硫蓄电池。

氧化铝陶瓷表面精加工工艺详解
氧化铝陶瓷是一种具有高温耐性、耐腐蚀性和电绝缘性的陶瓷材料,广泛应用于电子、冶金、化工等领域。
为了提高氧化铝陶瓷的表面精度和光洁度,需要进行精加工工艺。
以下是氧化铝陶瓷表面精加工工艺的详细解释:
1. 磨削:磨削是精加工氧化铝陶瓷表面最常用的工艺。
磨削可以使用钻石磨头或砂轮进行,通过磨削可以去除氧化铝陶瓷表面的粗糙部分,提高表面的平整度和光洁度。
2. 抛光:抛光是在磨削后进一步提高氧化铝陶瓷表面光洁度的工艺。
抛光可以使用石英砂或者纳米颗粒进行,通过摩擦和研磨可以去除磨削过程中产生的疤痕和划痕,使表面更加光滑。
3. 拋光:拋光是在抛光后进一步提高氧化铝陶瓷表面光洁度和平整度的工艺。
拋光可以使用抛光布或者抛光膏进行,通过反复摩擦和研磨可以使表面更加平整,达到所需的光洁度要求。
4. 涂层:涂层是一种在氧化铝陶瓷表面覆盖一层薄膜的工艺。
涂层可以使用氧化铬、二氧化硅等材料进行,通过涂层可以增加氧化铝陶瓷表面的硬度和抗腐蚀性能,提高表面的使用寿命。
5. 镀膜:镀膜是一种在氧化铝陶瓷表面镀上一层金属膜的工艺。
镀膜可以使用金、银、铜等金属进行,通过镀膜可以改变氧化铝陶瓷表面的外观和性能,增加其导电性和导热性。
总之,氧化铝陶瓷表面精加工工艺可以通过磨削、抛光、拋光、
涂层和镀膜等方法来改善表面质量,提高氧化铝陶瓷的性能和使用寿命。
根据具体需求和工艺要求,可以选择适当的精加工工艺进行。

2021年普通高等学校招生全国统一考试(全国乙卷)化学注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并将自己的姓名、准考证号、座位号填写在本试卷上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号,涂写在本试卷上无效。
3.作答非选择题时,将答案书写在答题卡上,书写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 Cl35.5 Fe 56一、选择题1. 我国提出争取在2030年前实现碳达峰,2060年实现碳中和,这对于改善环境,实现绿色发展至关重要。
碳中和是指2CO的排放总量和减少总量相当。
下列措施中能促进碳中和最直接有效的是A. 将重质油裂解为轻质油作为燃料B. 大规模开采可燃冰作为清洁燃料C. 通过清洁煤技术减少煤燃烧污染D. 研发催化剂将2CO还原为甲醇【答案】D【解析】【分析】【详解】A.将重质油裂解为轻质油并不能减少二氧化碳的排放量,达不到碳中和的目的,故A不符合题意;B.大规模开采可燃冰做为清洁燃料,会增大二氧化碳的排放量,不符合碳中和的要求,故B不符合题意;C.通过清洁煤技术减少煤燃烧污染,不能减少二氧化碳的排放量,达不到碳中和的目的,故C不符合题意;D.研发催化剂将二氧化碳还原为甲醇,可以减少二氧化碳的排放量,达到碳中和的目的,故D符合题意;故选D。
2. 在实验室采用如图装置制备气体,合理的是A. AB. BC. CD. D【答案】C【解析】【分析】由实验装置图可知,制备气体的装置为固固加热装置,收集气体的装置为向上排空气法,说明该气体的密度大于空气的密度;【详解】A.氨气的密度比空气小,不能用向上排空法收集,故A错误;B.二氧化锰与浓盐酸共热制备氯气为固液加热反应,需要选用固液加热装置,不能选用固固加热装置,故B错误;C.二氧化锰和氯酸钾共热制备氧气为固固加热的反应,能选用固固加热装置,氧气的密度大于空气,可选用向上排空气法收集,故C正确;D.氯化钠与浓硫酸共热制备为固液加热反应,需要选用固液加热装置,不能选用固固加热装置,故D错误;故选C。


展开编辑本段概要管制信息本品不受管制名称中文名称:铝氧,三氧化二铝英文别名:Aluminum oxide化学式Al2O3相对分子质量101.96性状白色结晶性粉末。
无臭。
无味。
质极硬。
易吸潮而不潮解。
溶于浓硫酸,缓慢溶于碱液中形成氢氧化物,几乎不溶于水及非极性有机溶剂。
相对密度(d204)4.0。
熔点约2000℃。
储存密封干燥保存。
SCRC100009用途用作分析试剂。
有机溶剂的脱水。
吸附剂。
有机反应催化剂。
研磨剂。
抛光剂。
质检信息质检项目指标值水中溶解物,% ≤0.5硅酸盐(SiO3) 合格碱金属及碱士金属,% ≤0.50重金属(以Pb计),% ≤0.005氯化物(Cl),% ≤0.01硫酸盐(SO4),% ≤0.05灼烧失量,% ≤5.0铁(Fe),% ≤0.01编辑本段物理性质式量 101.96 amu熔点 2303 K沸点 3250 K真密度 3.97 g/cm3松装密度:0.85g/mL(325目~0)0.9g/mL(120目~325目)晶体结构三方晶系 (hex)导电性常温状态下不导电热化学属性ΔfH0liquid ?1620.57 kJ/molΔfH0solid ?1675.69 kJ/molS0liquid, 1 bar 67.24 J/mol·KS0solid 50.9 J/mol·K编辑本段安全性食入低危险吸入可能造成刺激或肺部伤害皮肤低危险眼睛低危险在没有特别注明的情况下,使用SI单位和标准气温和气压。
氧化铝是铝和氧的化合物,分子式为Al2O3。
在矿业、制陶业和材料科学上又被称为矾土。
编辑本段应急处理隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
避免扬尘,小心扫起,置于袋中转移至安全场所。
若大量泄漏,用塑料布、帆布覆盖。
收集回收或运至废物处理场所处置。
编辑本段中国工业概况我国具有较丰富的铝土矿资源,迄今已探明保守储量23亿吨,位居世界第4,具备发展氧化铝工业的资源条件。


2021-2022学年中考化学模似试卷注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(本题包括12个小题,每小题3分,共36分.每小题只有一个选项符合题意)1.联合国将2019年定为国际化学元素周期表年,发明元素周期表的科学家是A.拉瓦锡B.道尔顿C.门捷列夫D.阿伏加德罗2.为制得太阳能燃料(合成气),科学家用镍基催化剂设计了如下转化过程。
下列有关说法不正确的是A.反应①的化学方程式为CH4+O2=CO2+H2OB.镍基催化剂在反应前后化学性质不变C.太阳能燃料主要成分是CO和H2D.上述反应前后元素种类不变3.实验结束后,图中仪器的处理方式正确的是A.B.C.D.4.某气体由CH4、CO、H2中的一种或几种组成,取该气体样品在氧气中完全燃烧,测得生成的CO2和H2O的质量比为11:9,下列判断正确的是()A.原气体可能是H2和CH4 的混合物B.原气体中一定含有CH4C.原气体中若含有CO,则一定含有H2D.气体中若同时含有CH4、CO 和H2,则CO与H2的质量之比为14:15.从下图所示的两种微粒结构示意图中,所获取信息不正确的是()A.它们属于同种元素B.它们的核外电子层数相同C.它们的核外电子数相同D.①表示阴离子,②表示原子6.右图是某固体物质A的溶解度曲线,下列说法的是()7.下表是某同学错题本中整理的部分内容,其中不需要修改的是A.A B.B C.C D.D8.某金属加工厂生产过程中产生的废液,含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤。
向滤液中加入稀盐酸,无沉淀产生;向滤渣中加入稀盐酸无气体放出。

氧化铝知识点一、知识概述《氧化铝》①基本定义:氧化铝啊,简单说就是铝和氧结合在一起形成的一种东西。
它的化学式是Al₂O₃。
就好比两个铝原子和三个氧原子手拉手成为了一个小团体。
②重要程度:在化学学科里那可是特别重要的。
氧化铝是铝生产过程中的关键中间产物,也是很多铝制品抗腐蚀的保护神。
而且在陶瓷、耐火材料这些工业领域里也是个大主角呢。
③前置知识:你得先知道原子啊,还有化合物是怎么回事,基本的化学元素符号得认识,像铝用Al表示,氧是O。
也得有点化学方程式的基础。
④应用价值:实际生活里用处贼多。
比如说,在厨房里的铝锅,表面那层氧化铝能防止铝锅被食物或者水进一步腐蚀。
在工业上,耐火砖里也会用到氧化铝,因为它耐高温。
二、知识体系①知识图谱:在化学学科里,氧化铝处在金属氧化物这个分支。
从铝元素的反应到各种铝制品,处处都有它的身影。
②关联知识:和铝的冶炼呀,金属的氧化还原反应紧密相连,还有酸碱反应也和它有关,因为氧化铝既能和酸反应又能和碱反应。
③重难点分析:掌握难度我觉得也就中等。
关键点在于理解它的两性性质,就是既能和酸又能和碱反应这一点。
④考点分析:在考试中算是中等重要的知识点。
考查方式就多种多样了,可能让你写氧化铝和酸反应的化学方程式,或者直接问氧化铝具有什么性质之类的。
三、详细讲解【理论概念类】①概念辨析:氧化铝就是由铝元素和氧元素按照2:3的比例组成的化合物。
你看,铝这种金属挺活泼的,在空气中很容易和氧气“交朋友”,这个过程中就产生了氧化铝。
②特征分析:它有一个很厉害的特性,就是两性。
啥叫两性呢?就是能像个“两面派”似的。
一方面它能像别的金属氧化物一样跟酸反应,比如和盐酸反应生成氯化铝和水。
另一方面又能和碱反应,像和氢氧化钠反应能生成偏铝酸钠和水。
而且氧化铝是白色固体,硬度还挺高的。
③分类说明:基本上就这么一种氧化铝,不过要是从晶体结构上来说,有不同的晶体类型,像α- 氧化铝和γ- 氧化铝。
α- 氧化铝硬度特别大,常出现在宝石、刚玉里。
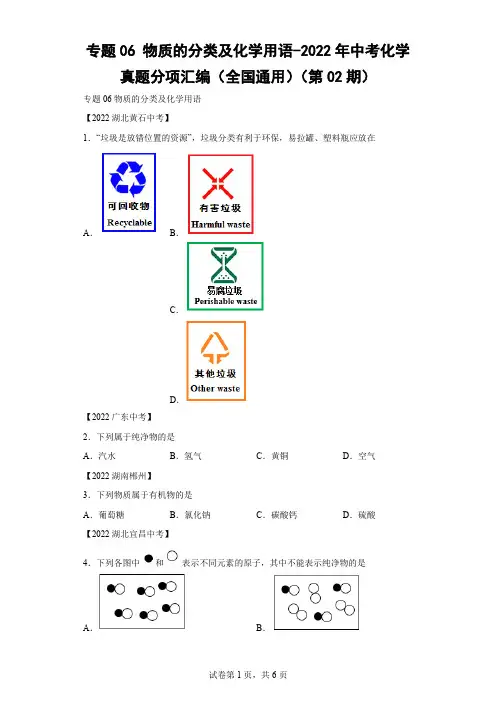
专题06 物质的分类及化学用语-2022年中考化学真题分项汇编(全国通用)(第02期)专题06物质的分类及化学用语【2022湖北黄石中考】1.“垃圾是放错位置的资源”,垃圾分类有利于环保,易拉罐、塑料瓶应放在A.B.C.D.【2022广东中考】2.下列属于纯净物的是A.汽水B.氢气C.黄铜D.空气【2022湖南郴州】3.下列物质属于有机物的是A.葡萄糖B.氯化钠C.碳酸钙D.硫酸【2022湖北宜昌中考】4.下列各图中和表示不同元素的原子,其中不能表示纯净物的是A.B.C.D.【2022福建中考】5.我国神舟载人飞船供氧系统中含有下列物质,其中属于氧化物的是A.O2B.CO2C.NaOH D.Na2CO3【2022湖北宜昌中考】6.我国化学家侯德榜学成归国,发明了制碱新法“侯氏制碱法”,所制纯碱属于A.氧化物B.酸C.碱D.盐【2022湖南邵阳中考】7.“”和“”分别表示不同元素的原子,其中表示单质的是A.B.C.D.【2022陕西中考A】8.化学物质使世界异彩纷呈。
下列物质属于化合物的是A.红色的葡萄酒B.紫色的高锰酸钾C.淡蓝色的液氧D.银白色的不锈钢【2022天津中考】9.分类是认识物质的常用方法,下列分类正确的是A.化合物:汽水B.单质:氢气C.混合物:氯酸钾D.有机物:一氧化碳【2022广东中考】10.科学家对人类文明和社会可持续发展作出了重要贡献。
下列选项正确的是A.拉瓦锡编制了元素周期表B.门捷列夫提出了近代原子学说C.道尔顿确定了空气的组成D.屠呦呦因研究青蒿素获诺贝尔奖【2022湖北潜江等中考】11.分类法在日常生活和科学研究中具有广泛的应用。
下列物质中属于盐类的是A.生石灰B.高锰酸钾C.干冰D.烧碱【2022四川乐山中考】12.分类是学习化学的重要方法,下列物质的分类正确的是A.H2、O2属于单质B.CH4、CaCO3属于有机物C.CuO、KClO3属于氧化物D.Na2SO4、KOH属于碱【2022山西中考】13.随着我国“资源节约型”与“环境友好型”社会的建设,垃圾综合化分类及资源再生利用进入了新的阶段。
中小学教学参考资料教学设计教育论文随堂检测2020年黔南州中考化学试题一、选择题。
(本题6小题,每题2分,共12分)1.下列历史典故中发生了化学变化的是()A. 火烧赤壁B. 司马光砸缸C. 刻舟求剑D. 铁杵磨成针【答案】A【解析】【详解】A、火烧赤壁包含着物质的燃烧,有新物质生成,属于化学变化;B、司马光砸缸只是形状的改变,没有生成其他物质,属于物理变化;C、刻舟求剑只是将物质的形状发生了改变,没有新物质生成,属于物理变化;D、铁杵磨成针只是将其磨细,没有新物质生成,属于物理变化。
故选:A。
2.下列图示实验操作正确的是()A. 加入铁钉B. 过滤C. 称取NaCID. 测溶液pH【答案】C【解析】【详解】A、向试管中装铁钉时,先将试管横放,用镊子把铁钉放在试管口,再慢慢将试管竖立起来,图中所示操作错误。
B、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,图中所示操作错误。
C、托盘天平的使用要遵循“左物右码”的原则,图中所示操作正确。
D、用pH试纸测定溶液的pH时,正确的操作方法为取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,把试纸显示的颜色与标准比色卡对比来确定pH.不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误。
故选:C3.分类是学习和研究化学的一种常见方法,下列分类正确的是()A. 混合物:空气、溶液B. 有机物:CO2, CO (NH2)2C. 复合肥料:硝酸钾、硫酸铉D. 合成材料:合金、合成橡胶【答案】A【解析】【详解】A、空气和溶液都是由多种物质组成的,均属于混合物,分类正确;B、二氧化碳中虽然含有碳元素,但是其组成和性质与无机物类似,习惯上还是将其看做无机物,分类错误;C、硫酸铵中只含氮、磷、钾中的氮元素,属于氮肥,分类错误;D、合金属于金属材料,分类错误。
故选:A。
4.“84消毒液”在抗击新冠病毒时可做环境的消毒剂,其有效成分为次氯酸钠(NaClO),下列对次氯酸钠的分析正确的是()A. 是一种氧化物B. 氧元素的化合价为-1C. 由3个原子构成D. 相对分子质量为74.5【答案】D【解析】【详解】A、NaClO是由三种元素组成的,不属于氧化物,选项说法错误;B、在次氯酸钠中,氧元素显-2价,选项说法错误;C、次氯酸钠是由钠离子与次氯酸根离子构成的,选项说法错误;D、NaClO的相对分子质量为23+35.5+16=74.5,选项说法正确。
氧化铝介绍分析解析氧化铝是一种常见的无机化合物,化学式为Al2O3,又称为三氧化二铝。
它是一种颜色无定形固体,具有高熔点、高硬度、高热稳定性和良好的电绝缘性等特点,广泛应用于多个领域。
氧化铝的制备方法多样,常见的包括热解氢氧化铝、碱熔法和氧化铝水解法等。
其中,热解氢氧化铝是最常用的制备方法之一、其过程可简述为:将氢氧化铝加热至一定温度,使其分解产生氧化铝和水蒸气,然后将水蒸气冷却收集。
碱熔法是将铝盐与碱性物质一起熔融,然后冷却析出氧化铝。
氧化铝水解法则是将氯化铝与水反应生成氢氧化铝,再将氢氧化铝热解得到氧化铝。
氧化铝具有多种应用领域。
首先,由于其高硬度和热稳定性,氧化铝常被用作磨料和研磨材料。
氧化铝磨料用于金属加工、陶瓷加工和抛光等工艺中,可以有效去除杂质和改善表面光洁度。
此外,氧化铝还被广泛应用于炼钢和铸造行业,用作渣球、陶瓷滤料和护套材料等。
其次,氧化铝在陶瓷行业中具有重要地位。
由于其优异的耐热性和电绝缘性,氧化铝常被用于制作陶瓷材料,如陶瓷瓷砖、陶瓷器皿和电子元件等。
此外,氧化铝还被用作陶瓷纤维的增强材料,提高其强度和耐磨性。
此外,氧化铝还被应用于化工领域。
由于其化学稳定性和抗腐蚀性,氧化铝常被用作催化剂和催化载体。
例如,氧化铝被广泛应用于催化裂化和氢化反应中,加速反应速率和提高产率。
另外,氧化铝还可用作催化剂载体,将金属催化剂负载在其表面,提高催化剂的稳定性和活性。
此外,氧化铝还具有电学和光学应用潜力。
由于其良好的电绝缘性和热稳定性,氧化铝可用于制作高压电容器、集成电路基板等电子器件。
同时,氧化铝还具有良好的光学性质,可用于制作红外窗口、光学玻璃等光学元件。
总之,氧化铝是一种常见的无机化合物,具有多种应用领域。
其高硬度、高热稳定性、良好的电绝缘性和化学稳定性使其成为重要的材料之一、随着科学技术的不断发展,氧化铝的应用前景将会更加广阔。
2024届福州第三中学化学高一上期中统考试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号、考场号和座位号填写在试题卷和答题卡上。
用2B铅笔将试卷类型(B)填涂在答题卡相应位置上。
将条形码粘贴在答题卡右上角"条形码粘贴处"。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案。
答案不能答在试题卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。
不按以上要求作答无效。
4.考生必须保证答题卡的整洁。
考试结束后,请将本试卷和答题卡一并交回。
一、选择题(每题只有一个选项符合题意)1、取一块用砂纸打磨过的铝箔在空气中加热至熔化,下列说法不正确的是A.铝表面失去光泽B.剧烈燃烧,火星四射,生成黑色固体C.熔化的铝不滴落D.在加热熔化过程中生成了氧化铝2、下列叙述正确的是A.分散系有的是纯净物,有的是混合物B.“冰水混合物”不是一种分散系C.直径介于1~100 nm之间的微粒称为胶体D.胶体很不稳定,极易发生聚沉3、把0.05molBa(OH)2固体加入到下列100mL液体中,溶液的导电能力明显变小的是A.水B.1mol/LMgCl2溶液C.1mol/L醋酸D.0.05mol/LCuSO44、下列离子方程式中,正确的是A.向NaHSO4溶液中滴加Ba(OH)2溶液至SO42−离子恰好沉淀完全:Ba2++2OH-+2H++SO42−=BaSO4↓+2H2OB.NaHSO4溶液滴入氢氧化钠溶液:H++OH-=H2OC.向澄清石灰水中滴入足量碳酸氢钠溶液:Ca2++ OH-+ HCO3-=CaCO3↓+H2OD.Ba (OH)2溶液中通入过量CO2:CO2+ Ba2++2OH-=BaCO3↓+ H2O5、垃圾分类有利于资源回收利用。
MSDS氧化铝氧化铝第一章、产品信息产品名称:氧化铝化学名称:氧化铝产品分类:粉末应用设备:制造商:制造信息:第二章、化合物/成分信息成分:?行业标准:第三章、危险性危险特性:未有特殊的燃烧爆炸特性。
对身体健康的影响:对机体一般不易引起毒害,对粘膜和上呼吸道有刺激作用。
经呼吸道吸入其粉尘可引起肺部轻度纤维化,肺部和肺淋巴结有大量的铝沉积。
第四章、紧急救护食入:饮足量温水,催吐。
就医。
皮肤接触:脱去污染的衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医。
吸入:脱离现场至空气新鲜处。
第五章、事故泄漏措施泄漏的措施:隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
避免扬尘,小心扫起,置于袋中转移至安全场所。
若大量泄漏,用塑料布、帆布覆盖。
收集回收或运至废物处理场所处置。
第六章、操作和储藏操作注意事项:密闭操作,局部排风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。
避免产生粉尘。
避免与氧化剂接触。
搬运时轻装轻卸,防止包装破损。
配备泄漏应急处理设备。
倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、干燥、通风良好的库房。
远离火种、热源。
保持容器密封。
应与氧化剂分开存放,切忌混储。
储区应备有合适的材料收容泄漏物。
第七章、个人防护及暴露部分控制MAC(mg/m3):6MAC(mg/m3):2~6TLVTN:ACGIH10mg/m3(按铝计)TLVWN:未制定标准监测方法:工程控制:密闭操作,局部排风。
呼吸系统防护:空气中粉尘浓度超标时,必须佩戴自吸过滤式防尘口罩。
紧急事态抢救或撤离时,应该佩戴空气呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿防毒物渗透工作服。
手防护:戴橡胶手套。
其他防护:注意个人清洁卫生。
第八章、物理和化学性质主要成分:Al2O3纯品外观与性状:白色粉末。
氧化铝碱土金属氧化铝概述氧化铝,又称铝石、刚玉或白玉,是一种重要的无机化合物。
它的分子式为Al2O3,是由铝和氧原子组成的化合物。
氧化铝具有高硬度、高熔点、耐腐蚀性强等特点,在工业生产中有着广泛的应用。
制备方法1. 气相沉积法:将铝原料加热至高温,使其蒸发成气态,然后通过控制温度和压力等条件使其在反应器中沉积成为固态氧化铝。
2. 水解法:将含铝物质溶解于水中,加入酸性或碱性催化剂,在一定条件下进行水解反应,生成氢氧化铝沉淀。
再将沉淀经过过滤、洗涤、干燥等步骤得到纯净的氧化铝。
3. 热解法:将含有铝元素的有机物质或无机盐在高温下分解,生成纯净的氧化铝。
应用领域1. 电子行业:用于制造电容器、绕线器、半导体器件等。
2. 陶瓷行业:用于制造高档陶瓷、陶瓷电子元件等。
3. 精细化工:用于制造催化剂、吸附剂、填料等。
4. 建筑行业:用于制造高强度玻璃、防火材料等。
碱土金属概述碱土金属是指周期表中第二族元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素的共同特点是在自然界中存在于化合物形式,具有较低的电负性和较高的金属性质。
碱土金属是人类生产生活中不可或缺的重要材料。
物理性质1. 铍:银白色金属,比铝更轻,有良好的导电性和导热性。
2. 镁:银白色金属,比铝更轻,具有良好的机械性能和耐腐蚀性。
3. 钙:银白色金属,在室温下易与空气中的氧气反应产生氧化钙。
4. 锶:银白色金属,在室温下与空气反应产生氧化锶,具有良好的光学性能。
5. 钡:银白色金属,在室温下与空气反应产生氧化钡,具有良好的放射性吸收性能。
6. 镭:放射性金属,具有较高的放射性活度和毒性。
应用领域1. 镁:用于制造航空、航天、汽车等轻量化材料。
2. 钙:用于制造建筑材料、农业肥料等。
3. 锶:用于制造荧光体、烟火剂等。
4. 钡:用于制造电子管、电视机显像管等。
5. 镭:用于医学放射治疗和科学研究。