第五章重排反应作业题
- 格式:doc
- 大小:1.28 MB
- 文档页数:10
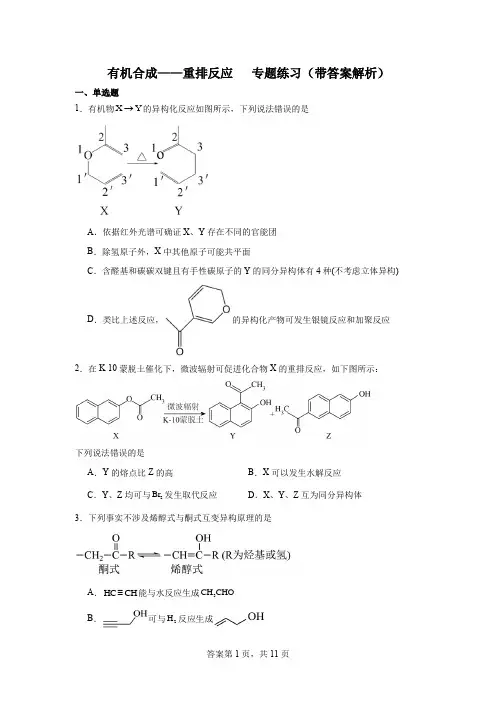
有机合成——重排反应 专题练习(带答案解析)一、单选题1.有机物X Y →的异构化反应如图所示,下列说法错误的是A .依据红外光谱可确证X 、Y 存在不同的官能团B .除氢原子外,X 中其他原子可能共平面C .含醛基和碳碳双键且有手性碳原子的Y 的同分异构体有4种(不考虑立体异构)D .类比上述反应,的异构化产物可发生银镜反应和加聚反应 2.在K -10蒙脱土催化下,微波辐射可促进化合物X 的重排反应,如下图所示:下列说法错误的是A .Y 的熔点比Z 的高B .X 可以发生水解反应C .Y 、Z 均可与2Br 发生取代反应D .X 、Y 、Z 互为同分异构体3.下列事实不涉及烯醇式与酮式互变异构原理的是A .HC CH ≡能与水反应生成3CH CHOB .可与2H 反应生成C.水解生成D.中存在具有分子内氢键的异构体二、解答题4.光伏组件封装胶膜是太阳能电池的重要材料,经由如图反应路线可分别制备封装胶膜基础树脂Ⅰ和Ⅰ(部分试剂及反应条件略)。
反应路线Ⅰ:反应路线Ⅰ:已知以下信息:Ⅰ互变异构-OH稀(R、R1、−−−→R2为H或烃基)Ⅰ+2ROH H+−−→+H2O(1)A+B→D的反应类型为。
(2)基础树脂Ⅰ中官能团的名称为 。
(3)F 的结构简式为 。
(4)从反应路线Ⅰ中选择某种化合物作为原料H ,且H 与H 2O 反应只生成一种产物Ⅰ,则H 的化学名称为 。
(5)K 与银氨溶液反应的化学方程式为 ;K 可发生消去反应,其有机产物R 的分子式为C 4H 6O ,R 及R 的同分异构体同时满足含有碳碳双键和碳氧双键的有 个(不考虑立体异构),其中核磁共振氢谱只有一组峰的结构简式为 。
(6)L 与G 反应制备非体型结构的Q 的化学方程式为 。
(7)为满足性能要求,实际生产中可控制反应条件使F 的支链不完全水解,生成的产物再与少量L 发生反应,得到含三种链节的基础树脂Ⅰ,其结构简式可表示为 。
5.一种利胆药物F 的合成路线如图:已知:Ⅰ.∆−−→+Ⅰ.2R NH Δ"→-回答下列问题: (1)A 的结构简式为 ;符合下列条件的A 的同分异构体有 种。
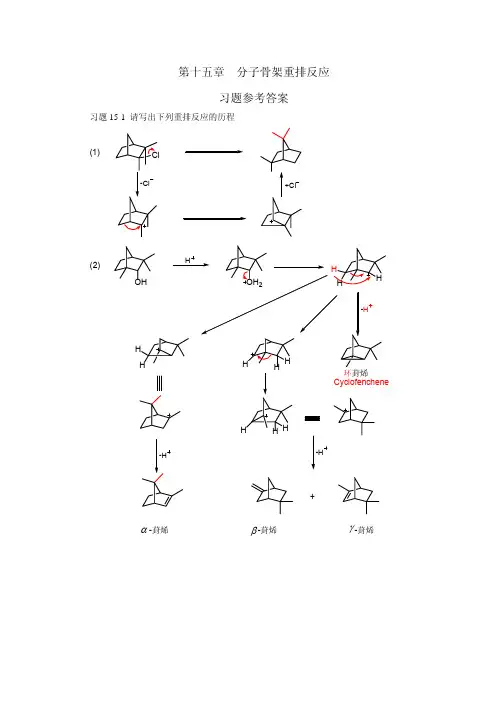
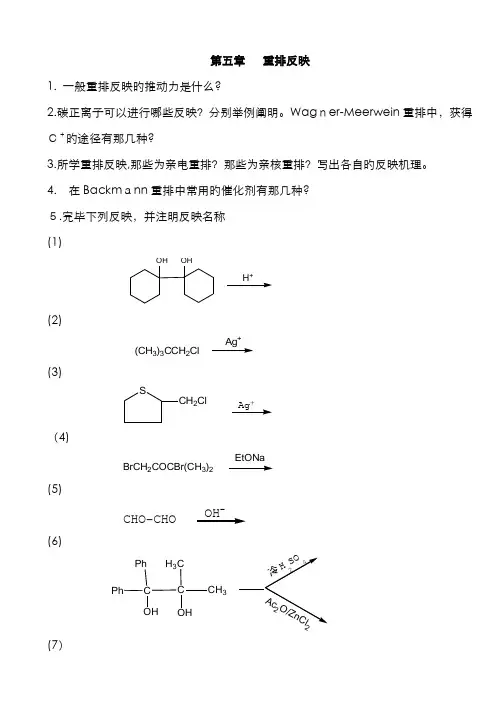
第五章 重排反映1. 一般重排反映旳推动力是什么?2.碳正离子可以进行哪些反映?分别举例阐明。
Wag ner-Meerwein 重排中,获得C+旳途径有那几种?3.所学重排反映,那些为亲电重排?那些为亲核重排?写出各自旳反映机理。
4. 在Backm ann 重排中常用旳催化剂有那几种? 5.完毕下列反映,并注明反映名称 (1)OHOHH +(2)(CH 3)3CCH 2Cl Ag +(3)SCH 2ClAg +(4)BrCH 2COCBr(CH 3)2EtONa(5)CHO-CHO -(6)C C H 3C CH 3PhPhOHOH(7)OCH3+(8)NClPhH 2COCCH 3OH -(9)OO-(10)H 2C H 2CC CNH 2OO Br 25H 2O(11)C C NCH 3CH 3PhPh OH3OH(12)NCH 3PhNaNH 2/C 6H 6(13)CO NO2CF3CO3H(14)OCH2CH=CHCH3KOH H2O (15)(16)COCl(17)CH2NH2HOCH3+ (18)CNNH2OH+ (19)C COHCH3OHCH3H+6、以所给原料为主,合成下列产物。
(1)O CHOO OCCO 2H OH(2)OO胍乙啶中间体庚内酰胺7、完毕下列反映,并写出反映旳历程(1)OH 3CCH 3HCO 2CH 3(2)OH 3CCH=CH 2CH 3140~200℃答案:1、一般重排反映旳推动力是什么?答:基于基团旳迁移可以形成更加稳定旳中间体,减少反映中中间体旳化学能。
2、碳正离子可以进行哪些反映?分别举例阐明。
Wagner-Meerwein重排中,获得C+旳途径有那几种?答:1、烯烃炔烃与HX\H2O\H2SO4\HXO旳加成2、卤代烃旳亲核取代反映:单分子和双分子3、卤代烃旳消除反映4、醇-OH旳取代和消除5、醚键旳断裂反映6、芳香烃旳傅克反映,攻打试剂为C+7、醛酮旳亲核加成,羰基C旳正电性越大,反映活性越大8、羧酸衍生物旳水解等反映,亲电试剂重要攻打显正电旳酰基C途径有:1、四取代邻二叔醇在苯磺酸条件下。


5章 思 考 题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N 2和S N 1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响? 5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度? 5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解 答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH 3CH=CHX (2)烯丙基卤代烃,如CH 2=CH-CH 2X (3)孤立式卤代烃,如CH 2=CHCH 2CH 2X 5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp 2杂化的碳原子上。
卤原子中具有弧电子对的p 轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习 题5.1 5.1 命名下列化合物。
CH 2ClC H 2C H 2C H 2Br C F 2CF 2C lCl(1)(3)(2) (4)CH 2CCHCH CHCH 2ICl CH 3CH 3CHBrCHCHCH3CH 2CH 33BrCH 3BrCl(5) (7)(8)(6)5.2 5.2 写出下列化合物的构造式。
(1)烯丙基溴 (2)苄氯 (3)4-甲基-5-溴-2-戊炔 (4)偏二氟乙浠 (5)二氟二氯甲烷 (6)碘仿 (7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷 (9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯 (10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷 (12) (2S,3S)-2-氯-3-溴丁烷 5.3 完成下列反应式。

第五章进入合成有机高分子化合物的时代(推断题带答案)第一节合成高分子化合物的基本方法一、加成聚合反应1、加聚反应:。
2、学生阅读课本100页内容,填写下表:高聚物中的结构高聚物中的结构名称加聚反应CH2=CH2—CH2—CH2—n高分子化合物,简称高分子,又叫聚合物或高聚物。
n值一定时,有确定的分子组成和相对分子质量,聚合物的平均相对分子质量=链节的相对分子质量×n。
一块高分子材料是由若干n值不同的高分子材料组成的混合物。
二、缩合聚合反应1、缩聚反应:。
2、缩聚反应的特点:。
3、填写下表:缩聚反应单体单体具备条件链节聚合度端基原子(原子团)小分子计量数3、由聚合物推单体的方法→单体:CH2=CH2边键沿箭头指向汇合,箭头相遇成新键,键尾相遇按虚线部分断键成单键。
→单体:凡链节主链只在C原子并存在有C=C双键结构的高聚物,其规律是“见双键、4个C;无双键、2个C”,划线断开,半键闭合,双键互换。
1、写出下列单体聚合成聚合物的化学方程式(1)CH2=CHCl :。
(2):。
(3) :2、写出生成下列高聚物的化学方程式:(1):。
(2):。
(3):。
(4):。
有机合成题(带答案)1.有一种名为菲那西汀的药物,其基本合成路线如下:则:(1)反应②中生成的无机物化学式为。
(2)反应③中生成的无机物化学式为。
(3)反应⑤的化学方程式是。
(4)菲那西汀水解的化学方程式为。
2.以石油产品乙烯为起始原料进行合成高分子化合物F和G,合成路线如图所示:已知:E的分子式为C4H6O2,F的分子式为(C4H6O2)n(俗名“乳胶”的主要成分),G的分子式为(C2H4O)n(可用于制化学浆糊),2CH2=CH2+2CH3COOH+O2 2C4H6O2(醋酸乙烯酯)+2H2O又知:与结构相似的有机物不稳定,发生分子重排生成请回答下列问题:(1)写出结构简式:E ,F 。
(2)反应①、②的反应类型、。
(3)写出A—→B、B—→C的化学方程式。

5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。

第一章电子效应及酸碱理论1. 比较下列化合物亲电加成反应的活性顺序并加以解释。
解:由于分子中存在给电子超共轭效应,所以超共轭效应越强,给电子效应越强,电子云密度越大,亲电加成反应活性越强。
2. 比较下列芳香烃亲电取代反应的活性顺序并加以解释。
解:给电子的超共轭效应越强,苯环上电子云密度越大,反应活性越强。
同时由于空间效应的影响。
反应活性依次为:2>3>4>13. 比较下列碳正离子的稳定性并加以解释。
解:超共轭效应的影响。
4. 写出下列化合物与氯化氢的加成产物,并解释.解:从两个方面考虑,一是电子效应的存在,二是碳正离子的稳定性。
苯乙烯加成产物满足马氏规则,主要是生成的苄基碳正离子比较稳定的原因。
5. 比较下列化合物碱性强弱,并解释。
解:从电子效应考虑,吸电子诱导效应使酸性增强,共轭效应使碱性减弱。
3>1>4>2第二章立体化学1. 指出下面化合物那些互为对映异构体,那些为非对映异构体,并用R/S法命名下列化合物。
2. 用D/L法命名下列化合物3. 将下列透视式转化为不同的Fischer投影式(最小基团分别在横键或竖键上),并对不同构型用R、S法命名。
第三章有机活性中间体作业1:比较下列碳正离子的稳定性解:(3)>(1)>(2)作业2:写出下面反应的历程解:先质子化再脱水,不发生重排,因为苄基正离子比较稳定。
作业3. 解释说明碳正离子与碳负离子的稳定性顺序真好相反的原因。
解:由电子效应和超共轭效应解释,关键是对电荷的分散!作业4. 写出下面反应历程解题思路:作业5. 比较下列自由基的稳定性顺序解题思路:作业6. 写出下面反应的主要产物并命名解题思路:作业7. 写出下面反应的历程第四章:亲核取代反应1.完成下面反应并写出机理2.写出羟基乙胺(H2NCH2CH2OH)与过量环氧乙烷的反应历程。
3.对下面反应提出合理解释4.比较下列各组化合物的亲核性的强弱RSNa>RONa ; P(CH3)3 > N(CH3)3 ; CH3CH2SH < CH3CH2T eH第五章芳烃的取代反应1.判断下面化合物是否具有芳香性解:(1)利用双键修正法可知共有14个π电子,符合“4n+2”规则,具有芳香性。

第一章卤化反应试题一.填空题。
(每空2分共20分)1.Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其过2渡态可能有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应的反应条件-----------------( NBS/CCl hv,4h)Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应正确的是(B)A.C CH CBr C CH3Br2+= B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl/r,t.48h3CHCBrCH2Br2.下列哪些反应属于SN1亲核取代历程(A)A.(CH3)2CHBr+H2O(CH3)2CHOH+HBrB .CH 2I +CH 2CNNaCN+NaIC. NH 3+CH 3CH 2ICH 3CH 3NH 4+ID. CH 3CH(OH)CHCICH 3+CH 3C H OC H CH 3CH 3ONa3.下列说法正确的是(A ) A 、次卤酸新鲜制备后立即使用.B 、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C 、次卤酸(酯)为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D 、最常用的次卤酸酯: 次氯酸叔丁酯 (CH3)3COCl 是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是(D )A.RCOOH RCOCl + H 3PO 3PCl 3B.RCOOH RCOCl + SO 2 + HCl SOCl 2C.N HCOOHN HCOOC 2H 5C 2H 5OH, H 2SO 4D.5、N-溴代乙酰胺的简称是(C )A 、NSB B 、NBAC 、NBSD 、NCS三.补充下列反应方程式(40分)1BrNO 2BrHNO 3 / H 2SO 4BrBrOEtO t -BuOCl / EtOH-55~0℃OEtOCl OEt .2.CH 3(CH 2)2CH 2CH=CHCH 3NBS / (PhCO)2O 24CH 3(CH 2)2CHCH=CHCH 3Br3.CH 2=CHCH 2C CHBr 2BrCH 2CHBrCH 2C CH4.R -CH=CH -CH 2-CH -OHOX 2OO RX5.PhCCCH 3CCPhBrBrCH 36.PhCHCH 2PhH C OHCH 2BrNBS/H 2O 25o C,35min7.COClClOHCClCl 28.COOAgNO 2BrO 2NBr 2/CCl 4加热3h9.10.O HB rO HO HBrBr1molBr /CS t-BWNH2-70c四.简答题(20分)1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。

第五章绿色化学方法答案1.什么是催化剂?为什么说催化剂在绿色化学中有十分重要的意义?答:催化剂可以加快热力学上可能进行的反应的速率(合成氨中的Fe-K2O Al2O3),可控制反应产物化学物种的选择性(乙烯选择性氧化的不同催化剂:PdCl2-V配合物, Ag/ Al2O3,Ni),控制产物的立体规整结构(丙烯的聚合:氧气或过氧化物,Ziegler-Natta),定向不对称合成旋光异构体(Ru手性膦配合物用于 2—(6—甲氧基-2萘基)丙烯酸+氢生产左旋二羟基苯并氨酸),与温度控制化学物种选择性,与接触时间共同控制产物化学物种选择性(甲烷氧化生产合成气中的Ni / Al2O3 ),具有高度专一性,高选择性,高的反应物转化率和反应的原子经济性的特殊功能的分子机器。
催化科学和技术在绿色化学发展中有重要作用.在污染防治(减少和消除发电厂的废气以及汽车尾气中NOx的排放;减少挥发性有机溶剂的使用等;)活化新的反应原料,催化与反应过程的改善(乙醛的合成、对苯二酚的合成、羰基化合物的合成)等方面都有重要应用。
2.相比于传统的氧化剂,哪些是新型的绿色氧化剂?他们各有什么特点?答:传统的氧化剂有:NaClO, NaBrO, HNO3, KHSO3;CrO3, KMnO4, KCr2O7等,主要的缺点有:产生大量的盐废物,产生大量的废气和废水,产生大量的有毒有害的重金属离子.新型的绿色氧化剂有:(1)O2:氧气是最清洁的氧化剂;受限于它的氧化条件,通常伴随有其它辅助性的氧化/还原剂(2)H2O2:过氧化氢含有47%的活性氧成分,而且其还原产物为水,不会对环境造成污染;但过氧化氢比O2和O3都贵,且在室温条件可以分解.(3)O3:臭氧也是一种对环境有好的氧化剂,它的还原产物O2,但O3通常需要特殊的发生装置(4)N2O:N2O在参与氧化后的产物为N2,不对环境造成危害,但是N2O的合成比较复杂,成本较高(5)晶格氧:可以在没有气相氧分子存在的条件下进行烃类的氧化反应,能大幅度提高烃类选择氧化的选择性,而且因不受爆炸极限的限制,可提高原料浓度,时反应物容易分离回收,是控制深度氧化、节约资源和环境保护的有效催化新技术。
第六章重排反应练习题一、完成从C到C的重排反应(1)CH2BrCH3H3C3AlBr-AlBr4(2)NH2H3CONaNO/HOAc(3)Ph COHPhCOHPhPhTsOH H O-H+(4)H3C COHH3CCOHPhH+-H2O(5)H3C COHH3COHPhAc2O/ZnCl2或含痕量H2SO4的HOAc(6)PhHC CPhOHCH3(7)OHCOHPhH SO/EtO(80.4mol/LSnCl4/CH2Cl2(PhO)2CHOEt(9)H+-H2O OHCH3CH3OH(10)H+-H2O CH3CH3OHOH(11)ClC(R)OHPhC HBr Ph2(12)HOCH 2NH 2HNO 2(13)O O KOH/EtOH 加热(14)OClNaOH(15)CH 33N 2OMeOH(16)MeOON 2-H 2O(17)COOHSOCl 22AgO/H 2O二、完成从碳原子到杂原子的重排反应(1) HO lewis 酸(2) OH H 3CN OH2(3)n-Bu C Et H MeN24(4) ClFCl FC NH 2O aq.NaOH/NaOCl(5)NNNH 22F 3COBr /KOH(6)NH 2O23(7)HC CONH 2X R(8)C H CHCONH 2Hofmann 重排R(9)CONH CH 3OHC 11H 233(10) NN CO 2CH 3Cl O3266(11)ONHCON 3(12)HOOCCH 3CH 3COOH NaN 3/H 2SO 4/CHCl 3r.t,25h(13) PhCH 3OHN 3/H 2SO 4(14)OCOOH+NH 3HSO(15) 2EtHN(16) HCH3O33(17) O2NO33(18)1间氯过氧苯甲酸/CH(19)NR CHOOMeOH H间氯过氧苯甲酸/CH Cl三、完成从杂原子到碳原子的重排反应(1)CHCH2RR1NMeCH22O KOH/C H+DMSO(2) NPhO(3)NCO2Et Me CH2Ph Br(4)H2CNCPhH CH3O H3C(5) R NMe2CH23(6)NMe CH2SiMe3I(7) PhNHSCH3CH3NaNH2/liq.NH3(8)N OMePh O Ph2eq.LDA/THF(9) MeO ON OMe(10)2 OMe(11) H2C CHH2C NCH3CH32]2O(12) SCH3X四、完成σ键迁移重排反应(1) OCH3CH3 R(2) OOO RR2R1OMe(3) OCF3CH3Ph甲苯100℃,2h(4) O(PhP)RuCl(5) HOOCH 2PhOMeO Me LDA/THF/Me SiCl(6)OCH 2CH OCH 3H 3COCH 2Δ(7) H 3CCH 33OBCl (8)N SOO OCH 2CH CH 2(9)SNOCH 2CH CH 2Δ(10)NOO CO 2Et NHArCH 2C 6H 6(11) SCH 2CH 2重排(12)SMe SMeOCH 2Ph3h,20℃(13)SSCH 2CH CH 22170~180℃(14) N MeCH 2CHCH 2AlCl 140℃,8h(15)NMe CH2CHCH2BF(Et O)(16)N CH3OPh(17)NH3CH3COLDA/THF(18) Ph Ph(19) Δ(20) HOCope重排(21) CC2ClCH2CH2(22) OHCH3 OHCH3(23) Ph N PhHCl/C H(24) NHN CH2CH3PhAlCl(25) NHNCH3NZnCl(26)稀H SO(27) H NOONaOCl/NaOH(28)N CONHOHHCONH (29)NHNH(30)CH 22)3NaNH /NH I(31)H 3CCONHPriOO 1.KOH/甲苯,4h(32)O+NH 2OH.HClHCOOH/SiO(33)3(34)COCHN 2C H COOAg/EtOH/Et N(35) OMeO 2NOMe CHN 2OMe OMeOAgNO /THF-H O(36)OCl+CH 3ONaEt O(37) OO R SiCCl R 3N(38)C 66H 5BF (39)R C H C HOHR 1OH [Pd](40)OCOCH 3OMehv/K CO /正己烷(41)OC 6H 6(42)OH RCHR 1(43)OTIPS(MeO)PCHN Ot-BuCOK -78℃(44) CCl(C H )P Cl ClH 2C ClS(45)hv(46) H 3CCH 3CH 3CH 3H SO(47) C OH RuCl H(48)RNEt H(49) OPd(PPh )(50) RHC CBrRO AgBFH2O(51) RH2CHC CCHOCH2Lewis acidCH3(52)RHOOn-BuLi(53) RORO cat Pd(PPh)dppe。
第五章重排反应1、一般重排反应得推动力就是什么?2、碳正离子可以进行哪些反应?分别举例说明。
Wagner-Meerwein重排中,获得C+得途径有那几种?3、所学重排反应,那些为亲电重排?那些为亲核重排?写出各自得反应机理。
4、在Backmann重排中常用得催化剂有那几种?5、完成下列反应,并注明反应名称(1)(2)(3)(4)(5)(6)(7)(8)(9)O-O(10)(11)(12)(13)(14)OCH 2CH=CHCH 3KOHH 2O(15)(16)(17)(18)(19)C C OH 3OHCH 3H +6、以所给原料为主,合成下列产物。
(1)O CHOOOCCO 2H OH(2)OO胍乙啶中间体庚内酰胺7、完成下列反应,并写出反应得历程 (1)(2)OH 3CCH=CH 2CH 3140~200℃答案:1、 一般重排反应得推动力就是什么?答:基于基团得迁移可以形成更加稳定得中间体,降低反应中中间体得化学能。
2、碳正离子可以进行哪些反应?分别举例说明。
Wagner-Meerwein 重排中,获得C +得途径有那几种? 答:1、烯烃炔烃与HX\H 2O\H 2SO 4\HXO 得加成 2、卤代烃得亲核取代反应:单分子与双分子3、卤代烃得消除反应4、醇-OH得取代与消除5、醚键得断裂反应6、芳香烃得傅克反应,进攻试剂为C+7、醛酮得亲核加成,羰基C得正电性越大,反应活性越大8、羧酸衍生物得水解等反应,亲电试剂主要进攻显正电得酰基C途径有:1、四取代邻二叔醇在苯磺酸条件下。
2、三取代邻二叔醇在酸性条件下。
3、羟基位于环酯上得邻二叔醇在酸性条件。
3、所学重排反应,那些为亲电重排?那些为亲核重排?写出各自得反应机理。
答:略。
4、在Backmann重排中常用得催化剂有那几种?答:矿物酸,有机酸,Lewis酸,氯化剂或酰氯。
5、(1)OHOHH +O(CH 3)3CCH 2ClAg+(2)SCH 2ClAg +S(3)BrCH 2COCBr(CH 3)2COOHBr(4)CHO-CHOOH -C H 2COOHHO(5)C C CH 3CH Ph Ph OHC CH 3Ph Ph O3C CH 3CH 3Ph O Ph(6)O CH 3H 2NOHH NCH 3HOHNOCH 3(7)NClPhH 2COCCH 3OH -NPhH 2C HOOCCH 3(8)OOOH -COOHOH(9)H 2C H 2C CCNHOOBr 25H 2ON OBr (10)CC NCH 3CH 3Ph Ph OH3NCH 3Ph266CO NO 2CF 3CO 3HOCH 2CH=CHCH3KOHH 2OCOCl222CH 2NH 2HOCH 3H +N NH 2OHH +(19)C C OH H 3C OH CH 3H +C C H 3C O CH 3C NH 2OH N+N H N(溶剂为亲核试剂时以此产物为主)O3COCHN 2CH 2COOHOHCHCH=CH 2H 3CCOO NO 2(硝基的间位为供电子位)N CH 3PhC C N H CH 3CH 3Ph PhO (11)(12)(13)(14)(15)(16)(17)(18)6、(1)(2)O胍乙啶中间体庚内酰胺O OCCO 2H OHOOO O-OCHONaCN,EtOH,H 2OOOO OH沙瑞特试剂HO CNH +HO CH 2NH 2或O CH 3NO 2HO CH 2NO2H +HO CH 2NH 2HNO HO CH 22-N 2-H +O7、答:(1)32CH 3H 3CCO 2CH 33(2)OH 3CCH=CH 2CH 3140~200℃O3OH 3CCH=CH 2CH 3140~200℃H 223O3。
是非题:1.重排反应可以大概分类为离子型机理(亲核重排,亲电重排), 自由基重排, 周环机理重排(σ-键迁移重排)等三类。
()2.Wagner-Meerwein重排反应中迁移基团的迁移顺序为:富电性的芳环>缺电性的芳环>烷基()3.Pinacol重排中迁移基团的电荷密度越高,越有利于迁移。
()4.Beckmann重排中离去基的离去和迁移基的迁移是同时进行的——协同过程。
()5.Beckmann重排中,一般情况下,与肟羟基处于顺位的集团优先迁移。
()6.Schmidt 反应中,当迁移集团R为手性碳原子时,重排后手性碳原子的构型不变。
()7.Beckmann重排反应中的溶剂既起到反应介质的作用,也起到一定的催化剂作用,催化性与溶剂的质子亲和力呈正相关关系。
()8.Hofmann重排和Curtius重排的中间体一样。
()9.Wolff 重排中,α-重氮酮失去氮气后形成碳烯(carbene),重排生成烯酮。
()10.Wolff 重排可以由羧酸变成多一个碳原子的羧酸。
()11.Pinacol 重排是以亲电重排反应机理进行的。
()12.不对称的连乙二醇化合物的重排产物通常由生成最稳定的碳正离子中间体来决定。
()13.Pinacol 重排反应中H的迁移能力跟芳基的比较接近。
()14.Arndt-Eistert成酸反应必须在无水条件下进行。
()15.有酸敏感取代基的肟类化合物在Beckmann重排反应中可以用非质子酸做催化剂。
()16.脂肪酮肟较稳定不易异构化,且芳基比烷基优先迁移。
()17.醛可以通过先转化成醛肟,然后在Lewis酸作用下生成甲酰胺。
()18.Hofmann重排是以亲核重排反应机理进行的。
()19.β位有氢的季铵盐也可以发生Steven重排。
()20.Stevens重排反应中,苄基的迁移能力大小为p-NO2>p-halogen>p-Me>p-OMe。
()21.Pinacol重排反应一定是以分子内重排形式出现的.()22.Pinacol重排反应一般是通过更稳定的中间态正离子形成产物醛或酮. ( )23.能发生Pinacol重排反应的分子一定是含有相邻的二醇基团(diols).( )24.Beckmann 重排的产物主要取决于基团的迁移能力。
第五章重排反应作业题-标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
第五章 重排反应
1. 一般重排反应的推动力是什么
2.碳正离子可以进行哪些反应分别举例说明。
Wagner-Meerwein 重排中,获得C +的途径有那几种
3.所学重排反应,那些为亲电重排那些为亲核重排写出各自的反应机理。
4. 在Backmann 重排中常用的催化剂有那几种
5.完成下列反应,并注明反应名称 (1)
OH
OH
H +
(2)
(CH 3)3CCH 2Cl Ag +
(3)
S
CH 2Cl
Ag +
(4)
BrCH 2COCBr(CH 3)2EtONa
(5)
CHO-CHO OH -
(6)
C C H 3C CH 3
Ph
Ph
(7)
O
CH 3
H 2NOH
H +
(8)
N
Cl
PhH 2COC
CH 3
OH -
(9)
O
O
-
(10)
H 2C H 2C
C C
NH
2
O
O Br 2
5H 2O
(11)
C C N
CH 3
CH 3
Ph Ph OH
3OH
(12)
N
CH 3Ph
NaNH 2/C 6H 6
(13)
CO
NO 2
CF 3CO 3H
(14)
OCH 2CH=CHCH 3
KOH
H 2O
(15)
(16)
COCl
CH 2N 2
2
(17)
CH 2NH 2
HO
CH 3
+
(18)
N NH 2
OH H +
(19)
C C OH 3OH CH 3
H +
6、以所给原料为主,合成下列产物。
(1)
O CHO
O O
C
CO 2H OH
(2)
O
O
胍乙啶中间体庚内酰胺
7、完成下列反应,并写出反应的历程
(1)
O H 3C CH 3H
CO 2CH 3
(2)
O
H 3C
CH=CH 2
CH 3
140~200℃
答案:
1、一般重排反应的推动力是什么
答:基于基团的迁移可以形成更加稳定的中间体,降低反应中中间体的化学能。
2、碳正离子可以进行哪些反应分别举例说明。
Wagner-Meerwein重排中,获得C+的途径有那几种
答:1、烯烃炔烃与HX\H2O\H2SO4\HXO的加成
2、卤代烃的亲核取代反应:单分子和双分子
3、卤代烃的消除反应
4、醇-OH的取代和消除
5、醚键的断裂反应
6、芳香烃的傅克反应,进攻试剂为C+
7、醛酮的亲核加成,羰基C的正电性越大,反应活性越大
8、羧酸衍生物的水解等反应,亲电试剂主要进攻显正电的酰基C
途径有:1、四取代邻二叔醇在苯磺酸条件下。
2、三取代邻二叔醇在酸性条件下。
3、羟基位于环酯上的邻二叔醇在酸性条件。
3、所学重排反应,那些为亲电重排那些为亲核重排写出各自的反应机理。
答:略。
4、在Backmann重排中常用的催化剂有那几种答:矿物酸,有机酸,Lewis酸,氯化剂或酰氯。
5、
(1)
OHOH
H +
O
(CH 3)3CCH 2Cl
Ag
+
(2)
S
CH 2Cl
Ag +
S
(3)
BrCH 2COCBr(CH 3)2
COOH
Br
(4)
CHO-CHO
OH -
C H 2
COOH
HO
(5)
C C CH 3
CH Ph Ph OH
C CH 3Ph Ph O
3C CH 3
CH 3
Ph O Ph
(6)O CH 3
H 2NOH
H N
CH 3
HO
HN
O
CH 3
(7)
N
Cl
PhH 2COC
CH 3
OH -
N
PhH 2C HOOC
CH 3
(8)
O
O
OH -
COOH
OH
(9)
H 2
C H 2C C
C
NH
O
O
Br 2
5H 2O
N O
Br (10)
C
C N
CH 3
CH 3
Ph Ph OH
3N
CH 3Ph
266
CO NO 2
CF 3CO 3H
OCH 2CH=CHCH
3
KOH
H 2
O
COCl
22
2CH 2NH 2
HO
CH 3
H +
N NH 2
OH
H +
(19)
C C OH H 3C OH CH 3
H +
C C H 3C O CH 3
C NH 2
O
H N
+
N H N
(溶剂为亲核试剂时以此产物为主)
O
3
COCHN 2
CH 2COOH
OH
CHCH=CH 2
H 3C
COO NO 2
(硝基的间位为供电子位)
N CH 3Ph
C C N H CH 3
CH 3Ph Ph
O (11)
(12)
(13)
(14)
(15)
(16)
(17)
(18)
6、
(1
)
(2
)
O
胍乙啶中间体庚内酰胺
O O
C
CO 2H OH
O
O
O O
-
O
CHO
NaCN,EtOH,H 2O
O
O
O OH
沙瑞特试剂
HO CN
H +
HO CH 2NH 2
或
O CH 3NO 2
HO CH 2NO
2
H +
HO CH 2NH 2
HNO HO CH 2
2
-N 2
-H +
O
7、答:(1)
3
2CH 3
H 3C
2CH 3
3
[3,3]σ迁移
(2)
O
H 3C
CH=CH 2
CH 3
140~200
℃
O
3
O
H 3C
CH=CH 2
CH 3
140~200℃
H 22
3
O
3。