卡培他滨USP31
- 格式:doc
- 大小:86.50 KB
- 文档页数:4
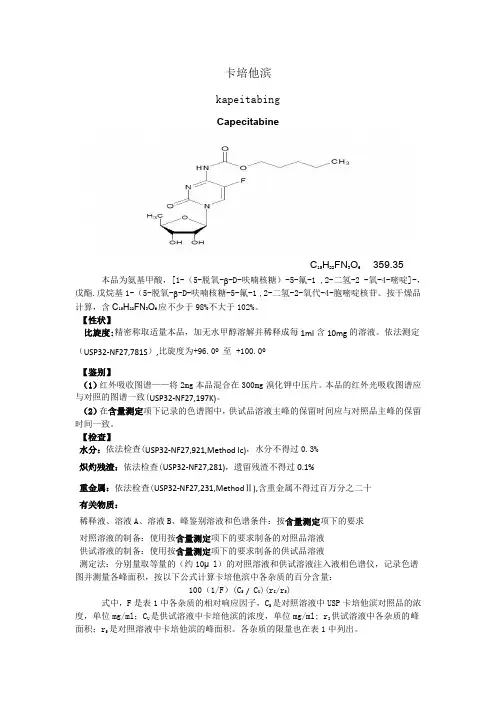
卡培他滨kapeitabingCapecitabineC15H22FN3O6 359.35本品为氨基甲酸,[1-(5-脱氧-β-D-呋喃核糖)-5-氟-1 ,2-二氢-2 -氧-4-嘧啶]-,戊酯.戊烷基1-(5-脱氧-β-D-呋喃核糖-5-氟-1 ,2-二氢-2-氧代-4-胞嘧啶核苷。
按干燥品计算,含C15H22FN3O6应不少于98%不大于102%。
【性状】比旋度:精密称取适量本品,加无水甲醇溶解并稀释成每1ml含10mg的溶液。
依法测定(USP32-NF27,781S),比旋度为+96.0⁰至 +100.0⁰【鉴别】(1)红外吸收图谱——将2mg本品混合在300mg溴化钾中压片。
本品的红外光吸收图谱应与对照的图谱一致(USP32-NF27,197K)。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品主峰的保留时间一致。
【检查】水分:依法检查(USP32-NF27,921,Method Ic),水分不得过0.3%炽灼残渣:依法检查(USP32-NF27,281),遗留残渣不得过0.1%重金属:依法检查(USP32-NF27,231,MethodⅡ),含重金属不得过百万分之二十有关物质:稀释液、溶液A、溶液B、峰鉴别溶液和色谱条件:按含量测定项下的要求对照溶液的制备:使用按含量测定项下的要求制备的对照品溶液供试溶液的制备:使用按含量测定项下的要求制备的供试品溶液测定法:分别量取等量的(约10μl)的对照溶液和供试溶液注入液相色谱仪,记录色谱图并测量各峰面积,按以下公式计算卡培他滨中各杂质的百分含量:100(1/F)(C S / C U)(r I/r S)式中,F是表1中各杂质的相对响应因子,C S是对照溶液中USP卡培他滨对照品的浓度,单位mg/ml;C U是供试溶液中卡培他滨的浓度,单位mg/ml; r I供试溶液中各杂质的峰面积;r S是对照溶液中卡培他滨的峰面积。
各杂质的限量也在表1中列出。



卡培他滨(希罗达在进展期结直肠癌中的治疗进卡培他滨(希罗达在进展期结直肠癌中的治疗进卡培他滨(希罗达)在进展期结直肠癌中的治疗进展卡培他滨(希罗达在进展期结直肠癌中的治疗进Xeloda 单药: 结直肠癌一线治疗药物世界范围内获准为进展期结直肠癌一线治疗药物美国NCCN指南推荐为单药一线治疗美国NCCN指南推荐为单药一线治疗NCCN 英国NICE将其列入结直肠癌的临床指南中,并评价:希罗达英国NICE将其列入结直肠癌的临床指南中,并评价:NICE将其列入结直肠癌的临床指南中至少与现有治疗同样有效,但使用更方便, 至少与现有治疗同样有效,但使用更方便,费用更低NCCN: 美国国家综合癌症网(National Comprehensive Cancer Network) NICE: 英国国家临床推荐治疗方案研究所(National Institute of Clinical Excellence)卡培他滨(希罗达在进展期结直肠癌中的治疗进单药一线治疗进展期结直肠癌: Xeloda vs Mayo方案方案二项欧/ III期国际开放RT: 二项欧/美III期国际开放RT: n=1207期国际开放方案:方案:Xeloda: *****×14/21d vsMayo: 5lC5/28d LV 20→bolus 5-FU 425, d l 5/28d疗效:疗效:Xeloda (n=603) PR + CR (%) IRC 26(22-30) 26(2222 21 26 33 38 22 4.6 12.9 5FU/LV (n=604) 17(14-20) 17(1413 9 17 10 24 15 4.7 12.8 P值值0.0002 0.0001 0.05曾AC 转移肝肺单个多个MTTP(mo) MOS(mo)安全性好:5FU常见↓; FNPSepsis S/E住院少;S/E减量少安全性好:常见S/E↓; FNPSepsis↓; 住院少;减量少常见住院少19:2282Paulo M. Et al. J Clin Oncol 19:2282-2292.2001 by ASCO卡培他滨(希罗达在进展期结直肠癌中的治疗进Xeloda 比较静脉滴注比较静脉滴注5-FUn de Gramont EORTC AIO1RR + ≈ + +TTP + + ? ≈OS ≈ ≈ + 3 weeks ≈448 49732CI 5 -FU meta -analysis Xeloda41 210 1 207Gramont A et al. J Clin Oncol 1997;15:808C15 CH et al. J Clin Oncol 2003;21:3721C28 3Meta-Analysis Group Cancer. J Clin Oncol 1998;16:301C8 4Twelves C. Eur J Cancer 2002;38(Suppl.2):S15CS202Khne1de卡培他滨(希罗达在进展期结直肠癌中的治疗进Xeloda 单药作为辅助化疗的依据单药: 在MCRC令人信服的临床依据MCRC令人信服的临床依据(Xeloda:Mayo=25.7%:16.7% n=1207) Xeloda能替代5-FU用在辅助化疗方案Xeloda能替代5 FU用在辅助化疗方案能替代优势: 优势: C口服方便口服方便C安全性好,病人依从性增加安全性好, 安全性好C门诊治疗节约费用门诊治疗节约费用卡培他滨(希罗达在进展期结直肠癌中的治疗进对比注射 5 FU/LV辅助治疗结肠癌希罗达对比注射5-FU/LV辅助治疗结肠癌III期多中心临床研究的III期多中心临床研究(X研究) (X-ACT 研究)Twelves C et al. Proc Am Soc Clin Oncol 2003;22:294 (Abst 1182)卡培他滨(希罗达在进展期结直肠癌中的治疗进对比注射5-FU/LV辅助治疗结肠希罗达对比注射辅助治疗结肠癌的III期多中心临床研究癌的期多中心临床研究方案设计:方案设计:162个临床中心的1987例患者入组162个临床中心的1987例患者入组个临床中心的1987 所有的患者均为Dukes’ C 结肠癌患者所有的患者均为Dukes Dukes 治疗: 治疗:C Xeloda: 2500mg/m2.d×14d 休7d 每三周为1疗程.d× 每三周为1 C Mayo: 5lC5, LV20mg/ m2 + 5-FU 425mg/m2,d l 5, 疗程;治疗共24 24周每4 周1 疗程;治疗共24周入组时间:11/98~11/01 入组时间:11/98~ :11/98卡培他滨(希罗达在进展期结直肠癌中的治疗进对比注射5-FU/LV辅助治疗结肠希罗达对比注射辅助治疗结肠癌的III期多中心临床研究癌的期多中心临床研究主要目的C 无疾病生存期≥5-FU/LV次要目的C 总生存率C 安全性C 生活质量C 卫生经济学和在指定实验室测定的生化指标卡培他滨(希罗达在进展期结直肠癌中的治疗进患者基础资料希罗达(n=963) 男/女(%) 女年龄: 平均范围年龄ECOG 评分(% 0/1): 评分淋巴结状态(% N1/N2) 淋巴结状态54/46 60.4 (25C46) 86/14 69/305-FU/LV (n=964) 54/46 60.0 (22C82) 86/14 71/29Twelves C et al. Proc Am Soc Clin Oncol 2003;22:294 (Abst1182)卡培他滨(希罗达在进展期结直肠癌中的治疗进Xeloda辅助化疗比Mayo组具有更好的安全性辅助化疗: 辅助化疗组具有更好的安全性病人(%) 100 80 60 * 40 * 20 * 0腹泻*p0.001 Laboratory value治疗相关不良反应(所有级别治疗相关不良反应所有级别) 所有级别Xeloda (n=993) 5-FU/LV (n=974)***中性白细胞↓ 中性白细胞↓ 恶心/ 恶心呕吐脱发口腔炎HFSNowacki M et al. Eur J Cancer 2003;1(Suppl. 5):S326 (Abst 1089)卡培他滨(希罗达在进展期结直肠癌中的治疗进Xeloda辅助化疗比Mayo组具有更好的安全性辅助化疗: 辅助化疗组具有更好的安全性Patients (%) 80 70 60 50 40 30 20 10 0腹泻*p0.001 Laboratory(3/4级不良反应级不良反应) 级不良反应Xeloda (n=993) 5-FU/LV (n=974)*口炎*HFS**恶心/ 呕吐白细胞减少性发热/败血症发热败血症中性白细胞减少症valueNowacki M et al. Eur J Cancer 2003;1(Suppl. 5):S326 (Abst 1089)卡培他滨(希罗达在进展期结直肠癌中的治疗进安全性结果: 安全性结果明显减少C 腹泻, 恶心/呕吐,口炎,脱发等毒副作用腹泻, 恶心/呕吐,口炎, C 3/4 级中性白细胞减少症和粒细胞减少性发热和败血症早期严重不良反应发生率低提高老年性患者治疗安全性,延长治疗持续时间提高老年性患者治疗安全性, 常见不良反应为手足综合症,但多为I-II级,而且常见不良反应为手足综合症,但多为I II级1 通过停药或剂量调整即可处理有效率将于2004年发表有效率将于2004年发表*****CassidyJ et al. Ann Oncol 2002;13:566C75卡培他滨(希罗达在进展期结直肠癌中的治疗进结论初步的安全性评估结果显示Xeloda辅助化疗初步的安全性评估结果显示Xeloda辅助化疗Xeloda 结直肠癌较Mayo方案具有更好的安全性, 结直肠癌较Mayo方案具有更好的安全性,病人Mayo方案具有更好的安全性更易耐受初步的临床疗效的资料预计在2004年公布,如初步的临床疗效的资料预计在2004年公布, 2004年公布果临床疗效结果支持口服Xeloda药物, 果临床疗效结果支持口服Xeloda药物,加上其Xeloda药物副作用较少,服用方便,希罗达将成为结直肠副作用较少,服用方便, 癌辅助化疗的很好选择. 癌辅助化疗的很好选择.卡培他滨(希罗达在进展期结直肠癌中的治疗进Xeloda 可在联合化疗中取代可在联合化疗中取代5FU/LV 静脉推注静脉滴注5FU/LV并不合理5FU/LV并不合理较好, 5FU/LV 较好, 但不方便,不舒适不方便, 费时CVA并发症CVA并发症Xeloda 模拟连续静脉滴注5-FU 模拟连续静脉滴注5 与Oxa or Iri联合有理论基础Iri联合有理论基础卡培他滨(希罗达在进展期结直肠癌中的治疗进一. 希罗达联合奥沙利铂治疗进展期结直肠癌卡培他滨(希罗达在进展期结直肠癌中的治疗进奥沙利铂可上调结直肠异种肿瘤移植瘤内TP活性奥沙利铂可上调结直肠异种肿瘤移植瘤内TP活性肿瘤移植瘤内TP 对照Oxaliplatin 5mg/kg Oxaliplatin 10mg/kg Oxaliplatin 15mg/kg* * *TP 活性(units/mg protein)TP = thymidine phosphorylase *p0.05 vs control 7 days after oxaliplatin administration Sawada N et al. Eur J Cancer 2003;1(Suppl. 5):S93 (Abst 303) 卡培他滨(希罗达在进展期结直肠癌中的治疗进XELOX在人结直肠癌移植瘤模型上具有协同作用XELOX在人结直肠癌移植瘤模型上具有协同作用肿瘤体积变化(cm3) 瘤体积变化积变10 5对照1 0.5 卡培他滨奥沙利奥沙利铂卡培他滨+奥沙利铂( 2/3 MTD) 卡培他滨卡培他滨(2/3 MTD) 奥沙利铂奥沙利铂(2/3 MTD)0.1 1 11 21 给药天数给药天数31 41 51*p0.05 vs both single agentsSawada N et al. Eur J Cancer 2003;1(Suppl. 5):S93 (Abst 303) 卡培他滨(希罗达在进展期结直肠癌中的治疗进卡培他滨和奥沙利铂联合方案作为晚期或转移性结直肠癌病人的一线治疗: 移性结直肠癌病人的一线治疗一项国际性多中心II 一项国际性多中心期研究的结果Chris Twelves Cancer Research Campaign Department of Medical Oncology, University of Glasgow, and Beatson Oncology Center Glasgow, UK卡培他滨(希罗达在进展期结直肠癌中的治疗进XELOX 一线治疗一线治疗MCRC:方案设计方案设计(n=96) 方案设计Day Oxaliplatin 130mg/m (2-hour infusion)2 181521Xeloda 1,000mg/m twice daily2Day 1 (pm)C15 (am)1Rest第22天重复天重复采用I期临床结果推荐剂量采用期临床结果推荐剂量 2 男/女(%) = 64/36; 中位年龄= 64 y 女28%病人既往接受过新)辅助化疗病人既往接受过(新辅助化疗病人既往接受过入选时间从2000 年7月到月到2001年2月入选时间从月到年月29%的病例在停用奥沙利铂后继续接受卡培他滨的单药治疗的病例在停用奥沙利铂后继续接受卡培他滨的单药治疗2 Díaz-Rubio E et al. Ann Oncol 2002;13:558C65 Sawada N et al. Eur J Cancer 2003;1(Suppl. 5):S93 (Abst 303)1卡培他滨(希罗达在进展期结直肠癌中的治疗进疗效: 疗效有效率病例数(%) 总有效率RR* 疾病稳定疾病进展早期停药55 32 6 695% CI 45 65 23 43 2 13 2 13*WHO 标准卡培他滨(希罗达在进展期结直肠癌中的治疗进XELOX亚组分析有效率亚组分析: 亚组分析Patients (%) 80 60 50 40 20 0 总有效率肝肺Yes No 55 55 61 56 55 60 54 60 53≤808060≥60转移灶(新)辅助化疗新辅助化疗KPS年龄Sawada N et al. Eur J Cancer 2003;1(Suppl. 5):S93 (Abst 303)。


卡培他滨片说明书【药品名称】通用名:卡培他滨片英文名: Capecitabinen Tablets汉语拼音: Kapeitabin Pian【适应证】卡培他滨片适用于紫杉醇和包括有蒽环类抗生素化疗方案治疗无效的晚期原发性或转移性乳腺癌的进一步治疗。
适用于结、直肠癌的治疗。
【剂量与用法】推荐剂量:每日 2,500mg/ m2,连用两周,休息一周。
每日总剂量分早晚两次于饭后半小时用水吞服。
如病情继续恶化或产生不能耐受的毒性时应停止治疗。
【治疗中剂量调整】卡培他滨片所引起的毒性有时需要做对症处理或对剂量进行调整(停药或减量)。
一旦减量,以后不能再增加剂量。
以下是对毒性进行剂量调整时的推荐剂量(根据加拿大国家癌症研究所制定的常见毒性标准)。
1 级。
2 级。
第一次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的100%进行下一疗程治疗。
第二次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的75%进行下一疗程治疗。
第三次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的50%进行下一疗程治疗。
第四次出现:永久停止治疗。
3 级:第一次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的75%进行下一疗程治疗。
第二次出现:停止治疗,直到恢复至0-1 级水平时,按维持剂量的50%进行下一疗程治疗。
第三次出现:永久停止治疗。
4级:永久停止治疗。
如停药后需继续治疗,则应考虑到病人的最大益处,且在毒性症状恢复至 0-1 级水平时以推荐剂量的50%进行使用。
【特殊人群的剂量调整】肝功能不全:对肝转移引起的轻度至中度肝功能不全的病人所进行的卡培他滨片药代动力学研究表明,无需对这类病人做剂量调整。
肾功能不全:尚未对肾功能不全者(指血清肌酐)进行卡培他滨片药代动力学研究。
儿童:尚未在儿童中进行卡培他滨片的疗效与安全性研究。
老年人:无须作剂量调整。
但在老年人( 65 岁以上)比年轻人更易对卡培他滨产生毒性,故应对其进行密切监测。

卡培他滨说明书,你真的会看吗?建议收藏的详细解析版首先,卡培他滨属于哪种化疗药物:细胞毒性药物,就是我们常说的化疗药物。
不同于靶向药物针对性杀死表达某种基因突变的肿瘤细胞,化疗药物主要攻击处于快速分裂期的细胞,因此除了蛮横的肿瘤细胞以外,极其容易受到攻击的就是血液细胞。
卡培他滨的主流用药方案卡培他滨有大致两种用药:01单用卡培他滨通常是口服,针对一些分期较早(复发概率较低),或是年龄较长的老年患者,考虑联合用药打击过猛,反而损害免疫系统,无法从化疗中收益。
单药应用推荐剂量为1250mg/m2,每日两次,口服(每日总剂量为2500mg/m2);吃2周,停1周,3周为一疗程,餐后30分钟内用水吞服。
那么具体怎么计算用量呢,首先要先算体表面积,体表面积计算公式:体表面积(m) =0.0061x身高(cm)+0.0128×体重(kg)-0.1529。
举个例子,患者A,75岁老年男性,身高:175cm,体重:65kg,体表面积:1.7466 m2约等于2.00m2;那么根据说明书:推荐剂量1250mg/m2,按照卡培他滨每片0.5g(=500mg)计算,患者A的卡培他滨具体用药量为:1250x2.00=2500mg 每顿;注:5片/次 2次/日餐后30分钟内用水吞服,连服14天,休息1周,3周(21天)为一个疗程。
02与奥沙利铂联用奥沙利铂130mg/m2,静脉输注,当天开始口服卡培他滨,剂量为1000mg/m2,每日两次,用药2周,停1周;再举个例子:患者B,55岁老年男性,身高:175cm,体重:65kg,体表面积:1.7466 m2约等于2.00m2;那么根据说明书:奥沙利铂推荐剂量:130mg/m2;卡培他滨推荐剂量1000mg/m2,按照卡培他滨每片0.5g(=500mg)计算:患者B的化疗药物具体用药量为:奥沙利铂:130x2.00=260mg+卡培他滨:1000x2.00=2000mg ;注:第一天静脉滴注奥沙利铂260mg;同日起,口服卡培他滨:4片/次2次/日餐后30分钟内用水吞服,连服14天,休息1周,3周(21天)为一个疗程。

卡培他滨单药化疗方案卡培他滨单药化疗方案:攻克癌症的里程碑癌症是当今社会面临的重大挑战之一,而化疗则是目前最常用的治疗手段之一。
卡培他滨作为一种新型的单药化疗方案,近年来备受瞩目。
本文将重点介绍卡培他滨的作用机制、应用领域和药物特点,以及它在临床实践中的效果。
卡培他滨,是一种核苷类似物,通过干扰DNA合成过程,抑制癌细胞的增殖和分裂。
相较于其他化疗药物,卡培他滨具有很强的选择性,可以选择性地杀死癌细胞而不损伤正常细胞。
这一点非常重要,因为常规化疗可能会对健康细胞造成一定的伤害,导致不良反应,如恶心、呕吐、脱发等。
而卡培他滨的独特作用机制可以最大限度地减少这些不良反应,提高患者的生活质量。
卡培他滨的应用领域非常广泛,可以用于治疗多种癌症,如结直肠癌、胃癌、乳腺癌、肺癌等。
根据患者的具体情况和癌症的类型,医生可以根据需要调整卡培他滨的剂量和使用时间。
这种个体化的治疗方案可以最大限度地发挥药物的疗效,提高患者的生存率。
除了广泛的应用领域,卡培他滨还具有一些独特的药物特点,值得我们关注。
首先,卡培他滨口服方便,避免了注射带来的痛苦和不适。
其次,卡培他滨具有较短的半衰期,即它在体内的消失速度较快,有效地减少了药物在体内的堆积风险。
这也允许医生更灵活地调整药物的剂量和方案。
此外,卡培他滨也被证明具有良好的耐受性,即使在长时间的应用下,也能减少不良反应的风险。
在临床实践中,卡培他滨的效果显著,为癌症患者带来了新的希望。
研究表明,卡培他滨不仅可以延长患者的生存时间,还能显著提高患者的生存率。
一项针对晚期结直肠癌的研究发现,卡培他滨联合其他化疗药物的治疗方案,与传统的化疗方案相比,能够显著提高患者的生存率,并延长无进展生存时间。
这一发现引起了广泛的关注,并获得了学术界的高度评价。
然而,我们也应该看到卡培他滨作为一种新型药物,仍然存在一些潜在的问题。
首先,卡培他滨的价格较高,对于一些经济困难的患者来说,可能是一个不可承受的负担。

卡培他滨 (Capecitabine) 抗癌药物卡培他滨(Capecitabine)抗癌药物卡培他滨(Capecitabine)是一种重要的抗癌药物,广泛应用于临床治疗多种恶性肿瘤。
它属于一类叫做口服脱氧尿苷类似物(Oral Fluoropyrimidines)的化学药物,它通过被转化为5-氟尿嘧啶(5-Fluorouracil,5-FU),使细胞内的嘧啶核苷酸合成减少,从而抑制了DNA的合成,达到抑制癌细胞生长和繁殖的效果。
本文将详细介绍卡培他滨的药物特性、临床应用、副作用以及药物相互作用等方面内容。
一、药物特性卡培他滨是一种咪唑型衍生物,在体内通过肝脏中的酶系反应转化为活性代谢产物,进而发挥药效。
其特点在于其制剂为口服制剂,使得患者可以在家中自行服用,大大提高了患者的治疗便利性和生活质量。
二、临床应用卡培他滨主要用于治疗结直肠癌、乳腺癌、胃癌以及胰腺癌等多种恶性肿瘤。
在结直肠癌的治疗中,卡培他滨可以单药应用或与其他化疗药物联合应用。
在乳腺癌的治疗中,卡培他滨通常与他莫昔芬(Tamoxifen)等内分泌治疗药物联合应用。
临床试验证明,卡培他滨的应用可以有效抑制肿瘤的生长和转移,并提高患者的生存率。
三、副作用卡培他滨的主要副作用包括消化系统反应、血液系统反应、皮肤反应、神经系统反应和肝功能受损等。
消化系统反应主要表现为恶心、呕吐和腹泻等症状;血液系统反应主要表现为骨髓抑制,导致贫血、白细胞减少和血小板减少等;皮肤反应主要为手足综合征,表现为手掌脱皮、疼痛和红肿等;神经系统反应主要为感觉异常和周围神经病变等。
此外,卡培他滨的应用还可能导致肝功能受损。
四、药物相互作用卡培他滨与其他药物之间存在一定的相互作用。
一些药物可能增强或降低卡培他滨的药效,例如抗血小板药物、抗凝药物和抗癫痫药物等。
因此,在患者接受卡培他滨治疗时,需告知医生目前正在使用的其他药物,以避免不良的药物相互作用。
总结:卡培他滨(Capecitabine)是一种口服的抗癌药物,通过转化为活性代谢产物抑制嘧啶核苷酸的合成,从而抑制癌细胞的生长和繁殖。

卡培他滨化疗方案1. 引言卡培他滨是一种广泛应用于肿瘤治疗的化疗药物,它通过抑制DNA合成的过程来干扰肿瘤细胞的生长和扩散。
本文将介绍卡培他滨的作用机制、副作用以及常见的化疗方案。
2. 卡培他滨的作用机制卡培他滨是一种抗癌药物,其作用机制主要通过以下三个方面来发挥:•DNA合成抑制:卡培他滨通过抑制DNA合成的过程,阻碍了肿瘤细胞的DNA复制和修复能力,从而抑制了肿瘤细胞的生长和扩散。
•核苷酸代谢抑制:卡培他滨被人体代谢为活性代谢产物,这些代谢产物能抑制一些关键的核苷酸代谢酶,进而干扰肿瘤细胞的代谢过程。
•RNA合成抑制:卡培他滨还可以抑制肿瘤细胞的RNA合成,从而对肿瘤细胞的基因表达产生影响,进一步干扰肿瘤细胞的生长和扩散。
通过这些机制,卡培他滨在治疗多种肿瘤类型中表现出良好的效果。
3. 卡培他滨的副作用尽管卡培他滨在治疗肿瘤中具有一定的疗效,但也存在一些副作用需要注意:•骨髓抑制:卡培他滨会抑制骨髓造血功能,导致白细胞、红细胞和血小板的减少,容易引发感染、贫血和出血等不良反应。
•消化道反应:卡培他滨可引起恶心、呕吐、腹泻等消化道不适反应,严重者可能需要减少剂量或暂停治疗。
•肝功能损伤:少数患者在使用卡培他滨后可能出现肝功能损伤,需定期监测肝功能指标并采取相应措施。
•皮肤反应:卡培他滨可引起皮疹、湿疹等皮肤不适反应,需要妥善护理皮肤,并及时就医处理。
在使用卡培他滨时,患者需要密切关注自身身体状况,及时向医生报告任何不适症状,以便及时调整治疗方案。
4. 常见的卡培他滨化疗方案根据具体病情和肿瘤类型的不同,卡培他滨的化疗方案也有所差异。
以下列举了一些常见的卡培他滨化疗方案:•FOLFIRINOX方案:卡培他滨与fluorouracil、亚叶酸和奥沙利铂联合应用,用于胰腺癌、胆管癌等消化系统肿瘤的治疗。
•GemCap方案:卡培他滨与gemcitabine联合应用,用于胰腺癌、肺癌、卵巢癌等多种肿瘤的治疗。

抗癌“杀手锏”卡培他滨,你所关心的都在这里抗肿瘤药物高昂的价格是大多数癌症患者及家属的心头之痛,今天介绍的这款抗肿瘤“功勋”药物——卡培他滨,它以相对低平的价格撑起了很多肿瘤患者对未来的希望。
那么这款药适用于哪些癌症呢?这么便宜会不会药效不好?副作用大不大?针对患者们关心的这些问题,今天,我们就专门来聊一聊。
一、卡培他滨的价格是如何“跌下神坛”的?卡培他滨最早由美国罗氏公司研制开发,商品名为“希罗达“。
因其良好的疗效和较低的毒副作用发生率而成为了传统抗肿瘤药物中用量最大的种类之一。
其销售数据也随之水涨船高,2013年,卡培他滨的销售额甚至到了峰值16.29亿美元。
当时,平均到每一个患者身上,卡培他滨的药物费用也较其他药物更高,一个疗程的费用甚至高达上万元。
当2013年“希罗达“专利到期后,国内厂商纷纷开始研发自己的卡培他滨产品。
截至目前,齐鲁制药的”卓伦“、恒瑞医药的”艾滨“、正大天晴的”首辅“等仿制药均已获批上市。
这些国产药的诞生迅速打破了罗氏公司多年来垄断经营的格局,使得国内卡培他滨的费用呈现了快速下降的态势。
现在一盒国产卡培他滨的费用可能仅为几百元,不再成为癌症患者身上沉重的枷锁。
而且未来随着国产药物的崛起和国家医保覆盖面的完善,卡培他滨的价格很可能会更加亲民!二、卡培他滨适用于哪些癌症的治疗?临床上,卡培他滨通常应用于结直肠癌、乳腺癌、胃癌等癌种。
对结直肠癌患者:卡培他滨既可以应用于原发肿瘤根治术后,也可以应用于可以接受氟嘧啶类药物单独治疗的患者。
除此之外,卡培他滨联合奥沙利铂(XELOX)也是转移性结直肠癌的一线治疗方案之一。
对乳腺癌患者:作为单药化疗时,卡培他滨可以单独用于对紫杉醇等药物耐药或不能用紫杉醇治疗的转移性乳腺癌患者。
当参与药物联合化疗时,卡培他滨可以和多西他赛联合用于治疗含蒽环类药物化疗失败的转移性乳腺癌。
对胃癌患者:卡培他滨可以用于晚期、转移性胃癌的一线治疗,或联合奥沙利铂(XELOX)用于胃腺癌患者根治术后的辅助化疗。
卡培他滨(USP31)C15H22FN3O6[].氨基甲酸,[1-(5-脱氧--D-呋喃核糖)-5-氟代-1,2-二氢-2-氧-4-嘧啶基]-, 戊基酯. 戊基 1-(5-脱氧--D-呋喃核糖)-5-氟代-1,2-二氢-2-氧-4-嘧啶氨基甲酸酯以无水和无溶剂物计,卡培他滨含C15H22FN3O6为%~%。
【包装和贮存】密闭,受控室温保存。
【性状】白色至类白色结晶性粉末。
易溶于甲醇,溶解于乙腈和乙醇,难溶于水。
【鉴别】A: 红外鉴别试样:2mg供试品与300mg溴化钾混合。
B:含量项下,样品溶液色谱图中主峰保留时间应与标准溶液色谱图中主峰保留时间一致。
【水分】:不得过%。
(库仑滴定)【比旋度】+~+。
供试品溶液:10 mg/ mL,溶于甲醇,20,以无水和无溶剂物计。
【炽灼残渣】不得过%。
【重金属】不得过20 ppm。
(重金属第二法)【有关物质】稀释液,溶液A,溶液B,峰鉴别溶液,色谱系统——同含量项下。
标准溶液——直接采用含量项下标准溶液。
供试品溶液——直接采用含量项下供试品溶液。
程序——分别进样等体积(约10 µL)标准溶液和供试品溶液,注入色谱仪,记录谱图,测定所有峰面积。
用下列公式计算卡培他滨中每个杂质的百分比:100(1/F)(C S / C U)(r I / r S) F——各个杂质的相对响应因子,见表1CS——标准溶液中卡培他滨标准品的浓度,mg/mlCU——供试品溶液中卡培他滨的浓度,mg/mlrI——供试品溶液中各个杂质的峰响应rS——标准溶液中卡培他滨的峰响应限度见表1。
表 1CompoundRelativeRetentionTimeRelativeResponseFactor (F)Limit(%) Capecitabine related compound ACapecitabine related compound B2,3-Di-O-acetyl-5-deoxy-5-fluorocytidine5-Deoxy-5-fluoro-N4-(2-methyl-1-butyloxycarbonyl)cytidine +5-Deoxy-5-fluoro-N4-(3-methyl-1-butyloxycarbonyl)cytidineCapecitabine—[1-[5-Deoxy-3-O-(5-deoxy--D-ribofuranosyl)--D-ribofuranosyl]-5-fluoro-2-oxo-1,2-dihydropyrimidin-4-yl]-carbamicacid pentyl ester[1-[5-Deoxy-2-O-(5-deoxy--D-ribofuranosyl)--D-ribofuranosyl]-5-fluoro-2-oxo-1,2-dihydropyrimidin-4-yl]-carbamicacid pentyl esterCapecitabine related compound C[1-[5-Deoxy-3-O-(5-deoxy--D-ribofuranosyl)--D-ribofuranosyl]-5-fluoro-2-oxo-1,2-dihydropyrimidin-4-yl]-carbamicacid pentyl ester2,3-Di-O-acetyl-5-deoxy-5-fluoro-N4-(pentyloxycarbonyl)cytidineIndividual unspecified impurity—Total unspecified impurities——Total impurities——【含量】稀释液——水:甲醇:乙腈=60:35:5稀醋酸——%醋酸水溶液(v/v)溶液A——稀醋酸:甲醇:乙腈=60:35:5溶液B——甲醇:稀醋酸:乙腈=80:15:5标准溶液——精密称取一定量USP卡培他滨对照品,溶于稀释液,超声,并用稀释液稀释以获得浓度约为mL的溶液。
卡培他滨肿瘤最佳治疗方法卡培他滨(Capecitabine)是一种口服的抗肿瘤药物,被广泛应用于治疗多种类型的肿瘤,特别是乳腺癌和结直肠癌。
它是一种脱氧胸苷类似物,通过抑制肿瘤细胞的增殖和诱导细胞凋亡来发挥治疗作用。
在临床实践中,卡培他滨已经被证实是一种有效的肿瘤治疗药物,但是在选择最佳治疗方法时,我们需要考虑一系列的因素,包括患者的身体状况、肿瘤的类型和分期、药物的剂量和疗程等。
在本文中,我们将探讨卡培他滨在肿瘤治疗中的最佳应用方法。
首先,对于乳腺癌患者,卡培他滨通常与其他化疗药物联合应用,如顺铂、多西他赛等,以增强治疗效果。
临床研究表明,卡培他滨联合化疗能够显著提高患者的生存率和缓解症状,尤其是对于转移性乳腺癌患者具有明显的疗效。
此外,对于晚期乳腺癌患者,卡培他滨也可以作为单药治疗的选择,尤其是对于那些不能耐受其他化疗药物的患者来说,卡培他滨的口服给药方式也为患者带来了便利。
其次,对于结直肠癌患者,卡培他滨常常与氟尿嘧啶类药物联合应用,如奥沙利铂、氟尿嘧啶等,以增强治疗效果。
临床研究表明,卡培他滨联合化疗不仅可以显著提高患者的生存率,还可以减轻患者的症状,如腹泻、恶心、呕吐等。
对于晚期结直肠癌患者,卡培他滨也可以作为维持治疗的选择,以延长患者的生存时间和提高生活质量。
除了上述两种常见的肿瘤类型外,卡培他滨在胃癌、胰腺癌、胆囊癌等消化系统肿瘤的治疗中也具有一定的应用前景。
在临床实践中,我们需要根据患者的具体情况和肿瘤的特点,综合考虑各种治疗方案,选择最佳的治疗方法。
总之,卡培他滨作为一种口服抗肿瘤药物,在肿瘤治疗中具有重要的地位。
在选择最佳治疗方法时,我们需要充分考虑患者的身体状况、肿瘤的类型和分期,以及药物的剂量和疗程等因素。
通过合理的应用,卡培他滨能够显著提高肿瘤患者的生存率和生活质量,为肿瘤治疗带来新的希望。
希望本文能够为临床医生和肿瘤患者提供一些参考,帮助他们选择最佳的治疗方法,共同抗击肿瘤,赢得胜利。
希罗达(卡培他滨片)【药品名称】商品名称:希罗达通用名称:卡培他滨片英文名称:Capecitabine Tablets【成份】卡培他滨【适应症】FDA批准治疗对普通疗法具有抗药性的转移性乳腺癌,治疗转移性结直肠癌联合泰素帝治疗晚期乳腺癌。
【用法用量】推荐剂量每日2,500mg/m2,连用两周,休息一周。
每日总剂量分早晚两次于饭后半小时用水吞服。
【不良反应】希罗达的不良反应较少,以下情况可能与之有关:消化系统:希罗达最常见的不良反应为可逆性胃肠道反应,如腹泻、恶心、呕吐、腹痛、胃炎等。
严重的(3-4级)不良反应相对少见。
皮肤:在几乎一半使用希罗达的病人中发生手足综合症:表现为麻木、感觉迟钝、感觉异常、麻刺感、无痛感或疼痛感,皮肤肿胀或红斑,脱屑、水泡或严重的疼痛。
皮炎和脱发较常见,但严重者很少见。
一般不良反应:常有疲乏但严重者极少见。
其他常见的不良反应为粘膜炎、发热、虚弱、嗜睡等,但均不严重。
【禁忌】有希罗达严重副反应或对氟嘧啶(卡培他滨的代谢产物)有过敏史者禁止使用希罗达。
【注意事项】曾经出现本品严重副反应或对氟嘧啶(卡培他滨的代谢产物)有过敏史者禁用。
.需限制剂量的毒性包括:腹泻、腹痛、恶心、胃炎及手足综合征。
近半数接受本品治疗者会诱发腹泻,对发生脱水的严重腹泻者应严密监测并给予补液治疗。
每日腹泻4-6次或有夜间腹泻者为2级腹泻,每日腹泻7-9次或大便失禁和吸收障碍者为3级腹泻,每日腹泻10次以上或者有肉眼血便和需静脉补液者为4级腹泻。
如发生2.3或4级腹泻,则应停用本品,直到腹泻停止或腹泻次数减少到1级时再恢复使用。
3级或4级腹泻后再使用本品时应减少用量。
几乎近一半使用本品的病人发【特殊人群用药】儿童注意事项:卡培他滨对18岁以下患者的安全性和疗效尚未证实。
【药物相互作用】希罗达与大量药物合用,如抗组胺药,NSAIDs,吗啡,扑热息痛,阿斯匹林,止吐药,H2受体拮抗剂等,未见具有临床意义的副作用。
卡培他滨的药物使用分析
卡培他滨是一种经典的抗肿瘤药物,常用于治疗多种类型的癌症,例如卵巢癌、肺癌等。
与其他化疗药物不同,卡培他滨可以单独使用或与其他化疗药物联合使用以达到更好的疗效,它是非常理想的化疗药物之一。
卡培他滨属于紫杉醇类药物,通过联合癌细胞的微管蛋白,防止细胞分裂的形成来发挥治疗作用。
这一机制使得卡培他滨能够非常有效地抑制癌细胞的生长和扩散。
然而,卡培他滨也有着明显的不良反应。
头发脱落,白细胞降低以及胃肠道症状都是最常见的不良反应。
这些不良反应通常在化疗完成后几个月内逐步消退。
因此,应根据患者的个体情况和癌症类型来决定该药的剂量和使用方式。
在剂量和使用方面,应该因人而异以充分考虑患者的条件和状况以及其他化疗药物的使用情况。
在联合化疗方面,卡培他滨往往是第一选择,特别是在治疗卵巢、宫颈癌、恶性黑色素瘤、前列腺癌等方面。
当与其他化疗药物结合使用时,卡培他滨的效果会得到进一步的提高。
近年来,随着基因测序技术的发展,卡培他滨临床个体化治疗成为可能。
根据每个患者的基因变异情况,可以针对性地制定个性化化疗方案,从而提高疗效和降低不良反应发生的可能性。
总之,卡培他滨是一种有效的抗肿瘤药物,但在使用前应仔细评估患者的状况,制定合理的个性化治疗方案,从而达到最佳的治疗效果和降低不良反应的风险。
卡培他滨片说明书通用名:卡培他滨片生产厂家: 正大天晴药业集团股份有限公司批准文号:国药准字H20213044药品规格:0.5g*12片药品价格:¥280元【通用名称】卡培他滨片【商品名称】卡培他滨片首辅【英文名称】CapecitabineTablets【拼音全码】KaPeiTaBinPianShouFu【主要成份】卡培他滨。
【性状】双凸,长方形桃色包衣片,除去包衣后显白色。
【适应症/功能主治】联合多西紫杉醇治疗包括蒽环类抗生素化疗失败的转移性乳腺癌;单药一线治疗转移性直肠癌。
【规格型号】0.5g*12s【用法用量】推荐剂量:每日2,500mg/m2,连用两周,休息一周。
每日总剂量分早晚两次于饭后半小时用水吞服。
如病情继续恶化或产生不能耐受的毒性时应停止治疗。
【不良反应】1.消化系统:常见的副反应为可逆性胃肠道反应,如腹泻、恶心、呕吐、腹痛、口炎等。
严重的3-4级副反应相对少见。
2.皮肤:在几乎一半使用卡培他滨片首辅的病人中发生手足综合征:表现为麻木、感觉迟钝、感觉异常、麻刺感、无痛感或疼痛感,皮肤肿胀或红斑,脱屑、水泡或严重的疼痛。
皮炎和脱发较常见,但严重者很少见。
3.全身不良反应:常有疲乏但严重者极少见。
其他常见的副反应为粘膜炎、发热、虚弱、嗜睡等,但均不严重。
4.神经系统:头痛、感觉异常、味觉障碍、眩晕、失眠等较常见,但严重者少见。
5.心血管系统:下肢水肿较轻且不常见。
尚未见其他心血管系统副作用。
6.血液系统:少见中性粒细胞减少,极少见贫血,但都不严重。
7.其他:常见厌食及脱水,但重者极少见。
【禁忌】曾经出现卡培他滨片首辅严重副反应或对氟嘧啶卡培他滨的代谢产物有过敏史者禁用。
【注意事项】需限制剂量的毒性包括:腹泻、腹痛、恶心、胃炎及手足综合征。
近半数接受卡培他滨片首辅治疗者会诱发腹泻,对发生脱水的严重腹泻者应严密监测并给予补液治疗。
每日腹泻4-6次或有夜间腹泻者为2级腹泻,每日腹泻7-9次或大便失禁和吸收障碍者为3级腹泻,每日腹泻10次以上或者有肉眼血便和需静脉补液者为4级腹泻。
卡培他滨(USP31)
C15H22FN3O6359.35
[154361-50-9].
氨基甲酸,[1-(5-脱氧--D-呋喃核糖)-5-氟代-1,2-二氢-2-氧-4-嘧啶基]-, 戊基酯.
戊基 1-(5-脱氧--D-呋喃核糖)-5-氟代-1,2-二氢-2-氧-4-嘧啶氨基甲酸酯
以无水和无溶剂物计,卡培他滨含C15H22FN3O6为98.0%~102.0%。
【包装和贮存】密闭,受控室温保存。
【性状】白色至类白色结晶性粉末。
易溶于甲醇,溶解于乙腈和乙醇,难溶于水。
【鉴别】
A: 红外鉴别
试样:2mg供试品与300mg溴化钾混合。
B:含量项下,样品溶液色谱图中主峰保留时间应与标准溶液色谱图中主峰保留时间一致。
【水分】:不得过0.3%。
(库仑滴定)
【比旋度】+96.0~+100.0。
供试品溶液:10 mg/ mL,溶于甲醇,20,以无水和无溶剂物计。
【炽灼残渣】不得过0.1%。
【重金属】不得过20 ppm。
(重金属第二法)
【有关物质】
稀释液,溶液A,溶液B,峰鉴别溶液,色谱系统——同含量项下。
标准溶液——直接采用含量项下标准溶液。
供试品溶液——直接采用含量项下供试品溶液。
程序——分别进样等体积(约10 µL)标准溶液和供试品溶液,注入色谱仪,记录谱图,测定所有峰面积。
用下列公式计算卡培他滨中每个杂质的百分比:
100(1/F)(C S / C U)(r I / r S)
F——各个杂质的相对响应因子,见表1
C S——标准溶液中卡培他滨标准品的浓度,mg/ml
C U——供试品溶液中卡培他滨的浓度,mg/ml
r I——供试品溶液中各个杂质的峰响应
r S——标准溶液中卡培他滨的峰响应
限度见表1。
表 1
Compound Relative
Retention
Time
Relative
Response
Factor (F)
Limit
(%)
Capecitabine related compound A 0.18 1.05 0.3 Capecitabine related compound B 0.19 0.81 0.3 2',3'-Di-O-acetyl-5'-deoxy-5-fluorocytidine 0.36 0.89 0.1 5'-Deoxy-5-fluoro-N4-(2-methyl-1-butyloxycarbonyl)cytidine +
5'-Deoxy-5-fluoro-N4-(3-methyl-1-butyloxycarbonyl)cytidine
0.95 1.01 0.5 Capecitabine 1.00 1.00 —[1-[5-Deoxy-3-O-(5-deoxy--D-ribofuranosyl)-
-D-ribofuranosyl]-5-fluoro-2-oxo-1,2-dihydropyrimidin-4-yl]-carbamic
acid pentyl ester
1.06 1.00 0.3
[1-[5-Deoxy-2-O-(5-deoxy--D-ribofuranosyl)-
-D-ribofuranosyl]-5-fluoro-2-oxo-1,2-dihydropyrimidin-4-yl]-carbamic
acid pentyl ester
1.09 1.00 0.2 Capecitabine related compound C 1.11 0.91 0.3 [1-[5-Deoxy-3-O-(5-deoxy--D-ribofuranosyl)-
-D-ribofuranosyl]-5-fluoro-2-oxo-1,2-dihydropyrimidin-4-yl]-carbamic
acid pentyl ester
1.20 1.00 0.3 2',3'-Di-O-acetyl-5'-deoxy-5-fluoro-N4-(pentyloxycarbonyl)cytidine 1.37 0.85 0.1 Individual unspecified impurity — 1.00 0.1
Total unspecified impurities ——0.5 Total impurities —— 1.5 【含量】
稀释液——水:甲醇:乙腈=60:35:5
稀醋酸——0.1%醋酸水溶液(v/v)
溶液A——稀醋酸:甲醇:乙腈=60:35:5
溶液B——甲醇:稀醋酸:乙腈=80:15:5
标准溶液——精密称取一定量USP卡培他滨对照品,溶于稀释液,超声,并用稀释液稀释以
获得浓度约为0.6mg/mL的溶液。
峰鉴别溶液——称取一定量USP卡培他滨对照品,USP卡培他滨有关物质A对照品,USP
卡培他滨有关物质B对照品,USP卡培他滨有关物质C对照品,溶于稀释液,超声,并用稀
释液稀释以获得浓度分别约为0.06mg/mL的溶液。
用稀释液定量稀释以获得浓度分别约为
0.6µg/mL的溶液。
供试品溶液——精密称取一定量卡培他滨,溶于稀释液,超声,并用稀释液稀释以获得浓度
约为0.6mg/mL的溶液。
色谱系统——色谱柱:4.6m m×25cm,5-µm;填料:L1
检测波长:250nm
冷却自动进样装置:5℃
流速:约1ml/min
柱温:40℃
色谱程序如下:
时间(分钟) 溶液 A (%) 溶液 B (%) 洗脱
0–5 100 0 等度
5–20 100 → 49 0 → 51 线性梯度
20–30 49 51 等度
30–31 49 → 100 51 → 0 线性梯度
31–40 100 0 平衡
进样稀释液,接着是峰鉴别溶液,按程序记录峰响应:卡培他滨有关物质A和卡培他滨有关物质B之间的分离度不得小于1.0。
进样标准溶液,按程序记录峰响应:卡培他滨峰的拖尾因子不得过1.5,重复进样卡培他滨峰的RSD不得过2.0%。
[注意:峰鉴别的目的是确认相对于卡培他滨的相对保留时间,大致的相对保留时间见表1]
程序——分别进样等体积(约10 µL)标准溶液和供试品溶液,注入色谱仪,记录谱图,测定卡培他滨峰响应。
用下列公式计算卡培他滨中C15H22FN3O6的百分含量:
100(C S / C U)(r U / r S)
——标准溶液中卡培他滨标准品的浓度,mg/ml
C
S
C U——供试品溶液中卡培他滨的浓度,mg/ml
r U——供试品溶液中的峰响应
r S——标准溶液中的峰响应
熔点:约112-120℃
Capecitabine: White to off-white crystalline powder. Freely soluble in methanol; soluble in acetonitrile and in alcohol; sparingly soluble in water.
白色至类白色结晶性粉末。
易溶于甲醇,溶于乙腈和乙醇,难溶于水。