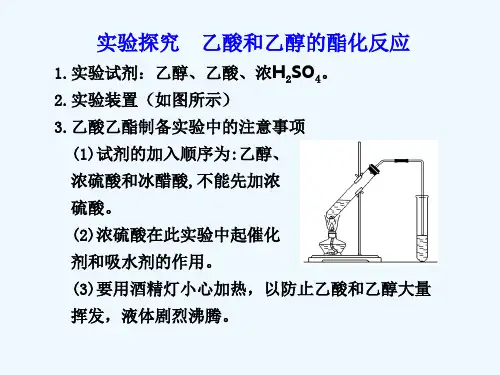
乙酸和乙醇的酯化反应
- 格式:ppt
- 大小:1.42 MB
- 文档页数:10

乙醇与乙酸发生酯化反应方程式
摘要:
I.乙醇与乙酸的酯化反应基本概念
- 酯化反应的定义
- 酯化反应的类型
II.乙醇与乙酸发生酯化反应的化学方程式
- 乙醇与乙酸酯化反应的化学方程式
- 乙醇与乙酸酯化反应的机理
III.乙醇与乙酸酯化反应的条件
- 反应温度和压力
- 催化剂的作用
IV.酯化反应在实际应用中的重要性
- 酯化反应在医药工业中的应用
- 酯化反应在食品工业中的应用
正文:
I.乙醇与乙酸的酯化反应基本概念
酯化反应是一种有机化学反应,指醇与羧酸或含氧无机酸生成酯和水的反应。
这种反应属于酸碱中和反应的一种,但酸与醇的反应并不一定是酯化反应,只有当醇是羟基氢的来源时,反应才能进行。
在有机化学中,乙醇与乙酸发生的酯化反应是最常见的反应之一。
II.乙醇与乙酸发生酯化反应的化学方程式
乙醇与乙酸发生酯化反应的化学方程式如下:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
在这个反应中,乙酸(CH3COOH)与乙醇(C2H5OH)发生反应,生成乙酸乙酯(CH3COOC2H5)和水(H2O)。
III.乙醇与乙酸酯化反应的条件
乙醇与乙酸的酯化反应一般在有催化剂存在的条件下进行。
常用的催化剂有硫酸、氢氧化钠、醇钠和酸酐等。
反应的温度和压力也会影响反应的进行,一般情况下,反应温度越高,反应速率越快;反应压力越大,反应速率也越快。
IV.酯化反应在实际应用中的重要性
酯化反应在医药工业和食品工业中具有非常重要的应用价值。
在医药工业中,酯化反应常被用于合成药物,例如,抗炎药布洛芬就是通过酯化反应合成的。

乙酸与乙醇的酯化反应1.酯化反应是一个可逆反应。
为了提高酯的产量,必须尽量使反应向有利于生成酯的方向进行。
一般是使反应物酸和醇中的一种过量。
在工业生产中,究竟使哪种过量为好,一般视原料是否易得。
价格是否便宜以及是否容易回收等具体情况而定。
在实验室里一般采用乙醇过量的办法。
乙醇的质量分数要高,如能用无水乙醇代替质量分数为95%的乙醇效果会更好。
催化作用使用的浓硫酸量很少,一般只要使硫酸的质量达到乙醇质量的3%就可完成催化作用,但为了能除去反应中生成的水,应使浓硫酸的用量再稍多一些。
但一般老师的体会是:最好使用冰醋酸(冬天是固体,夏天可能是液体)和无水乙醇。
同时采用乙醇过量的办法。
只须加入2 滴浓硫酸,多了效果反而不好。
2.制备乙酸乙酯时,反应温度不宜过高,保持在60℃~70℃,不能使液体沸腾。
温度过高时会产生乙醚和亚硫酸等杂质。
液体加热至沸腾后,应改用小火加热。
事先可在试管中加入几片碎瓷片,以防止液体暴沸(一般是没有加碎瓷片,因此加热过猛时有暴沸产生)。
3.使用无机盐Na2CO3溶液吸收挥发出的乙酸。
蒸馏出的乙酸乙酯中因混有乙酸和乙醇,故不能闻到明显的酯的果香味。
此时必须振荡试管,使饱和碳酸钠跟乙酸反应将其吸收,这样既溶解了乙醇又降低酯的溶解性,让酯浮在液面上便于闻其香味,观察色、态。
Na2CO3溶液的作用是:(1)乙酸乙酯在无机盐Na2CO3溶液中的溶解度减小,容易分层析出。
(2)Na2CO3能跟挥发出的乙酸反应,生成没有气味的乙酸钠,便于闻到乙酸乙酯的香味。
4.导气管不要伸到Na2CO3溶液中去,防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。
5.该实验也可以用中圆底烧瓶作反应物的容器,这时反应物的量要大一些。
我的体会是可按书上装置进行,所得乙酸乙酯量也不少,效果也明显。
一般是加热沸腾,让其反应,使乙酸乙酯蒸发出来。
一般未加碎石,要出现暴沸。
[注意事项]乙醛的银镜反应1.不能用久置起沉淀的乙醛。

乙酸与乙醇酯化反应机理
说起乙酸跟乙醇那个酯化反应,咱们得先从它是个啥子反应讲起。
乙酸,就是咱们说的醋酸,乙醇呢,就是酒里面的主要成分酒精。
这两个东西搁一块儿,加点催化剂,比如浓硫酸,再加热一下,就能反应生成乙酸乙酯跟水。
这个反应的过程,说起来也简单。
先是乙酸在催化剂的作用下,变得更容易被乙醇攻击。
乙酸把个质子丢给乙醇,自己变成了乙酰离子,乙醇呢,就变成了带正电的乙铵离子。
这时候,乙酰离子就像个亲核试剂,去攻击乙铵离子的氧原子,两个东西就缠到一块儿,形成了一个四面体的中间体。
但是呢,这个中间体不稳定,它会把个水分子丢出去,就变成了咱们要的乙酸乙酯。
这个过程,就像两个人先拉近距离,再互相配合,最后分出个结果来。
为啥子说这个过程重要呢?因为乙酸乙酯这个东西,用处可大了。
它是个重要的有机溶剂,还能用来做香精、香料,甚至涂料、油墨里头都要用到它。
所以,咱们得把这个反应搞透了,才能想办法提高产率,做出更多更好的乙酸乙酯来。
当然了,这个反应也不是一帆风顺的。
温度、压力、催化剂的种类跟用量,都能影响到反应的速率跟产率。
所以,科学家们一直都在研究,怎么优化这些条件,才能让反应更加高效、环保。
总的来说,乙酸跟乙醇的酯化反应,就是个典型的有机化学反应,里头涉及到的机理,也是咱们化学里头的基础知识。
虽然说起来有点复杂,但是只要咱们理解了,就能更好地掌握它,为咱们的生产生活服务。

乙酸与乙醇的酯化反应的副反应
乙酸与乙醇酯化反应是一种常见的有机化学反应,通常用于合成酯类化合物。
然而,这种反应在实际应用中存在一些副反应,这些副反应会影响反应的效率和产物的纯度。
其中一种常见的副反应是消耗醇反应。
在乙酸与乙醇进行酯化时,有些乙醇通过消耗反应与乙酸反应,产生大量副产物水和二乙酸。
消耗反应的一个常见机制是醇脱水作用,即乙醇中的羟基被脱除,形成乙烯气体和水。
这种消耗反应通常会导致反应的低收率和产品的低纯度。
另一种副反应是逆酯化反应。
逆酯化反应是酯键反向断裂并释放酸和醇。
它通常由酸中水分的存在引起。
在酯化反应中,加入一些水可以促进逆酯化反应,导致产物中出现未反应的乙酸和乙醇。
逆酯化反应也会导致产物与理论收率之间的差异。
在一些脱度缩合反应中出现的副反应在酯化反应中也可能会出现,例如产生醇和酸的缩合反应。
这种反应是通过酸催化作用引起的,会形成酮或醛。
如果缩合反应产生的产物没有被进一步反应掉,产品的纯度也会受到负面影响。
除了上述副反应,还有其他少见的副反应,例如酸水解反应,即酸催化下产物被水分硬化成醇与酸;以及酶水解反应,即产生酯醇浆料转变至醇酸浆料。
这些副反应通常由反应条件和催化剂的选择等因素影响。
为了控制这些副反应并提高反应效率和产物的纯度,反应条件需要进行优化。
例如,可以控制反应中水分和催化剂的量,以避免逆酯化和消耗反应的发生。
此外,通过在反应中加入分子筛等干燥剂,可以有效地减少水分的存在,从而抑制逆酯化反应的发生。

乙酸的酯化反应方程式乙酸的酯化反应是一种常见的有机合成反应。
酯化反应是一种醇和酸发生酯结合的化学反应。
在乙酸的酯化反应中,乙酸与一种醇反应生成酯,并释放水分子。
这种反应通常需要酸催化剂的存在,常用的酸催化剂包括硫酸、磷酸等。
乙酸的酯化反应可以用以下方程式表示:酸 + 乙醇→ 乙酸乙酯 + 水在这个方程式中,酸可以是无机酸,如硫酸、磷酸等,也可以是有机酸,如乙酸、苯甲酸等。
乙醇是一种醇,也就是乙酸的醇基。
乙酸乙酯是生成的酯,它由乙酸和乙醇的醇基通过酯结合形成。
水是酯化反应中生成的副产物,它由醇和酸反应生成。
乙酸的酯化反应是一种平衡反应,反应达到平衡时,生成物和反应物的浓度将保持不变。
在这种情况下,反应的方向取决于反应物的浓度。
如果反应物中酸或醇的浓度较高,反应将向右进行,生成更多的酯。
相反,如果生成物中酯的浓度较高,反应将向左进行,生成更多的反应物。
乙酸的酯化反应在有机合成中有广泛的应用。
酯是一类重要的有机物,它们具有多种用途,包括作为溶剂、香料、润滑剂和某些药物的原料等。
乙酸乙酯是一种常用的溶剂,在油漆、涂料和胶水等工业中广泛使用。
此外,乙酸乙酯还可以作为合成某些药物的中间体。
乙酸的酯化反应可以通过不同的方法进行改变和控制。
一种常见的方法是改变反应物的摩尔比例,通过控制乙酸和乙醇的比例来控制生成物的产量。
此外,可以调节反应的温度、反应时间和酸催化剂的浓度等参数,以优化反应条件,提高产率和选择性。
乙酸的酯化反应是一种常见的有机合成反应,通过乙酸和乙醇的酯化反应,可以合成乙酸乙酯等酯类化合物。
这种反应在化工和制药工业中具有广泛的应用,通过调节反应条件和反应物的比例,可以控制反应的产率和选择性。

乙酸和乙醇反应的活化能
乙酸和乙醇之间的反应通常是酯化反应,其中乙酸和乙醇反应生成乙酸乙酯(常称为醋酸乙酯)和水。
这种反应是一个酸催化的酯化反应,通常使用硫酸等酸性催化剂。
酯化反应的活化能主要与反应的催化剂、反应条件以及反应物的性质有关。
由于这是一个催化反应,酸性催化剂通常能够降低反应的活化能,促使反应更容易发生。
在实际化学反应中,活化能的具体数值会受到多种因素的影响,因此具体数值可能会有所不同。
这包括反应条件(温度、压力等)、使用的催化剂类型和浓度、反应物浓度等。
总体而言,酸催化的酯化反应通常是相对较容易进行的反应,催化剂有助于降低反应的活化能,使反应在温和的条件下进行。

乙酸乙醇反应实验报告乙酸乙醇反应实验报告实验目的:本实验旨在探究乙酸和乙醇之间的酯化反应,通过实验观察和数据分析,了解反应条件对反应速率和产物收率的影响。
实验原理:酯化反应是一种酸催化的醇和酸之间的反应,其中乙酸是酸,乙醇是醇。
在反应中,乙酸的羧基与乙醇的羟基发生酯键的形成,生成乙酸乙酯和水。
该反应是一个可逆反应,通常需要酸催化剂来加速反应速率。
实验步骤:1. 实验前准备:准备好所需的实验器材和试剂,包括乙酸、乙醇、浓硫酸、冷却水、反应瓶、磁力搅拌器等。
2. 实验操作:将一定量的乙酸和乙醇按照一定的摩尔比例加入反应瓶中,加入适量的浓硫酸作为催化剂。
在磁力搅拌器的作用下,将反应瓶放入冷却水中进行反应。
反应过程中,观察反应液体的变化。
3. 反应结束:反应一段时间后,停止搅拌,取出反应瓶,将反应液体进行分离。
收集产物,通过蒸馏或其他方法进行纯化和提取。
4. 数据记录:记录实验过程中的数据,包括反应时间、反应温度、产物收率等。
实验结果:在实验过程中,我们观察到反应液体从最初的透明变为乳白色,随着反应的进行,乳白色逐渐加深,最终转变为乳黄色。
这表明乙酸和乙醇之间的酯化反应已经发生。
在实验结束后,我们将反应液体进行分离,得到了一定量的乙酸乙酯产物。
根据实验数据的记录,我们可以计算出反应的产物收率。
产物收率是指实际得到的产物质量与理论产物质量之间的比值。
通过实验数据的分析,我们可以发现产物收率受到反应温度、反应时间和反应物摩尔比例等因素的影响。
实验讨论:在本实验中,我们观察到反应液体的颜色变化,这是由于反应中生成了乙酸乙酯,而乙酸乙酯的颜色较浓。
这也说明了反应的进行。
另外,我们注意到反应液体的浓度随着反应的进行而增加,这是由于乙酸和乙醇的消耗,以及乙酸乙酯的生成。
在实验中,我们还发现反应温度对反应速率有很大的影响。
较高的温度可以加快反应速率,但同时也会增加副反应的可能性。
因此,在实际应用中,需要根据具体情况选择适当的反应温度。
![实验探究 乙酸和乙醇的酯化反应[优质PPT]](https://uimg.taocdn.com/b39cb91287c24028915fc347.webp)

生成乙酸乙酯的化学反应方程式
乙酸乙酯是一种常用的酯类化合物,化学式为CH3COOCH2CH3。
它是由乙酸和乙醇反应生成的,反应方程式如下:
CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O
乙酸乙酯的生成过程是酯化反应,酯化反应是一种酸催化的醇与酸反应,通过酸催化,醇的羟基(-OH)与酸的羧基(-COOH)发生缩合反应,生成酯类化合物。
在乙酸乙酯的生成过程中,乙酸是酯化反应的酸催化剂,起到催化反应的作用。
乙醇是酯化反应的醇基物质,它的羟基与乙酸的羧基发生缩合反应,生成乙酸乙酯。
反应过程中,羟基和羧基发生酯化缩合反应,生成酯键(-COO-),同时释放出一个水分子。
乙酸乙酯是一种具有水果香味的无色液体,常用作溶剂和香料成分。
它在工业上广泛应用于油漆、涂料、胶水、染料、香精等领域。
此外,乙酸乙酯还可用于合成其他有机化合物,如乙酸纤维素乙酯等。
乙酸乙酯的合成反应是一个平衡反应,反应条件对反应速率和平衡位置有重要影响。
一般情况下,酯化反应需要在酸性条件下进行,常用的催化剂有硫酸、磷酸等。
反应温度和反应时间也会影响反应的进行,一般在酯化反应中,温度较高,可以促进反应速率,但过高的温度会导致副反应的发生。
同时,反应时间的选择也需考虑反
应平衡的达到程度。
总结起来,生成乙酸乙酯的化学反应方程式为:
CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O
其中,乙酸和乙醇在酸性条件下经过酯化反应生成乙酸乙酯,反应过程中生成酯键并释放出水分子。
乙酸乙酯是一种常用的溶剂和香料成分,在工业上有广泛应用。
乙酸与乙醇的酯化反应1.酯化反应是一个可逆反应。
为了提高酯的产量,必须尽量使反应向有利于生成酯的方向进行。
一般是使反应物酸和醇中的一种过量。
在工业生产中,究竟使哪种过量为好,一般视原料是否易得。
价格是否便宜以及是否容易回收等具体情况而定。
在实验室里一般采用乙醇过量的办法。
乙醇的质量分数要高,如能用无水乙醇代替质量分数为95%的乙醇效果会更好。
催化作用使用的浓硫酸量很少,一般只要使硫酸的质量达到乙醇质量的3%就可完成催化作用,但为了能除去反应中生成的水,应使浓硫酸的用量再稍多一些。
但一般老师的体会是:最好使用冰醋酸(冬天是固体,夏天可能是液体)和无水乙醇。
同时采用乙醇过量的办法。
只须加入2 滴浓硫酸,多了效果反而不好。
2.制备乙酸乙酯时,反应温度不宜过高,保持在60℃~70℃,不能使液体沸腾。
温度过高时会产生乙醚和亚硫酸等杂质。
液体加热至沸腾后,应改用小火加热。
事先可在试管中加入几片碎瓷片,以防止液体暴沸(一般是没有加碎瓷片,因此加热过猛时有暴沸产生)。
3.使用无机盐Na2CO3溶液吸收挥发出的乙酸。
蒸馏出的乙酸乙酯中因混有乙酸和乙醇,故不能闻到明显的酯的果香味。
此时必须振荡试管,使饱和碳酸钠跟乙酸反应将其吸收,这样既溶解了乙醇又降低酯的溶解性,让酯浮在液面上便于闻其香味,观察色、态。
Na2CO3溶液的作用是:(1)乙酸乙酯在无机盐Na2CO3溶液中的溶解度减小,容易分层析出。
(2)Na2CO3能跟挥发出的乙酸反应,生成没有气味的乙酸钠,便于闻到乙酸乙酯的香味。
4.导气管不要伸到Na2CO3溶液中去,防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。
5.该实验也可以用中圆底烧瓶作反应物的容器,这时反应物的量要大一些。
我的体会是可按书上装置进行,所得乙酸乙酯量也不少,效果也明显。
一般是加热沸腾,让其反应,使乙酸乙酯蒸发出来。
一般未加碎石,要出现暴沸。
[注意事项]乙醛的银镜反应1.不能用久置起沉淀的乙醛。
乙酸和乙醇的酯化反应碳酸钠的作用乙酸和乙醇的酯化反应是一种常见的有机化学反应,它是通过酯交换反应将乙酸和乙醇转化为乙酸乙酯的过程。
在这个反应中,碳酸钠可以作为催化剂或中和剂使用。
下面我将详细介绍碳酸钠在乙酸和乙醇的酯化反应中的作用。
首先,碳酸钠可以作为催化剂催化乙酸和乙醇的酯化反应。
乙酸和乙醇的酯化反应为可逆反应,通过加入碳酸钠可以提高反应速率和产率。
碳酸钠可以与乙酸和乙醇中的羧酸和羟基反应生成乙酸盐和碱性醇,而这些中间产物可以通过酯交换反应生成乙酸乙酯。
此外,碳酸钠还能够中和反应中生成的酸性物质,保持反应体系的中性,促进酯化反应的进行。
其次,在乙酸和乙醇的酯化反应中,碳酸钠还可以作为反应的中和剂。
酯化反应生成的乙酸盐和碱性醇是弱碱性的,而碱性条件有利于酯化反应的进行。
碳酸钠的存在可以中和乙酸盐和碱性醇中的酸性物质,使体系保持碱性,从而促进酯化反应的进行。
此外,碳酸钠还可以中和一些副产物或杂质中的酸性物质,从而提高酯化反应的纯度和产率。
需要注意的是,碳酸钠在酯化反应中的使用量应该适量。
过多的碳酸钠会导致碱性过强,从而促使反应生成大量副产物,降低反应产率。
此外,过量的碳酸钠还可能导致酸带电离度的降低,从而影响酯化反应的进行。
在实际操作中,通常在反应体系中加入适量的碳酸钠,并在适当的温度下进行搅拌和加热。
酯化反应一般在惰性气氛下进行,以防止氧气的氧化副产物或干扰反应的影响。
综上所述,碳酸钠在乙酸和乙醇的酯化反应中起着催化剂和中和剂的作用。
它可以催化反应的进行,提高反应速率和产率,并且可以中和酸性物质,保持反应体系的中性,促进反应的进行。
然而,使用碳酸钠时需要注意适量使用,以避免过度碱性和产生过多的副产物。