第三章 电化学腐蚀的理论基础
- 格式:ppt
- 大小:247.50 KB
- 文档页数:38

电化学腐蚀的原理及应用1. 什么是电化学腐蚀电化学腐蚀是指金属在电解质溶液中发生氧化反应和还原反应,导致金属表面发生物理和化学变化的过程。
在电化学腐蚀过程中,金属表面被腐蚀掉,在金属内部生成电化学腐蚀产物,从而导致金属的退化和破坏。
2. 电化学腐蚀的原理电化学腐蚀是由以下三个基本要素组成的:- 金属:作为电极参与电化学反应。
- 电解质溶液:提供导电性和溶解氧的介质。
- 环境:包括温度、压力、湿度等因素,会对腐蚀过程产生影响。
电化学腐蚀的过程可以分为两种基本反应: 1. 氧化反应(阳极反应):金属表面发生氧化反应,将金属原子转化为正离子并释放电子。
2. 还原反应(阴极反应):导电的电解质溶液中的阳离子被还原为金属或者其他物质。
通过以上两种反应,金属表面发生物理和化学变化,导致腐蚀和金属破坏。
3. 电化学腐蚀的应用电化学腐蚀的原理和机制在工业和科学研究中有广泛的应用。
以下是一些主要的应用领域。
3.1 金属腐蚀研究电化学腐蚀的研究对于理解金属的腐蚀行为和机制至关重要。
通过研究不同金属在不同环境下的电化学腐蚀行为,可以评估金属的腐蚀性能,选择合适的材料用于特定的应用,以延长金属的使用寿命。
3.2 防腐蚀技术电化学腐蚀的原理为防腐蚀技术的研发和应用提供了理论基础。
通过使用合适的涂层、阻隔层或者中和剂等物质,可以降低金属的腐蚀速率,延长金属的使用寿命。
例如,在航空航天工业中,通过电镀技术给金属表面添加一层保护性的金属镀层,可以防止金属在高温和高湿环境下的腐蚀。
3.3 腐蚀监测和控制电化学腐蚀的研究还为腐蚀监测和控制提供了方法和工具。
通过使用电化学腐蚀监测技术,可以实时监测金属的腐蚀速率和腐蚀产物的生成情况。
这对于设备的维护、预测设备的寿命和做出合理的维修计划非常重要。
3.4 腐蚀改良和治理电化学腐蚀的原理还可应用于腐蚀改良和治理。
通过了解腐蚀的原因和机制,可以研发出适用的腐蚀治理方法,以减少或避免金属材料的腐蚀。

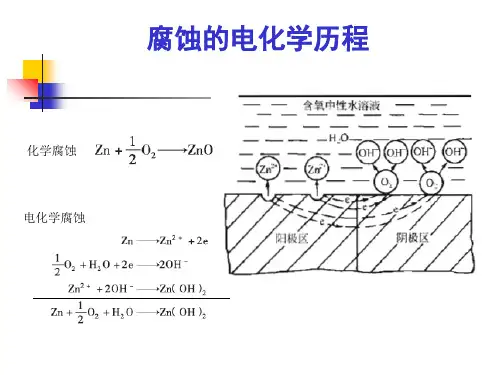







第三章电化学腐蚀基础金属材料与电解质溶液接触时,会发生电化学腐蚀或称湿腐蚀,它是以金属为阳极的腐蚀原电池过程。
工业用金属一般都是还有杂质的,当其浸在电解质溶液中时,发生电化学腐蚀的实质就是在金属表面上形成了许多以金属为阳极,以杂质为阴极的腐蚀电池。
它的工作特点是只能导致金属材料的破坏而不能对外做有用电功的短路原电池。
§3-1 腐蚀原电池一、原电池P33图1是一个最常见的原电池。
中心碳棒是电池的正极,外围的锌皮是负极。
电解质是NH4Cl溶液。
当外电路接通时,灯泡亮。
电极反应为:阳极锌皮上发生氧化反应(使锌原子离子化):Zn→Zn2++2e阴极碳棒是发生还原反应:2H++2e→H2电池总反应为:Zn+2H+→Zn2++H2在反应过程中,电池的锌皮不断被离子化,并放出电子,在外电路中形成电流。
金属锌的离子化结果就是腐蚀破坏。
一个腐蚀电池必须包括阳极、阴极、电解质溶液和外电路四个部分,缺一不可。
这四个组成部分构成腐蚀电池工作的三个必需的环节。
1 阳极过程金属进行阳极溶解,以金属离子或水化离子形式转入溶液,同时将等量电子留在金属上。
2 阴极过程从阳极通过外电路流过来的电子被来自电解质溶液且吸附于阴极表面能够接受电子的物质,即氧化性物质所吸收,在金属腐蚀中将溶液中的电子接受体称为阴极去极化剂。
3 电流的流动电流的流动在金属中依靠电子从阳极经导线流向阴极,在电解质溶液中则是依靠离子的迁移。
腐蚀电池的三个环节既相互独立又彼此紧密联系和相互依存。
只要其中一个环节受阻或停止工作,则整个腐蚀过程也就停止。
电池中离子的迁移和电子流动的驱动力是电极电位差——电池电动势。
在电化学作用下,单位时间,单位面积上发生变化的物质量称腐蚀速度。
可以证明,腐蚀速度V与腐蚀电流密度i呈正比。
因此可用腐蚀电流密度i来表示腐蚀速度大小。
二、腐蚀原电池腐蚀原电池实质上是一个短路的原电池。
如P33图2,将锌与铜接触并置于盐酸水溶液中,就构成了以锌为阳极,铜为阴极的原电池。
