高考化学复习高中总复习:专题4第5讲生活中的含氮化合物(一)——氮的氧化物和硝酸
- 格式:doc
- 大小:626.50 KB
- 文档页数:17

高三第一轮复习第四章 非金属及其重要化合物 第四节 氮及其重要化合物考点一 氮及其重要化合物铵盐单质氧化物酸N 2HNO 2HNO 3NaNO 3含氧酸盐NaNO 2-30+2+3+4+1+5N 2ONO N 2O 3 NO 2 N 2O 5 NH 4Cl氢化物NH 3酸氮气铵盐氧化物氢化物(1)自然界中氮的存在和氮的固定(2) N 2的性质铵盐单质氧化物酸N 2HNO 2HNO 3NaNO 3含氧酸盐NaNO 2-30+2+3+4+1+5N 2ONO N 2O 3 NO 2 N 2O 5 NH 4Cl氢化物NH 3酸氮气铵盐氧化物氢化物(2) NH 3化学性质(1) NH 3物理性质 颜色 气味 密度 溶解性 用途 无色刺激比空气小溶于水(1∶700)制冷剂(易液化)酸氮气铵盐氧化物氢化物氨气的实验室制法①常规方法: 固+固 NH 3△②其他方法铵盐单质氧化物酸N 2HNO 2HNO 3NaNO 3含氧酸盐NaNO 2-30+2+3+4+1+5 N 2ONO N 2O 3 NO 2 N 2O 5 NH 4Cl氢化物NH 3NH 3·H 2O氮气铵盐氧化物 酸氢化物(1)物理性质(2)化学性质—“三解”都是无色或白色晶体,易溶于水铵盐单质氧化物酸N 2HNO 2HNO 3NaNO 3含氧酸盐NaNO 2-30+2+3+4+1+5N 2ONO N 2O 3 NO 2 N 2O 5 NH 4Cl氢化物NH 3NH 3·H 2O氮气铵盐氧化物酸氢化物(2)NO、NO2的比较(1)氮的氧化物氮气铵盐氧化物酸含氧酸盐氢化物(3)常见NOx 的尾气处理方法① 碱液吸收法2NO 2+2NaOH==NaNO 3+NaNO 2+H 2O NO 2+NO+2NaOH==2NaNO 2+H 2O② 催化转化:在催化剂、加热条件下,氨将氮氧化物转化为无毒气体(N 2)或NO x 与CO 在一定温度下催化转化为无毒气体(N 2和CO 2),一般适用汽车尾气的处理。

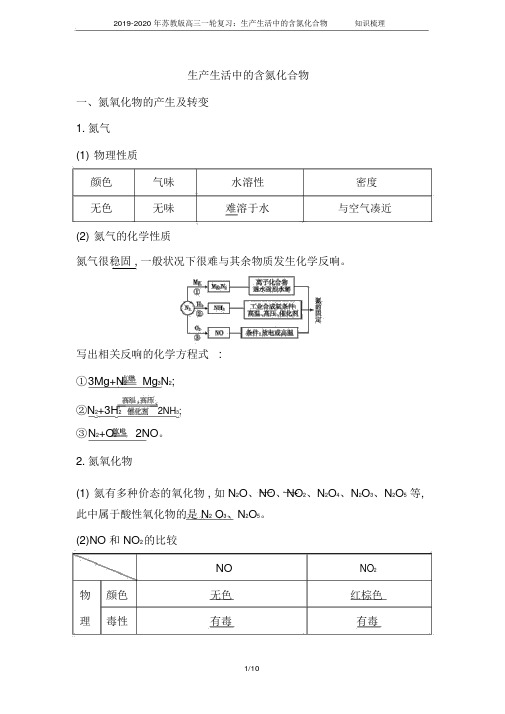
生产生活中的含氮化合物一、氮氧化物的产生及转变1.氮气(1)物理性质颜色气味水溶性密度无色无味难溶于水与空气凑近(2)氮气的化学性质氮气很稳固 , 一般状况下很难与其余物质发生化学反响。
写出相关反响的化学方程式:①3Mg+N2 Mg3N2;②N2+3H22NH3;③N2+O2 2NO。
2.氮氧化物(1)氮有多种价态的氧化物 , 如 N2O、NO、NO2、N2O4、N2O3、N2O5等, 此中属于酸性氧化物的是 N2 O3、N2O5。
(2)NO 和 NO2的比较NO NO2物颜色无色红棕色理毒性有毒有毒性溶解不溶能溶质性与 O2化2NO+O 2NO反响学与性HO3NO2+H2O2质2HNO3+NO反响与人体、①与血红蛋白联合令人中毒形成硝酸型酸雨、光化环境的②转变成 NO2形成硝酸型酸雨、学烟雾关系光化学烟雾3.氮的氧化物对环境的污染(1)NO、NO2的根源 : 煤和石油的焚烧、汽车尾气、硝酸工厂等。
(2)氮氧化物的危害①直接危害人体健康 , 惹起呼吸道疾病 , 严重时会令人死亡。
②大气中的NO2溶于水后形成酸性溶液, 随雨水降下 , 成为硝酸型酸雨。
(3)汽车尾气的成分汽车尾气中除含有氮氧化物外 , 还含有 CO,未焚烧的碳氢化合物、含铅化合物 ( 如使用含铅汽油 ) 和颗粒物等。
1.相关氮的氧化物溶于水的计算(1)NO2和 O2的混淆气体溶于水时 , 其反响式为① 4NO2+O2+2HO4HNO3,由此反响式可知 :4 : 3,恰巧完整反响当体积比>4 :1,NO 2过度,节余气体为NOV (NO 2) :V (O 2)<4 :1,O 2过度,节余气体为O 2(2)NO 和 O 2的混淆气体溶于水时,其反响是 2NO+O2NO,3NO 2+H 2O2HNO 3+NO, 总 反 应式 为 ②234NO+3O+2HO 4HNO, 由此反响式可知 :4 : 3,恰巧完整反响当体积比V (NO) : V (O 2)>4:1, NO 2过度,节余气体为 NO<4 :1,O 2过度,节余气体为O 2注意 :4NO 2+O 2 和 4NO+3O 2从构成上均相当于 2NO 5, 即①、②两反响式都与 N 2O 5+H 2O 2HNO 3等效。


第七单元生活中的含氮化合物第一课时氮及其氧化物考纲要求:了解N2的重要性质及用途掌握NO、NO2等氧化物的重要性质和用途难点:有关NO、NO2溶于水的体积变化的相关计算课型:知识梳理课教学方法讨论式教学过程复习提问:1 写出氮族各种元素的元素符号和名称,总结氮族元素的性质递变规律。
2 列举氮气及氮氧化物的重要化学性质(学生上黑板板书)知识梳理:(老师概括总结氮气及其氧化物的性质)一、N2的性质空气的主要成分,性质稳定提问:为什么N元素在周期表的V A族中半径最小,非金属性最强,而N2的化学性质却非常稳定?引导学生从氮气分子的结构考虑,写出电子式、结构式氮气主要的化学反应:N2 + 3Mg = Mg3 N2N2 + O2 = 2NO 2NO + O2 = 2NO2N2 + 3H2 = 2 NH3二、各种价态氮氧化物:1N+(N2O)、2N+(NO)、3N+(N2O3)、4N+(NO2、N2O4)、5N+(N2O5),其中N2O3和N2O5分别是HNO2和HNO3的酸酐。
气态的氮氧化物几乎都是剧毒性物质,在太阳辐射下还会与碳氢化物反应形成光化学烟雾。
NO和NO2性质比较NO:一种无色气体,难溶于水,不成盐氧化物。
常温下,极易被氧化为NO2NO2:一种有刺激性气味的红棕色气体,溶于水后与水反应:3NO2+H2O==2HNO3+NO相关化学反应方程式分别为:3NO2+H2O=2HNO3+NO、4NO+3O2+2H2O=4H NO3、4NO2+O2+2H2O=4HNO3、NO2+NO+O2+H2O=2HNO3。
提问:举例说明NO在现代医药领域的重要用途?三、白磷的性质学生列举白磷的分子结构,红磷白磷的转化等典型例题讲解例题1(2011全国29)(2)在实验室欲制取适量N0气体。
①下图中最适合完成该实验的简易装置是________(填序号);②根据所选的装置完成下表(不需要的可不填):③简单描述应观察到的实验现象_________________________ ______________。

第4讲 氮及其重要化合物 复 习 目 标知 识 建 构1.了解氮元素单质及其重要化合物的制备方法,掌握其主要性质及应用。
2.了解氮的化合物对环境的影响。
一、氮气及其氧化物1.自然界中氮的存在和氮的固定2.氮气写出有关化学方程式:①3Mg +N 2=====点燃Mg 3N 2;②N 2+3H 2高温、高压催化剂2NH 3; ③N 2+O 2=====放电或高温2NO 。
3.氮的氧化物(1)氮元素从+1~+5价都有对应的氧化物,如N 2O 、NO 、N 2O 3、NO 2(或N 2O 4)、N 2O 5,其中属于酸性氧化物的是N 2O 3、N 2O 5。
(2)NO 和NO 2的比较性质NO NO 2 色、态、味 无色、无味气体 红棕色、有刺激性气味气体【诊断1】 判断下列说法是否正确,正确的打√,错误的打×。
(1)食品袋中充氮气可用来防腐( )(2)通过灼热的镁粉,可除N 2中的少量氧气()(3)NO 中的NO 2杂质气体,可通过盛有水的洗气瓶除去( )(4)CO 、NO 、NO 2都是大气污染气体,在空气中都稳定存在( )(5)N 2与O 2在放电条件下直接化合成NO 2( )(6)NO 2溶于水时,NO 2是氧化剂,水是还原剂( )(7)NO 2是酸性氧化物,与水反应生成硝酸( )答案 (1)√ (2)× (3)√ (4)× (5)× (6)× (7)×二、硝酸1.物理性质2.化学性质(1)不稳定性①化学方程式:4HNO 3(浓)=====△或光照2H 2O +4NO 2↑+O 2↑。
②市售浓硝酸呈黄色的原因是HNO 3分解生成的NO 2溶于硝酸中。
③浓硝酸的保存方法是保存在棕色带有玻璃塞的细口试剂瓶中,置于冷暗处。
(2)强氧化性①与金属反应,如浓、稀硝酸与铜反应(化学方程式):Cu +4HNO 3(浓)===Cu(NO 3)2+2NO 2↑+2H 2O ;3Cu +8HNO 3(稀)===3Cu(NO 3)2+2NO ↑+4H 2O 。
专题四 第5讲 生活中的含氮化合物(一)——氮的氧化物和硝酸 第3~4课时 习题课 使用时间(2013.2.24)【真题重组 规范集训】高考题组一 有关氮的氧化物及硝酸所参与的离子反应1.判断下列说法是否正确,正确的划“√”,错误的划“×”(1)NO 2与水的反应:3NO 2+H 2O===2NO -3+NO +2H + ( ) (2011·江苏,6B)(2)用稀NaOH 溶液吸收NO 2:2OH -+2NO 2===NO -3+NO ↑+H 2O ( )(2010·江苏,3C)(3)铁与稀HNO 3反应:Fe +2H +===Fe 2++H 2↑ ( )(2009·广东理基,32A)(4)FeS 溶于稀HNO 3:FeS +2H +===Fe 2++H 2S ↑ ( ) (2011·新课标全国卷,12A)(5)在1.0 mol·L -1的KNO 3溶液中,H +、Fe 2+、Cl -、SO 2-4可以大量共存( )(2011·江苏,4A)高考题组二 氮的氧化物2.判断下列说法是否正确,正确的划“√”,错误的划“×”(1)CO 、NO 、NO 2都是大气污染气体,在空气中都能稳定存在 ( )(2010·山东理综,13C)(2)NO 可用于某些疾病的治疗 ( )(2010·上海,4D)3.发射“嫦娥二号”的长三丙火箭由三个子级构成。
其中一子级上部装有液体四氧化二氮(N 2O 4),下部装有液体偏二甲肼(C 2H 8N 2)。
发动机内燃烧的化学方程式为C 2H 8N 2+2N 2O 4―→3N 2+2CO 2+4H 2O ,该反应中 ( )A .C 2H 8N 2发生还原反应B .C 2H 8N 2是氧化剂C .N 2O 4发生氧化反应D .N 2O 4是氧化剂4.(2009·宁夏理综,7)将22.4 L 某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积变为11.2 L(体积均在相同条件下测定),则该氮氧化合物的化学式为 ( )A .NO 2B .N 2O 3C .N 2OD .N 2O 4 5.(2009·台湾,25)某氮氧化合物的一分子中含有38个电子。
第5讲生活中的含氮化合物(一)——氮的氧化物和硝酸[考纲要求] 1.知道氮气稳定的原因及用途。
2.了解常见的氮的氧化物(NO、NO2)的性质及对环境的影响。
3.会用硝酸的氧化性解释硝酸与金属、非金属及其他具有还原性物质反应的特点。
考点一氮气及氮的氧化物1.氮气(1)氮的固定使空气中__________的氮转化为__________的过程。
(2)氮气的性质①物理性质纯净的N2是一种无色无味的气体,难溶于水,在空气中约占总体积的______。
②化学性质通常情况下,N2化学性质很稳定,只在高温、放电、催化剂等条件下才能发生一些化学反应。
a.与H2反应:________________________________________________________________________。
b.与O2反应:________________________________________________________________________。
2.氮的氧化物氮有多种价态的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5等。
完成NO和NO2的比较表:NO NO2物理性质颜色毒性溶解性化学性质与O2反应2NO+O2===2NO2与H2O反应3NO2+H2O===2HNO3+NO实验室制法(填化学方程式) 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2OCu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O与人体、环境的关系①与血红蛋白结合使人中毒②转化成NO2形成酸雨、光化学烟雾形成酸雨、光化学烟雾特别提醒(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
(3)空气中NO、NO2主要来源于煤和石油的燃烧、汽车尾气、硝酸工厂等。
(4)NO2:既有氧化性又有还原性,以氧化性为主。
NO2能使湿润的淀粉KI试纸变蓝。
1.根据氮在元素周期表中的位置可知氮元素是一种活泼的非金属,为什么氮气很稳定?2.农谚“雷雨发庄稼”,写出雷雨时,雨水中形成稀硝酸的化学方程式。
3.相同质量的镁条分别在氧气、氮气和空气中充分燃烧,所得固体产物的质量由大到小的顺序是________________;过量的镁条分别在相同状况下相同体积的氧气、氮气和空气中充分燃烧,所得固体产物的质量由大到小的顺序是________________________________________________________________________。
(空气中的CO2可忽略)4.如何鉴别NO2与溴蒸气?5.将容积为50 mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5 mL。
则原混合气体中NO2和O2体积比可能是__________或________。
氮的氧化物的几种计算的方法(1)NO2或NO2与N2(非O2)的混合气体溶于水时,可依据3NO2+H2O===2HNO3+NO,利用气体体积的变化差值进行计算。
(2)NO2和O2的混合气体溶于水时,由反应4NO2+O2+2H2O===4HNO3进行计算。
①当V(NO2)∶V(O2)=4∶1时,恰好完全反应,无气体剩余。
②当V(NO2)∶V(O2)>4∶1时,NO2过量,剩余气体为NO。
③当V(NO2)∶V(O2)<4∶1时,O2过量,剩余气体为O2。
(3)NO和O2的混合气体溶于水时,由反应4NO+3O2+2H2O===4HNO3进行计算。
①当V(NO)∶V(O2)=4∶3时,恰好完全反应。
②当V(NO)∶V(O2)>4∶3时,剩余气体为NO。
③当V(NO)∶V(O2)<4∶3时,剩余气体为O2。
(4)NO、NO2、O2三种混合气体同时通入水中,可先按反应3NO2+H2O===2HNO3+NO求出NO2与水反应生成NO的体积,再加上原混合气体中NO的体积,得NO的总体积,再按反应4NO+3O2+2H2O===4HNO3进行计算。
(5)通常“纯净”的NO2或N2O4并不纯,因为在常温常压下它们存在着一个平衡:2NO2 N2O4,在涉及NO2气体颜色变化、压强、密度、相对分子质量等问题时,要考虑此可逆反应的存在。
考点二硝酸1.物理性质色味态:______________________;挥发性:____挥发;水溶性:________________;发烟硝酸:________________________________________________________________________。
2.化学性质3.工业上制备硝酸流程NH 3――→①NO ――→②NO 2――→③HNO 3 写出上述转化的化学方程式①________________________________________________________________________ ②________________________________________________________________________ ③________________________________________________________________________6.发现盛放浓硝酸的试剂瓶中硝酸显黄色,如何处理?7.铝和铁在浓硝酸中“钝化”是化学变化吗?8.在下列反应中,硝酸既表现氧化性又表现酸性的是( )A .FeO 和HNO 3B .Al(OH)3与HNO 3C .H 2S 和HNO 3D . CH 3与HNO 3特别提醒 (1)硝酸既有酸性又有强氧化性,当生成硝酸盐时表现出酸性,当化合价发生变化时表现出氧化性。
(2)硝酸有强氧化性,硝酸浓度越大氧化性越强,硝酸浓度越小氧化性越弱,但产物氮的化合价越低,这是因为浓HNO 3氧化性很强,在反应过程中生成氮的低价氧化物在强的氧化气氛中不能存在,继续被氧化成高价的氮的氧化物,所以产物为NO 2;在稀硝酸中生成的NO 2继续被还原为低价产物。
硝酸与金属、非金属反应的一般规律1.硝酸与金属反应的一般规律(1)金属与HNO 3反应一般不生成H 2,浓HNO 3一般被还原为NO 2,稀HNO 3一般被还原为NO 。
(2)足量金属与一定量浓硝酸反应时,随着硝酸浓度的降低,产物也发生改变。
(3)金属与HNO 3反应的一般通式为①金属+浓硝酸―→金属硝酸盐+NO 2↑+H 2O反应中,表现氧化性(被还原)的HNO 3占12;表现酸性生成硝酸盐的HNO 3占12。
②金属+稀硝酸―→金属硝酸盐+NO↑+H 2O 反应中,表现氧化性(被还原)的HNO 3占14;表现酸性生成硝酸盐的HNO 3占34。
2.硝酸与非金属反应的规律(1)浓硝酸能与碳、硫、磷等非金属单质反应,一般生成最高价含氧酸或最高价氧化物、二氧化氮和水。
(2)与非金属反应,HNO 3表现强氧化性,不表现酸性。
【例1】 在浓硝酸中放入铜片: (1) 开始反应的化学方程式为________________________________________________________________________, 实验现象为________________________________________________________________________。
(2) 若铜有剩余,则反应将要结束时的化学方程式为________________________________________________________________________ ________________________________________________________________________。
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是________________________________________________________________________ ________________________________________________________________________。
(4)若将12.8 g 铜与一定量的浓硝酸反应,铜消耗完时,得NO 、NO 2混合气体5.6 L(标准状况下)。
则所消耗硝酸的物质的量是________。
金属与硝酸反应计算题1.思维模型2.计算中的守恒思想的应用 (1)原子守恒法HNO 3与金属反应时,一部分HNO 3起酸的作用,以NO -3的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO 3中氮原子的物质的量。
(2)得失电子守恒法HNO 3与金属的反应属于氧化还原反应,HNO 3中氮原子得电子的物质的量等于金属失电子的物质的量。
(3)电荷守恒法HNO 3过量时反应后溶液中(不考虑OH -)则有: c(NO -3)=c(H +)+nc(M n +)(M n +代表金属离子)。
(4)离子方程式计算法金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO-3在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO-3进行相关计算,且溶液中要符合电荷守恒。
【例2】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。
若向所得硝酸铜溶液中加入5 mol·L -1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )A.60 mL B.45 mL C.30 mL D.15 mL【例3】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。
请回答:(1)NO的体积为______ L,NO2的体积为______ L。
(2)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
有关硝酸氧化性的实验探究浓、稀HNO3均具有强氧化性,为了证明其强氧化性,要对其还原产物进行检验,金属与HNO3的反应一直是高考的热点,主要考查方式有现象的描述、装置的选择、实验的设计是否符合环保、化学计算等。