高锰酸钾标准溶液的配制和标定及过氧化氢含量的测定
- 格式:ppt
- 大小:1.28 MB
- 文档页数:17




过氧化氢含量的测定实验报告一、实验目的本实验旨在掌握测定过氧化氢含量的原理和方法,通过实验操作,准确测定给定样品中过氧化氢的含量。
二、实验原理过氧化氢(H₂O₂)具有氧化性,在酸性条件下能与高锰酸钾(KMnO₄)发生氧化还原反应。
其化学方程式为:2KMnO₄+ 5H₂O₂+ 3H₂SO₄= K₂SO₄+ 2MnSO₄+ 5O₂↑ + 8H₂O在此反应中,高锰酸钾的紫红色逐渐褪去,通过测定高锰酸钾溶液的用量,可以计算出过氧化氢的含量。
三、实验试剂与仪器1、试剂约 002 mol/L 高锰酸钾标准溶液3 mol/L 硫酸溶液过氧化氢样品溶液2、仪器酸式滴定管(50 mL)锥形瓶(250 mL)移液管(25 mL)容量瓶(100 mL)电子天平玻璃棒烧杯(500 mL、100 mL)四、实验步骤1、高锰酸钾标准溶液的标定准确称取约 015 g 预先干燥过的基准物质草酸钠(Na₂C₂O₄),置于 250 mL 锥形瓶中。
加入 50 mL 水使之溶解,再加入 10 mL 3 mol/L 硫酸溶液。
加热至 75 85℃,趁热用待标定的高锰酸钾溶液滴定。
开始滴定时反应速度慢,待溶液中产生了 Mn²⁺后,滴定速度可加快,直到溶液呈现微红色并保持 30 秒不褪色,即为终点。
记录消耗的高锰酸钾溶液的体积,平行标定三份,计算高锰酸钾标准溶液的浓度。
2、过氧化氢样品溶液的配制用移液管准确移取 2500 mL 过氧化氢样品溶液,置于 100 mL 容量瓶中。
用蒸馏水稀释至刻度,摇匀。
3、过氧化氢含量的测定用移液管准确移取 2500 mL 上述稀释后的过氧化氢溶液,置于 250 mL 锥形瓶中。
加入 10 mL 3 mol/L 硫酸溶液。
用高锰酸钾标准溶液滴定至溶液呈微红色并保持 30 秒不褪色,即为终点。
记录消耗的高锰酸钾标准溶液的体积,平行测定三份。
五、实验数据记录与处理1、高锰酸钾标准溶液的标定|测定次数|草酸钠质量(g)|消耗高锰酸钾溶液体积(mL)|高锰酸钾标准溶液浓度(mol/L)|平均值(mol/L)|相对平均偏差||::|::|::|::|::|::|| 1 |_____ |_____ |_____ |_____ |_____ || 2 |_____ |_____ |_____ |_____ |_____ || 3 |_____ |_____ |_____ |_____ |_____ |2、过氧化氢含量的测定|测定次数|消耗高锰酸钾标准溶液体积(mL)|过氧化氢溶液浓度(mol/L)|平均值(mol/L)|相对平均偏差||::|::|::|::|::|| 1 |_____ |_____ |_____ |_____ || 2 |_____ |_____ |_____ |_____ || 3 |_____ |_____ |_____ |_____ |计算公式:\\begin{align}c(KMnO₄)&=\frac{2m(Na₂C₂O₄)}{5×13400×V(KMnO₄)}\\c(H₂O₂)&=\frac{5c(KMnO₄)×V(KMnO₄)}{2×2500}\end{align}\式中:\(c(KMnO₄)\)——高锰酸钾标准溶液的浓度(mol/L)\(m(Na₂C₂O₄)\)——草酸钠的质量(g)\(V(KMnO₄)\)——消耗高锰酸钾溶液的体积(L)\(c(H₂O₂)\)——过氧化氢溶液的浓度(mol/L)六、实验结果与讨论1、实验结果高锰酸钾标准溶液的平均浓度为_____ mol/L。



高锰酸钾制氧气实验报告多篇高锰酸钾制氧气实验报告13篇高锰酸钾制氧气实验报告(1)高锰酸钾法测定过氧化氢含量实验报告一、实验目的1.了解高锰酸钾标准溶液的配制方法和保存条件。
2.掌握以Na2C2O4为基准物的标定高锰酸钾溶液浓度的方法原理及滴定条件。
3.掌握用高锰酸钾法测定H2O2含量的原理和方法。
二、实验原理1.高锰酸钾标定原理标定高锰酸钾的基准物有很多,常用的是Na2C2O4。
在H2SO4介质中Na2C2O4与KMnO4反应,其反应式为:2MnO4-+5C2O42-+16H+=2Mn2++5CO2↑+8H2O含量测定原理H2O2的含量可用高锰酸钾法测定。
在酸性溶液中H2O2很容易被KMnO4氧化而生成有力的氧和水,其反应式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O开始反应时速度很慢,滴入第一滴KMnO4溶液时溶液不容易褪色,待生成Mn2+之后,由于Mn2+的催化,加快了反应速度,故能一直顺利地滴定到终点,根据KMnO4标准溶液的用量计算样品中H2O2的含量。
三、实验仪器及药品仪器:铁架台、酸式滴定管、250ml锥形瓶、移液管、电热炉药品:L KMnO4标准溶液、2mol/L H2SO4溶液、Na2C2O4固体、市售H2O2样品四、实验步骤高猛酸钾标定步骤1. 洗涤按要求把实验用的仪器洗涤干净。
2. 润洗将酸式滴定管用待标定的KMnO4溶液润洗2-3次。
3. 称量用电子称准确称取Na2C2O4基准物。
4. 溶解将称量好的基准物置于250ml锥形瓶中,加水约20ml使之溶解,再加15ml 的2mol/L H2SO4溶液,并加热至70-85℃。
5. 滴定将加热好的溶液立即用待标定的KMnO4 溶液滴定,滴定至溶液呈淡红色,并且30s不褪色,即为反应终点。
平行测定2次,根据滴定所消耗KMnO4溶液的体积和基准物的质量,计算KMnO4溶液的浓度。
H2O2溶液含量的测定1. 洗涤按要求把实验用的仪器洗涤干净。


实验B-8 过氧化氢含量的测定实验目的:1、了解高锰酸钾标准溶液配制方法。
2、采用Na2C2O4作基准物标定高锰酸钾的标准溶液。
3、了解高锰酸钾法测定过氧化氢的原理、方法。
4、测定过氧化氢的含量。
实验原理:1. 高锰酸钾为强氧化剂,在酸性溶液中,KMnO4时地将草酸氧化。
此反应随温度升高而加快。
其反应初期要有Mn2+作催化剂,才能使反应速度达到实际应用的程度。
滴定时,利用MnO4本身的颜色变化指示确定终点。
2. H2O2分子中有一个过氧键—O—O—,在酸性溶液它是一个强氧化剂。
但遇KMnO4,表现为还原剂。
测定过氧化氢的含量时,在稀释硫酸溶液中,在室温条件下用高锰酸钾法测定,其反应式为:5H2O2+2MnO4+6H+=2Mn2++5O2+8H2O开始时反应速度慢,滴入第一滴溶液易褪色,待Mn2+生成后,由于Mn2+的催化作用,加快了反应速度,故能顺利地滴定到呈现稳定微红色即为终点。
稍过量的滴定剂本身的紫红色(10-5mol·l-1)即显示终点。
H 2O2在反应过程中,最后产物是O2,半反应式为H2O2===2H++O2+2e-(2220.682O H OE V)实验试剂:Na2C2O4基准物质,于105℃干燥后2h后备用。
3mol·l-1 H2SO40.02mol·l-1KMnO4标准溶液30%左右H2O2(液体试样)实验仪器:烧杯 1000ml 1只棕色细口瓶 1000ml 1只表面玻璃 1块台秤(公用) 100g 4台称量瓶 1只洗瓶 1只 烧杯 400ml 3只 酸式滴定管 50ml 1支 量筒 50ml 1只10ml 1只磁芯漏斗,过滤瓶 1套 滴瓶 50ml 1只 容量瓶 250ml 1只 移液管 25ml 1支 锥形瓶 250ml 3只实验步骤:1、高锰酸钾标准溶液的配制在台秤上称出预先计算好的配制0.02mol ·l -1KMnO 4标准溶液600ml 所需的固体KMnO 4重量。

实验四高锰酸钾标定及过氧化氢含量测定
一实验目的:
1.掌握高锰酸钾法测定过氧化氢的原理;
2.学习高锰酸钾标准溶液的配制和标定;
3.掌握滴定终点的判断。
二、试剂及器皿
0.020mol/L KMnO4标准溶液;H2SO4溶液2mol/L;草酸钠基准物质;H2O2试样,市售质量分数约为30%的H2O2水溶液。
烧杯…
三、实验步骤
1.0.020mol/L KMnO4标准溶液的标定
用减量法称取0.15-0.2克草酸钠(Na2C2O4)基准物质三份,分别置于250ml 锥形瓶中,加入20ml蒸馏水溶解,加入2mol/L10ml H2SO4 ,加热到70-85度,用KMnO4标准溶液滴定到溶液呈微红色,半分钟不褪即为终点。
平行三次。
注意滴定开始一定等前一滴溶液褪色后再加入第二滴,滴定速度要慢。
滴定温度不低于70度。
根据消耗KMnO4的体积和草酸钠的质量计算KMnO4标准溶液的准确浓度。
2.过氧化氢含量的测定
用移液管移取H2O2试样溶液10.00ml,置于250ml容量瓶中,加蒸馏水稀释至刻度,充分摇匀备用。
用移液管移取稀释过的H2O2 25.00ml于250ml锥形瓶中,加入20ml蒸馏水,再加入2mol/L H2SO4 10ml,用KMnO4标准溶液滴定到溶液呈微红色,半分钟不褪即为终点。
平行测定三次,计算试样中H2O2的质量浓度(g/L)和相对平均偏差。
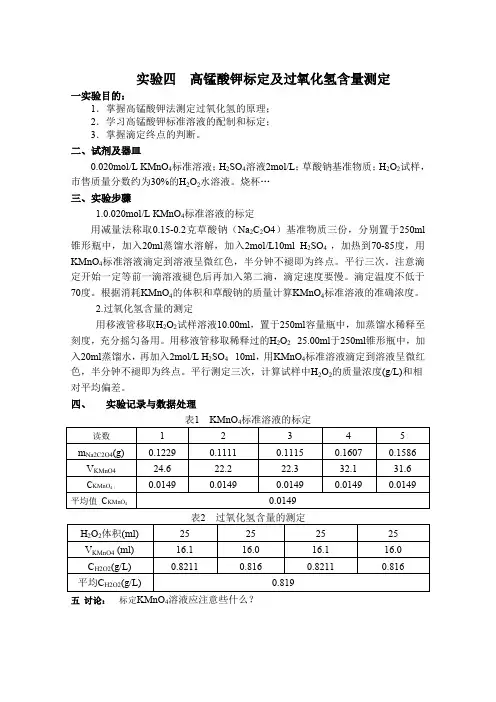
四、实验记录与数据处理
五讨论:标定KMnO4溶液应注意些什么?。
实验六 高锰酸钾的标定及过氧化氢含量的测定 内容:P206-210一、实验目的1. 掌握KMnO 4标准溶液的标定原理。
2. 掌握温度、滴定速度等对滴定分析的影响。
3. 掌握用高锰酸钾法测定过氧化氢含量的原理和方法。
4. 进一步熟练掌握移液管及酸式滴定管的使用方法。
二、实验原理由于Na 2C 2O 4不含结晶水,容易制纯,没有吸湿性,性质稳定,因此常用Na 2C 2O 4作基准物标定KMnO 4溶液浓度。
在酸性介质中KMnO 4与 Na 2C 2O 4发生如下反应:2 MnO 4— + 5 C 2O 42—+16 H + ═ 10 CO 2↑+ 2 Mn 2+ +8 H 2O因溶液本身有紫红色,不需外加指示剂。
H 2O 2又称双氧水,医药上常用作消毒剂。
市场上出售的H 2O 2含量一般为30%。
但由于H 2O 2不稳定,产品中常加入少量的乙酰苯胺等作稳定剂,滴定时也要消耗KMnO 4,使测定结果偏高。
在实验室中常将H 2O 2装在塑料瓶中,置于阴暗处。
在室温条件下,它在稀H 2SO 4溶液中,能定量地被KMnO 4溶液氧化,因此可以用KMnO 4法测定过氧化氢的含量,其反应式为:5 H 2O 2 + 2 MnO 4— +6 H + = 2Mn 2+ +5O 2↑+ 8 H 2O开始反应时速度较慢,滴入第一滴溶液颜色不易退去,但由于H 2O 2不稳定,不能加热。
但可先加少量的Mn 2+作催化剂,加快反应速度。
然后根据KMnO 4标准溶液的浓度和滴定消耗的体积,即可计算出试液中H 2O 2的含量。
三、实验仪器与试剂1. 仪器酸式滴定管 移液管(25 mL ) 锥形瓶(250 mL )量筒(10 mL ) 洗耳球 电子天平2. 试剂H 2O 2(0.15 %):将原装的H 2O 2溶液(30%)稀释200倍即得,贮存于棕色塑料试剂瓶中。
KMnO 4(0.02 mol ·L –1)H 2SO 4(3 mol ·L –1)MnSO 4(1 mol ·L –1)Na 2C 2O 4(固体)四、实验内容1. 0.02 mol ·L –1KMnO 4标准溶液的配制。
河北工业大学实验报告课程:分析化学实验班级:姓名:组别:同组人:日期:2011-3-2实验:过氧化氢含量测定(KMnO4法)一、实验目的:1、掌握应用高锰酸钾法测定过氧化氢含量的原理和方法。
2、掌握高锰酸钾标准溶液的配制和标定方法。
二、实验原理:1、工业品过氧化氢(俗名双氧水)的含量可用高锰酸钾法测定。
在稀硫酸溶液中,室温条件下,H2O2被KMnO4定量氧化,其反应式为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O根据高锰酸钾溶液的浓度和滴定所耗用的体积,可以算得溶液中过氧化氢的含量。
市售的H2O2约为30%的水溶液,极不稳定,滴定前需先用水稀释到一定浓度,以减少取样误差。
在要求较高的测定中,由于商品双氧水中常加入少量乙酰苯胺等有机物质作稳定剂,此类有机物也消耗4而造成误差,此时,可改用碘量法测定。
2、高锰酸钾是最常用的氧化剂之一。
市售的高锰酸钾常含有少量杂质,如硫酸盐、氯化物及硝酸盐等,因此不能用精确称量的高锰酸钾来直接配置准确浓度的溶液。
用KMnO4配制的溶液要在暗处放置数天,待KMnO4把还原性杂质充分氧化后,再除去生成的MnO2沉淀,标定其准确浓度。
光线和Mn2+、MnO2等都能促进KMnO4分解,故配好的KMnO4应除尽杂质,并保存于暗处。
KMnO4标准溶液常用还原剂Na2C2O4作基准物来标定。
Na2C2O4不含结晶水,容易配制。
用Na2C2O4标定KMnO4溶液的反应如下:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O滴定时可利用4-离子本身的颜色指示滴定终点。
三、实验试剂:KMnO4(s) Na2C2O4(s) 1mol·L-1 H2SO4(aq) 1mol·L-1 MnSO4H2O2样品四、实验步骤:1、KMnO4溶液的配置:2、KMnO4溶液浓度的标定:3、H2O2含量的测定:五、实验记录:1、KMnO4溶液浓度的测定:六、问题与思考:1、配制KMnO4标准溶液时为什么要把KMnO4溶液煮沸一定时间(或放置数天)?答:为了使KMnO4溶液中的还原性物质完全反应,使KMnO4溶液浓度稳定。
高锰酸钾标准溶液的配制和标定一、实验目的1.了解高锰酸钾标准溶液的配制方法和保存条件。
2.掌握采用Na2C2O4作基准物标定高锰酸钾标准溶液的方法。
二、实验原理市售的KMnO4试剂常含有少量MnO2和其他杂质,如硫酸盐、氯化物及硝酸盐等;另外,蒸馏水中常含有少量的有机物质,能使KMnO4还原,且还原产物能促进KMnO4自身分解,分解方程式如下:2MnO4-+2H2O====4 MnO2+3 O2↑+4OH-见光是分解更快。
因此, KMnO4的浓度容易改变,不能用直接法配制准确浓度的高锰酸钾标准溶液,必须正确的配制和保存,如果长期使用必须定期进行标定。
标定KMnO4的基准物质较多,有As2O3、H2C2O4·2 H2O 、Na2C2O4和纯铁丝等。
其中以Na2C2O4最常用,Na2C2O4不含结晶水,不宜吸湿,宜纯制,性质稳定。
用Na2C2O4标定KMnO4的反应为:2MnO4-+5 C2O42-+16H+==2Mn2++10CO2↑+8 H2O滴定时利用MnO4-本身的紫红色指示终点,称为自身指示剂。
三、实验试剂1.KMnO4(A.R.), 2. Na2C2O4(A.R.), 3.H2SO4(3mol/L)。
五、实验步骤1.高锰酸钾标准溶液的配制(已完成)在台秤上称量1.0g 固体KMnO4,置于大烧杯中,加水至300mL(由于要煮沸使水蒸发,可适当多加些水),煮沸约1小时,静置冷却后用微孔玻璃漏斗或玻璃棉漏斗过滤,滤液装入棕色细口瓶中,贴上标签,一周后标定。
保存备用。
2.高锰酸钾标准溶液的标定用Na2C2O4溶液标定KMnO4溶液准确称取0.15g基准物质Na2C2O4三份,分别置于250mL的锥形瓶中,加约30mL水和3mol·L-1 H2SO4 15 mL,盖上表面皿,在石棉铁丝网上慢慢加热到70~80℃(刚开始冒蒸气的温度),趁热用高锰酸钾溶液滴定。
开始滴定时反应速度慢,待溶液中产生了Mn2+后,滴定速度可适当加快,直到溶液呈现微红色并持续半分钟不褪色即终点。
高锰酸钾法测定过氧化氢含量实验报告一、实验目的1.了解高锰酸钾标准溶液的配制方法和保存条件。
2.掌握以Na2C2O4为基准物的标定高锰酸钾溶液浓度的方法原理及滴定条件。
3.掌握用高锰酸钾法测定H2O2含量的原理和方法。
二、实验原理1.高锰酸钾标定原理标定高锰酸钾的基准物有很多,常用的是Na2C2O4。
在H2SO4介质中Na2C2O4与KMnO4反应,其反应式为:2MnO4-+5C2O42-+16H+=2Mn2++5CO2↑+8H2O2.H2O2含量测定原理H2O2的含量可用高锰酸钾法测定。
在酸性溶液中H2O2很容易被KMnO4氧化而生成有力的氧和水,其反应式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O开始反应时速度很慢,滴入第一滴KMnO4溶液时溶液不容易褪色,待生成Mn2+之后,由于Mn2+的催化,加快了反应速度,故能一直顺利地滴定到终点,根据KMnO4标准溶液的用量计算样品中H2O2的含量。
三、实验仪器及药品仪器:铁架台、酸式滴定管、250ml锥形瓶、移液管、电热炉药品:0.020mol/L KMnO4标准溶液、2mol/L H2SO4溶液、Na2C2O4固体、市售H2O2样品四、实验步骤高猛酸钾标定步骤1. 洗涤 按要求把实验用的仪器洗涤干净。
2. 润洗 将酸式滴定管用待标定的KMnO4溶液润洗2-3次。
3. 称量 用电子称准确称取0.15-0.20g Na2C2O4基准物。
4. 溶解 将称量好的基准物置于250ml锥形瓶中,加水约20ml使之溶解,再加15ml 的2mol/L H2SO4溶液,并加热至70-85℃。
5. 滴定 将加热好的溶液立即用待标定的KMnO4溶液滴定,滴定至溶液呈淡红色,并且30s不褪色,即为反应终点。
平行测定2次,根据滴定所消耗KMnO4溶液的体积和基准物的质量,计算KMnO4溶液的浓度。
H2O2溶液含量的测定1. 洗涤 按要求把实验用的仪器洗涤干净。
实验一过氧化氢含量的测定(高锰酸钾法)【1】一、实验目的(1)掌握高锰酸钾法测定过氧化氢含量的原理、滴定条件和操作步骤;(2)掌握移液管及容量瓶的正确使用方法,熟悉液体样品的取样和稀释操作。
二、实验原理过氧化氢(H2O2)在工业、生物、医药等方面应用很广泛。
利用H2O2的氧化性漂白毛、丝织物;医药上常用于消毒和杀菌剂;纯H2O2可作为火箭燃料的氧化剂:工业上利用H2O2的还原性除去氯气;植物体内的过氧化氢酶也能催化H2O2的分解反映,股在生物上利用H2O2分解所放出的氧气来测量过氧化氢酶的活性。
由于H2O2有着广泛的应用,常需要测定它的含量。
由于在酸性溶液中,KMnO4的氧化性比H2O2的氧化性强,所以,测定H2O2的含量时,常采用在稀硫酸溶液中,室温条件下用高锰酸钾法测定。
其反应为:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2开始反应缓慢,第1滴溶液滴入后不易褪色,待产生Mn2+后,由于Mn2+的催化作用,加快了反应速率,故滴定速度也应加快,直至溶液呈微红色且半分钟内不退色,即为终点。
根据高锰酸钾浓度和滴定中消耗KMnO4的体积,按下式计算过氧化氢的含量:P(H2O2)=_5c(KMnO4).V(KMnO4).M(H2O2)式中p(H2O2)——稀释后的H2O2质量浓度,g/L。
三、仪器与试剂仪器:移液管(25ml),吸量管(10ml),洗耳球,容量瓶(250ml),酸式滴定管(50ml).试剂:工业H2O2样品,KMnO4(0.02mol/L)标准溶液,H2SO4(3mol/L)溶液。
四、实验步骤1.0.02mol/L的KMnO4标准溶液的配置及标定2.H2O2的含量测定用吸量管吸取10mlH2O2样品(约为3%),置于250ml容量瓶中,加水稀释至标线,混合物均匀。
用移液管准确移取25.00ml过氧化氢稀释液三份,分别置于三个250ml锥形瓶中,各加5mlH2SO4(3mol/L),用高锰酸钾标准溶液滴定。