实验五-苯甲醛歧化制备苯甲酸和甲醇及产物的分离纯化
- 格式:doc
- 大小:670.00 KB
- 文档页数:1
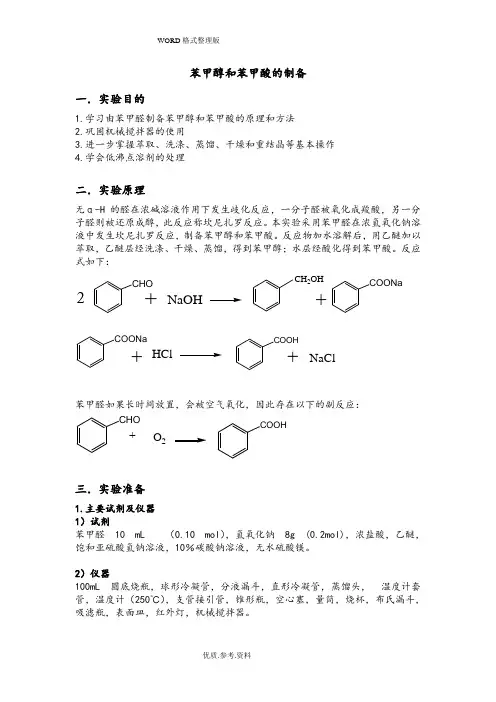
苯甲醇和苯甲酸的制备一.实验目的1.学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法2.巩固机械搅拌器的使用3.进一步掌握萃取、洗涤、蒸馏、干燥和重结晶等基本操作4.学会低沸点溶剂的处理二.实验原理无α-H的醛在浓碱溶液作用下发生歧化反应,一分子醛被氧化成羧酸,另一分子醛则被还原成醇,此反应称坎尼扎罗反应。
本实验采用苯甲醛在浓氢氧化钠溶液中发生坎尼扎罗反应,制备苯甲醇和苯甲酸。
反应物加水溶解后,用乙醚加以萃取,乙醚层经洗涤、干燥、蒸馏,得到苯甲醇;水层经酸化得到苯甲酸。
反应式如下:CHO2+NaOH CH2OH+COONaCOONa+HCl COOH+NaCl苯甲醛如果长时间放置,会被空气氧化,因此存在以下的副反应:CHO+O2COOH三.实验准备1.主要试剂及仪器1)试剂苯甲醛10 mL (0.10 mol),氢氧化钠8g (0.2mol),浓盐酸,乙醚,饱和亚硫酸氢钠溶液,10%碳酸钠溶液,无水硫酸镁。
2)仪器100mL 圆底烧瓶,球形冷凝管,分液漏斗,直形冷凝管,蒸馏头,温度计套管,温度计(250℃),支管接引管,锥形瓶,空心塞,量筒,烧杯,布氏漏斗,吸滤瓶,表面皿,红外灯,机械搅拌器。
2.主要物料物理常数化合物分子量比重(d)熔点(℃)沸点(℃)折光率(n) 溶解度水乙醇乙醚苯甲醛105.12 1.046 -26 179.1 1.5456 0.3 溶溶苯甲醇108.13 1.0419 -15.3 205.3 1.5392 417∞∞苯甲酸122.12 1.2659 122 249 1.501 微溶溶溶四.实验装置及操作要点制备苯甲醇和苯甲酸采用回流搅拌装置,实验装置如图1所示。
乙醚沸点低,要注意安全。
蒸馏低沸点液体的装置如图2所示。
图1.制备苯甲醇和苯甲酸的反应装置图2.蒸乙醚的装置图【干燥操作要点】1.干燥剂不是越多越好2.干燥操作在干燥的带有塞子的锥形瓶中进行。
加入干燥剂后,加塞旋摇,放置一段时间,根据干燥情况补加。

苯甲醛的制备及其产物的分离10级药学院2班谢桐富学号28100204指导教师王志才摘要:苯甲醛在强碱下进行自身的氧化与还原反应,一分子被氧化为酸,另一分子被还原为醇。
根据产物的水溶性不同分离出苯甲醇和苯甲酸钾,酸化得到苯甲酸。
用乙醚将苯甲醇萃取出来,再蒸馏得苯甲醇并称量记录,后测折光率。
减压过滤得苯甲酸,烘干后称量记录并保存。
关键词:苯甲醛、苯甲醇、苯甲酸、蒸馏苯甲醛,为苯的氢被醛基取代后形成的有机化合物。
苯甲醛为最简单的,同时也是工业上最常为使用的芳醛。
在室温下其为无色液体,具有特殊的杏仁气味。
本品对眼睛、呼吸道粘膜有一定的刺激作用。
由于其挥发性低,其刺激作用不足以引致严重危害。
苯甲醇为无色透明液体,微有芳香气味,味苦。
能与乙醚、乙醇、氯仿相混溶,微溶于水。
该品具有刺激性,吸入或口服有害。
沸点为204.7/101.325kpa。
苯甲酸为无色、无味片状晶体。
熔点122.13℃,沸点249℃,相对密度1.2659(15/4℃)。
在100℃时迅速升华,它的蒸气有很强的刺激性,吸入后易引起咳嗽。
微溶于水,易溶于乙醇、乙醚等有机溶剂。
苯甲酸是弱酸,比脂肪酸强。
它们的化学性质相似,都能形成盐、酯、酰卤、酰胺、酸酐等,都不易被氧化。
苯甲酸的苯环上可发生亲电取代反应,主要得到间位取代产。
1.实验部分1.1主要试剂和材料苯甲醛、氢氧化钾、乙醚、10%碳酸钠溶液、浓盐酸250ml 分液漏斗、蒸馏装置、减压过滤装置、折光仪、加热浴(北京市永明医疗仪器厂)。
1.2化学反应在250ml锥形瓶内加入18g氢氧化钾和18ml水配制成碱液并冷却至室温。
然后加入苯甲醛20ml,盖上保鲜膜,用力振摇使原料混合充分,呈白色糊状物,放置一周进行反应。
1.3苯甲醇的分离纯化观察得反应后锥形瓶的混合物为白色块状固体。
向混合物中加入足量的水,边加边振摇使苯甲酸盐全部溶解,溶液为淡黄色。
对该溶液分别用20ml、10ml、10ml乙醚进行萃取。


苯甲醇和苯甲酸的制备实验报告实验目的:本实验旨在通过碳酸钠与苯甲醛的反应制备苯甲醇,并通过苯甲醇的氧化反应制备苯甲酸,探究有机化学中的醛与酮的还原反应以及醇的氧化反应。
实验原理:苯甲醇的制备是通过碳酸钠与苯甲醛的反应实现的。
反应方程式如下:2C6H5CHO + Na2CO3 → 2C6H5CH2OH + CO2 + Na2CO3苯甲醇的氧化反应可以使用氧气气体或者过氧化氢作为氧化剂,生成苯甲酸。
反应方程式如下:C6H5CH2OH + [O] → C6H5COOH + H2O实验步骤:1. 准备实验设备和试剂:称取适量苯甲醛、碳酸钠、过氧化氢等试剂,并准备好反应容器。
2. 反应制备苯甲醇:将苯甲醛和碳酸钠按摩尔比例加入反应容器中,加热反应,并收集产物。
3. 反应制备苯甲酸:将苯甲醇与过氧化氢按摩尔比例加入反应容器中,加热反应,并收集产物。
4. 对产物进行分析:使用红外光谱仪对苯甲醇和苯甲酸进行表征,观察其红外光谱图谱。
实验结果与讨论:通过实验,我们成功制备了苯甲醇和苯甲酸。
在实验过程中,我们发现苯甲醇的制备反应较为顺利,产物收率较高。
而苯甲酸的制备则需要较高的温度和较长的反应时间,反应条件较为严苛。
通过红外光谱仪的分析,我们观察到苯甲醇的红外光谱图谱中出现了-OH官能团的吸收峰,进一步证实了苯甲醇的生成。
而苯甲酸的红外光谱图谱中出现了-COOH官能团的吸收峰,进一步证实了苯甲酸的生成。
实验中,我们还注意到苯甲酸的制备反应需要控制反应条件,避免过度氧化产生其他副产物。
同时,苯甲酸的制备反应需要一定的反应时间,以保证反应的充分进行。
实验结论:本实验通过碳酸钠与苯甲醛的反应制备了苯甲醇,并通过苯甲醇的氧化反应制备了苯甲酸。
实验结果表明,苯甲醇和苯甲酸的制备反应均成功进行,产物的纯度较高。
通过本实验,我们进一步了解了有机化学中醛与酮的还原反应以及醇的氧化反应的原理和应用。
这些反应在有机合成中具有重要的意义,为我们深入理解有机化学提供了实验基础。
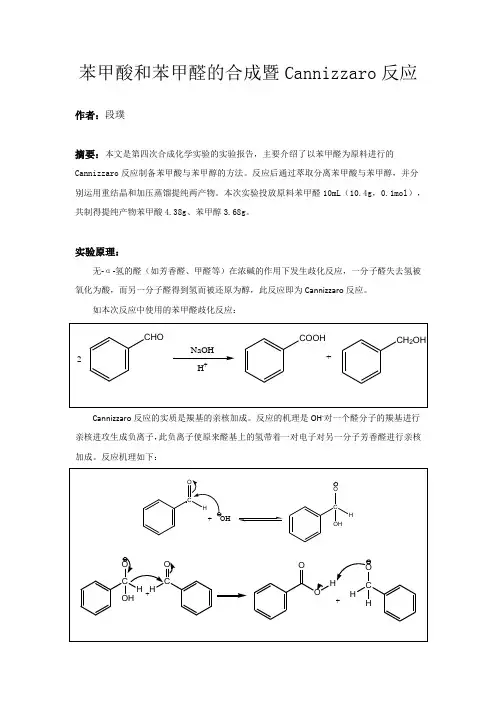
苯甲酸和苯甲醛的合成暨Cannizzaro反应作者:段璞摘要:本文是第四次合成化学实验的实验报告,主要介绍了以苯甲醛为原料进行的Cannizzaro反应制备苯甲酸与苯甲醇的方法。
反应后通过萃取分离苯甲酸与苯甲醇,并分别运用重结晶和加压蒸馏提纯两产物。
本次实验投放原料苯甲醛10mL(10.4g,0.1mol),共制得提纯产物苯甲酸4.38g、苯甲醇3.68g。
实验原理:无-α-氢的醛(如芳香醛、甲醛等)在浓碱的作用下发生歧化反应,一分子醛失去氢被氧化为酸,而另一分子醛得到氢而被还原为醇,此反应即为Cannizzaro反应。
如本次反应中使用的苯甲醛歧化反应:Cannizzaro反应的实质是羰基的亲核加成。
反应的机理是OH-对一个醛分子的羰基进行亲核进攻生成负离子,此负离子使原来醛基上的氢带着一对电子对另一分子芳香醛进行亲核加成。
反应机理如下:由于第一步反应为可逆反应,且平衡偏向反应物一侧,所以Cannizzaro反应需要非常高的碱度,常用过量一倍以上的浓度为50%的强碱。
本次反应中使用了10g氢氧化钠(0.25mol,即2.5当量)。
利用产物苯甲酸与苯甲醇在碱性溶液与乙醚中溶解度的不同(苯甲酸以苯甲酸盐的形式存在于碱液,而苯甲醇主要存在于乙醚)达到分离两种产物的效果。
接着利用未反应完全的苯甲醛易与亚硫酸氢钠反应生成α-羟基苄磺酸钠,从而达到与苯甲醇分离的效果。
反应机理如下:实验操作及现象:1.于150mL锥形瓶中称取10g氢氧化钠(0.25mol)加入10mL水。
溶解并冷却至室温后,边振摇边加入10mL苯甲醛(10.4g,0.1mol)。
加完后用称量纸封口,剧烈振摇,充分混合,数分钟后,原料凝结成固体,呈现微黄色,后逐渐变为淡粉色。
于避光处放置两礼拜。
2.取适量水溶解,转移至分液漏斗,乙醚萃取3次,每次25mL。
初次醚层呈红褐色,水层微浑浊,萃取若干次后基本澄清。
合并醚层,倒入分液漏斗中,先用10mL饱和亚硫酸氢钠洗涤;再用20mL碳酸氢钠洗涤,放出少量气泡;最后用10mL水洗。

Cannizzaro反应——苯甲酸和苯甲醇的制备Cannizzaro ReactionSynthesis of Benzoic acid and Benzyl alcohol11307110279 高涵本次实验是利用苯甲醛作为反应物,以氢氧化钠为催化剂,通过歧化反应——Cannizzaro反应,制备苯甲酸(Benzoic acid)和苯甲醇(Benzyl alcohol)。
苯甲酸和苯甲醇通过分液操作分离;通过分液萃取、蒸馏及减压蒸馏提纯得到产物苯甲醇,为无色液体,净重3.53g,产率65.3%;通过重结晶提纯得到产物苯甲酸结晶,为无色针状晶体,净重5.16g,产率84.5%。
In this experiment, Benzaldehyde was taken as the reactant, Sodium hydroxide solution was used as the catalytic centre, Benzoic acid and Benzyl alcohol can be made based on Cannizzaro reaction. Benzoic acid and Benzyl alcohol were separated by separating funnel; Benzyl alcohol was purified by extraction, distillation and vacuum distillation. The product was a colorless, transparent liquid, net weight was 3.53g, yield was 65.3%; Benzoic acid was purified by recrystallization. The product was a colorless, flake crystal, net weight was 5.16g, yield was 84.5%;关键词:Cannizzaro 反应;苯甲酸;苯甲醛;减压蒸馏;重结晶;Cannizzaro reaction; Benzoic acid; Benzyl alcohol; Vaccum distillation; Recrystallization一、实验简介1. Cannizzaro反应无α-氢的醛在浓碱的作用下发生歧化反应,一分子醛失去氢被氧化为酸,而另一分子醛得到氢被还原为醇。

苯甲醇和苯甲酸的制备实验一、实验原理利用坎尼扎罗(Cannizzaro)反应由苯甲醛制备苯甲醇和苯甲酸。
坎尼扎罗反应是指无α-活泼氢的醛类在浓的强NaOH或KOH水或醇溶液作用下发生的歧化反应。
此反应的特征是醛自身同时发生氧化及还原作用,一分子醛被氧化成羧酸(在碱性溶液中成为羧酸酸盐),另一分子醛则被还原成醇。
主反应:机理:醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
二、反应试剂、产物、副产物的物理常数三、药品四、实验流程图五、实验装置图图1 磁力搅拌器图2 分液漏斗的振摇方法图3 分液漏斗图4 抽滤装置六、实验内容往锥形瓶中加 12.0g(0.21mol)氢氧化钾和12ml水,放在磁力搅拌器上搅拌,使氢氧化钾溶解并冷至室温。
在搅拌的同时分批加入新蒸过的苯甲醛,每次加入2-3ml,共加入13.5ml(约14g,0.13mol)。
加后应塞紧瓶口,若锥形瓶内温度过高,需适时冷却。
继续搅拌60min,最后反应混合物变成白色蜡糊状。
(1)苯甲醇向反应瓶中加入大约45ml水,使反应混合物中的苯甲酸盐溶解,转移至分液漏斗中,用45ml 乙醚分三次萃取苯甲醇,合并乙醚萃取液。
保存水溶液留用。
依次用15ml25%亚硫酸氢钠溶液及8ml水洗涤乙醚溶液,用无水硫酸镁干燥。
水浴蒸去乙醚后,继续蒸馏,收集产品,沸程204-206℃,产率为75%。
纯苯甲醇有苦杏仁味的无色透明液体。
沸点bp=205.4℃,折光率=1.5463。
(2)苯甲酸在不断搅拌下,往留下的水溶液中加入浓盐酸酸化,加入的酸量以能使刚果红试纸由红变蓝为宜。
充分冷却抽滤,得粗产物。
粗产物用水重结晶后晾干,产率可达80%。
纯苯甲酸为白色片状或针状晶体。
熔点mp=122.4℃。
(一)制备阶段1.准备锥形瓶:一只100ml锥形瓶。
2.加药品与歧化反应:向锥形瓶中加 12.0g氢氧化钾和12ml水,向瓶内放入一只搅拌子,然后将锥形瓶放在磁力搅拌器上搅拌,使氢氧化钾溶解并冷至室温。

苯甲酸和苯甲醇的制备实验报告苯甲醇和苯甲酸的制备学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:实验八:苯甲醇和苯甲酸的制备一、实验目的1.学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法。
3.进一步掌握萃取、洗涤、蒸馏和干燥等基本操作。
二、产品介绍苯甲醇是最简单的芳香醇之一,可看作是苯基取代的甲醇。
在自然界中多数以酯的形式存在于香精油中。
中文别名苄醇;。
苄醇是极有用的定香剂,用于配制香皂;日用化妆香精。
但苄醇能缓慢地自然氧化,一部分生成苯甲醛和苄醚,使市售产品常带有杏仁香味,故不宜久贮。
苄醇在工业化学品生产中用途广泛;医药;合成树脂溶剂;可用作尼龙丝;纤维及塑料薄膜的干燥剂,染料;纤维素酯;酪蛋白的溶剂,制取苄基酯或醚的中间体。
同时,广泛用于制笔(圆珠笔油);油漆溶剂等。
苯甲酸为具有苯或甲醛的气味的鳞片状或针状结晶,具有苯或甲醛的臭味。
在100℃时迅速升华,它的蒸气有很强的刺激性,吸入后易引起咳嗽。
微溶于水,易溶于乙醇、乙醚等有机溶剂。
苯甲酸是弱酸,比脂肪酸强。
它们的化学性质相似,都能形成盐、酯、酰卤、酰胺、酸酐等,都不易被氧化。
苯甲酸的苯环上可发生亲电取代反应,主要得到间位取代产。
三:反应式CHO2+ NaOHCH2OH+COONaCOONaCOOH+ HCl+ NaClCOOH主反应:CHO副反应:+O2学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:四:主要试剂及产品的物理常数五:试剂与仪器1、主要仪器:125mL 圆底烧瓶、分液漏斗,蒸馏装置、烧杯等。
2、主要试剂规格及用量:学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:六:实验装置图图一:分液漏斗图二:抽滤装置图三:蒸馏装置七:实验步骤及现象学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:学生姓名:小田田学号:专业班级:实验类型:□验证■综合□设计□创新实验日期:2013年4月24日实验地点:同组学生姓名:指导教师:实验成绩:八:实验结果及分析得到苯甲醇4.6mL,处在参考值4.5—6g之间,说明实验操作基本正确;苯甲酸9.4g,高于参考值6g,说明在实验过程中还存在失误。

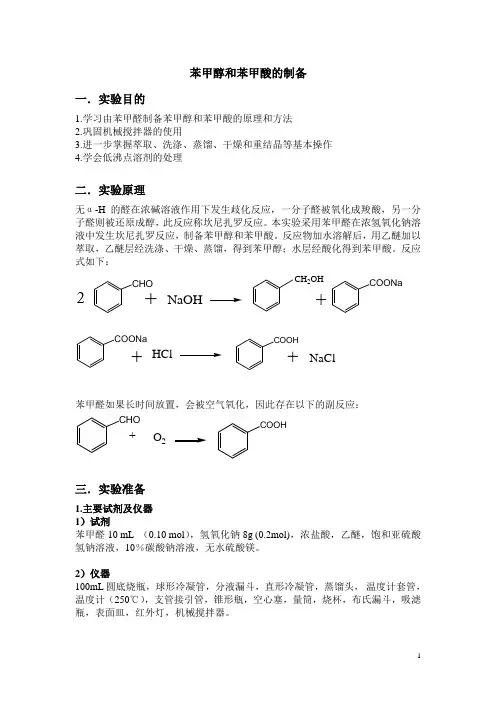
苯甲醇和苯甲酸的制备一.实验目的1.学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法2.巩固机械搅拌器的使用3.进一步掌握萃取、洗涤、蒸馏、干燥和重结晶等基本操作4.学会低沸点溶剂的处理二.实验原理无α-H的醛在浓碱溶液作用下发生歧化反应,一分子醛被氧化成羧酸,另一分子醛则被还原成醇,此反应称坎尼扎罗反应。
本实验采用苯甲醛在浓氢氧化钠溶液中发生坎尼扎罗反应,制备苯甲醇和苯甲酸。
反应物加水溶解后,用乙醚加以萃取,乙醚层经洗涤、干燥、蒸馏,得到苯甲醇;水层经酸化得到苯甲酸。
反应式如下:CHO2+NaOH CH2OH+COONaCOONa+HCl COOH+NaCl苯甲醛如果长时间放置,会被空气氧化,因此存在以下的副反应:CHO+O2COOH三.实验准备1.主要试剂及仪器1)试剂苯甲醛 10 mL (0.10 mol),氢氧化钠 8g (0.2mol),浓盐酸,乙醚,饱和亚硫酸氢钠溶液,10%碳酸钠溶液,无水硫酸镁。
2)仪器100mL 圆底烧瓶,球形冷凝管,分液漏斗,直形冷凝管,蒸馏头,温度计套管,温度计(250℃),支管接引管,锥形瓶,空心塞,量筒,烧杯,布氏漏斗,吸滤瓶,表面皿,红外灯,机械搅拌器。
2.主要物料物理常数化合物分子量比重(d)熔点(℃)沸点(℃)折光率(n) 溶解度水乙醇乙醚苯甲醛105.12 1.046 -26 179.1 1.5456 0.3 溶溶苯甲醇108.13 1.0419 -15.3 205.3 1.5392 417∞∞苯甲酸122.12 1.2659 122 249 1.501 微溶溶溶四.实验装置及操作要点制备苯甲醇和苯甲酸采用回流搅拌装置,实验装置如图1所示。
乙醚沸点低,要注意安全。
蒸馏低沸点液体的装置如图2所示。
图1.制备苯甲醇和苯甲酸的反应装置图2.蒸乙醚的装置图【干燥操作要点】1.干燥剂不是越多越好2.干燥操作在干燥的带有塞子的锥形瓶中进行。
加入干燥剂后,加塞旋摇,放置一段时间,根据干燥情况补加。
设计实验:苯甲醛制备苯甲酸一、实验原理苯甲醛可以通过氧化反应氧化成苯甲酸。
苯甲醛和苯甲酸的熔点差异大,可以通过降温结晶来分离出苯甲酸。
二、实验用品仪器:圆底烧瓶、恒压漏斗、蒸馏装置、回流装置、抽滤装置试剂:苯甲醛、30%过氧化氢溶液、无水碳酸钠、三、产物性质苯甲酸为具有苯或甲醛的气味的鳞片状或针状结晶,具有苯或甲醛的臭味。
熔点122.13℃,沸点249℃,相对密度1.2659(15/4℃)。
在100℃时迅速升华,它的蒸气有很强的刺激性,吸入后易引起咳嗽。
微溶于水,易溶于乙醇、乙醚等有机溶剂。
苯甲酸是弱酸,比脂肪酸强。
它们的化学性质相似,都能形成盐、酯、四、投料量和理论产率(一)投料量苯甲醛10.6克(0.1mol)30%过氧化氢溶液22ml(0.194mol)无水碳酸钠3.2克(0.003mol)(二)理论产率苯甲醛制备苯甲酸理论产率83.3%苯甲酸重结晶产率余额75%理论应得苯甲酸7.5克五、实验装置图六、实验步骤(一)、制备苯甲酸在50ml的圆底烧瓶中加入10.6克苯甲醛、3.2克无水碳酸钠,加入豆粒大小的硫酸锌,磁力搅拌下,用恒压漏斗从上方快速滴加30%过氧化氢溶液,回流1小时。
反应结束后,用浓盐酸调节pH为2,低温静止,冷水洗涤后,抽滤得固体苯甲酸。
(二)、苯甲酸的精制将所得固体苯甲酸溶解到100ml水中,加热至近沸,此时苯甲酸溶解在水中,分为两层,上层为浅黄色液体,下层为深褐色油状层。
通过倾倒法分离,再令上层溶液自然冷却结晶,约得7克。
下层通过降温也会结晶。
将下层结晶的苯甲酸再次倒入上层母液中。
从新加热,溶解,结晶。
约得0.5克七、实验设计总结关于实验方案的设计,参考了老师给出的建议。
并且根据自己现阶段学习到的知识,醛氧化得羧酸,比较各种方法的优缺点,考虑实验时间、产率、实验条件等。
采取了这样的设计方案。
通过在碱性条件下使用过氧化氢氧化苯甲酸。
苯甲醛制备苯甲酸,考虑能否在酸性条件下制备,但是实验操作相对复杂,而且使用的酸也并不熟悉。
苯甲醛的歧化反应实验报告实验五-苯甲醛歧化制备苯甲酸和甲醇及产物的分离纯化有机化学实验方案苯甲醛歧化制备苯甲酸和甲醇及产物的分离纯化一、目的要求1. 掌握歧化反应制备苯甲酸和苯甲醇的原理与方法;2. 熟练掌握萃取与蒸馏操作;二、基本原理1、无α-氢的醛类和浓的强碱溶液作用时,发生分子间的自氧化还原反应,一分子醛被还原成醇,另一分子醛被氧化成酸,此反应称为坎罗尼扎罗反应。
如:2、按上述反应式只能得到一半的醇。
如应用稍过量的甲醛水溶液与醛(1.3∶1mol)反应时,则可使所有的醛还原至醇,而甲醛则氧化成甲酸。
例如:三、主要仪器与药品仪器:250mL锥形瓶、分液漏斗、刚果红试纸、玻璃棒、烧杯药品:氢氧化钾18g、饱和亚硫酸氢钠溶液、10%碳酸钠溶液、无水硫酸镁、无水碳酸钾、浓盐酸苯甲醛21g、乙醚四、实验步骤1、在250mL锥形瓶中配制18g氢氧化钾和18mL水的溶液,冷至室温后,加入21g新蒸过的苯甲醛20mL。
用橡皮塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置过夜。
2、向反应混合物中逐渐加入足够量的水(约60mL),不断振摇使其中的苯甲酸盐全部溶解。
将溶液倒入分液漏斗,每次用20mL 乙醚萃取三次,合并乙醚萃取液,依次用5mL饱和亚硫酸氢钠溶液、10mL10%碳酸钠溶液及10mL水洗涤,最后用无水硫酸镁或无水碳酸钾干燥。
3、干燥后的乙醚溶液,先蒸去乙醚,再蒸馏苯甲醇,收集204~206℃的馏分,产量8~8.5g(产率74~79%)。
4、乙醚萃取过的水溶液,用浓盐酸酸化直至刚果红试纸变蓝,冰水冷却使苯甲酸完全析出,抽滤,用少量水洗涤,挤压去水分。
将制得的苯甲酸放在沸水浴上干燥。
若要得到纯产品,可用水重结晶提纯,取出并称量所得产品。
(纯粹苯甲酸为无色针状晶体,熔点为122.4℃。
纯粹苯甲醇的沸点为205.5℃。
)五、注意事项1、步骤4 中,要控制好浓盐酸的量,PH过高或过低都会影响产品的质量。
苯甲醛歧化制备苯甲酸和苯甲醇及产物的分离提纯检验091 34号 康永祥一、实验目的1.学习由苯甲醛制备苯甲醇和苯甲酸的原理和方法。
2.进一步熟悉机械搅拌器的使用。
3.进一步掌握萃取、洗涤、蒸馏、干燥和重结晶等基本操作。
4.全面复习巩固有机化学实验基本操作技能。
二、实验原理无α-H 的醛在浓碱溶液作用下发生歧化反应,一分子醛被氧化成羧酸,另一分子醛则被还原成醇,此反应称坎尼扎罗反应。
本实验采用苯甲醛在浓氢氧化钠溶液中发生坎尼扎罗反应,制备苯甲醇和苯甲酸,反应式如下: CHO+ NaOH 2CH 2OH +COONaCOONa+ HCl COOH + NaCl三、实验药品、仪器、装置试剂:苯甲醛 10 mL (0.10 mol ),氢氧化钠 8g (0.2mol),浓盐 酸,乙醚,饱和亚硫酸氢钠溶液,10%碳酸钠溶液,无水硫酸镁。
仪器:100mL 圆底烧瓶,球形冷凝管,分液漏斗,直形冷凝管,蒸馏头, 温度计套管,温度计(250℃),支管接引管,锥形瓶,空心塞,量筒,烧杯,布氏漏斗,吸滤瓶,表面皿,红外灯,机械搅拌器。
四、实验内容、实验步骤和操作方法1.在250 mL 三口烧瓶上安装机械搅拌及回流冷凝管,另一口塞住。
2.加入8 g 氢氧化钠和30 mL 水,搅拌溶解。
稍冷,加入10 mL 新蒸过的苯甲醛。
3.开启搅拌器,调整转速,使搅拌平稳进行。
加热回流约40 min。
4.停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。
5.反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10 mL。
水层保留待用。
6.合并三次乙醚萃取液,依次用5 mL饱和亚硫酸氢钠洗涤,10mL10%碳酸钠溶液洗涤,10 mL水洗涤。
7.分出醚层,倒入干燥的锥形瓶,加无水硫酸镁干燥,注意锥形瓶上要加塞。
8.安装好低沸点液体的蒸馏装置,缓缓加热蒸出乙醚(回收)。
9.升高温度蒸馏,当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分,即为苯甲醇,量体积,回收,计算产率。
苯甲醇和苯甲酸的制备185.本实验根据什么原理来分离纯化苯甲醇和苯甲酸这两种产物的?答:根据苯甲酸钠、苯甲醇在水中和在乙醚中的溶解度不同。
苯甲醇在乙醚中易溶,苯甲酸钠易溶于水。
用乙醚可在反应混合物中萃取苯甲醇,再经蒸馏除去萃取剂乙醚,便可得到产物苯甲醇;将萃取后的水溶液酸化就得到苯甲酸固体,经抽滤,就可以得到另一产物苯甲酸。
186.醚层用饱和NaHSO3及NaCO3溶液洗涤,是洗去什么杂质?答:醚层中加饱和NaHSO3溶液是为了除去醚层中未反应完的苯甲醛。
用NaCO3溶液是洗去醚层中极少量的苯甲酸。
187.本实验中所用的苯甲醛为何应重蒸馏?答:苯甲醛很容易被空气中的氧气氧化成苯甲酸。
为除去苯甲酸,所以在实验前重新蒸馏苯甲醛。
实验十四苯甲醇和苯甲酸的制备一.实验目的1.理解苯甲醛由Cannizzaro歧化反应制备苯甲醇和苯甲酸的原理和方2.通过萃取分离粗产物熟练掌握,洗涤,蒸馏及重结晶等纯化技术3.掌握低沸点,易燃有机溶剂的蒸馏操作。
4.掌握有机酸的分离方法。
二.实验原理芳醛和其他无α-氢原子的醛在浓的强碱溶液作用下,发生Cannizzaro反应,一分子醛被氧化成羧酸(在碱性溶液中成为羧酸盐),另一分子醛则被还原成醇。
本实验是应用Cannizzaro反应,以苯甲醛为反应物。
在浓氢氧化钠作用下生成苯甲醇和苯甲酸。
反应式:三.物理常数四.实验装置五.试剂与器材试剂:苯甲醛、氢氧化钠、浓盐酸、乙醚、饱和亚硫酸氢钠、10%碳酸钠、无水硫酸镁。
器材:锥形瓶、圆底烧瓶、直形冷凝管、接引管、接受器、蒸馏头、温度计、分液漏斗、烧杯、短颈漏斗、玻璃棒、布氏漏斗、吸滤瓶。
六.实验步骤七.产率计算苯甲醇:理论产量:实际产量:理论折射率:产率:苯甲酸:理论产量(m理论):一半粗产物的质量(m粗):重结晶质量(m重结晶):产率:八.产物纯化九.实验讨论1. 原料苯甲醛易被空气氧化,所以保存时间较长的苯甲醛,使用前应重新蒸馏;否则苯甲醛已氧化成苯甲酸而使苯甲醇的产量相对减少。
有机化学实验方案
1 苯甲醛歧化制备苯甲酸和甲醇及产物的分离纯化
一、目的要求
1. 掌握歧化反应制备苯甲酸和苯甲醇的原理与方法;
2. 熟练掌握萃取与蒸馏操作;
二、基本原理
1、无α-氢的醛类和浓的强碱溶液作用时,发生分子间的自氧化还原反应,一分子醛被还
原成醇,另一分子醛被氧化成酸,此反应称为坎罗尼扎罗反应。
如:
2、按上述反应式只能得到一半的醇。
如应用稍过量的甲醛水溶液与醛(1.3∶1mol )反应
时,则可使所有的醛还原至醇,而甲醛则氧化成甲酸。
例如:
三、主要仪器与药品
仪器:250mL 锥形瓶、分液漏斗、刚果红试纸、玻璃棒、烧杯
药品:氢氧化钾18g 、饱和亚硫酸氢钠溶液、10%碳酸钠溶液、无水硫酸镁、无水碳酸钾、浓盐酸苯甲醛21g 、乙醚
四、实验步骤
1、在250mL 锥形瓶中配制18g 氢氧化钾和18mL 水的溶液,冷至室温后,加入21g 新蒸过的苯甲醛20mL 。
用橡皮塞塞紧瓶口,用力振摇,使反应物充分混合,最后成为白色糊状物,放置过夜。
2、向反应混合物中逐渐加入足够量的水(约60mL ),不断振摇使其中的苯甲酸盐全部溶解。
将溶液倒入分液漏斗,每次用20mL 乙醚萃取三次,合并乙醚萃取液,依次用5mL 饱和亚硫酸氢钠溶液、10mL10%碳酸钠溶液及10mL 水洗涤,最后用无水硫酸镁或无水碳酸钾干燥。
3、干燥后的乙醚溶液,先蒸去乙醚,再蒸馏苯甲醇,收集204~206℃的馏分,产量8~8.5g
(产率74~79%)。
4、乙醚萃取过的水溶液,用浓盐酸酸化直至刚果红试纸变蓝,冰水冷却使苯甲酸完全析
出,抽滤,用少量水洗涤,挤压去水分。
将制得的苯甲酸放在沸水浴上干燥。
若要得到纯产品,可用水重结晶提纯,取出并称量所得产品。
(纯粹苯甲酸为无色针状晶体,熔点为122.4℃。
纯粹苯甲醇的沸点为205.5℃。
)
五、注意事项
1、 步骤 4 中,要控制好浓盐酸的量,PH 过高或过低都会影响产品的质量。
2、 在最后一步萃取中,要严格控制好温度,这样才能得到更纯的产
六、数据处理
产品质量: 理论质量: 产率:
七、思考问答
1、本实验中两种产物是根据什么原理分离提纯的?用饱和的亚硫酸氢钠及10%碳酸钠
溶液洗涤的目的何在?
2、乙醚萃取后的水溶液,用浓盐酸酸化到中性是否最适当?为什么?不用试纸或试剂
检验,怎样知道酸化已经恰当?。