第九章化学键与分子结构
- 格式:ppt
- 大小:2.11 MB
- 文档页数:83

化学键与分子结构化学键是原子间的一种相互作用力,它使原子形成化学结合并形成分子。
分子结构是描述分子中原子之间连接关系的方式。
化学键和分子结构是化学研究中非常重要的概念,对于理解物质的性质和化学反应具有重要意义。
本文将介绍不同类型的化学键和分子结构的基本原理。
一、共价键共价键是最常见的化学键类型之一。
在共价键中,原子通过共享电子来实现化学结合。
共价键的形成源于原子的电子云之间的相互作用。
1. 单共价键单共价键是最简单的共价键形式。
它是一个电子对在两个原子之间的共享。
例如,氢气(H2)中的两个氢原子通过共享一个电子对形成单共价键。
在化学方程式中,这种键可以用一个连线“-”来表示。
2. 双共价键和三共价键双共价键和三共价键是由于电子双共享和三共享而形成的。
以氧气(O2)为例,两个氧原子彼此共享两对电子形成双共价键。
类似地,氮气(N2)中两个氮原子通过共享三对电子形成三共价键。
二、离子键离子键是由正负电荷之间的相互吸引力形成的化学键。
在离子键中,电子从一个原子转移到另一个原子,形成带电离子。
1. 阳离子和阴离子在离子键中,其中一个原子失去电子变成带正电的阳离子,另一个原子获得电子变成带负电的阴离子。
这种电子转移使两个原子之间形成强烈的吸引力,形成离子键。
2. 离子晶体离子键的典型例子是盐(NaCl)晶体。
在盐晶体中,钠离子和氯离子通过离子键紧密地结合在一起。
由于离子键的强力,盐晶体具有高熔点和良好的导电性。
三、金属键金属键是金属元素中特有的一种化学键。
金属键是由金属中自由移动的电子形成的。
1. 电子海模型金属键的一个重要概念是“电子海模型”。
在这个模型中,金属中的原子释放出部分外层电子形成电子海,而原子核则形成离子核。
这些自由移动的电子使金属中的原子之间形成强大的连接。
2. 金属的特性金属键的存在赋予金属独特的性质。
金属具有良好的导电性和热导性,以及可塑性和延展性。
这些性质是由金属键中的自由电子能够自由移动而产生的。

化学键与分子结构在我们的日常生活中,从我们呼吸的空气到我们所吃的食物,从我们所穿的衣物到我们使用的各种材料,无一不与化学相关。
而在化学的世界中,化学键与分子结构则是理解物质性质和化学反应的关键所在。
让我们先来聊聊什么是化学键。
简单来说,化学键就是将原子结合在一起形成分子的“强力胶水”。
想象一下,原子就像是一个个独立的小珠子,而化学键就是把这些小珠子串起来的线。
不同类型的化学键有着不同的强度和性质,从而决定了所形成分子的特性。
最常见的化学键类型有离子键、共价键和金属键。
离子键通常在金属元素和非金属元素之间形成。
比如说,氯化钠(NaCl)就是一个典型的例子。
钠原子失去一个电子变成带正电的钠离子,氯原子得到一个电子变成带负电的氯离子,这两种带相反电荷的离子通过静电引力相互吸引,从而形成了离子键。
这种键的强度较大,使得离子化合物在常温下通常是固体,具有较高的熔点和沸点。
共价键则是原子之间通过共用电子对形成的化学键。
例如氢气(H₂),两个氢原子各自拿出一个电子形成共用电子对,从而把两个氢原子紧紧地“绑”在一起。
共价键又可以分为极性共价键和非极性共价键。
如果两个原子对共用电子对的吸引能力相同,比如氢气中的氢原子,那么形成的就是非极性共价键;而如果两个原子对共用电子对的吸引能力不同,就像氯化氢(HCl)中氢原子和氯原子,形成的就是极性共价键。
金属键则存在于金属单质中。
金属原子失去部分或全部外层电子,形成“电子气”,这些自由电子在整个金属晶体中自由移动,将金属原子或离子“胶合”在一起。
这也解释了为什么金属具有良好的导电性和导热性。
了解了化学键的类型,接下来我们看看分子结构。
分子结构指的是分子中原子的排列方式和空间构型。
分子的结构对于其物理和化学性质有着至关重要的影响。
比如甲烷(CH₄),它的分子结构是正四面体。
碳原子位于正四面体的中心,四个氢原子分别位于正四面体的四个顶点。
这种结构使得甲烷分子具有相对稳定的性质。


化学键与分子结构化学键是指由原子之间的电子相互作用形成的强力,用于连接原子并形成分子的结构。
它决定了分子的性质、稳定性和反应性。
本文将介绍不同类型的化学键以及它们对分子结构的影响。
一、离子键离子键是指由正负电荷之间的电吸引力形成的,常见于金属和非金属之间的化合物。
金属原子会失去电子形成阳离子,而非金属原子会接受这些电子形成阴离子。
两种离子之间的电吸引力就形成了离子键。
离子键通常是非常强大的,使得离子化合物具有高熔点和高溶解度。
二、共价键共价键是由原子共享一个或多个电子而形成的。
它是分子中最常见的键。
共价键可以分为极性共价键和非极性共价键。
1. 极性共价键极性共价键是指电子不均匀地被共享,导致形成不均匀的电荷分布。
极性共价键通常由非金属原子之间形成,其中一个原子的电负性较高,吸引了共享电子对。
由于电荷分布的不均匀,极性共价键会导致分子局部带电。
2. 非极性共价键在非极性共价键中,共享电子对是均匀分布的,没有电荷分离。
这种键形成于相同或相似电负性的原子之间,如氢气分子(H2)或氧气分子(O2)。
非极性共价键通常较弱。
三、金属键金属键是金属原子之间形成的。
在金属晶体中,金属原子通过共享它们的外层电子来形成金属键。
这些电子在整个晶体中自由移动,形成所谓的电子海。
金属键是金属具有高导电性和高热传导性的关键原因。
四、氢键氢键是指由部分带正电的氢原子与带有负电荷的氮、氧或氟原子之间的作用力。
氢键在生物分子如DNA、蛋白质和多肽中起着重要作用。
氢键虽然较弱,但对分子的稳定性和特性产生显著影响。
总结起来,化学键的类型和分子结构密切相关。
离子键在金属和非金属之间形成,共价键有极性和非极性两种形式,金属键形成于金属晶体中,而氢键具有特殊的电荷吸引力。
通过理解不同类型的化学键,我们可以更好地理解分子的性质和行为,促进对化学和生物学等领域的深入研究。
阅读本文,希望读者对化学键与分子结构有更清晰的认识,进一步了解分子间的相互作用和性质变化机制,为科学研究提供更为坚实的基础。
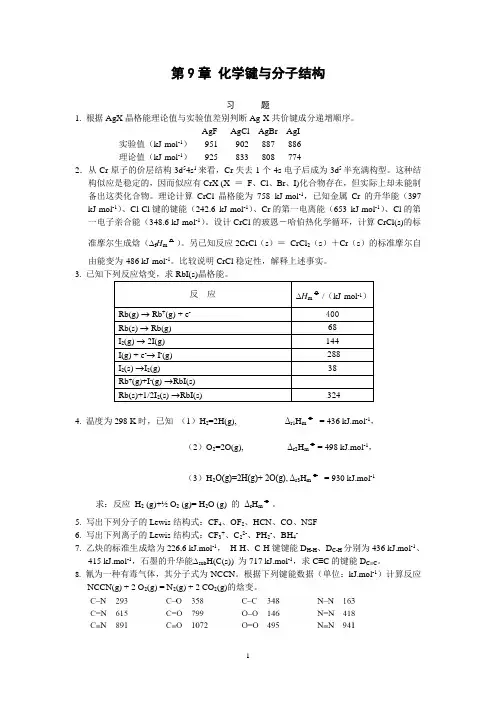
第9章化学键与分子结构习题1. 根据AgX晶格能理论值与实验值差别判断Ag-X共价键成分递增顺序。
AgF AgCl AgBr AgI实验值(kJ·mol-1)951 902 887 886理论值(kJ·mol-1)925 833 808 7742.从Cr原子的价层结构3d54s1来看,Cr失去1个4s电子后成为3d5半充满构型。
这种结构似应是稳定的,因而似应有CrX (X =F、Cl、Br、I)化合物存在,但实际上却未能制备出这类化合物。
理论计算CrCl晶格能为758 kJ·mol-1,已知金属Cr的升华能(397 kJ·mol-1)、Cl-Cl键的键能(242.6 kJ·mol-1)、Cr的第一电离能(653 kJ·mol-1)、Cl的第一电子亲合能(348.6 kJ·mol-1)。
设计CrCl的玻恩-哈伯热化学循环,计算CrCl(s)的标准摩尔生成焓(∆f H m o)。
另已知反应2CrCl(s)=CrCl2(s)+Cr(s)的标准摩尔自由能变为-486 kJ·mol-1。
比较说明CrCl稳定性,解释上述事实。
3.4. 温度为298 K时,已知(1)H2=2H(g), Δr1H m o= 436 kJ.mol-1,(2)O2=2O(g), Δr2H m o= 498 kJ.mol-1,(3)H2O(g)=2H(g)+ 2O(g), Δr3H m o= 930 kJ.mol-1 求:反应H2 (g)+½ O2 (g)= H2O (g) 的Δr H m o。
5. 写出下列分子的Lewis结构式:CF4、OF2、HCN、CO、NSF6. 写出下列离子的Lewis结构式:CF3+、C22-、PH2-、BH4-7. 乙炔的标准生成焓为226.6 kJ.mol-1,H-H、C-H键键能D H-H、D C-H分别为436 kJ.mol-1、415 kJ.mol-1,石墨的升华能∆sub H(C(s)) 为717 kJ.mol-1,求C≡C的键能D C≡C。

第九章双原子分子结构与化学键理论第九章双原子分子结构与化学键理论(下)主要讲述了双原子分子的能量和电子结构,包括分子轨道理论和离化能。
在双原子分子中,原子间的相互作用将导致分子的结合和分裂,这种作用被称为化学键。
分子轨道理论被用来描述能量和电子结构,而离化能则是用来度量化学键的强度。
分子轨道理论是基于量子力学的。
在这个理论中,分子中的原子轨道将组合成分子轨道,这些分子轨道可以是成键轨道或反键轨道。
成键轨道具有较低的能量,而反键轨道具有较高的能量。
当原子轨道重叠时,将形成成键电子密度,从而使分子稳定。
分子轨道的数量与原子轨道的数量相等,分子轨道可以用波函数来描述,这些波函数可以用来计算分子的性质。
离化能是指将一个电子从一个原子中移动到另一个原子中所需的能量。
离化能越大,说明化学键越强。
离化能的大小取决于分子的电子结构和分子大小。
较小的分子通常具有较大的离化能,因为它们的电子云更接近核心,更难离开。
在分子轨道理论中,键的强度可以通过排斥能来衡量。
排斥能是指电子间的相互斥力,它越大,表示键越强。
排斥能的大小取决于成键和反键电子的数量和能量。
本章还介绍了氢分子离子(H2+)和氢分子(H2)的结构和能量。
在氢分子离子中,一个原子损失了一个电子,形成一个正离子和一个负离子。
在氢分子中,两个氢原子共用一个电子,形成化学键。
此外,本章还包括分子的振动和旋转以及分子光谱学。
分子的振动是指分子中原子之间相对于它们的平衡位置的周期性运动。
分子的旋转是指分子以其轴心为中心的旋转运动。
分子光谱学是研究分子吸收和发射光的过程。
总的来说,本章通过双原子分子的能量和电子结构、分子轨道理论和离化能的介绍,深入讲述了双原子分子的结构和化学键的理论基础。
并且讨论了分子的振动、旋转和分子光谱学,为后续的分子结构和化学键理论的学习打下了基础。



化学化学键与分子结构化学键与分子结构化学键是化学反应发生的基础,它决定了分子的结构及其性质。
本文将围绕化学键和分子结构展开讨论,以加深对化学键与分子结构的理解。
一、离子键离子键是由正离子和负离子之间的电荷相互作用形成的键。
正离子失去了一个或多个电子,而负离子获得了一个或多个电子。
这种相互作用力使得离子彼此紧密结合。
典型的例子是氯化钠(NaCl),钠离子和氯离子通过离子键结合在一起。
离子键通常具有高熔点和良好的导电性。
二、共价键共价键是两个或更多原子间由电子共享形成的键。
共价键的形成使得原子围绕着共享电子形成稳定的分子。
单个共价键由一个电子对形成,而双键由两个电子对形成。
共价键的强度取决于电子对在共享中的有效吸引力和原子核的排斥力。
水分子(H2O)是一个典型的例子,其中氧原子和两个氢原子通过共价键结合在一起。
三、金属键金属键是在金属元素之间形成的特殊化学键。
金属中的原子失去了自己的外层电子并形成正离子,这些正离子在电子“海洋”中运动。
金属键由正离子和自由电子之间的吸引力形成,使得金属具有高熔点、良好的导电性和塑性。
例如,钠的晶体结构由钠离子和自由电子形成。
四、杂化轨道与分子形状杂化轨道是由单个原子轨道混合而成的新轨道。
这种混合可以解释分子的形状。
通过杂化,原子轨道的朝向和能量可以改变,从而适应共价键的形成。
sp轨道是一种常见的杂化形式,其中s轨道和p轨道混合形成。
sp3杂化形成四面体形状的分子,如甲烷(CH4),而sp2杂化形成三角形平面形状的分子,如乙烯(C2H4)。
五、共振结构共振结构是指分子中原子位置的不同方式的表示。
共振结构通过解释分子的稳定性和化学反应提供了有价值的信息。
共振结构从而使电子分布更加均匀。
苯分子(C6H6)是一个经典的例子,它可以用两种不同的共振结构式表示。
六、分子几何结构对性质的影响分子的几何结构直接影响其化学性质。
例如,线性分子通常具有较小的极性,而非线性分子则具有较大的极性。
