液体饱和蒸汽压的测定以及氨基甲酸铵分解反应平衡常数的测定
- 格式:pdf
- 大小:824.14 KB
- 文档页数:11


物化实验思考题实验一液体饱和蒸气压的测定1.试分析引起本实验误差的因素有哪些?答:①判断液面是否相平的标准;②液面相平时压力和温度的读数会有误差。
2.为什么AB弯管中的空气要排干净?怎样操作?答:AB弯管空间内的压力包括两部分:一是待测液的蒸气压;另一部分是空气的压力。
测定时,必须将其中的空气排除后,才能保证B 管液面上的压力为液体的蒸气压,检漏之后要关闭阀1,防止外界空气进入缓冲气体罐内。
3.试说明压力计中所读数值是否为纯液体的饱和蒸气压?答:不是,纯液体的饱和蒸气压等于外界大气压加上所测得的压差值。
4.为什么减压完成后必须使体系和真空泵与大气相通才能关闭真空泵?答:真空泵在关闭之前,因系统内压力低,先通大气,以防油泵中的油倒流使真空泵损坏。
实验二氨基甲酸铵分解反应平衡常数的测定1.该实验的实验目的是什么呢?答:①掌握低真空操作技术;②掌握静态法测定平衡压力的原理和方法;③计算氨基甲酸铵分解反应的标准平衡常数及其有关的热力学函数。
2.氨基甲酸铵分解反应平衡常数与哪些因素有关呢?答:温度。
3.该实验需要获得哪些实验数据呢?答:不同温度下的分解压。
4.该实验是如何测定氨基甲酸铵分解反应平衡常数的?答:测定出不同温度下的分解压之后,利用公式求出平衡常数。
5.该实验成功的关键是什么呢?为了获得准确的实验结果,实验中应该注意什么呢?答:打开放空阀时一定要缓慢进行,小心操作。
若放空气速度太快或放气量太多,易使空气倒流,即空气将进入到氨基甲酸铵分解的反应瓶中,此时实验需重做。
6.实验中温度是如何测定的?答:使用恒温槽调节温度。
7.压力计的读数是否是体系的压力?是否代表分解压?答:不是,不是。
8.缓冲储气罐有何作用?答:缓冲,防止管内液体倒流,使供气更加稳定,减少空压机的频繁启动。
9.使用真空泵应注意什么?为什么减压完成后必须使体系和真空泵与大气相通才能关闭真空泵?答:启动真空泵前要仔细检查各连接处及焊口处是否完好,泵的排气口胶塞是否打开。


17氨基甲酸铵分解反应平衡常数的测定实验十七氨基甲酸铵分解反应平衡常数的测定一、实验目的1.熟悉用等压计测定平衡压力的方法。
测定各温度下氨基甲酸铵的分解压力,计算各温度下分解反应的平衡常数K及有关2.p的热力学函数。
二、预习要求1.掌握氨基甲酸铵分解反应平衡常数的计算及其与热力学函数间的关系。
2.了解氨基甲酸铵的制备方法。
3.熟悉实验装置图,了解做好实验的关键步骤。
三、实验原理氨基甲酸铵为白色固体,很不稳定,其分解反应式为:NHCOONH(s) 2NH(g)+CO(g) 2432该反应为复相反应,在封闭体系中很容易达到平衡,在常压下其平衡常数可近似表示为:pp,,,,NHCO32 (1) K,,,,,ppp,,,,pp式中,分别表示NH和CO平衡时的分压,其单位为Pa。
32NHCO32、设平衡时总压为p,由于1molNHCOONH(s)分解能生成2molNH(g)和1molCO(g),2432pp又因为固体氨基甲酸铵的蒸气压很小,所以体系的平衡总压就可以看作与之和,CONH23pp,2即: NHCO3221则: (2) pppp,,,NHCO3233(2)式代入(1)式得:23,,,,,,24pppK,, (3) p,,,,,,3327ppp,,,,,,因此,当体系达平衡后,测量其总压p,即可计算出平衡常数温度对平衡常数的影响可用下式表示:dKln,Hprm (4) ,2dTRT,H式中,T为热力学温度;为标准反应热效应。
rm,H当温度在不大的范围内变化时,可视为常数,由(4)式积分得: rm,Hrm,ln (5) KC,,,pRT,H1rm,式中C′为积分常数。
若以对作图,得一直线,其斜率为,由此可求出lnKpRT,H。
rm氨基甲酸铵分解反应为吸热反应,反应热效应很大,在25?时每摩尔固体氨基甲酸铵3-1,H分解的等压反应热为159×10J?mol,所以温度对平衡常数的影响很大,实验中必须rm严格控制恒温槽的温度,使温度变化小于?0.1?。

实验五氨基甲酸铵分解反应平衡常数的测定一、实验目的1.了解氨基甲酸铵分解反应的基本过程和条件。
2.学习测定化学反应平衡常数的方法及其应用。
二、实验原理氨基甲酸铵在高温下分解,生成氨气和二氧化碳,反应式如下:CH3COONH4 -------> CH3COOH + NH3 ↑+ CO2 ↑由于化学反应的反应率常常与反应物的浓度有关,因此,当反应到达平衡时,反应物浓度和生成物浓度与时间无关,而是保持不变的。
对于上述反应,我们可以用反应平衡常数 Kc 表示为:Kc=[CH3COOH]/[NH3]×[CO2]式中 [CH3COOH]、[NH3]、[CO2] 分别表示平衡时甲酸浓度、氨气浓度和二氧化碳浓度。
通过实验测定在一定的条件下反应平衡时三种物质的浓度,进而计算反应平衡常数Kc 的大小。
三、实验仪器分光光度计、恒温槽。
四、实验材料氨基甲酸铵,稀盐酸,标准二氧化碳水溶液。
五、实验操作1.制备实验物质取适量氨基甲酸铵,加入适量的稀盐酸溶液,搅拌使之完全溶解,取出一部分于恒温槽中进行实验。
(1)实验条件:室温为25℃。
(2)取一定量的标准二氧化碳水溶液,并规定其浓度 C。
(3)将制备好的溶液放置于恒温槽中 5 分钟,使其达到稳态。
(4)取出一部分溶液并放入分光光度计中,测定其吸光度。
(5)用标准二氧化碳水溶液定量向其溶液中滴加一定量的 CO2 溶液,并在每次加入后短时间内在分光光度计中测定剩余未反应的 CO2 的吸光度。
6.收集实验数据记录每次加入二氧化碳水溶液前和每次测定后的实验溶液温度,并记录吸收光度数据。
七、实验注意事项1.实验中所用的各种玻璃仪器要求干燥、清洁,以免影响实验结果。
2.实验操作时应注意防止氨气和二氧化碳溶液造成的刺激。
3.实验过程中应注意一定加入量的二氧化碳水溶液。
八、实验结果与分析1.用分光光度计测定实验溶液中溶质的浓度,并计算出 CO2、NH3、CH3COOH 三种物质的吸收光度。

一、实验目的1、掌握测定平衡常数的一种方法。
2、用等压法测定氨基甲酸铵的分解压力并计算分解反应的有关热力学常数。
二、实验原理氨基甲酸铵的分解可用下式表示:24322NH COONH NH CO →↑+↑Kp=P 2 NH3 ×P CO2 (3-1)设反应中气体为理想气体,则其标准平衡常数可表达为322(/)(/)NH CO K p p p p θθθ=A 式中,3NH p 和2co p 分别表示反应温度下NH 3和CO 2的平衡分压,为100kPa 。
设平衡总pθ压为p ,则23p =3NH p ;213co p p =代入式(3-2),得到(3-3)34(/)27K p p θθ=因此测得一定温度下的平衡总压后,即可按式(3-3)算出此温度的反应平衡常数。
氨K θ基甲酸铵分解是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
但当温度变化范围不大时,按平衡常数与温度的关系式,可得:(3-4)ln r mp H K C RTθθ∆=-+式中,为该反应的标准摩尔反应焓,R 为摩尔气体常数,C 为积分常数。
根据式r m H θ∆(3-4),只要测出几个不同温度下的,以对1/T 作图,所得直线的斜率即为ln pK θ,由此可求得实验温度范围内的。
/r m H R θ-∆r mH θ∆ 利用如下热力学关系式还可以计算反应的标准摩尔吉氏函数变化和标准摩尔熵变r m G θ∆:r mS θ∆ (3-5)ln r m p G RT K θθ∆=-(3-6)r m r mr m H G S Tθθθ∆-∆∆= 本实验用静态法测定氨基甲酸铵的分解压力。
参看图3-1所示的实验装置。
样品瓶A 和零压计B 均装在空气恒温箱D 中。
实验时先将系统抽空(零压计两液面相平),然后关闭活塞1,让样品在恒温箱的温度t 下分解,此时零压计右管上方为样品分解得到的气体,通过活塞2、3不断放入适量空气于零压计左管上方,使零压计中的液面始终保持相平。

氨基甲酸铵分解反应平衡常数的测定
一.实验目的
1.用静态法测定一定温度下氨基甲酸铵的分解压力,求算该反应的平衡常数;
2.了解温度对反应平衡常数的影响,由不同温度下平衡常数的数据,计算反应焓变;
3.进一步掌握真空实验技术和恒温槽的调节使用。
实验方法与实验“静态法测定液体得饱和蒸汽压”实验相同。
因本实验所需真空度较高,试漏时要抽气
至真空系统压力p
s <8.5kPa。
三.注意事项
四.思考题
1.如何检测体系是否漏气?
2.为什么要抽净小球泡中的空气?若体系中有少量空气,对实验结果有何影响?
3.如何判断氨基甲酸铵分解已达平衡?没有平衡就测数据,将有何影响?。

氨基甲酸铵分解平衡常数测定一、实验目的1、测定氨基甲酸铵的分解压力,并求得反应的标准平衡常数和有关热力学函数;2、掌握空气恒温箱的结构。
二、实验原理氨基甲酸铵是是合成尿素的中间产物,为白色不稳定固体,受热易分解,其分解反应为2432NH COONH (s)2NH (g)+CO (g)−−→←−−该多相反应是容易达成平衡的可逆反应,体系压强不大时,气体可看作为理想气体,则上述反应式的标准平衡常数可表示为322NH CO θθθp p K p p ⎛⎫⎛⎫= ⎪ ⎪⎝⎭⎝⎭(1)式中3NH p 和2CO p 分别表示在实验温度下3NH 和2CO 的平衡分压。
又因氨基甲酸铵固体的蒸气压可以忽略,设反应体系达平衡时的总压为p ,则有3NH 23p p =, 2CO 13p p = 代入式(1)式可得3θθ427p K p ⎛⎫= ⎪⎝⎭(2)实验测得一定温度下的反应体系的平衡总压p ,即可按式(2)式算出该温度下的标准平衡常数θK 。
由范特霍夫等压方程式可得θθr m2Δd ln d H K T RT = (3) 式中θr m ΔH 为该反应的标准摩尔反应热,R 为摩尔气体常量。
当温度变化范围不大时,可将θr m ΔH 视为常数,对式(3)求积分得θθr mΔln H K C RT=+- (4)通过测定不同温度下分解平衡总压p 则可得对应温度下的θK 值,再以θln K 对1/KT 作图,通过直线关系可求得实验温度范围内的θr m ΔH 。
本实验的关系为:4θ1.89410ln 55.18/KK T -⨯=+由某温度下的θK 可以求算该温度下的标准摩尔吉布斯自由能变θr m ΔGθθr m Δln G RT K =-由θθθr m r m r m ΔΔΔG H T S =-可求算出标准摩尔反应熵变θr m ΔSθθθr m r mr mΔΔΔH G S T-=三、实验装置和药品整套实验装置主要由空气恒温箱(图中虚线框8)、样品瓶、数字式低真空测压仪,等压计,真空泵,样品管、干燥塔等组成,实验装置示意图如图所示。

实验二 氨基甲酸铵分解反应平衡常数的测定1 前言1.1实验目的1) 用等压法测定氨基甲酸铵的分解压力。
2) 通过测得的分解压力求得氨基甲酸铵分解反应的平衡常数,并计算Δr H ? m ,Δr G ? m (T ),Δr S ? m (T )等与该反应有关的热力学常数。
1.2(1) 式中,P 将式(2) (3) 2m d RT Tr = (4) 式中,T 为热力学温度;Δr H ? m为标准反应热效应,R 为摩尔气体常量。
氨基甲酸铵分解反应是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
当温度在不大的范围内变化时,Δr H ? m可视为常数,由(4)式积分得:C RTH Kr +∆-=m pln (C 为积分常数) (5)若以ln K ? p 对1/T 作图,得一直线,其斜率为-Δr H ? m /R 。
由此可求出Δr H ? m 。
并按下式计算T 温度下反应的标准吉布斯自由能变化Δr G ? m,Δr G ? m =-RT ln K ? p(6) 利用实验温度范围内反应的平均等压热效应Δr H ? m 和T 温度下的标准吉布斯自由能变化Δr G ? m,可近似计算出该温度下的熵变Δr S ? mTG H S r r rmm m∆-∆=∆ (7)因此通过测定一定温度范围内某温度的氨基甲酸铵的分解压(平衡总压),就可以利用上述公式分别求出 K ? p ,Δr H ? m ,Δr G ? m (T ),Δr S ? m (T )。
由福廷式气压计测得的大气压力需要进行温度及纬度的校正。
当温度改变时,水银和铜管的热仪示数不变,则系统不漏气。
然后反复练习开启旋塞接通毛细管的过程,使自己能较为熟练地控制一次放入系统内的空气的量。
【1】2)装样。
(实验室已完成)3)测量:读出大气压和室温。
将等压计小心与真空系统连接好,并固定在恒温槽中,打开恒温控制仪开关,调节恒温控制仪的温度为25℃,旋通活塞,开动真空泵,将系统中的空气排除,抽气时间约持续15min;缓慢开启旋塞接通毛细管,小心地将空气逐渐放入系统,直至等压计U 型管两臂硅油齐平,立即关闭旋塞,观察硅油面,反复小心调节,直至等压计U 型管两臂硅油齐平持续约45气,使6330。
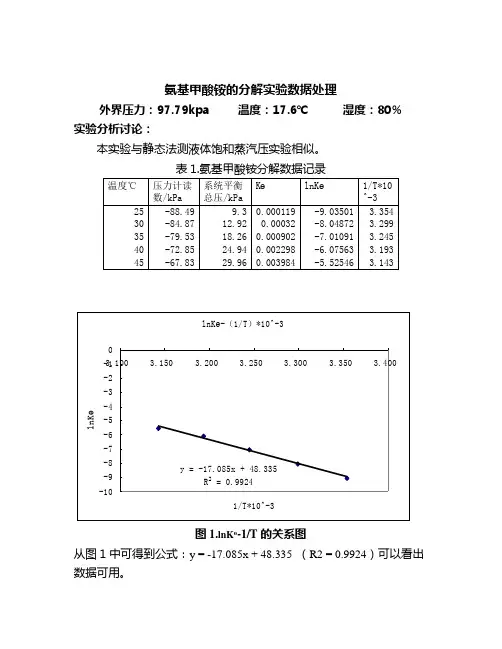
氨基甲酸铵的分解实验数据处理外界压力:97.79kpa 温度:17.6℃湿度:80% 实验分析讨论:本实验与静态法测液体饱和蒸汽压实验相似。
表1.氨基甲酸铵分解数据记录温度℃压力计读数/kPa 系统平衡总压/kPaKөlnKө1/T*10^-325 -88.49 9.3 0.000119 -9.03501 3.354 30 -84.87 12.92 0.00032 -8.04872 3.299 35 -79.53 18.26 0.000902 -7.01091 3.24540 -72.85 24.94 0.002298-6.075633.19345 -67.83 29.96 0.003984 -5.52546 3.143lnKө-(1/T)*10^-3y = -17.085x + 48.335R2 = 0.9924-10-9-8-7-6-5-4-3-2-13.100 3.150 3.200 3.250 3.300 3.350 3.4001/T*10^-3lnKө图1.lnKө-1/T的关系图从图1中可得到公式:y = -17.085x + 48.335 (R2 = 0.9924)可以看出数据可用。
然后结合公式lnKө=-/(RT)+B可知-/R=-17.085 =142.05kJ/mol计算25℃时的Δr G mθ=22.396kJ/molΔr S mθ=0.4013kJ/mol问题回答:1.怎样检查系统是否漏气?装置检查漏气的方法和静态法测液体饱和蒸汽压实验中检查漏气的方法一样,都是在使压力计通过抽气的方式得到一个负压值,然后关闭抽气泵以及各个阀门,观察压力计示数的变化,若是其变化在0.2kpa到0.3kpa的范围内,皆可认为装置气密性较好,能完成实验。
同时在实验步骤(5)中也是对装置实验过程中气密性的一个复查方式。
2.为什么要抽干净氨基甲酸铵小瓶中的空气?如果没有抽干净对测量数据会有什么样的影响?实验是测氨基甲酸铵的分解压力,若是在氨基甲酸铵小瓶中还有未抽干净的空气将使得测得的压力中包含了剩余空气产生的分压,将使结果偏大。

实验一液体饱和蒸气压的测定目的要求:1、明确纯液体饱和蒸气压的定义和气液两相平衡的概念,深入了解纯液体饱和蒸气压和温度的关系——克劳修斯—克拉贝龙方程式;2、用等压记测定不同温度下液体的饱和蒸气压。
初步掌握真空实验技术;3、学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸点。
实验预习:1.掌握用静态法测定液体饱和蒸气压的操作方法。
2.了解真空泵、恒温槽、气压计的使用及注意事项。
3.掌握水银温度计的露茎校正方法。
仪器介绍:恒温槽 1台;数字压力计 1台;饱和蒸汽压玻璃仪器 1套;不锈钢储气罐 1只;真空泵 1台;实验二凝固点降低法测摩尔质量目的要求:1、用凝固点降低法测定萘的摩尔质量;2、通过实验掌握凝固点降低法测定摩尔质量的原理,加深对稀溶液依数性质的理解。
实验预习:数字贝克曼温度计的使用仪器介绍:凝固点测定仪1套;烧杯2个;数字贝克曼温度计1台;普通温度计(0℃~50℃)1只;压片机1个;移液管(50mL)1只。
实验三燃烧热的测定目的要求1、用氧弹热量计测定萘的燃烧热;2、明确燃烧热的定义,了解恒压燃烧热与恒容燃烧热的差别;3、了解热量计中主要部分的作用,掌握氧弹热量计的实验技术;4、学会雷诺图解法校正温度改变值。
实验预习1、明确燃烧焓的定义。
2、了解氧弹式量热计的基本原理和使用方法。
3、熟悉热敏电阻温度计的调节和使用。
4、了解氧气钢瓶和减压阀的使用方法。
仪器介绍:绝热式氧弹量热计1套;氧气钢瓶1只;氧气表1只;压片机1套;分析天平1台;实验四温度的控制与测量及液体粘度的测定目的要求:1、了解恒温水浴的构造激起工作原理,学会恒温水浴的装配技术;2、测绘恒温水浴的灵敏度曲线;3、掌握贝克曼温度计的调节技术和正确使用方法;4、掌握乌式粘度计的使用。
实验预习:1、接触温度计的调节及使用2、了解奥氏粘度计结构的特点。
3、了解恒温槽的构造、控温原理及各主要部件的作用仪器介绍:玻璃浴槽 1台;数字温度计 1支;停表 1只;搅拌器 1台;加热器 1台;接触温度计 1支;常规温度计 1台;继电器 1台奥式粘度计1只实验五粘度法测定高聚物的分子量目的要求:1、了解乌氏粘度计的测量原理;2、掌握用乌氏粘度计测定溶液粘度的方法;3、图解法求特性粘度并计算聚苯乙烯分子量。
氨基甲酸铵分解反应平衡常数的测定
一.实验目的
1.用静态法测定一定温度下氨基甲酸铵的分解压力,求算该反应的平衡常数;
2.了解温度对反应平衡常数的影响,由不同温度下平衡常数的数据,计算反应焓变;
3.进一步掌握真空实验技术和恒温槽的调节使用。
实验方法与实验“静态法测定液体得饱和蒸汽压”实验相同。
因本实验所需真空度较高,试漏时要抽气
至真空系统压力p
s <8.5kPa。
三.注意事项
四.思考题
1.如何检测体系是否漏气?
2.为什么要抽净小球泡中的空气?若体系中有少量空气,对实验结果有何影响?
3.如何判断氨基甲酸铵分解已达平衡?没有平衡就测数据,将有何影响?。
实验九氨基甲酸铵分解反应平衡常数的测定[日期:2008-06-18] 来源:作者:[字体:大中小]四、实验步骤1打开恒温水浴开关,按回差键使之变为0.12装样:打开氨基甲酸銨分解反应平衡常数测定仪上端的加样口盖,加入一定量的氨基甲酸銨(平衡器中已装好)。
3抽空:关闭平衡阀1,打开平衡阀2,打开进气阀。
旋转玻璃活塞,使两个活塞为全通。
打开氨基甲酸銨分解反应平衡常数测定仪,使单位调为kpa。
按指零键置零。
打开真空泵,待泵运转正常后,关闭玻璃放空活塞,观察氨基甲酸銨分解反应平衡常数测定仪上的读数,待压力计读数达-93.5kpa时,关闭玻璃活塞,打开玻璃放空活塞后,关闭真空泵,关闭进气阀。
4测量:关闭平衡阀2,缓慢打开平衡调节阀1放入空气,观察U型管两端液面相等(3分钟不变,因为是化学反应调平后还会动,直到不动为止。
)时,关闭平衡阀1。
记录下温度和氨基甲酸銨分解反应平衡常数测定仪上的读数(室温测一个)。
打开恒温槽上的加热开关,打开搅拌开关,设置温度。
按置数键。
然后数字闪动按正三角键加数,按倒三角键减数,调至所需温度,比上一个温度高5℃。
第一位数字设完后按置数键设定下一位,三位数设完后,按置数键进入工作状态。
(加热时可用强档,当加热到与设定温度差2度时改用弱档)。
待恒温后用平衡阀1放气调平,测定方法同上,共做6组。
当六组数测完后,打开平衡阀1,打开平衡阀2,打开进气阀,打开玻璃活塞,关闭恒温槽及氨基甲酸銨分解反应平衡常数测定仪电源,实验结束。
五、数据处理1、将压力计读数,系统平衡总压,Kө,,lnKө等数据列成下表:室温:22.9℃气压:100.03kPa温度/℃压力计读数/kPa系统平衡总压/kPa KөlnKө1/T/10-3K)25-88.9311.100.000203-8.502 3.3530-84.6815.350.000536-7.531 3.3035-79.1520.880.00134-6.615 3.2540-69.7130.320.00413-5.489 3.1945-55.5044.530.01308-4.337 3.142、根据实验数据lnKө对1/T作图,并计算此反应的:。
实验十二 氨基甲酸铵分解平衡常数的测定一、实验目的1. 掌握测定平衡常数的一种方法。
2. 用等压法测定氨基甲酸铵的分解压力,并计算反应的标准平衡常数和有关热力学函数。
二、实验原理氨基甲酸铵是白色固体,是合成尿素的中间体,研究其分解反应是具有实际意义的。
氨基甲酸铵很不稳定,易于分解,可用下式表示:243(2((NH COONH NH 2固)气)+CO 气)此复相反应正逆向都很容易进行,若不将产物移去,则很容易达到平衡。
在实验条件下,把反应中的气体均看作理想气体,压力对固体的影响忽略不计,其标准平衡常数可表示为:322()()NH CO p p p K ppθθθ= (1)式中,3NH p 和2CO p 分别表示反应温度下NH 3和CO 2的平衡分压,p θ为100kPa 。
平衡体系的总压p 为3NH p 和2CO p 之和,从上述反应可知:323NH p p =, 213CO p p = 代入式(1)得到:23214()()()3327p p p p K p p pθθθθ== (2)因此,当体系达到平衡后,测定其总压p 即可算出标准平衡常数p K θ。
氨基甲酸铵分解是一个热效应很大的吸热反应,温度对平衡常数的影响比较灵敏。
但当温度变化范围不大时,按平衡常数与温度的关系式,可得:ln rmp H K C RTθθ=-+ (3)式中,rm H θ为该反应的标准摩尔反应热,R 为摩尔气体常数,C 为积分常数。
根据式(3),只要测出几个不同温度下的总压p ,以ln p K θ对1/T 作图,由所得直线的斜率即可求得实验温度范围内的rm H θ。
利用如下热力学关系式还可以计算反应的标准摩尔吉氏函数变化r m G θ和标准摩尔熵变r m S θ:ln r m p G RT K θθ=- (4)r m r m r G H TS θθθ=- (5)本实验用静态法测定氨基甲酸铵的分解压力。
参看图1所示的实验装置。
氨基甲酸铵分解反应平衡常数的测定一、 前言1.1意义平衡常数在化学中有着十分重要的地位,从平衡常数的大小,可确定在该温度下可逆反应中的正反应可能达到的程度。
平衡常数不仅在分析化学和物理化学中有重要的理论意义,而且在化学工艺中一项重要的数据,可用以通过计算来确定生产条件。
掌握平衡常数的测量方法也是化学工作者必须拥有的一项基本技能。
1.2前期工作平衡常数作为一个与化工生产具有密切联系的化学概念,从很早以前,科学家便已开始认识到相关现象并对其进行研究。
从19世纪50-60年代开始,热力学的基本规律已明确起来,但是一些热力学概念还比较模糊,数字处理很烦琐,不能用来解决稍微复杂一点的问题,例如化学反应的方向问题。
当时,大多数化学家正致力于有机化学的研究,也有一些人试图解决化学反应的方向问题。
比如丹麦人汤姆森(Thomson)和贝特洛(Berthelot)试图从化学反应的热效应来解释化学反应的方向性(也是氧弹量热学的创始人)。
他们认为,反应热是反应物化学亲合力的量度,每个简单或复杂的纯化学性的作用,都伴随着热量的产生。
M.贝特洛更为明确地阐述了与这相同的观点,并称之为“最大功原理”,史称“汤姆森-贝特洛原理”(Thomsen-Berthelot principle)。
他认为任何一种无外部能量影响的纯化学变化,向着产生释放出最大能量的物质的方向进行。
他认为有以下关系:可见他此时已经意识到了化学反应的可逆性。
虽然这时他发现了一些吸热反应也可以自发地进行,但他却主观地假定其中伴有放热的物理过程。
30年代,他对其进行了修正,将“最大功原理”的应用范围限制在固体间的反应上,并提出了实际上是“自由焓”的化学热的概念。
19世纪50年代,挪威科学家古德贝格(Guldberg)和瓦格(Waage)在贝特洛研究成果的基础上提出了质量作用定律(law of mass action):其中A、B、S和T都是有效质量,k+和k−是速率常数。
氨基甲酸铵的分解实验数据处理外界压力:97.79kpa 温度:17.6℃湿度:80% 实验分析讨论:本实验与静态法测液体饱和蒸汽压实验相似。
表1.氨基甲酸铵分解数据记录温度℃压力计读数/kPa 系统平衡总压/kPaKөlnKө1/T*10^-325 -88.49 9.3 0.000119 -9.03501 3.354 30 -84.87 12.92 0.00032 -8.04872 3.299 35 -79.53 18.26 0.000902 -7.01091 3.24540 -72.85 24.94 0.002298-6.075633.19345 -67.83 29.96 0.003984 -5.52546 3.143lnKө-(1/T)*10^-3y = -17.085x + 48.335R2 = 0.9924-10-9-8-7-6-5-4-3-2-13.100 3.150 3.200 3.250 3.300 3.350 3.4001/T*10^-3lnKө图1.lnKө-1/T的关系图从图1中可得到公式:y = -17.085x + 48.335 (R2 = 0.9924)可以看出数据可用。
然后结合公式lnKө=-/(RT)+B可知-/R=-17.085 =142.05kJ/mol计算25℃时的Δr G mθ=22.396kJ/molΔr S mθ=0.4013kJ/mol问题回答:1.怎样检查系统是否漏气?装置检查漏气的方法和静态法测液体饱和蒸汽压实验中检查漏气的方法一样,都是在使压力计通过抽气的方式得到一个负压值,然后关闭抽气泵以及各个阀门,观察压力计示数的变化,若是其变化在0.2kpa到0.3kpa的范围内,皆可认为装置气密性较好,能完成实验。
同时在实验步骤(5)中也是对装置实验过程中气密性的一个复查方式。
2.为什么要抽干净氨基甲酸铵小瓶中的空气?如果没有抽干净对测量数据会有什么样的影响?实验是测氨基甲酸铵的分解压力,若是在氨基甲酸铵小瓶中还有未抽干净的空气将使得测得的压力中包含了剩余空气产生的分压,将使结果偏大。