[指导]2004-2005学年第一学期无机化学试题2标准答案及平分细则
- 格式:doc
- 大小:235.50 KB
- 文档页数:8

无机及分析化学第一学期期终考试A卷(200(20044级)一.用离子-电子法配平以下反应方程式:(12%)1.MnO4-+NO2-+H+→Mn2++NO3-+H2O(酸性介质)2.Cr2O72-+Fe2++H+→Cr3++Fe3+(酸性介质)3.Cr3++H2O2→CrO42-+H2O(碱性介质)4.I2+OH-→I-+IO3-+H2O(碱性介质)二.填空:(28%)1.若在HCl浓度标定实验中滴定速度均较快,滴定完毕立即读数,则标定结果将可能偏。
2.在CaCO3(K spΘ=3.36×10-9),CaF2(K spΘ=3.45×10-11),Ca3(PO4)2(K spΘ=2.07×10-33)这些物质的饱和溶液中,Ca2+浓度由大到小的顺序为。
3.BaSO4在一定浓度的Na2SO4溶液中的溶解度比在纯水中的溶解度,这种现象称为效应。
4.沉淀形成过程中的定向速率是指,主要取决于。
5.原电池中ϕθ值越大的电极,电对的氧化型________越强,ϕθ值越小的电极,电对的还原型________越强。
6.已知氯元素在碱性溶液中的电势图为:ClO4-+0.36V ClO3-+0.495V ClO-+0.40V Cl2+1.36V Cl-则ϕθ(ClO4-/ClO-)=________;298K时将Cl2(g)通入到稀NaOH溶液中,能稳定存在的离子是________________。
7.只有当两电对的EθV,这样的氧化还原反应才有可能用于滴定分析。
8.碘量法测铜含量时,KI的作用有,,。
9.n=3,l=2的原子轨道最多可容纳_______个电子。
10.M2+离子的核外电子排布式为[Ar]3d5,则M原子的价电子构型为_______________,位于____周期,____族。
11.F、O、Na和K原子中,电负性最大的是________。
12.原子轨道以____________方式重叠所形成的共价键为σ键。

2004-2005学年度第一学期素质评估卷(二)九年级化学(第三单元)班级姓名得分一、填空题:(每空1分,共30分)1、有下列物质,①水②氧气③二氧化碳④铁粉⑤空气⑥自来水⑦五氧化二磷⑧高锰酸钾⑨澄清石灰水。
用序号填空:属于纯净物的有,属于混合物的有;属于单质的有,属于化合物的有;属于氧化物的有。
2、分子是,原子是,分子和原子的根本区别是。
3、在电解水时,若正极产生5ml的某气体,该气体是,则负极会产生ml 的气体。
该反应的文字表达式是。
4、、点燃不纯氢气(混有空气)就可能发生。
所以点燃H2前必须先。
纯净的氢气可以在空气中安静地燃烧,产生色火焰。
反应的文字表达式为:。
5、右图是有关分子性质的实验。
上瓶盛的是空气,下瓶盛的是红棕色的二氧化氮气体,当抽出玻璃片后会观察到红棕色气体逐渐扩散到上瓶,同时下瓶颜色逐渐变。
最后上下两瓶的颜色。
此现象说明。
当两瓶气体混合均匀后分子(继续或停止)运动。
6、能保持水的化学性质的粒子是,金秋十月,人们站在桂花树旁,常闻到怡人的花香,这一现象说明了。
7、把50ml水中倒入50ml酒精中,混合后总体积(填“>”,“<”或“=”)100ml。
⑴我国人均水量约为2300m3·a-1,居世界第八十几位,水资源紧缺程度为⑵研究表明,一节含汞、镉、铅等金属的电池所造成的污染可使60t水无法使用。
若成年人每人每天饮水约2kg,则60t水能供一个人饮用约年。
(一年按365天计,结果保留整数)⑶为迎接全国第五届农运会在我市召开,某同学向政府提出了保护秀江河的几条建议:①向河中放养鱼苗,保持生态平衡②清理秀江河中的污泥③禁止向河道内倾倒垃圾④禁止使用化肥和农药,防止水质污染其中不合理的是。
(填序号)9、有些地区的水很容易在水壶或盛水器具上结水垢,就是因为该地区的水中溶有较多的可溶性的化合物。
我们把这种水称为。
设法除去硬水中的这些化合物可使硬水变为。
检验硬水和软水常可用。
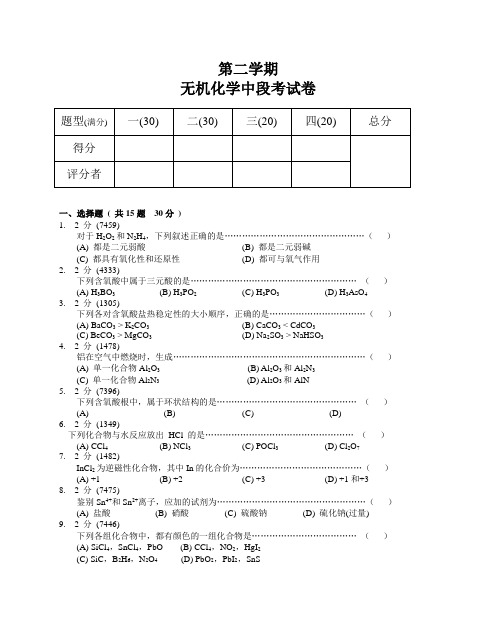
第二学期无机化学中段考试卷题型(满分)一(30)二(30)三(20)四(20)总分得分评分者一、选择题( 共15题30分)1. 2 分(7459)对于H2O2和N2H4,下列叙述正确的是…………………………………………()(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用2. 2 分(4333)下列含氧酸中属于三元酸的是…………………………………………………()(A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO43. 2 分(1305)下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………()(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO34. 2 分(1478)铝在空气中燃烧时,生成…………………………………………………………()(A) 单一化合物Al2O3(B) Al2O3和Al2N3(C) 单一化合物Al2N3(D) Al2O3和AlN5. 2 分(7396)下列含氧酸根中,属于环状结构的是…………………………………………()(A) (B) (C) (D)6. 2 分(1349)下列化合物与水反应放出HCl 的是……………………………………………()(A) CCl4(B) NCl3(C) POCl3(D) Cl2O77. 2 分(1482)InCl2为逆磁性化合物,其中In的化合价为……………………………………()(A) +1 (B) +2 (C) +3 (D) +1和+38. 2 分(7475)鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)9. 2 分(7446)下列各组化合物中,都有颜色的一组化合物是………………………………()(A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2(C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF(C) Na2SiO3,Na2SiF6(D) SiO2,HF11. 2 分(1421)将NCl3通入碱性溶液,其水解产物是…………………………………………()(A) NH3和ClO-(B) NH3和Cl-(C)和Cl-(D)和Cl-12. 2 分(4348)PCl3和水反应的产物是…………………………………………………………()(A) POCl3和HCl (B) H3PO3和HCl(C) H3PO4和HCl (D) PH3和HClO13. 2 分(7463)下列各对物质,水解能力对比,正确的是………………………………………()(A)>(B)>(C) SnCl2 > SnCl4(D) PCl3 > BiCl314. 2 分(4361)二氧化氮溶解在NaOH溶液中可得到:(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O15. 2 分(1460)下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S3二、填空题( 共12题30分)16. 5 分(7452)N2O3很容易分解为和。

《无机化学》习题解析和答案1、教材《无机化学》师大学、华中师大学、师大学无机化学教研室编,高等教育,2002年8月第4版。
2、参考书《无机化学》师大学、华中师大学、师大学无机化学教研室编,高等教育,1992年5月第3版。
《无机化学》邵学俊等编,大学,2003年4月第2版。
《无机化学》大学、大学等校编,高等教育,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章 p区金属(4学时)第二十二章 ds区元素(6学时)第二十三章 d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质 (chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
●化学研究包括对化学物质的①分类;②合成;③反应;④分离;⑤表征;⑥设计;⑦性质;⑧结构;⑨应用以及⑩它们的相互关系。

2004-2005学年第一学期月考(二)高二化学试题一、选择题(每小题只有一个选项符合题意,每小题2分,共24分)1、相同物质的量浓度的下列溶液,导电性能最差的是:( )A氢氧化物溶液 B 醋酸溶液 C 盐酸溶液 D 醋酸铵溶液2、下列有关叙述中正确的是:( )A 难溶于水的电解质一定是弱电解质B 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强C 易溶于水的电解质一定是强电解质D 强电解质在水溶液中的电离过程是不可逆的3、PH值和体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下,放出二氧化碳气体的体积是A 一样多B 醋酸比硫酸多C 硫酸比醋酸多D 无法比较4、用pH试纸测定某无色溶液的pH值时,规范的操作是:( )A 将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较B 将溶液倒在pH试纸上,跟标准比色卡比较C 用干燥洁净玻璃棒蘸取溶液,点在pH试纸上跟标准比色卡比照D 先用蒸馏水湿润PH试纸,再用干燥洁净玻璃棒蘸取溶液,点在pH试纸上跟标准比色卡比照5、把0.05mol NaOH固体分别加入下列100mL液体中,溶液的导电性基本不变的是:A 自来水B 0.5mol·L-1的盐酸C 0.5mol·L-1的醋酸D 0.5mol·L-1的氨水6、在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是:A 氯化铝B 碳酸氢钠C 氯化铁D 氯化钠7、将滴有酚酞的醋酸钠溶液加热,溶液的颜色:( )A不变 B 加深 C 变浅 D 无色8、在Na2S溶液中c(Na+)与c(S2-)的比值是:( )A 2B 小于2C 大于2D 1/29、100毫升0.1摩尔/升醋酸溶液中,欲使醋酸的电离度和溶液的PH值都增大,不可以采用的方法是A 加少量1摩尔/升氢氧化钠溶液B 加少量醋酸钠C 加100毫升水D 加少量碳酸钠10、pH相同的醋酸溶液和盐酸分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m、n的关系是:( )A m=nB m>nC m<nD 无法判断11、pH=3的盐酸和pH=3的醋酸溶液,由水电离产生的c(H+):( )A 前者大于后者B 前者小于后者C 前者等于后者D 不能确定12、100mL0.1mol/L醋酸与50mL0.2mol/L氢氧化钠溶液混合,在所得溶液中:( )A c(Na+) >c(CH3COO-)>c(OH-)>c(H+)B c(Na+) >c(CH3COO-)>c(H+)>c(OH-)C c(Na+) >c(CH3COO-)>c(OH-)= c(H+)D c(Na+) =c(CH3COO-)>c(OH-)>c(H+)13、在0.01mol/L的醋酸中加入少量硫酸后,其变化结果是:( )A 酸性增强,pH减小B 醋酸的浓度减小C 氢离子浓度变小D 醋酸根离子浓度变大14、在同体积pH=3的H2SO4、HCl、CH3COOH溶液中,加入足量锌粉,下列说法正确的是:( )A H2SO4中放出H2最多B 醋酸中放出H2最多C HCl放出H2最少D H2SO4比HCl放出H2多15、用标准NaOH溶液滴定未知浓度的盐酸溶液,以测定盐酸的浓度,下列操作使测定结果偏高的是:( )A 未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗B 装待测液的锥形瓶,洗涤后未干就盛入待测液C 滴完开始时,用俯视法观察碱式滴定管刻度,其余操作正确D 滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液16、在pH=1的溶液中,可以大量共存的是:( )A Na+ 、K+、S2-、Cl-B Al3+ 、Mg2+、SO42-、Cl-C Na+ 、K+、HCO3-、NO3-D Na+ 、K+、SO32-、S2O32-17、不能说明醋酸是弱电解质的是:( )A 0.1mol/L的醋酸溶液的PH>1B 体积相同PH值相同的醋酸溶液比盐酸溶液的中和能力强 C PH值相同的醋酸溶液和盐酸溶液稀释同样倍数后,醋酸的PH值小。

试题编号:441 试题名称:无机化学注意:答题一律答在答题纸上,答在草稿纸或试卷上一律无效一、选择题(单项选择,每题2分,共100分)1. 浓度相同的NaCl, Na2SO4, C6H12O6, CH3COOH溶液中, 若按沸点由高至低的顺序排列的是()。
(A)NaCl > Na2SO4 > C6H12O6 > CH3COOH(B)Na2SO4 > NaCl > CH3COOH > C6H12O6(C)C6H12O6 > CH3COOH > NaCl > Na2SO4(D)Na2SO4 > CH3COOH > NaCl > C6H12O62.50ml 0.01 mol L-1 AgNO3与50 ml 0.015 mol L-1 KI 溶液混合后得到的AgI溶胶,其电位离子是()。
(A) Ag+(B) NO3-(C) K+(D) I-3. 下列化学反应中,其反应热效应代表CO2 (g) 的Δf H mø的是()。
(A)C(金刚石) + O2(g) = CO2(g)(B)2 C(金刚石) + 2O2(g) = 2CO2(g)(C)2C(石墨) + 2O2(g) = 2CO2(g)(D)C(石墨) + O2(g) = CO2(g)4. 混合气体某组份A的摩尔分数和其分压与总压力之比P A/P总关系是()。
(A)成正比(B)相等(C)即不相等,也不成正比(D)成反比5. 用半透膜隔开两种不同浓度的蔗糖溶液,为了一开始就保持渗透平衡,必须在浓蔗糖溶液一侧液面上施加一定的压力,这个压力值为()。
(A) 浓蔗糖溶液的渗透压(B) 稀蔗糖溶液的渗透压(C) 两种蔗糖溶液渗透压之和(D) 两种蔗糖溶液渗透压之差6. H2(g)和O2(g)在绝热的钢瓶中燃烧生成液态水,则有()。
(A) ΔH=0 (B) ΔU=0 (C) ΔS=0 (D) ΔG=07. 破坏臭氧的反应机理为:NO + O3 = NO2 + O2NO2 + O = NO + O2其中NO是()(A) 反应物(B)催化剂(C)产物(D)惰性物质8. 若某一反应速率常数单位为mol L-1 S-1,则该反应的级数为()。
江苏省白蒲高级中学2004—2005学年度第一学期阶段考试高三化学试卷2004.10时间:100分钟总分:150分第I卷(选择题共74分)可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—32 Mn—55 Cu—64一、选择题:本题包括8小题,每小题4分,共32分。
每小题只有一个....选项符合题意。
1、下列实验采用的方法,错误的是A、用盐析的方法提纯某些蛋白质B、用渗析的方法除去淀粉液中的Cl—C、用盐析过滤的方法从油脂皂化混合物中分离出肥皂D、用加热升华的方法除去高锰酸钾晶体中少量的碘2、在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是A、XY3晶体一定是离子晶体B、若Y的原子序数为m,X的原子序数一定是m±4C、X和Y可属于同一周期,也可属于两个不同周期D、X和Y一定不属于同一主族3、下列物质中,既可由单质直接化合而得,也可以在溶液中反应制得的是A、Al2S3B、CuSC、FeCl3D、Fe3O44、Fe与硝酸反应随温度和硝酸的浓度不同而产物不同。
已知0.2 mol HNO3做氧化剂时,恰好把0.4 mol Fe氧化为Fe2+,则HNO3将被还原成A、NH4+B、N2OC、NOD、NO25、在由水电离产生的c(H+)=1×10—14mol·L—1的溶液中,一定可以大量共存的离子组是A、NH4+、Al3+、Br—、SO42—B、Na+、Mg2+、Cl—、NO3—C、K+、Ba2+、Cl—、NO3—D、K+、Na+、SO32—、SO42—6、已知t℃下Na2SO3的溶解度是S g。
一定质量的Na2SO3溶液中加入a g Na2SO3,在t℃恰好饱和。
若以Na2SO3·7H2O代替Na2SO3,也使原溶液在t℃恰好饱和,需加入Na2SO3·7H2O (摩尔质量为252 g·mol—1)的质量是A、200100ag S-B、100100agS+C、200100agS+D、100100agS-7、设N A为阿伏加德罗常数,下列说法正确的是A、1 L 0.1 mol/L的Na2CO3溶液中,含Na+ 0.2 N A,CO32—0.1 N AB、1 L 0.3 mol/L的K2SO4溶液中,含K+和SO42—离子总数为0.9 N AC、2 L 0.6 mol/L的Fe2(SO4)3溶液中,含SO42—离子总数为2.4 N AD、0.1 mol/L的H3PO4溶液中,c(H+):c(PO43—)<3:18、由ⅢA族元素X和ⅥA族元素Y组成的阴离子,结构如下图所示,则所带电子a、b、c分别为A、2、3、4B、4、3、2C、5、6、4D、2、3、2选项符合题意,若正确答案只包括一个选项,多选时,二、选择题:每小题有一个或两个.....该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分。
石门中学 2004- 2005 学年度第一学期高一年级化学科中段考试题注意:①全卷共7 页,供 1- 18 班使用。
考试时间为90 分钟②全卷分第一卷和第二卷,此中第一卷占60%,第二卷占40%。
③解题可能需要的原子量:H - 1C- 12 N- 14O- 16Ne- 20S- 32Cu- 64 Cl - 35.5 Na- 23 Mg -24 Al -27Fe- 56Zn- 65第一卷(第一卷答案填在答题卡上)一、选择题(以下1-20 题每题仅一个正确选项,每题 2 分)1.以下操作不正确的选项是:A.用燃着的酒精灯去点燃另一盏酒精灯。
B.熄灭酒精灯时,用灯帽盖灭。
C.过滤操作中,一定用玻璃棒引流混淆物。
D.转移溶液入容量瓶时,一定用玻璃棒引流。
2.以下混淆物的分别方法不正确的选项是:A.沸点不一样的液体可用蒸馏的方法分别。
B.易溶与难溶的固体混淆物可用溶解、过滤、蒸发、结晶的方法分别。
C.用酒精能够从碘水中萃取碘。
D.汽油和水的混淆物能够用分液漏斗分别。
3.以下实验操作中有错误的选项是:A.分液时,分液漏斗基层液体从下口放出,上层液体从上口倒出。
B.蒸馏时,温度计水银球应淹没在液体中。
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出。
D. 把几滴 FeCl3饱和溶液滴入250mL 的开水中制取 Fe(OH) 3胶体。
4. 以下表达正确的选项是:A.1 摩尔氢为 2克B. H 2O 的摩尔质量为 18 克C. 44 克 CO2的体积为 22.4LD. 9.8 克 H2SO4含 0.1N A个 H 2SO4分子5.1molSO2和 1molSO 3拥有同样的:①分子数②原子数③ S原子数④ O原子数A. ①②B. ①③C. ①④D. ②④6.以下物质中,在标准状况下,体积最大的是:A. 180 克 H2OB. 4 克氢气C. 500mL 2mol/L 的 H 2SO4和足量锌反响D. 1molKMnO 4加热完整分解生成的 O27. 以下溶液中,氯离子浓度最大的是:A. 100mL1mol/L 的 NaCl 溶液B. 150mL1mol/L 的 MgCl 2溶液C. 200mL1mol/L 的 HCl 溶液D. 10mL1mol/L 的 AlCl 3溶液8.N A为阿伏加德罗常数,对于 1mol/L 的硫酸溶液,以下表达错误的选项是:A.1000mL 溶液中,含 2N A个 H +。
试题312 试题名称:化学 注意:答题一律答在答题纸上,答在草稿纸或试卷上一律无效无机化学部分(75分)一、单选题(每题二分)1mol/Kg 的下列物质溶液沸点大小顺序是A 32AICl ZnCl NaCl >>B NaCl ZnCl AICl >>23C 23ZnCl AICl NaCl >>D 32AICl ZnCl NaCl ==2. 以下关于溶胶的叙述,正确的是A.均相,稳定,粒子能通过半透膜 B 多相,比较稳定,粒子不能通过半透膜C 均相,比较稳定,粒子能通过半透膜D 多相,稳定,粒子不能通过半透膜3. 乙醇,丙酮能使高分子溶液聚沉,原因是A 它们有强烈亲水性B 它们不溶解高分子化合物C 它们使高分子化合物失去电荷D 它们本身可以电离4. 关于自发反应以下说法正确的是A 自发反应是放热反应B 自发反应在一定条件下可达平衡C 自发反应是吸热反应D 自发反应是可逆反应5. 恒压下,某反应A(s)+B(g)=2C(g)为放热反应,则反应体系的A ΔU>0,W>0B ΔU>0,W<0C ΔU<0,W<0D ΔU<0,W>06. 标准状态时下列哪一物质的m m f m f S H G ,,∆∆都是0A 氧气B 金属CaC H 离子D OH 离子7. 催化剂不能改变的是A 正反应速度B 逆反应速度C 反应活化能D 反应自由能8. 勒夏特列原理适用于A 等容体系B 开放体系C 孤立体系D 平衡体系9. 反应)()()()(222g O H g CO g H g CO +=+ 等容条件下,对于水的摩尔质量有影响的步骤是A 降低温度B 降低压力C 增加压力D 加入氮气10. 根据稀释定律和解离度成正比关系的是A 浓度cB cC KaD Ka11. 下列溶液pH 值最大的是A 0.10mol/LHAcB 0.010mol/LHClC 0.10mol/LNH 4ClD 0.00010mol/LHCl12. 实验测定100ml0.01mol/L 2NaNO 水溶液的pH 值是8.0,则为的Ka HNO 2A 1210-B 810-C 610-D 410-13. 溶液中,当122)(101.8332-⨯=⋅=+CO Ag CO Ag SP C C K 时可以说明的是A 银离子浓度是碳酸根的二倍B Ag 2CO 3不容易电离C 溶液是Ag 2CO 3的饱和溶液D 银离子浓度等于碳酸根浓度14.某难溶电解质AB 2的饱和溶液中是其θsp K L ymol B L xmol A /][,/][2==--A y x ⋅B 2y x ⋅C 2)2(y xD 25.0xy15.按氧化还原方程式可以写出或查出反应自由能,热效应,平衡常数和电动势,其中和方程式写法无关的是A E (电动势)B rG ∆C rH ∆D θK16..已知-−−→−−−→−−→−−−→−=-I I HIO HIO IO H V E V V V I IO H 54.0245.0370.065/,37.065则=--IO IO E /3A 0.30VB 0.21VC 0.18VD 0.1417.已知则)()(CuS K ZnS K sp sp θθ>A θθθZnS S S S CuS S E E E ///2>>-B θθθ->>2///S S Z n S S C u S S E E E C θθθCuS S ZnS S S S E E E ///2>>- D θθθCuS S S S ZnS S E E E ///2>>-18.提出微观粒子有波粒二象性的是A PlanckB de BroglieC EinsteinD Bohr19.关于波函数ψ说法正确的是A 一种原子有一种波函数B 一种波函数对应电子一种运动状态C 波函数有明确物理意义D. 波函.数代表电子在某处出现的概率20.已知某元素在序号36前,此元素失去三个电子后,它的角量子数为二的轨道内电子恰好半充满,此元素序号为A 25B 26C 27D 2821.产生能级分裂现象的主要原因是A 屏蔽效应和钻穿效应B Pauli 不相容原理C Slater 规则D 能量最低原理22.钼原子外层电子排布是1554s d ,这样排布的主要依据是A Slater 规则B Hund 规则C Pauli 不相容原理 D. 能量最低原理23.二个具有单电子的原子互相靠近,可能形成共价键的条件是A 二电子自旋方向不同B 二电子能量相近C 二电子自旋量子数相同D 二电子波函数相同24.氨水溶液中氨分子之间的作用力有A 一种B 二种C 三种D 四种25.螯合物比相应简单配位物稳定的本质是A 热效应B 形成多元环C 熵效应D 螯合效应二、计算题(每小题5分)1. 0.50mol/L 水在其沸点气化,恒压汽化热2.26kJ/g,求W,Q,ΔU,ΔH 和ΔG .2.)()()(235g Cl g PCl g PCl += 已知100a p K ,523K 时K p =1.6,求(1) 总压力1000a p K 时PCl 5的摩尔分解率(2) 如果摩尔分解率为10%,此时总压力多少3.0.10mol/L 的HAc 和0.050mol/LNaOH 等体积混合,计算溶液中-+Ac O H 3离子浓度51077.1(-⨯=Ka )4.反应 )(21)()(2g O s C g CO += )/(mol ki fH m θ∆ -110.52 0 0)(11--⋅⋅k mol J S m θ 197.67 5.74 205.14根据以上热力学数据计算反应自由能并判断其自发性.5.已知反应m ol KJ rG g CO g O H g NH g HCO NH m olKJ rG g CO g O H s CO Na S NaHCO m m /22.28)()()()(/19.28)()()()(22233422323=∆++==∆++=θθ计算当298K 时,34323,HCO NH CO Na NaHCO 和共存时氨的分压可能用到的公式:CKa H RTInK G a a a a RTIn G G ST H G WQ U r d D b B f F e E m r r ⋅=-=∆⋅⋅+∆=∆∆-∆=∆-=∆+][θθ有机化学部分(75分)一、选择一个正确答案填入下列括号内(每题1分,共20分)1.水中溶解度最大的是()A.HO(CH2)3OHB.C2H5OCH(CH3)2C.CH3CH2CH2CH2OHD.CH3CHO2.乙酰乙酸乙酯能使溴水褪色是因为存在()A.对映异构B.顺反异构C.构象异构D.互变异构3.皂化值越大,油脂平均相对分子质量()A.越大B.越小C.不受影响4.最稳定的游离基是()A.(CH3)3C∙B.(CH3)2CH∙C.CH3CH2∙D.CH3∙5.具有相同分子式的外消旋体与内消旋体之间是()A.对映异构B.非对映异构C.差相异构D.互变异构6.下列化合物中,与氢氰酸反应活性顺序排列正确的是()(1)CH3CH3CHO(2)HCHO(3)C6H5COCH3(4)C6H5CHOA.2>1>4>3B.2>1>3>4C.1>2>3>4D.1>2>4>37.下列四种化合物中没有芳香性的是()A.六氢吡啶 B.吡咯C.环丙烯正离子D.α-甲基呋喃8.苹果酸失水时生成的产物是()A.顺丁烯二酸B.反丁烯二酸C.琥珀酸D.酒石酸9.在合成乙酰苯胺实验中,加入少量锌粉的目的是()A.防止苯胺氧化B.防止乙酰苯胺分解C.作为催化剂10.甲苯在光照或高温下与氯气的反应属于()A.亲电取代反应B.亲核取代反应C.亲电加成反应D.自由基反应11.赖氨酸的pI=9.74,它在pH为2.7的溶液中主要呈()A.正离子B.中性分子C.负离子D.两性离子12.与D-葡萄糖生成相同糖脎的是()A.麦芽糖B. L-甘露糖C.D-核糖D.D-果糖13.能把伯、仲、叔胺分离开的试剂为()A.斐林试剂B.硝酸银的乙醇溶液C.苯磺酰氯的氢氧化钠溶液D.碘的氢氧化钠溶液14.组成蛋白质的氨基酸结构特点是()A.L型、α-氨基酸B. D型、α-氨基酸C. L型、β-氨基酸D. D型、β-氨基酸15.内消旋酒石酸的构型是()A. 2S,3RB. 2R,3RC. 2S,3SD. 2R,3S16.下列脂肪酸中,属于不饱和脂肪酸的是()A.硬脂酸B.十二烷酸C.油酸D.软脂酸17. 重结晶进行热过滤时,采用折叠滤纸的目的是()A.扩大过滤面积、加快过滤速度B.过滤更容易进行C.除去活性炭18.常压蒸馏沸点在140︒C以上的物质时,选用的冷凝管为()A.直型冷凝管B.蛇型冷凝管C.球型冷凝管D.空气冷凝管19. 抽气过滤时,选用的漏斗是()A.玻璃漏斗B.热水漏斗C.布氏漏斗D.砂芯漏斗20. 固体有机化合物纯化的方法通常采用的是 ( )A.重新蒸馏B.重结晶C.重新过滤二、写出下列化合物的结构简式(每题1分,共8分)1. 乙基- -D-核糖苷2. 甘油三硝酸酯3. 2Z ,4Z-己二烯酸4. 对羟基氯化重氮苯5. 氢氧化四甲基铵6. 水扬酸7. 尿嘧啶 8. D-半胱氨酸三、命名下列化合物(有构型的要注明构型,每题1.5分,共12分)1. 2. O O O CH 3CHOHHH H OH3. 4. OCH 3CH 2BrCH 3CH 2NH 2HC 6H 5 (R/S ) 5. 6. CH 33CH(CH 3)2C O NN COOH7. 8. CH 3OCCH 2COCH 3OH OH四、合成下列化合物(无机试剂任用,每题4分,共16分)1. 乙苯2-氯-4-硝基苯甲酸2. CH3CH2CH2CHOCH3CH2CH2CH2CHCHO2CH33. CH2=CH-CH=CH2HOOC(CH2)4COOH4.由原料苯乙烯、乙烯合成CHOCH22五、区别下列各组化合物(共7分)1. 淀粉溶液、蛋白质溶液、蔗糖溶液(3分)2. (4分)NH2NH2COOH六、推导结构(共8分)某化合物分子式为C6H12O,不能起银镜反应,但能与羟胺作用生成肟,在铂催化下加氢可生成一种醇,该醇经脱水,臭氧化分解后,得到两种液体,其中之一能起碘仿反应,但不能与斐林试剂反应,另一种则能起银镜反应,但不能起碘仿反应。
无机及分析化学第一学期期中考试卷(200(20044级)判分标准及参考答案一.选择题(15分,1分/题):1.(D)2.(C)3.(A)4.(C)5.(B)6.(C)7.(A)8.(C)9.(B)10.(D)11.(C)12.(B)13.(C)14.(D)15.(C):二.填空题(35分,1分/空):1.105.7。
2.4;2;100;4。
3.基元;之和;反应级数;3。
4.右;左;右;左;不。
5.两性;HPO42-;H3PO4。
6.6.00;0.5。
7.H2C2O4;H2O;[H+]=[OH-]+[HC2O4-]+2[C2O42-]8.总浓度;两者浓度比;缓冲能力9.8.0-10.0。
10.滴定剂与被滴物按滴定反应正好作用完全;指示剂刚好发生颜色转变停止滴定;终点误差。
11.不同;相同。
12.浓度;被滴酸碱强度。
13.cK≥10-8;K n1/K n2≥104。
三.简答题(10分):1.(1分)两种;(1分)间接法;(2分)HCl易挥发,浓度难确定;NaOH易吸收水份,CO2。
(1分)减量法。
2.(3分)重结晶除去少量可溶性杂质;水解除去重金属的可溶性杂质;过滤除去不溶性杂质。
(2分)水解时pH≈4;蒸发时至结晶膜出现停止加热。
四.计算题(40分):1.(5分)1.18×10-2;(5分)464。
2.(7.5分)(10.7;10.7);78.6;78.6%;(2.5分)85.2%。
3.(7分)(K=1.25×10-5),pH=8.76;(3分)酚酞。
4.(2分)判断;(4分)75.03%;(4分)22.19%。
2004-2005学年第一学期无机化学试题2答案及平分细则一.名词解释(每个2分,共20分)过冷现象;屏蔽效应;可逆过程;缓冲溶液;盖斯定律;理想溶液;化学平衡;杂化轨道;歧化反应;镧系收缩。
答:过冷现象:在一定外压下,如果一种纯液体的温度达到甚至低于其凝固点而不发生凝固的现象称为过冷现象。
屏蔽效应:内层电子对外层电子的排斥相当于抵消了部分的核电荷,削弱了原子核对外层电子的吸引,这种作用称为屏蔽效应。
可逆过程:某体系经某一过程,由状态I变到状态II之后,如果能使体系恢复到原来状态,而在环境中又不留下任何影响,则这一过程称为热力学可逆过程。
缓冲溶液:能抵抗外来少量强酸、强碱的加入或稀释的影响而保持自身的pH不发生显著变化的溶液称为缓冲溶液。
盖斯定律:在( )TP或( )TV条件下,一个化学反应,不管是一步还是多步完成,其反应总的热效应相同。
理想溶液:从宏观热力学的角度讲,是指溶解过程不产生任何热效应的溶液,从微观力学的观点看,在理想溶液中溶质分子与溶剂分子间的作用力等于溶剂分子与溶剂分子间的作用力。
化学平衡:在一定条件下,对可逆反应来讲,当正逆向反应速率相等、体系内各组分浓度不再随时间发生变化时的状态,也称平衡态。
杂化轨道:在形成分子时,同一原子中不同类型、能量相近的原子轨道混合起来,重新分配能量和空间伸展方向,组成一组新的轨道的过程称为杂化,新形成的轨道称为杂化轨道。
歧化反应:在反应中同一物质中同一元素处于同一氧化态的原子既有氧化数升高也有氧化数降低的反应称为歧化反应。
镧系收缩:镧系元素随着原子序数的增加原子半径的减小(约11pm)称为镧系收缩。
镧系收缩使第六周期镧系后面的副族元素的半径相当于减小了11pm,从而与第五周期同族元素的原子半径几乎相等,又因为同族元素的价层电子构型相同,因此,他们的性质十分接近,在自然界中常共生在一起而难以分离。
二.问答题(每题5分,共50分)1. 设计实验,用凝固点下降原理测定葡萄糖的相对分子质量。
答:称取100.00g 葡萄糖溶解于1000.00g 水中,逐渐冷却测定其溶液的凝固点,根据其凝固点与273.15K 的差值ΔT 计算葡萄糖的莫尔质量M :M = 86.100.100⨯∆T 5分2. 已知金(Au)的晶胞属面心立方,晶胞边长为0.409nm ,试求:(1) 的原子半径; (2) 晶胞体积;(3) 一个晶胞中金的原子个数;(4) 金的密度(Au 的相对原子质量为197)。
答: (1)面心立方晶胞的一个正方形面上,处于对角线上的三个质点相互接触,所以对角线的长为4r(r 为质点半径)。
所以r=145.0409.0241=⨯⨯(nm)(2))(m 1084.6)(nm 1084.6409.0329323--⨯=⨯==V(3)一个晶胞中八个顶点处各有一个质点、六个面上各一个质点,因此独立的金原子数为:4316818=⨯+⨯(4)3329323m kg 101.191084.6101002.60.1974---⋅⨯=⨯⨯⨯⨯==Vmρ3. 已知CS 2(1)在101.3kPa 和沸点温度(319.3K)时气化吸热352J ·g -1。
求1molCS2(1)在沸点温度时气化过程的∆U 、∆H 、∆S 、∆G 。
答:41068.276352⨯=⨯=∆H J9.833.3191068.24=⨯=∆=∆T H S J ·K -1441041.23.319314.811068.2⨯=⨯⨯-⨯=∆-∆=∆nRT H U J ·mol -10=∆-∆=∆S T H G4. 以合成氨为例,定量说明浓度、压力和温度对化学平衡移动的影响。
答:合成氨反应:N 2 + 3H 2 + = 2NH 3 (1)浓度的影响:∆r m CCo lnG RT Q K = 平衡时Q C = K C o,∆r m G = 0,此时若不改变产物浓度而增大反应物浓度,则Q C <K C o ,∆r m G < 0,平衡将向正反应方向移动。
反之亦然。
结论:恒温下,增加反应物浓度或减少产物浓度,平衡向正反应移动;减少反应物浓度或增加产物浓度,平衡向逆反应方向移动。
2分 (2)压力的影响:∆r m P P o ln G RT Q K =,平衡时K P P P P o NH 2N H 32=23。
若将体系的体积减小一半,在平衡尚未移动之前,各组分的分压应该增大一倍,此时o P3H N 2NH 3H N 2NH P 4141)2(2)2(223223K P P P P P P Q ==Q P < K Po,∆r m G < 0,平衡向正反应方向移动,正方向是气体分子数减少的方向。
结论:恒温下,增大体系的压力平衡向气体分子减少的方向移动,减小压力,平衡向气体分子数增加的方向移动。
如向体系中加入惰性气体增大压力,则总平衡不变。
1分(3)温度的影响:∆r m oH =-46.11×2=-92.22kJ·mol -1即反应为一放热反应。
由RS RT H K om r o m r oPln ∆+∆-=可知:温度升高,oP K 变小,即平衡向逆反应方向(吸热反应方向)移动。
结论:升高温度,化学平衡向吸热反应方向移动,降低温度,化学平衡向放热反应方向移动。
2分5. 根据质子平衡,推到小苏打溶液pH 计算公式。
答:在溶液中存在下列平衡: NaCO 3 = Na ++ HCO 3-HCO 3- = H + + CO 32- K a2 = 5.6⨯10-11 HCO 3- + H 2O = H 2CO 3 + OH - K h1 =K K wa 1= 2.3⨯10-8 H 2O = H ++ OH - K w = 1.0⨯10-14 2分 根据质子平衡可得:[H +] + [H 2CO 3] = [CO 32-] + [OH -] 其中:[H 2CO 3] = [H ][HCO ]a 1+-3K[CO 32-] = K a 23[HCO ][H ]-+[OH -] =K w[H ]+将其代入(5-17)式,得到:[H +] + [H ][HCO ]a 1+-3K = K a 23[HCO ][H ]-+ + K w [H ]+整理得:[H +] =K K K a 2wa [HCO ][HCO ]3311--++2分同样,当K a2[HCO 3-]》Kw ,[HCO ]a 13-K 》1(20倍以上)时,溶液中H +离子浓度的近似计算公式为:[H +] =K K a 1a 2⋅ 1分6. 根据酸碱质子理论,按由强到弱的顺序排列下列各碱:NO2-、SO42-、HCOO-、HSO4-、Ac-、CO32-、S2-、ClO4-。
根据酸碱电子理论,按由强到弱的顺序排列下列各酸:Li+、Na+、K+、Be2+、Mg2+、Al3+、B3+、Fe2+。
答:S2-、CO32-、Ac-、HCOO-、NO2-、HSO4-、SO42-、ClO4-。
3分B3+、Al3+、Be2+、Fe2+、Mg2+、Li+、Na+、K+。
2分7.在原子的量子力学模型中,电子的运动状态要用几个量子数来描述?简要说明各量子数的物理含义、取值范围和相互间的关系。
答:主量子数n物理意义:决定电子出现最大几率的区域离核的远近,主要决定电子的能量,代表了主电子层。
取值:1、2、3、……1分角量子数(副量子数)l物理意义:决定电子运动的角动量,决定原子轨道和电子云角度分布的情况或空间图像;同时决定多电子原子中电子运动的能量。
l的取值:0,1,2,……(n-1)2分磁量子数m物理意义:决定原子轨道在空间的伸展方向;决定在外磁场作用下电子绕核运动时角动量在外磁场方向上的分量大小(根据原子光谱在磁场中的分裂情况而得到的结果)。
m的取值:0,±1,±2,±l1分自旋量子数m s物理意义:代表了电子的自旋方向。
m s的取值:±1/2。
1分8.写出29、35、42、66、79号元素的电子排布式、元素符号、中文名称,并判断它们在周期表所处的周期、族和区域。
答:每个答案1分,共5分。
(1)1s22s22p63s23p64s13d10,Cu,铜,第四周期,IIB族,ds区;(2)1s22s22p63s23p64s23d104p5,Br,溴;第四周期,VIIA族,p区;(3)1s22s22p63s23p64s23d104p65s14d5,Mo,钼;第五周期,VIB族,d区;(4)1s 22s 22p 63s 23p 64s 23d 104p 65s 24d 105p 66s 24f 10,Dy ,镝,第六周期,f 区; (5)1s 22s 22p 63s 23p 64s 23d 104p 65s 24d 105p 66s 14f 145d 9,Au ,金,第六周期,ds 区。
9. 根据共价键理论,说明下列分子或离子的成键情况和空间构型:NH 3;N 2O ;PCl 6-;SO 3;NO 2。
答:NH 3:N 采取不等性sp 3杂化,含有3个σN -H 键,分子构型为三角锥形;N 2O :中心N 原子采取sp 杂化,含有1个σN -O 键、1个σN -N 键和2个43π大π键,分子构型为直线形;PCl 6-:P 采取sp 3d 2杂化,含有6个σP -Cl 键,分子构型为正八面体形; SO 3:S 采取sp 2杂化,含有3个σS -O 键,分子构型为平面三角形; NO 2:N 采取不等性sp 2杂化,含有2个σN -O 键,分子构型为“V ”形; 10.据分子轨道理论,判断下列分子的磁性大小和稳定性高低:CO ;NO ;O 2。
答:CO 、NO 、O 2的分子轨道表达式分别为: CO :(σ1s )2(σ1s *)2(σ2s )2(σ2s *)2(π2py )2(π2pz )2(σ2px )2; NO :(σ1s )2(σ1s *)2(σ2s )2(σ2s *)2(π2py )2(π2pz )2(σ2px )2(π2py *)1; O 2:(σ1s )2(σ1s *)2(σ2s )2(σ2s *)2(σ2px )2(π2py )2(π2pz )2 (π2py *)1(π2pz *)1;在NO 和O 2中含有成单电子,显示顺磁性,而且O 2的磁性高于NO ,CO 没有成单电子显反磁性;键级分别为CO3级、NO2,5级O 22级,因此稳定性由高到低的排列次序为CO ;NO ;O 2。
三.计算题(每题10分,共30分)1.在1dm 3 0.10 mol ·dm-3ZnSO 4溶液中含有0.010mol 的Fe 2+杂质,加入过氧化氢将Fe 2+氧化为Fe 3+后,调节溶液pH 使Fe 3+生成Fe(OH)3沉淀而除去,问如何控制溶液的pH?已知K sp ︒[Zn(OH)2]=1.2×10-17,K sp ︒[Fe(OH)3]=4×10-38。