高中化学人教版必修1学案:第一章 第二节 第三课时 物质的量浓度
- 格式:pdf
- 大小:475.07 KB
- 文档页数:8

第3课时物质的量浓度课程标准核心素养1.了解物质的量浓度的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质的组成及其化学变化,并运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
3.能配制一定物质的量浓度的溶液。
1.变化观念:认识物质的量浓度在化学定量研究中的重要作用。
2.宏观辨识与微观探析:建立物质的量浓度的概念,基于物质的量浓度定量认识物质的组成及物质的化学变化。
3.科学探究:选择常见实验仪器、装置和试剂,配制一定物质的量浓度的溶液。
物质的量浓度及其计算1.概念:单位体积的溶液里所含溶质B的物质的量,符号为c B,常用单位为mol/L或mol·L-1。
2.表达式:c B=n BV,其中的“V”指的是溶液的体积,而非溶剂的体积。
3.简单计算(1)已知溶液中某种离子的浓度,求其他离子的浓度溶液中阴、阳离子的物质的量浓度之比=化学组成中的离子个数之比。
例如:Na2SO4溶液中,c(SO2-4)=1 mol·L-1,则c(Na+)=2__mol·L-1,c(Na2SO4)=1__mol·L-1。
(2)已知一定体积的溶液中溶质的质量计算浓度例如:2.0 g NaOH固体溶于水配成500 mL溶液,则该溶液的浓度为__0.1__mol·L-1。
(3)标准状况下,一定体积的气体溶于水形成V L 溶液计算浓度例如:标准状况下,11.2 L HCl 气体溶于水配成200 mL 溶液,则该溶液的浓度为2.5__mol·L -1。
1.物质的量浓度与溶质的质量分数的换算 (1)换算公式:c B =1 000ρw Mmol ·L -1M :溶质B 的摩尔质量(单位:g·mol -1);ρ:溶液密度(单位:g·mL -1);w :溶质的质量分数。
(2)推导方法设溶液体积为1 L ,则c B =n BV=ρ g ·mL -1×1 000 mL ×wM g ·mol -11 L =1 000ρw Mmol ·L -1。
![化学教案-物质的量的浓度[第二、三课时]_高一化学教案_模板](https://img.taocdn.com/s1/m/1c11494769dc5022abea00e7.png)
化学教课方案-物质的量的浓度[ 第二、三课时 ]_ 高一化学教课方案 _模板第三节物质的量浓度第二课时知识目标进一步稳固物质的量浓度的看法使学生初步学会配制必定物质的量浓度溶液的方法。
能力目标经过配制必定物质的量浓度溶液的教课,培育学生的察看和着手实验能力。
感情目标经过实验激发学生学习化学的兴趣,培育学生谨慎务实的科学作风。
教课要点:必定物质的量浓度的溶液的配制方法。
教课难点:正确配制必定物质的量浓度的溶液。
教课方法:启迪式教课手段:多媒体协助教课过程():在学习了看法以后,今日我们学习引入:物质的量浓度是表示溶液浓度的一种重要的方法,怎样配制必定物质的量浓度溶液的方法。
板书:二、物质的量浓度溶液的配制比如:配制500mL0.1mol/LNa2CO3溶液。
发问:配制的第一步要做什么?板书: 1.计算学生计算,教师加以校正。
发问:知道了质量假如取固体?假如是液体呢?板书: 2.称量发问:天平使用时的注意事项演示:用托盘天平称量无水碳酸钠。
设问:假如需要配制氢氧化钠溶液,假如称量其固体?叙述:配制用的主要仪器―― 容量瓶。
让学生察看容量瓶,注意有体积、温度和刻度线。
介绍其规格,怎样查验能否漏水及其使用方法。
(此处也能够播放动画“配制必定物质的量浓度溶液”中的有关部分。
板书: 3.溶解发问:溶解能够在容量瓶中进行吗?演示:在烧杯中溶解固体,用玻璃棒搅拌加快溶解。
边演示边解说注意事项:溶解时不可以加入太多的水;搅拌时玻璃棒不可以碰烧杯壁;不可以把玻璃棒直接放在实验台上;待溶液冷却后,再转移到容量瓶中,所以第四步是转移。
板书: 4.转移叙述:因为容量瓶瓶颈很细,为了防止溶液洒落,应用玻璃棒引流。
演示:把烧杯中的溶液转移到容量瓶中发问:烧杯和玻璃棒上残留的液体应怎样办理?板书: 5.清洗演示:清洗2~3 次,每次的清洗液也转移到容量瓶中。
边演示边解说注意事项。
提示:如果用量筒量取液体药品,量筒不用清洗。
因为这是量筒的“自然残留液”,若清洗后转移到容量瓶中会致使所配溶液浓度偏高。


第三课时物质的量在化学实验中的应用[学习目标] 1.了解物质的量浓度的含义。
2.掌握配制一定物质的量浓度溶液的方法及操作和误差分析。
(重点) 3.了解容量瓶的使用方法。
4.掌握物质的量浓度的有关计算和稀释计算。
(重难点)一、物质的量浓度1.58.5 g NaCl投入1 L水中,所得溶液的物质的量浓度为1 mol/L 吗?为什么?【提示】不是1 mol/L,因为溶液体积不是1 L。
二、一定物质的量浓度溶液的配制以配制100 mL 1.00 mol·L-1 NaCl溶液为例。
1.主要仪器:(1)托盘天平、药匙、烧杯、量筒、玻璃棒、100_mL容量瓶、胶头滴管。
(2)容量瓶2.主要步骤(1)计算配制100 mL 1.00 mol·L-1 NaCl溶液所需NaCl固体的质量为5.85 g。
(2)称量准确称量NaCl固体5.9 g。
(3)溶解将NaCl固体放入烧杯中,用适量蒸馏水溶解,恢复到室温。
用玻璃棒搅拌,加速溶解。
(4)移液用玻璃棒引流将溶液转移至100_mL容量瓶中(5)洗涤、振荡:将烧杯内壁和玻璃棒洗涤2~3次,并将洗涤液都转移至容量瓶,轻轻摇动,使溶液混合均匀。
(6)定容①将蒸馏水注入容量瓶,至液面离容量瓶刻度线下1~2_cm。
②改用胶头滴管滴加蒸馏水至溶液凹液面最低点与刻度线相切。
(7)摇匀:塞好瓶塞,反复上下颠倒,使溶液混合均匀。
(8)装瓶:将配好的溶液转移到指定的容器中,贴上标签,注明溶液名称及浓度。
2.玻璃棒在整个实验过程中,有哪些作用?【提示】搅拌促进溶解,引流。
3.配制一定浓度的氢氧化钠溶液时,氢氧化钠在烧杯中刚好溶解,即把溶液转移到容量瓶,这样可以吗?若不可以,这样所配溶液的浓度如何变化?【提示】不可以,溶液未冷却,液体膨胀,故向容量瓶中所加的水偏少,这样所配溶液浓度偏高。
1.判断(1)1 mol NaCl溶于1 L水所得溶液的物质的量浓度是1 mol·L-1。

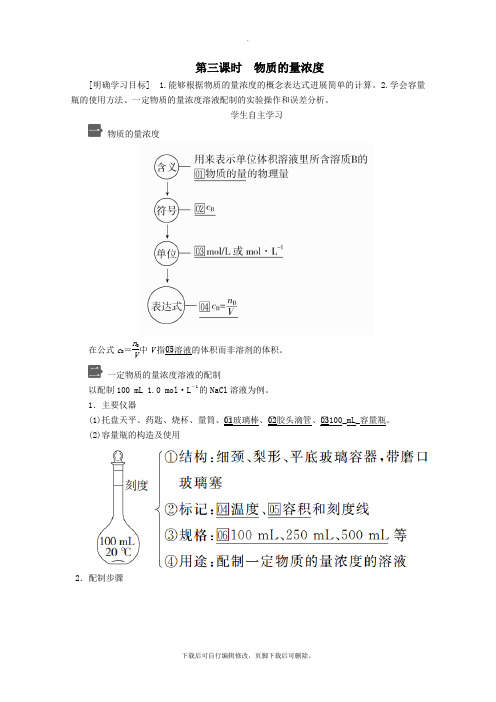
第三课时 物质的量浓度[明确学习目标] 1.能够根据物质的量浓度的概念表达式进展简单的计算。
2.学会容量瓶的使用方法、一定物质的量浓度溶液配制的实验操作和误差分析。
学生自主学习物质的量浓度在公式c B =n BV中V 指□05溶液的体积而非溶剂的体积。
一定物质的量浓度溶液的配制以配制100 mL 1.0 mol·L -1的NaCl 溶液为例。
1.主要仪器(1)托盘天平、药匙、烧杯、量筒、□01玻璃棒、□02胶头滴管、□03100_mL_容量瓶。
(2)容量瓶的构造及使用2.配制步骤1.98 g H2SO4溶于1 L水中配成的溶液即是1 mol/L的H2SO4溶液,这句话正确吗?为什么?提示:不正确,将98 g H2SO4(即1 mol)溶于1 L水后所得溶液体积不是1 L,故H2SO4的物质的量浓度不是1 mol/L。
2.实验室需要450 mL 0.1 mol/L的NaOH溶液,要配制该溶液是否选择200 mL和250 mL 的容量瓶?提示:否,当所配溶液体积没有对应容积的容量瓶(常用的容量瓶容积有100 mL、250 mL、500 mL和1000 mL)时,应选择比所配制溶液体积大且最接近的容量瓶,故配制450 mL溶液应选择500 mL容量瓶。
课堂互动探究知识点一物质的量浓度一、运用c B 的考前须知1.物质的量浓度的概念中的“单位体积〞指的是溶液的体积,而不是溶剂的体积。
2.溶质B 表示任意的溶质,B 的组成可以是分子、离子等,也可以是由阴、阳离子构成的构造单元。
3.对于一定物质的量浓度的溶液,不管取用多少体积,各份溶液中溶质的物质的量浓度始终不变,只是在不同体积的溶液中,溶质的物质的量不同。
例如,1 L 1 mol·L-1的NaCl溶液中,Cl -的物质的量浓度为1 mol·L -1,Cl -的物质的量为1 mol ;从中取出0.5 L ,该份溶液中Cl -的物质的量浓度仍为1 mol·L -1,而Cl -的物质的量变为0.5 mol 。
三、物质的量在化学实验中的应用(3课时)【学习目标】1. 理解物质的量浓度的概念2. 掌握有关物质的量浓度的简单计算3. 掌握配制一定物质的量浓度的方法第一课时 物质的量浓度的定义【知识回忆】请用图示法表示出质量(m )、气体体积(V )及微粒数(N)与物质的量(n)之间的关系: 。
【问题探究1】取多少10%的盐酸刚好有0.1mol 的HCl ?怎么表示溶液的浓度更方便呢? 【概念形成】物质的量浓度: 。
符号为 ,单位是 ,计算公式: 。
【概念辨析】1.1mol/L NaOH 溶液的含义是什么?2. 100mL1mol/LNaOH 溶液中,NaOH 的物质的量是多少?从该溶液中倾倒出20mL ,此20mLNaOH 溶液的物质的量浓度还是1mol/L 吗?为什么?3.将10gNaOH 溶解在250mL 水中,所得溶液的物质的量浓度是1mol/L 吗?【知识体系】物质的量浓度注意要点:1.溶质用物质的量表示,而不是用质量表示。
2.V 是溶液的体积并非溶济的体积。
3.从某溶液中提取出任意体积的溶液,其物质的量浓度都相同,但所含溶质的物质的量因体积不同而不同。
4.能与水发生反应的物质溶于水后,溶质的判断:(1)Na 、Na 2O 、Na 2O 2 NaOH (2)CO 2、SO 2、SO 3 H 2CO 3、H 2SO 3、H 2SO 4(3)NH 3 NH 3•H 2O (计算时仍以NH 3 计算)(4)带有结晶水的物质作为溶质时,其“物质的量”的计算:用带有结晶水的物质的质量除以带有结晶水物质的摩尔质量。
【概念运用】1.用40gNaOH 配成2L 溶液,其物质的量浓度___ _ ____mol/L2.58.5gNaCl 配成500mL 溶液,其物质的量浓度___ ____mol/L溶于水 溶于水溶于水3.标准状况下,22.4LHCl配成0.5L盐酸,其物质的量浓度___ _____mol/L4.物质的量浓度为2mol/L的硫酸溶液250mL,含硫酸的物质的量为_____ _____mol过渡:1mol/L的氯化钠和氯化镁溶液各1L,溶质的物质的量相等吗?溶液中有哪些微粒?微粒的数目是多少,相同吗?【知识拓展】1.0.5L 2mol/L K2SO4溶液中,含有K+的物质的量为,K+的物质的量浓度为,含有SO42-的物质的量为,SO42-的物质的量浓度为。
第一章从实验学化学第二节化学计量在实验中的应用(第3课时)一教材分析:本节是必修一第一章从实验学化学第二节化学计量在实验中的应用(第3课时)的内容,主要包括物质的量浓度的概念,有关物质的量浓度的计算和配制一定物质的量浓度的溶液的方法等几部分。
本节教材是在学生学习了质量分数和物质的量的概念的基础上,使学生掌握另一种表示溶液组成的方法。
通过本节的学习,可以使学生扩大知识面,提高计算能力,初步学会配制一定物质的量浓度溶液的实验技能,为以后的学习打下基础。
因此,本节是高中的重点内容,也是有关化学计算和化学实验基本操作的重点内容之一。
是高考不可缺少的考点,占有很大的分值。
二教学目标知识目标1.使学生理解物质的量浓度的概念。
2.使学生掌握有关物质的量浓度概念的计算。
3.使学生掌握溶液的质量分数和物质的量浓度的换算。
4.使学生初步学会配制一定物质的量浓度溶液的方法。
能力目标1.在概念的教学中,培养学生的思维能力。
2.通过有关物质的量浓度计算的教学,培养学生的计算能力。
3.通过配制一定物质的量浓度溶液的教学,培养学生的观察和动手实验能力。
情感目标1.与初中知识的衔接,使学生感到获取新知识、新方法的喜悦。
2.通过实验激发学生学习化学的兴趣,培养学生严谨求实的科学作风。
三教学重点:物质的量浓度的概念、有关物质的量浓度的计算、一定物质的量度的溶液的配制方法。
难点:溶液的物质的量浓度与溶质的质量分数之间的换算;气体溶质的物质的量浓度的计算;正确配制一定物质的量浓度的溶液。
四学情分析:本节知识点比较多,比较抽象,且有学生分组实验,学生动手做实验有些困难。
针对学生实际应该让学生充分预习,由简单的入手,逐层深入,采用边讲边练的方法,实验时老师加以指导,最终让学生掌握知识,突破难点。
五教学方法:学案导学。
分组实验。
六课前准备:1 学生的学习准备:阅读课本,填写导学案空白,并结合预习内容找出疑惑内容。
2 教师的教学准备:阅读课本,认真备课,写教案,出导学案并提前发给学生,上课前检查学生预习情况。