吉大-物理化学-电化学
- 格式:ppt
- 大小:2.89 MB
- 文档页数:114

吉林大学化学学院2002~2003学年第2学期期末考试物理化学 试题 2003年7月3日说明:1、全部答案写在答题纸上,标明题号,不抄题。
2、考试时间为2.5小时。
3、考试结束时,请将试题、答题纸、草纸上交。
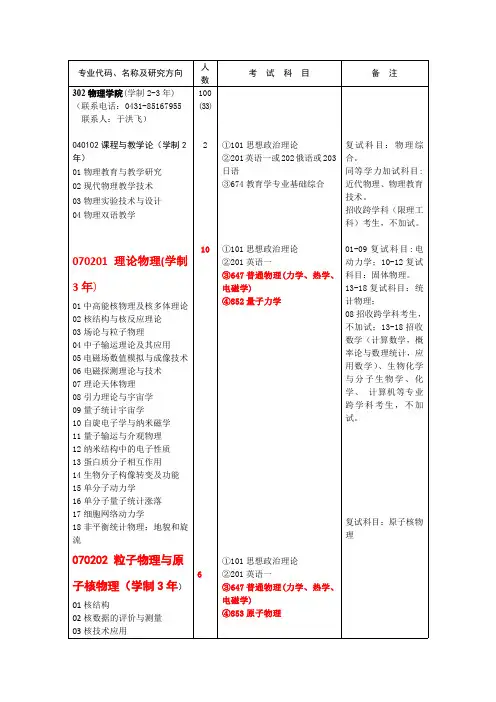
注意: 答题时要列出详细运算步骤并计算出中间运算数值和最终计算结果.(玻兹曼常数k B =1.3806×10-23 J.K -1; 普朗克常数h = 6.6262×10-34 J.s;N A =6.023×1023; F=96500; 摩尔质量: O 16.00; Kr 83.80; He 4.0026)一、计算题 ( 共10题 100分 )(1). 10 分 (1636)已知 N 2分子的转动惯量 I = 13.9×10-47kg ⋅m 2,求1mol N 2分子在 25℃时各转动热力学函数G m (r ),F m (r ),H m (r ),U m (r ),S m (r )。
(2). 10 分 (1570)有1 mol Kr ,温度为300 K 、体积为V ,有1 mol He 具有同样的体积V ,如要使这两种气体具有相同的熵值(忽略电子运动的贡献),则He 的温度应多高?并用熵的统计意义解释此结果。
(M r (Kr) = 83.8, M r (He) = 4.0026)(3). 10 分 (5447)含有相同物质量的A, B 溶液,等体积相混合,发生反应 A+B=C, 在反应 1 h 后, A 的75%已反应掉, 当反应时间为2 h 时, 在下列情况下, A 有多少未反应?[1] 当该反应对A 为一级, 对B 为零级[2] 当对A, B 均为一级[3] 当A, B 均为零级(4). 10 分 (5416)碳的放射性同位素14C ,在自然界树木中的分布基本保持为总碳量的1.10×10-13%。
某考古队在一山洞中,发现一些古代木头燃烧的灰烬, 经分析14C 的含量为总碳量的9.57×10-14%, 已知14C 的半衰期为 5700 a (年), 试计算这灰距今约有多少年?(5). 10 分 (5371)300 K 时,研究反应 A 2+ 2B = 2C + 2D 有下列实验事实:[1] 当按化学计量比进料时,测得下列数据t / s 0 90 217[B] /mol ·dm -3 0.02 0.010 0.0050[2] 当二次实验中 [B]0相同,[A]0增加一倍时,反应速率增大至 1.4 倍,假设反应速率方程为 r = k [A 2]x [B]y ,请求 x ,y ,并求算反应速率常数。

物理化学—电化学练习题及参考答案(1)分析解析(推荐完整)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(物理化学—电化学练习题及参考答案(1)分析解析(推荐完整))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为物理化学—电化学练习题及参考答案(1)分析解析(推荐完整)的全部内容。
物理化学—电化学练习题及参考答案(1)分析解析(推荐完整)编辑整理:张嬗雒老师尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布到文库,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是我们任然希望物理化学—电化学练习题及参考答案(1)分析解析(推荐完整)这篇文档能够给您的工作和学习带来便利。
同时我们也真诚的希望收到您的建议和反馈到下面的留言区,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请下载收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为 <物理化学—电化学练习题及参考答案(1)分析解析(推荐完整)> 这篇文档的全部内容。
电化学A一、选择题1。
某燃料电池的反应为:O2(g)─→H2O(g)H2(g)+12在400 K 时的r H m和r S m分别为—251.6 kJ·mol-1和–50 J·K—1·mol—1,则该电池的电动势为: ( )(A) 1.2 V (B) 2.4 V(C) 1。
4 V (D) 2。
8 V2。
已知下列两个电极反应的标准电极电位为:= 0.337 VCu2++ 2e-─→ Cu(s)1= 0。
521 VCu++ e—─→ Cu(s)2由此可算得 Cu2++ e-─→ Cu+的值为:( )(A) 0.184 V (B) 0。

吉大物化考研题库
吉林大学物理化学考研题库涵盖了物理化学的基础知识和应用,以下是一些模拟试题,旨在帮助考生复习和准备考试。
一、选择题
1. 物理化学中的热力学第一定律描述的是:
A. 能量守恒
B. 熵增加原理
C. 能量转换
D. 温度与能量的关系
2. 以下哪个不是理想气体的状态方程?
A. PV = nRT
B. PV = n'RT
C. P = ρRT/M
D. P = nRT/V
二、填空题
1. 化学势是描述______的物理量,它与系统的______和______有关。
2. 反应的吉布斯自由能变化(ΔG)可以用来判断反应的______性。
三、简答题
1. 简述熵的概念及其在热力学中的应用。
2. 什么是范特霍夫方程?并解释其在化学平衡中的应用。
四、计算题
1. 已知某理想气体的初始状态为P1 = 1 atm,V1 = 2
2.4 L,最终状态为P2 = 2 atm,V2 = 11.2 L。
求该气体经历的温升。
2. 某化学反应的平衡常数Kc = 0.05,初始时反应物A的浓度为1.0 M,生成物B的浓度为0 M。
求达到平衡时,A和B的浓度。
五、论述题
1. 论述物理化学在材料科学中的应用,并给出至少两个实例。
2. 讨论温度对化学反应速率的影响,并解释阿累尼乌斯方程。
结束语:
通过上述题库的练习,考生可以加深对物理化学基本概念和计算方法的理解,为考研做好充分准备。
希望每位考生都能在考试中取得优异成绩。

物理化学问答题第一定律部分1、 1、为什么第一定律数学表示式dU=δQ-δW 中内能前面用微分号d , 而热量和功的前面用δ符号?答:因为内能是状态函数,具有全微分性质。
而热量和功不是状态函数,其微小改变值用δ表示。
2、 2、公式H=U+PV 中H > U,发生一状态变化后有ΔH =ΔU +Δ(PV ),此时ΔH >ΔU 吗?为什么?答:不一定。
因为Δ(PV )可以为零、正数和负数。
3、 3、ΔH = Qp , ΔU = Qv 两式的适用条件是什么?答:ΔH = Qp 此式适用条件是:封闭系等压非体积功为零的体系。
ΔU = Qv 此式适用条件是:封闭系等容非体积功为零的体系。
4、 4、ΔU=dTCT Tv⎰21,ΔH=dTCp T T⎰21两式的适用条件是什么?答:ΔU=dTCT Tv⎰21此式适用条件是:封闭系等容非体积功为零的简单状态变化体系。
ΔH=dTCp T T ⎰21此式适用条件是:封闭系等压非体积功为零的简单状态变化体系。
5、 5、判断下列说法是否正确(1)状态确定后,状态函数的值即被确定。
答:对。
(2)状态改变后,状态函数值一定要改变。
答:不对。
如:理想气体等温膨胀过程,U 和H 的值就不变化。
(3)有一个状态函数值发生了变化,状态一定要发生变化。
答:对。
6、 6、理想气体绝热向真空膨胀,ΔU=0,ΔH=0对吗?答:对。
因理想气体绝热向真空膨胀过程是一等温过程。
7、恒压、无相变的单组分封闭体系的焓值当温度升高时是增加、减少还是不变? 答:增加。
7、 7、在P Ø下,C (石墨)+O 2(g )——>CO 2(g )的反应热为Δr H θm ,对于下列几种说法,哪种不正确?(A )Δr H θm 是CO 2的标准生成热,(B )Δr H θm 是石墨的燃烧热,(C )Δr H θm=Δr U m ,(D )Δr H θm >Δr U m 答:D 不正确。

综合练习(一)一.选择题1.物质的量为n 的理想气体,该气体的哪一组物理量确定后,其他状态函数都有定值(1)p (2)V (3)T ,U √(4)T ,p 2.公式p p H Q ∆=适用于下列哪个过程(1)理想气体从1013。
25kPa 反抗恒定外压101.325kPa 膨胀 √(2)273。
2K ,101。
325k Pa 下,冰融化成水 (3) 298。
2K,101.325k Pa 下,电解CuSO 4水溶液 (4)理想气体从状态A 变化到状态B3.某化学反应若在300K, p 下在试管中进行时放热6×104J ,若在相同条件下通过可逆电池进行反应,则吸热6×103J ,该化学反应的熵变为(1) —200J ﹒K —1 (2) 200 J ﹒K —1 (3) -20 J ﹒K —1 √ (4) 20 J ﹒K -14.上题反应在试管中进行时其环境的熵变√(1) 200J ﹒K —1 (2) -200 J ﹒K -1 (3) —180J ﹒K -1 (4) 180 J ﹒K -1 5.第3题中系统可能做的最大非体积功为(1) -66000J √(2) 66000 J (3) -54000 J (4) 54000 J 6.在通常情况下,对于二组分系统能平衡共存的最多相 (1) 1 (2) 2 (3) 3 √(4) 4 7.下列各式哪个表示了偏摩尔量 √(1)()C TPn B U n ∂∂ (2)()c TVn BA n ∂∂ (3)()C SPnB Hn ∂∂ (4)()C B TPn B n μ∂∂ 8.298K ,当H 2SO 4溶液的浓度从0.01mol ﹒kg -1增加到0.1 mol ﹒kg —1时,其电导率和摩尔电导率将(1)m κΛ减小,增加 (2)m κΛ增加,增加 (3)m κΛ减小,减小 √ (4)m κΛ增加,减小 9.在化学动力学中,质量作用定律只适用于(1)反应基数为正整数的反应 (2)恒温恒容反应 √(3)基元反应 (4)理想气体反应 10.兰格缪尔等温吸附理论中,最重要的基本假设是(1)吸附质为理想气体 (2)中压条件 √(3)单分子层吸附 (4)多分子层吸附二.填空1.在一个绝热箱内装有浓硫酸和水,开始中间用隔膜分开,然后弄破隔膜,使水和浓硫酸混合,以水和浓硫酸为系统,则:Q( = )0, W ( = ),△U ( = )0。

吉大化学考研科目
吉大化学考研科目主要围绕化学的基本知识和专业要求展开,具体包括:
1. 有机化学:主要涉及有机化合物的结构、性质、合成方法、反应机理等内容。
2. 无机化学:主要涉及无机化合物的结构、性质、合成方法、反应机理等内容。
3. 分析化学:主要涉及化学分析方法、仪器分析、化学计量学等内容。
4. 物理化学:主要涉及化学热力学、动力学、电化学、量子化学等内容。
5. 化学工程与工艺学:主要涉及化学工程原理、化工过程、化工设计等内容。
以上内容仅供参考,建议查阅吉大化学专业考研招生简章获取准确信息。


附录9:吉林大学化学学院课程材料化学学院化学学院是在1952年创建的吉林大学化学系的基础上建立的。
蔡馏生院士、陶慰荪教授、关实之教授、唐敖庆院士、孙家钟院士、江元生院士、徐如人院士、沈家骢院士等一批国内外知名学者、教育家是学院的创始人。
学科齐全、教学与科研设施先进的化学学院,在国内外享有良好声誉,已成为我国高级化学人才培养基地与科学研究中心。
化学学院本科专业设置化学学院本科设置五个专业,分别是化学、应用化学、高分子材料与工程、化学工程与工艺、材料化学。
一、化学专业专业简介:化学专业是国家第一类特色专业建设点,国家基础科学人才培养基地依托专业。
化学专业旨在培养德智体全面发展,具有良好的科学素养,掌握化学基本理论、基本知识和基本技能,受到基础研究和应用研究初步训练,能在化学及其相关领域从事教学、科学研究、应用开发和管理等工作的专门人才。
化学专业的学生多数免试保送或考取研究生继续深造。
化学专业培养的毕业生,以理论基础扎实、实验动手能力强在国内享有盛誉,在国外一些高校中也有很好的影响。
主干课程:无机化学、分析化学、有机化学、物理化学、结构化学、仪器分析、普通化学实验、无机化学实验、分析化学实验、有机化学实验、物理化学实验、仪器分析实验、化学综合实验、高分子科学导论,专业英语、化学信息学、生物化学(双语)、无机材料化学(双语)、金属有机化学(双语)、高分子材料(双语)、超分子化学(双语)、配位化学、光谱分析、催化化学等。
就业方向:适宜到科研院所、高等院校从事科学研究和教学工作,以及到化工、石化、冶金、电子、材料、环保、商检、医药、公安、外贸、国防等有关系统的科研、工厂、企业、公司等部门从事科学研究、科技开发和管理工作。
二、应用化学专业专业简介:培养德智体全面发展,掌握化学基本理论、基本知识和技能,具有良好的科学素养,受到科技开发与管理初步训练的具有一定科学思维和创造性思维,能够从事复合材料的研究、开发的复合型应用化学专门人才。