配合物与沉淀溶解平衡
- 格式:doc
- 大小:60.50 KB
- 文档页数:5


《沉淀溶解平衡》知识清单一、沉淀溶解平衡的概念在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解速率和沉淀速率相等的状态,叫做沉淀溶解平衡。
例如,我们把一定量的氯化银固体投入水中,氯化银会在水中溶解,同时溶液中的银离子和氯离子又会结合生成氯化银沉淀。
开始时,溶解速率较大,沉淀速率较小,随着溶解的进行,溶液中银离子和氯离子的浓度逐渐增大,沉淀速率也逐渐增大。
当溶解速率和沉淀速率相等时,就达到了沉淀溶解平衡。
二、沉淀溶解平衡的特征1、动态平衡沉淀溶解平衡是一种动态平衡,溶解和沉淀这两个过程仍在不断进行,只是速率相等。
2、等速溶解速率和沉淀速率相等。
3、定态达到平衡时,溶液中各离子的浓度保持不变。
4、同条件平衡的建立与条件有关,条件改变,平衡可能发生移动。
三、沉淀溶解平衡的表达式以 AgCl 为例,其沉淀溶解平衡的表达式为:AgCl(s) ⇌ Ag+(aq) + Cl(aq)这里要注意,固体物质不能写入平衡常数表达式。
四、沉淀溶解平衡常数——溶度积(Ksp)1、定义在一定温度下,难溶电解质在溶液中达到沉淀溶解平衡时,离子浓度幂的乘积为一个常数,这个常数叫做溶度积常数,简称溶度积,用Ksp 表示。
2、表达式例如,对于 AgCl ,Ksp = Ag+Cl ;对于 Fe(OH)3 ,Ksp =Fe3+OH3 。
3、意义Ksp 反映了难溶电解质在水中的溶解能力。
Ksp 越大,说明溶解能力越强;Ksp 越小,溶解能力越弱。
4、影响因素Ksp 只与温度有关,温度不变,Ksp 不变。
五、影响沉淀溶解平衡的因素1、内因难溶电解质本身的性质,这是决定沉淀溶解平衡的主要因素。
2、外因(1)温度大多数难溶电解质的溶解是吸热过程,升高温度,平衡向溶解方向移动,Ksp 增大;少数难溶电解质的溶解是放热过程,升高温度,平衡向沉淀方向移动,Ksp 减小。
(2)浓度加水稀释,平衡向溶解方向移动,但 Ksp 不变。
(3)同离子效应向平衡体系中加入相同的离子,平衡向沉淀方向移动。

配合物与沉淀溶解平衡实验报告
合金水化溶解平衡实验是利用溶解反应的平衡性,测定含有多种溶质的合金的溶解度的常用实验。
本实验目的是探究在某温度下,某合金的溶解度及沉淀配合物形成的情况,研究其热力学参数。
实验取得的基本原始数据是,在室温25℃的情况下,合金溶液中分别含有0、250、500、1000、1250mg/L的各种溶质,并于24小时内采集溶液和沉淀物的样品,进行示踪分析测定,确定溶液和沉淀物中溶质含量,以计算其实验数据,并分析溶液和沉淀物的組成及出现的化学反应。
根据实验结果,当不同溶质的溶液量级相同时,沉淀物的组成物质基本相同,但其形成量与溶质质量不断增加成正比,且溶液以一定数量的溶质饱和。
另外,再结合配置曲线及热力学计算,实验验证了同反应条件下,当不同溶质组分溶质量相同时,K值以及溶质沉淀均是相同的,即沉淀量跟溶质量成正比,越大的溶质量,沉淀量越大,而热力学参数也确定了所测定的反应热常数。
综上所述,合金水化溶解平衡实验可以用来定量测量一个特定合金在给定条件下的溶质沉淀情况,从而为热力学参数及其变化规律的研究提供来源和依据。

《沉淀溶解平衡》知识清单一、沉淀溶解平衡的概念在一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡。
例如,将难溶电解质 AgCl 放入水中,尽管 AgCl 难溶于水,但仍有少量的 Ag⁺和 Cl⁻离开固体表面进入溶液,同时溶液中的 Ag⁺和 Cl⁻又会在固体表面沉淀下来。
当溶解速率和沉淀速率相等时,就达到了沉淀溶解平衡。
二、沉淀溶解平衡的特征1、动态平衡沉淀溶解平衡是一种动态平衡,溶解和沉淀仍在不断进行,只是速率相等。
2、等速v 溶解= v 沉淀3、定态平衡时,溶液中各离子的浓度保持不变。
4、同条件不变改变条件,平衡会发生移动。
三、沉淀溶解平衡的表达式以 AgCl 为例,其沉淀溶解平衡的表达式为:AgCl(s) ⇌ Ag⁺(aq) + Cl⁻(aq)需要注意的是,固体物质的浓度在表达式中视为常数“1”,不写在平衡表达式中。
四、影响沉淀溶解平衡的因素1、内因物质本身的性质是决定沉淀溶解平衡的主要因素。
不同的难溶电解质在相同条件下的溶解度不同,溶解度越大,越容易溶解。
2、外因(1)温度大多数难溶电解质的溶解是吸热过程,升高温度,平衡向溶解方向移动,溶解度增大;降低温度,平衡向沉淀方向移动,溶解度减小。
(2)浓度加水稀释,平衡向溶解方向移动,但各离子浓度不变。
(3)同离子效应向平衡体系中加入相同的离子,平衡向沉淀方向移动。
例如,在 AgCl 的饱和溶液中加入 AgNO₃溶液,会使 AgCl 的溶解度减小。
(4)能反应的离子向平衡体系中加入能与体系中某些离子反应的物质,平衡向溶解方向移动。
比如,在 AgCl 的饱和溶液中加入氨水,由于 Ag⁺与 NH₃形成配合物,会使沉淀溶解平衡向右移动,AgCl 逐渐溶解。
五、溶度积常数(Ksp)1、定义在一定温度下,难溶电解质在溶液中达到沉淀溶解平衡时,离子浓度幂的乘积为一个常数,这个常数称为溶度积常数,简称溶度积。

配合物与沉淀溶解平衡一、配合物的概念配合物是由中心离子与其周围配体结合形成的一种化合物。
其中,中心离子通常是金属离子,周围配体是一些阴离子或者分子。
配合物在化学中有着广泛的应用,特别是在无机化学中,常常作为功能性材料、催化剂和生物分子的模型使用。
二、配合物的形成配合物的形成取决于中心离子和配体之间的相互作用。
这些相互作用可以有以下几种:1. 静电相互作用当中心离子的电荷与配体的电荷相互吸引时,两者会形成配合物。
2. 配位键的形成配位键是指中心离子与配体之间的化学键。
通常,这种化学键形成于配体的一个或者多个电子对与中心离子之间的相互作用。
3. 氢键相互作用某些情况下,配体中的羟基或者碳氧化物官能团与中心离子之间可以形成氢键相互作用。
4. 范德华力在某些情况下,中心离子和配体之间也可以通过范德华力相互吸引。
三、沉淀溶解平衡概念沉淀溶解平衡是指在水中一种物质的溶解度与其在水中形成沉淀的平衡状态。
对于某些物质而言,如果其在水中溶解度较低,会导致其在水中形成沉淀。
如果这个沉淀物质可以被水重新溶解,则就可以形成沉淀溶解平衡。
例如,银钙盐在水中的溶解度很低。
当在水中加入氯离子时,银离子和氯离子会结合形成银氯化物沉淀物质。
然而,在溶解和沉淀之间,银氯化物沉淀物质也会重新溶解。
当这种溶解和沉淀达到平衡状态时,就形成了沉淀溶解平衡。
四、配合物对沉淀溶解平衡的影响对于某些天然气体或者污染物,它们在水中的溶解度很低,而且在水中容易形成沉淀。
但是,如果向水中加入一种配体,这种配体可以与沉淀形成配合物,从而使沉淀重新溶解。
例如,铅离子可以与氰化物形成铅氰配合物。
由于铅氰配合物在溶液中很稳定,所以它可以防止铅在水中形成沉淀。
另外,一些金属离子也可以与典型的有机配体形成配合物。
例如,硬水是指含有大量镁离子和钙离子的水。
这些离子容易在水中形成沉淀,从而降低水的质量。
然而,如果用一些具有分散性的有机配体,就可以形成离子配合物,从而防止沉淀形成。

溶液中离子的沉淀和溶解平衡问题的解决方法溶液中离子的沉淀和溶解平衡是化学领域中一个重要的问题。
在许多化学实验和工业过程中,我们经常会遇到溶液中某些离子发生沉淀或溶解的现象。
这些现象对于化学反应的进行和化学物质的分离都有着重要的影响。
为了解决这个问题,我们需要采取一些方法来控制和调节溶液中离子的沉淀和溶解平衡。
一、离子沉淀的控制方法1.选择溶剂和溶质:溶剂的选择是控制离子沉淀的关键。
我们可以选择一种溶剂,使得待溶质在其中具有较高的溶解度,从而减少离子的沉淀。
此外,选择适当的溶质也是重要的,一些离子具有较高的溶解度,可以避免沉淀的发生。
2.调节溶液的pH:溶液的pH值对于离子的沉淀有着重要的影响。
通过调节溶液的pH值,可以改变离子的溶解度,从而控制离子的沉淀。
例如,对于一些阳离子来说,在酸性条件下它们更容易沉淀,在碱性条件下更容易溶解。
因此,通过调节溶液的pH值,可以有效地控制离子的沉淀和溶解平衡。
3.利用络合剂:络合剂可以与离子形成配合物,从而增加离子的溶解度,减少离子的沉淀。
络合剂通常具有高度的亲和力,可以与离子形成稳定的络合物,使离子处于溶态。
通过添加适量的络合剂,可以有效地控制溶液中离子的沉淀。
二、离子溶解平衡的调节方法1.加热溶液:提高溶液的温度可以增加离子的溶解度,促使其溶解而不发生沉淀。
这是因为在高温下,溶液中的分子和离子活动性增强,离子之间的相互吸引力减小,使得离子更容易溶解。
2.稀释溶液:通过向溶液中加入适量的溶剂,可以使溶液的浓度降低,从而减少离子之间的相互作用,增加离子的溶解度。
稀释溶液可以有效地调节溶液中离子的溶解平衡。
3.改变溶液的离子浓度:通过增加或减少溶液中某种离子的浓度,可以调节离子之间的平衡,使得某些离子沉淀或溶解。
例如,如果我们希望某种阳离子沉淀,可以增加该离子的浓度,使其超过其溶解度,从而促使其沉淀。
综上所述,溶液中离子的沉淀和溶解平衡问题可以通过选择适当的溶剂和溶质、调节溶液的pH值、利用络合剂等方法来解决。

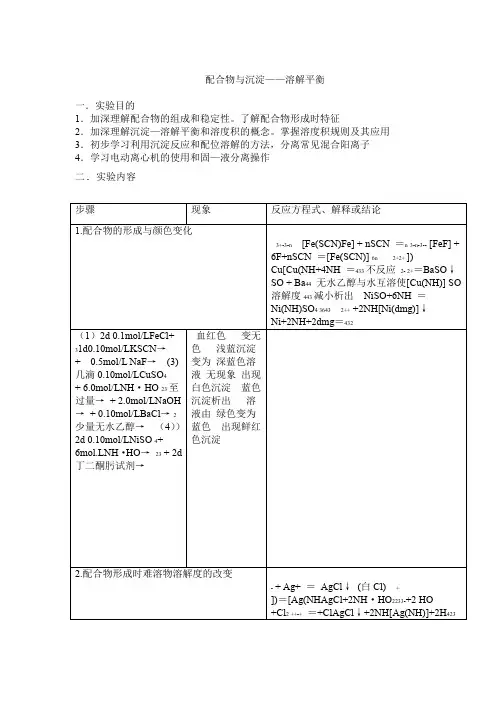
试验九配合物与沉淀——溶解平衡一.实验目的:1.加深理解配合物的组成和稳定性。
了解配合物形成时特征2.加深理解沉淀—溶解平衡和溶度积的概念。
掌握溶度积规则及其应用3.初步学习利用沉淀反应和配位溶解的方法,分离常见混合阳离子4.学习电动离心机的使用和固—液分离操作二.实验原理:配合物石油形成体(又称为中心离子或原子)与一定数目的配位体(负离子或中性分子)。
以配位键结合而形成的一类复杂化合物,是路易斯(Lewis)酸和路易斯(Lewis)碱的加合物。
配合物的内层与外层之间以离子键结合,在水溶液中完全解离。
配位个体在水溶液中分步解离,其类似于弱电解质。
在一定条件下,中心离子。
配位个体和配位个体之间达到配位平衡。
例:Cu2++ 4NH3——[Cu(NH3)4]2+相应反应的标准平衡常数Kf Q。
成为配合物的稳定常数。
对于相同类型的配合物Kf Q数值愈大就愈稳定。
在水溶液中,配合物的生成反应。
主要有配位体的取代反应和加合反应例:[Fe(SCN)n]3++ ===[FeF6]3-+ nScn-HgI2(s) + 2I-==[HgI4]2-配合物形成时,往往伴随溶液颜色、酸碱性(即PH)。
难溶电解质溶解度,中心离子氧化还原的改变等特征。
2.沉淀—溶解平衡在含有难溶电解质晶体的饱和溶液中,难溶强电解质与溶液中相应离子间的多相离子平衡。
称为:沉淀—溶解平衡。
用通式表示如下;AnBn(s) == mA n+(ag)+ nB m-(ag)其溶度积常数为:Ksp Q(A m B n)==[c(A n+)/c Q]m[c(B m-)/c Q]n沉淀的生成和溶解。
可以根据溶度积规则判断:J Q> Ksp Q有沉淀析出、平衡向右移动J Q= Ksp Q 处于平衡状态、溶液为饱和溶液J Q< Ksp Q无沉淀析出、或平衡向右移动,原来的沉淀溶解溶液PH的改变,配合物的形成发生氧化还原反应。
往往会引起难溶电解质溶解度的改变。

试验九配合物与沉淀——溶解平衡一.实验目的:1.加深理解配合物的组成和稳定性。
了解配合物形成时特征2.加深理解沉淀—溶解平衡和溶度积的概念。
掌握溶度积规则及其应用3.初步学习利用沉淀反应和配位溶解的方法,分离常见混合阳离子4.学习电动离心机的使用和固—液分离操作二.实验原理:配合物石油形成体(又称为中心离子或原子)与一定数目的配位体(负离子或中性分子)。
以配位键结合而形成的一类复杂化合物,是路易斯(Lewis)酸和路易斯(Lewis)碱的加合物。
配合物的内层与外层之间以离子键结合,在水溶液中完全解离。
配位个体在水溶液中分步解离,其类似于弱电解质。
在一定条件下,中心离子。
配位个体和配位个体之间达到配位平衡。
例:Cu2++ 4NH3——[Cu(NH3)4]2+相应反应的标准平衡常数Kf Q。
成为配合物的稳定常数。
对于相同类型的配合物Kf Q数值愈大就愈稳定。
在水溶液中,配合物的生成反应。
主要有配位体的取代反应和加合反应例:[Fe(SCN)n]3++ ===[FeF6]3-+ nScn-HgI2(s) + 2I-==[HgI4]2-配合物形成时,往往伴随溶液颜色、酸碱性(即PH)。
难溶电解质溶解度,中心离子氧化还原的改变等特征。
2.沉淀—溶解平衡在含有难溶电解质晶体的饱和溶液中,难溶强电解质与溶液中相应离子间的多相离子平衡。
称为:沉淀—溶解平衡。
用通式表示如下;AnBn(s) == mA n+(ag)+ nB m-(ag)其溶度积常数为:Ksp Q(A m B n)==[c(A n+)/c Q]m[c(B m-)/c Q]n沉淀的生成和溶解。
可以根据溶度积规则判断:J Q> Ksp Q有沉淀析出、平衡向右移动J Q= Ksp Q 处于平衡状态、溶液为饱和溶液J Q< Ksp Q无沉淀析出、或平衡向右移动,原来的沉淀溶解溶液PH的改变,配合物的形成发生氧化还原反应。
往往会引起难溶电解质溶解度的改变。


配合物与沉淀溶解平衡实验报告实验目的:通过本次实验,我们旨在探究配合物与沉淀溶解平衡的相关知识,了解配合物的形成、溶解和沉淀溶解平衡的影响因素,以及实验方法和步骤。
实验原理:配合物是由中心离子和配体通过配位键结合而成的化合物,其形成、溶解和沉淀溶解平衡受到多种因素的影响,包括温度、浓度、PH值等。
在实验中,我们将通过添加不同的试剂,观察配合物的形成、溶解和沉淀溶解平衡的变化,从而加深对这些知识的理解。
实验步骤:1. 准备实验所需的试剂和设备,包括中心离子、配体、溶剂等。
2. 将一定量的中心离子溶解于溶剂中,形成中心离子的溶液。
3. 逐步加入配体试剂,观察是否形成配合物沉淀。
4. 如果形成了沉淀,尝试加入过量的配体试剂,观察沉淀是否溶解。
5. 记录实验过程中的观察结果和现象变化。
实验结果与分析:在本次实验中,我们观察到了配合物与沉淀溶解平衡的一些重要现象。
首先,当我们逐步加入配体试剂时,出现了沉淀的形成,这表明配合物已经形成。
随后,当我们加入过量的配体试剂时,观察到了沉淀的溶解现象,说明沉淀溶解平衡发生了变化。
这些实验结果说明了配合物与沉淀溶解平衡受到配体浓度的影响,当配体浓度增加时,沉淀溶解平衡向溶解方向移动。
这与我们实验原理中所述的影响因素是一致的。
另外,温度和PH值等因素也会对配合物与沉淀溶解平衡产生影响,这些可以作为进一步研究的方向。
实验结论:通过本次实验,我们深入了解了配合物与沉淀溶解平衡的相关知识,了解了配合物的形成、溶解和沉淀溶解平衡受到多种因素的影响。
实验结果表明,配体浓度的变化会影响沉淀溶解平衡的位置,这为我们进一步研究配合物的行为提供了重要的参考。
总而言之,本次实验为我们提供了深入了解配合物与沉淀溶解平衡的机会,我们将继续深入研究这一领域,以期更好地应用这些知识。
高中化学的归纳化学平衡中的溶解度平衡与配合物溶解度化学平衡是化学反应达到动态平衡时的状态,而溶解度平衡是指溶解过程中溶质的溶解速率与晶体的溶出速率达到平衡,而配合物溶解度则是指在溶液中配合物的溶解程度与溶解时生成的配合物的浓度之间的平衡关系。
本文将阐述高中化学中归纳的化学平衡中溶解度平衡和配合物溶解度的相关知识。
一、溶解度平衡在化学反应中,当溶质固体与溶剂液体接触时,溶质会溶解到溶液中,同时晶体中溶质也会溶出到溶液中,这种过程称为溶解度平衡。
溶解度平衡通常以溶解度积(Ksp)来表示。
溶解度积(Ksp)是指在给定温度下,溶质溶解所形成的饱和溶液中,可溶解物离子浓度的乘积,其表达式为:Ksp = [A+]^m • [B-]^n其中,[A+]和[B-]分别表示可溶解物的阳离子和阴离子在饱和溶液中的浓度,m和n分别为阳离子和阴离子的摩尔系数。
溶解度积与溶液中可溶解物的浓度有关,浓度越高,溶解度积越大。
高的溶解度积表示溶质溶解度较大,反之溶质溶解度较小。
溶解度积的大小决定了某些物质在溶液中溶解度的大小。
二、配合物溶解度配合物是由中心金属离子(常为过渡金属离子)与其周围的配位体通过配位键结合而成的化合物,其溶解度与普通物质有一定的区别。
在溶解度平衡中,配合物的溶解度取决于配位体与中心金属离子之间的化学键的强度。
当配位体对中心金属离子的配位键强度较强时,配合物的溶解度较小;反之,当配位体对中心金属离子的配位键强度较弱时,配合物的溶解度较大。
配合物溶解度与溶液中配位体的浓度有关。
当溶液中配位体浓度较高时,配位体与中心金属离子形成的配位键会竞争性地断开,导致配合物的溶解度降低。
相反,当溶液中配位体浓度较低时,配位体与中心金属离子形成的配位键相对稳定,配合物的溶解度较高。
需要注意的是,溶解度平衡和配合物溶解度是由多个因素共同影响的。
除了溶质的性质和溶液中的其他物质浓度外,温度也会对溶解度产生影响。
温度增加有时可以提高溶解度,而有时却会降低溶解度。
试验九配合物与沉淀——溶解平衡一.实验目的:1.加深理解配合物的组成和稳定性。
了解配合物形成时特征2.加深理解沉淀—溶解平衡和溶度积的概念。
掌握溶度积规则及其应用3.初步学习利用沉淀反应和配位溶解的方法,分离常见混合阳离子4.学习电动离心机的使用和固—液分离操作二.实验原理:配合物石油形成体(又称为中心离子或原子)与一定数目的配位体(负离子或中性分子)。
以配位键结合而形成的一类复杂化合物,是路易斯(Lewis)酸和路易斯(Lewis)碱的加合物。
配合物的内层与外层之间以离子键结合,在水溶液中完全解离。
配位个体在水溶液中分步解离,其类似于弱电解质。
在一定条件下,中心离子。
配位个体和配位个体之间达到配位平衡。
例:Cu2++ 4NH3——[Cu(NH3)4]2+相应反应的标准平衡常数Kf Q。
成为配合物的稳定常数。
对于相同类型的配合物Kf Q数值愈大就愈稳定。
在水溶液中,配合物的生成反应。
主要有配位体的取代反应和加合反应例:[Fe(SCN)n]3++ ===[FeF6]3-+ nScn-HgI2(s) + 2I-==[HgI4]2-配合物形成时,往往伴随溶液颜色、酸碱性(即PH)。
难溶电解质溶解度,中心离子氧化还原的改变等特征。
2.沉淀—溶解平衡在含有难溶电解质晶体的饱和溶液中,难溶强电解质与溶液中相应离子间的多相离子平衡。
称为:沉淀—溶解平衡。
用通式表示如下;AnBn(s) == mA n+(ag)+ nB m-(ag)其溶度积常数为:Ksp Q(A m B n)==[c(A n+)/c Q]m[c(B m-)/c Q]n沉淀的生成和溶解。
可以根据溶度积规则判断:J Q> Ksp Q有沉淀析出、平衡向右移动J Q= Ksp Q 处于平衡状态、溶液为饱和溶液J Q< Ksp Q无沉淀析出、或平衡向右移动,原来的沉淀溶解溶液PH的改变,配合物的形成发生氧化还原反应。
往往会引起难溶电解质溶解度的改变。